Частота соматических клеток с генными мутациями у лиц, проживающих в загрязненных радионуклидами районах Орловской области
Автор: Саенко А.С., Замулаева И.А., Смирнова С.Г., Орлова Н.В., Селиванова Е.И., Верещагина А.О.
Статья в выпуске: S1, 2003 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/170169884
IDR: 170169884
Текст статьи Частота соматических клеток с генными мутациями у лиц, проживающих в загрязненных радионуклидами районах Орловской области
-
5. Частота соматических клеток с генными мутациями у лиц, проживающих в загрязненных радионуклидами районах Орловской области
Биологическое влияние малых доз ионизирующего излучения не подлежит сомнению, хотя существует много неопределенностей в оценке отдаленных эффектов облучения, прежде всего канцерогенных [1]. После чернобыльской аварии большая территория РФ подверглась загрязнению радионуклидами, а ее жители - действию ионизирующего излучения в малых дозах. Механизмы действия малых доз изучены пока недостаточно, однако считают, что изменение генетического материала клеток во многом определяет отдаленные последствия облучения. В связи с этим особенный интерес представляет исследование мутаций в соматических клетках людей, подвергающихся низкоинтенсивному радиационному воздействию в малых дозах вследствие проживания на загрязненной радионуклидами территории, в том числе в ряде районов Орловской области.
Целью данного раздела работы является исследование частоты соматических клеток, несущих генные мутации, у жителей Орловской области в сравнении с соответствующими показателями у контрольных необлученных лиц. С этой целью мы использовали методы определения мутаций по двум генным локусам: гликофорина А (glycophorin A - GPA) и Т-клеточного рецептора (T-cell receptor - TCR). Оба метода, основанные на проточно-цитометрическом анализе иммунофенотипа клеток, обеспечивают достаточно высокую скорость обследования больших групп людей.
Определение генных мутаций представляется относительно новым подходом к изучению состояния генетического материала соматических клеток, однако его высокая информативность для дозиметрии и индикации генотоксического воздействия, прежде всего радиационного, вна-стоящее время не подвергается сомнению [2-6]. Принято считать, что GPA-мутации, определяемые в клетках периферической крови, формируются в низкодифференцированных клетках стволового типа, вследствие чего они способны длительное время (более 40 лет) сохраняться и накапливаться в организме [7]. Уровень таких мутаций увеличивается после действия генотоксических факторов химической или физической природы и находится в прямой зависимости от дозы гамма-облучения [8-11]. Поэтому частоту GPA-мутантных клеток рассматривают в качестве интегрального показателя (дозиметра) генотоксических воздействий в течение всей жизни индивидуума.
Установлено, что количество TCR-мутантных клеток также увеличивается после генотоксического воздействия [5, 8, 12]. Однако поскольку мутации по TCR-локусу возникают в зрелых лимфоцитах, имеющих ограниченный срок жизни в организме, то частота мутантных клеток, повышенная в результате воздействия, со временем постепенно уменьшается [13]. Полагают, что время полужизни TCR-мутантных клеток составляет около 2 лет [14].
Таким образом, использованные в данной работе методы определения генных мутаций позволяют оценивать поврежденность генетического материала в различных соматических клетках человека: стволовых и зрелых клетках.
Материалы и методы
Исследованию подверглись образцы периферической крови 225 постоянных жителей 4 районов Орловской области, которым на момент чернобыльской аварии было 0-14 лет. Из них у 111 человек с помощью УЗИ выявлены узловые новообразования в щитовидной железе (ЩЖ). Каждому случаю с узлом были подобраны 1-2 лица сходного возраста, пола и места жительства, которые и составили остальные 114 человек. У всех исследуемых была определена частота лимфоцитов, несущих мутации, по локусу Т-клеточного рецептора.
-
У всех пациентов была также определена группа крови по системе MN. Гетерозиготные индивидуумы (105 человек) отобраны для дальнейшего анализа частоты клеток с мутациями по локусу гликофорина А.
Одновременно проанализированы образцы крови практически здоровых людей сходного возраста (контрольная группа), которые проживали на незагрязненной радионуклидами территории РФ и не имели зарегистрированного контакта с генотоксическими факторами. Вся контрольная группа состояла из учащихся или преподавателей летней биологической школы при МГУ им. М.В.Ломоносова, которые добровольно сдали кровь для проведения данного исследования. С помощью ТCR-метода проанализировано 32 образца крови, с помощью GPA - 18.
Весь анализ генных мутаций проведен в течение мая-августа 2002 г., т.е. спустя 16 лет после аварии на Чернобыльской АЭС.
Определение генных мутаций по локусу Т-клеточного рецептора (TCR)
TCR-метод основан на использовании моноклональных антител, меченных разными флуорохромами, к CD3- и CD4-антигенам. Как известно, на поверхности Т-лимфоцитов экспрессирован комплекс Т-клеточного рецептора и CD3-антигена. Так как TCR-гены функционально гемизиготны, на поверхности лимфоцитов представлены продукты только одного аллеля . Мутация в функционирующем аллеле приводит к тому, что CD3-комплекс не экспрессируется на поверхности Т-лимфоцита. Такие мутанты определяются c помощью проточной цитометрии как CD3-негативные клетки среди CD4-позитивных Т-хелперов.
Венозная кровь обследуемых была помещена в пробирки с гепарином («Becton Dickin-son», США) и транспортирована к месту анализа. С помощью центрифугирования в градиенте плотности фиколл-урографина («Панэко», РФ, плотность 1,077) из 3 мл крови выделяли моно-нуклеарную фракцию клеток. Процедуру выполняли в течение 24 часов после венепункции. При этом кровь, разбавленную в два раза раствором Хенкса («Панэко», РФ), наслаивали на 3 мл раствора фиколл-урографина и центрифугировали в течение 30 минут при 250 g. Клетки из слоя мононуклеаров собирали и отмывали по 2 раза раствором Хенкса, а затем 0,01 М фосфатным буфером, содержащим 0,15 М NаCl (ФБ, рН 7,2), с помощью центрифугирования при 350 g вте-чение 15 мин. Для последующего окрашивания отбирали (1,0-1,5) 106 клеток.
Окрашивание мононуклеарных клеток проводили по методике, разработанной Kyoizumi et al. [12], с некоторыми модификациями. К клеткам добавляли по 10 мкл моноклональных антител к CD4, меченных ФИТЦем, к CD3 и HLA-DR, меченных фикоэритрином («Becton Dickinson Immunocytometry Systems» - «BDIS», США), и инкубировали в темноте 30 минут. Затем клетки отмывали в 1,0 мл ФБ, содержащего 1,0% бычьего сывороточного альбумина («Sigma», США) и 0,1% NaN3 («Sigma», США), с помощью центрифугирования (300 g, 5 минут). К осадку добавляли 0,5 мл ФБ, затем суспензию клеток фильтровали через нейлоновый фильтр (Д-45 мкм) и фиксировали в 0,5 мл 1% раствора формальдегида в ФБ.
Образцы анализировали на проточном цитофлуориметре FACS Vantage («BDIS», США), оборудованном 488 нм лазером (Enterprise 621, Coherent Inc., США) не позднее, чем через 24 часа после окрашивания. Анализ клеток в образце проводили по четырем параметрам: интенсивности прямого и бокового светорассеяния (линейная шкала), флуоресценции ФИТЦа и фикоэритрина (логарифмическая шкала). Для измерения флуоресценции ФИТЦа использовали узкополосные фильтры 530/30 нм, фикоэритрина - 575/26 нм. Мощность лазера составляла 30 мВт.
Компьютерную обработку проводили с использованием программы LysysΙΙ («BDIS», США). На графике распределения клеток по интенсивности светорассеяния выбирали регион неповрежденных лимфоцитов и в дальнейшем оценивали флуоресценцию клеток, меченных ФИТЦем и фикоэритрином, только в этом регионе. На графике распределения клеток по интенсивности флуоресценции определяли количество клеток с иммунофенотипом СD3+CD4+, характерным для Т-хелперных лимфоцитов, и с вариантным иммунофенотипом СD3-СD4+, который соответствует клеткам с мутациями по локусу Т-клеточного рецептора. Частоту мутантных клеток определяли как отношение числа клеток с фенотипом СD3-CD4+ к числу СD3+СD4+клеток. В каждом образце анализировали 2 105 лимфоцитов.
Определение генных мутаций по локусу гликофорина А (GPA)
Для проведения анализа пригодны образцы крови только гетерозиготных по этому локусу доноров, которые составляют около 50% популяции. На поверхности эритроцитов гетерозиготных доноров представлены обе аллельные формы гликофорина А: M и N. В настоящее время разработаны методы получения антител к указанным формам гликофорина А и последующего их выявления с помощью флуоресцентных красителей. Принято считать, что мутации в генах, кодирующих гликофорин А, приводят к потере представительства соответствующего гликопротеина на поверхности эритроцитов. В случае мутации N-аллеля на поверхности клетки будет обнаруживаться только гликофорин M и наоборот. Проточно-цитометрический анализ позволяет определять число эритроцитов, потерявших способность связывать одно из антител вследствие мутации в соответствующем аллеле гена, и, таким образом, оценивать частоту мутантных клеток. В данной работе использовали, так называемый, BR-6 метод, позволяющий определять потерю экспрессии М-формы гликофорина А.
На первом этапе определяли группу крови по системе MN, для чего проводили реакцию гемагглютинации в присутствии поликлональных антител к гликофорину М или N («Orto Diagnostic Systems», США). Отобранную кровь гетерозиготного MN-фенотипа фиксировали в формаль- дегиде. Процедуру фиксации клеток выполняли по методике Langlois et al. [15]. Затем клетки окрашивали меченными моноклональными антителами к М-форме и N-форме, как подробно описано в работе Саенко А.С. идр. [8]. Использовали антитела к N-форме гликофорина А (клон BRIC 157), конъюгированные с ФИТЦем («International Blood Group Reference Laboratory», Англия). Моноклональные антитела к М-форме (клон 6А7, «International Blood Group Reference Laboratory», Англия) предварительно биотинилировали по стандартному протоколу. Рабочие концентрации подбирали в предварительных экспериментах для каждой партии антител. Окрашивание проводили в 2 этапа: сначала клетки инкубировали с указанными антителами, а затем - со стрептавидином, меченным фикоэритрином (“BDIS”, США), для выявления биотинилированных антител.
Окрашенные образцы анализировали на проточном цитофлуориметре FACS Vantage («BDIS», США), оборудованном 488 нм лазером (Enterprise 621, Coherent Inc., США) со скоростью 1500 кл./с. Мощность лазера составляла 60 мВт. Для измерения флуоресценции фикоэритрина использовали узкополосный фильтр 575/26 нм, ФИТЦа - 530/30 нм.
Компьютерную обработку проводили с использованием программы LysysΙΙ («BDIS», США). На основе показателей светорассеяния идентифицировали неповрежденные эритроциты, флуоресценцию которых затем анализировали. Подавляющая часть эритроцитов MN донора связывает оба антитела, демонстрируя флуоресценцию ФИТЦа и фикоэритрина одновременно. Небольшое число клеток связывает только антитела к N-форме, демонстрируя флуоресценцию ФИТЦа и, так называемый, NО-фенотип. Интенсивность флуоресценции по фикоэритрину NO-клеток, возникающих, как принято считать, в результате мутации М-аллеля, составляла не более 2% от интенсивности флуоресценции основной массы MN-клеток. Этот факт определял основной принцип компьютерной обработки данных и подсчет количества клеток с фенотипами MN и NО. Частоту мутантных клеток определяли как отношение числа NО-клеток к числу эритроцитов с фенотипом MN. В каждом образце анализировали (1-2) 106 клеток.
Статистическая обработка
Статистическая обработка выполнена с помощью программы Origin («MicroCal Software», США). По t -критерию Стьюдента проведено сравнение средней частоты мутантных клеток в группах обследованных лиц. Различия считали статистически значимыми при p <0,05.
Результаты
Частота TCR-мутантных клеток
В таблице 5.1 представлены данные, полученные с помощью TCR-метода, для всех обследованных жителей Орловской области и контрольной группы. Установлено статистически значимое увеличение средней частоты TCR-мутантных клеток в общей группе обследованных жителей Орловской области и каждого из районов по сравнению с контролем ( p <0,05). Наиболее высокая средняя частота TCR-мутантных клеток отмечалась у жителей Болховского района.
При сопоставлении этого показателя в группах жителей разных районов статистически значимые различия показаны только между Болховским и Мценским районами.
Проведен раздельный анализ частоты TCR-мутантных клеток улиц без патологии ЩЖ (по данным УЗИ) и с узловыми новообразованиями (таблица 5.2, рис. 5.1).
Средняя частота TCR-мутантных клеток у жителей Орловской области с выявленной узловой патологией ЩЖ была значимо выше, чем улиц без такой патологии. Сходная тенденция сохранялась при сопоставлении этого показателя отдельно в разных районах ( p >0,05).
Таблица 5.1. Частота клеток с мутациями по локусу Т-клеточного рецептора у всех обследованных жителей Орловской области и контрольной группы.
|
Место жительства |
Число обследованных |
Частота TCR-мутантных клеток, х10-4 |
|
|
среднее ± SE |
Диапазон |
||
|
Незагрязненные радионуклидами территории РФ (контроль) |
32 |
2,6 ± 0,2 |
0,9-5,6 |
|
Орловская область, в том числе: |
225 |
4,0 ± 0,2* |
1,0-21,5 |
|
Болховский район |
49 |
4,7 ± 0,5* |
1,4-21,5 |
|
Колпнянский, Урицкий районы |
112 |
4,0 ± 0,2* |
1,0-13,4 |
|
Мценский район |
64 |
3,4 ± 0,2* |
1,1-9,1 |
* р <0,05 по сравнению с контролем.
Таблица 5.2. Частота клеток с мутациями по локусу Т-клеточного рецептора у жителей Орловской области в зависимости от наличия узловых новообразований в ЩЖ.
|
Место жительства |
Число обследованных |
Узловые новообразования |
Частота TCR-мутантных клеток, х10-4 |
|
|
среднее ± SE |
диапазон |
|||
|
Орловская область в целом, |
111 |
выявлены |
4,2 ± 0,2*л |
1,4-21,5 |
|
в том числе: |
114 |
не выявлены |
3,7 ± 0,2л |
1,0-13,4 |
|
Болховский район |
28 |
выявлены |
5,3 ± 0,9Л |
1,6-21,5 |
|
21 |
не выявлены |
4,0 ± 0,4Л |
1,4-7,2 |
|
|
Колпнянский, Урицкий районы |
50 |
выявлены |
4,4 ± 0,3Л |
1,9-12,7 |
|
62 |
не выявлены |
3,8 ± 0,2Л |
1,0-13,4 |
|
|
Мценский район |
33 |
выявлены |
3,7 ± 0,3Л |
1,4-9,1 |
|
31 |
не выявлены |
3,2 ± 0,2 |
1,1-7,1 |
|
* p =0,05 по сравнению с группой лиц, проживающих на той же территории, без выявленной патологии ЩЖ;
Л р <0,01 по сравнению с контрольной группой лиц из незагрязненных радионуклидами территорий РФ.
Следует отметить, что средняя частота TCR-мутантных клеток у жителей Орловской области без патологии ЩЖ отличалась статистически значимо от таковой в контрольной группе ( р =0,001), составляя соответственно 3,7 10-4 и 2,6 10-4. Значимые различия с контролем сохранялись также при раздельном анализе этого показателя у жителей Болховского, Колпнянского и Урицкого районов без выявленной патологии ЩЖ. Средняя частота TCR-мутантных клеток у жителей Мценского района (без патологии ЩЖ) значимо не отличалась от контроля ( р =0,06).
Количество обследуемых с повышенными частотами TCR-мутантных клеток (т.е. превышающими 95% доверительный интервал, установленный для контрольной группы) составило по Орловской области в целом 22,3%; отдельно по Болховскому району - 28,6%, по Колпнянскому, Урицкому районам - 23,2%, по Мценскому району - 15,6%.
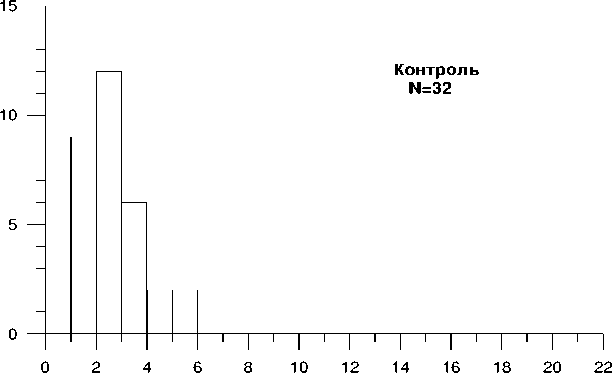
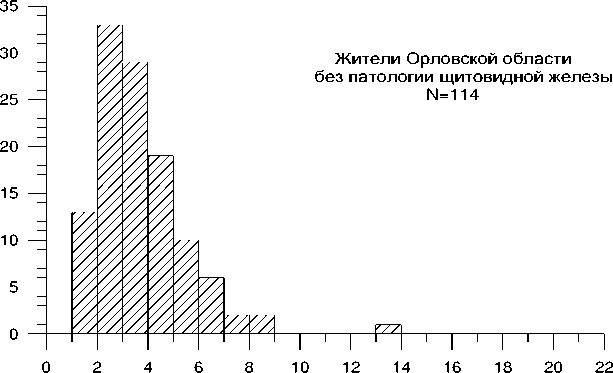
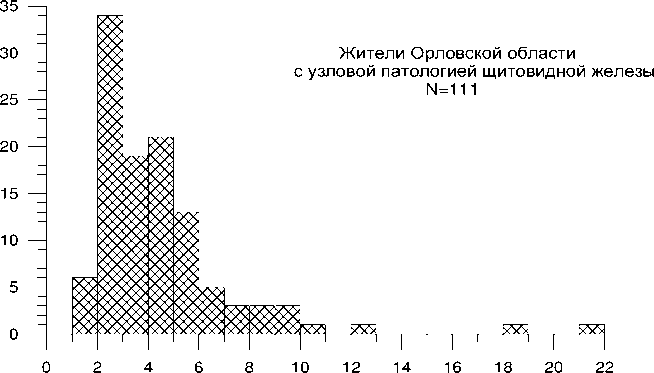
Рис. 5.1. Распределение обследованных лиц по частоте клеток, мутантных по локусу Т-клеточного рецептора. По оси абсцисс - частота TCR-мутантных клеток; по оси ординат - количество обследованных.
Частота GPА-мутантных клеток
В таблице 5.3 представлены результаты обследования жителей Орловской области и контрольной группы с помощью GPA-метода. Установлено статистически значимое увеличение средней частоты GPA-мутантных клеток в общей группе обследованных жителей Орловской области по сравнению с контролем ( р <0,05).
Проведен раздельный анализ частоты GPA-мутантных клеток у лиц без патологии ЩЖ (по данным УЗИ) и с узловыми новообразованиями (таблица 5.4). Средняя частота GPA-мутантных клеток у жителей Орловской области с узловой патологией ЩЖ была статистич ески значимо выше, чем у контрольной группы, и составляла соответственно 45,8 10-6 и 22,78 10-6 ( р =0,01). Сходные изменения наблюдали и при анализе по отдельным районам, кроме Болховского.
Таблица 5.3. Частота клеток с мутациями по локусу гликофорина А у всех обследованных жителей Орловской области и контрольной группы.
|
Место жительства |
Число обследованных |
Частота GPA-мутантных клеток, х10-6 |
|
|
среднее ± SE |
Диапазон |
||
|
Незагрязненные радионуклидами территории РФ (контроль) |
18 |
22,7 ± 4,6 |
2,4-73,3 |
|
Орловская область, в том числе: |
105 |
39,7 ± 3,0* |
2,0-140,0 |
|
Болховский район |
22 |
40,4 ± 5,3* |
13,0-93,3 |
|
Колпнянский, Урицкий районы |
51 |
38,2 ± 4,7 |
2,0-140,0 |
|
Мценский район |
32 |
41,9 ± 5,4* |
7,6-127,5 |
* р < 0,05 по сравнению с контролем.
Таблица 5.4. Частота клеток с мутациями по локусу гликофорина А у жителей Орловской области в зависимости от наличия узловых новообразований в ЩЖ.
|
Место жительства |
Число обследованных |
Узловые новообразования |
Частота GPA-мутантных клеток, х10-6 |
|
|
среднее ± SE |
диапазон |
|||
|
Орловская область в целом, |
47 |
выявлены |
45,8 ± 5,1л |
2,0-140,0 |
|
в том числе: |
58 |
не выявлены |
34,7 ± 3,4 |
5,0-127,5 |
|
Болховский район |
9 |
выявлены |
36,2 ± 42,6 |
15,0-74,3 |
|
13 |
не выявлены |
42,6 ± 7,6Л |
13,0-93,3 |
|
|
Колпнянский, Урицкий районы |
23 |
выявлены |
49,1 ± 8,1*л |
2,0-140,0 |
|
28 |
не выявлены |
29,3 ± 4,8 |
5,0-127,5 |
|
|
Мценский район |
15 |
выявлены |
46,5 ± 9,4Л |
12,2-127,5 |
|
17 |
не выявлены |
37,8 ± 5,9 |
7,6-80,0 |
|
* р =0,05 по сравнению с группой лиц, проживающих на той же территории, без выявленной патологии ЩЖ;
Л р <0,05 по сравнению с контрольной группой лиц из незагрязненных радионуклидами территорий РФ.
Отмечена тенденция к увеличению средней частоты GPA-мутантных клеток у жителей Орловской области с узловыми новообразованиями ЩЖ по сравнению с таковой улиц без выявленной патологии ( р =0,06); у жителей Колпнянского и Урицкого районов указанное увеличение было статистически значимым.
Количество обследованных с повышенными частотами GPA-мутантных клеток (т.е. превышающими 95% доверительный интервал, установленный для контрольной группы) составило по Орловской области в целом 21,9%; отдельно по Болховскому району - 22,7%, по Колпнянско-му, Урицкому районам - 17,6%, по Мценскому району - 28,1%.
Обсуждение
Данные двух независимых методов, использованных в нашем исследовании, свидетельствуют о повышенной частоте соматических клеток, несущих генные мутации, в общей группе обследованных жителей Орловской области. Наиболее выраженные изменения исследованных показателей поврежденности генетического материала отмечены у жителей Болховского района, загрязненного изотопами 131I и 137Cs сильнее, чем у проживающих в других обследованных районах [16, 17]. Так, по данным TCR-метода, частота мутантных клеток у жителей этого района увеличена по сравнению с контролем в 1,8 раза, по данным GPA-метода - также в 1,8 раза.
Однако имеется и некоторое различие в результатах, полученных с помощью указанных методов, как показывает сопоставление средней частоты мутантных клеток в контрольной группе и в подгруппах жителей Орловской области с узловой патологией ЩЖ или без таковой. Так, по данным TCR-метода, наблюдаются значимые различия с контролем в обеих подгруппах. В то время по данным GPA-метода различия установлены только между контролем и группой жителей с выявленной патологией. У лиц без узловой патологии ЩЖ статистически значимых различий с контролем не установлено ( p >0,05), хотя наблюдалась явная тенденция к увеличению частоты GPA-мутантных клеток по сравнению с контролем: 34,7 10-6 и 22,7 10-6, соответственно.
По-видимому, возможно несколько объяснений этого расхождения в отношении лиц без патологии ЩЖ. Главным из них является следующее: поскольку определить частоту GPA-мутантных клеток можно только у половины населения, объем выборки был относительно невелик (105 жителей Орловской области и 18 из контрольной группы) и при высокой вариабельности данных не позволил выявить статистически значимую разницу. Для получения более определенного результата необходимо дальнейшее накопление данных. Можно предложить и другие объяснения. Как показано нами ранее, TCR-метод является более чувствительным при оценке генотоксического воздействия в ближайшие сроки перед анализом, чем GPA-метод [8]. Последний, однако, позволяет судить о генотоксическом воздействии (главным образом, радиационном) и спустя много лет после его окончания [14]. Поэтому полученные нами данные могут свидетельствовать о наличии генотоксического воздействия (возможно, нерадиационной природы) на организм обследованных жителей скорее в ближайшие сроки перед анализом, чем в отдаленные. С другой стороны, наличие наиболее выраженных генетических изменений в соматических клетках жителей Болховского района по сравнению с менее загрязненными районами свидетельствует в пользу возможного вклада радиационного фактора, если в остальном условия проживания сходны. Определенную ясность в вопрос о вкладе радиационного фактора могло бы внести сопоставление индивидуальных накопленных доз с частотой мутантных клеток по обоим локусам.
Кроме того, под действием малых доз ионизирующего излучения в отдаленные сроки после воздействия возможно возникновение нестабильности генома [18]. Хотя проявления и механизмы этого феномена в соматических клетках человека in vivo изучены недостаточно, можно предположить, что нестабильность генома, выявляемая, как правило, только у части облученной популяции, является следствием увеличения чувствительности к действию разнообразных факторов окружающей среды [19]. Следует отметить, что и в нашем исследовании повышенная частота мутантных клеток наблюдалась лишь у части (чуть более 20%) жителей Орловской области. Нестабильность генома, возможно, проявляется по-разному в клетках стволового типа и высокодифференцированных клетках, прошедших разное число делений после действия ионизирующего излучения. В таком случае частота мутантных клеток может быть повышена только по одному из исследованных нами локусов, поскольку мутации по GPA-локусу формируются в клетках-предшественниках крови, а по локусу Т-клеточного рецептора - в зрелых лимфоцитах.
В значительной степени предпочтительность одного или другого предположения может быть решена на основании анализа хромосомных аберраций, который в настоящее время проводится у этих лиц и скоро будет завершен.
В отношении пациентов с узловой патологией ЩЖ полученные нами данные свидетельствуют о более выраженных генетических изменениях в соматических клетках по сравнению с контролем. Изменения являются статистически значимыми и затрагивают оба исследованных локуса. Можно предполагать, что небольшая часть популяции, которую представляют обследованные с патологией ЩЖ, подверглась более интенсивному (по сравнению с контролем) генотоксическому воздействию (необязательно радиационному) в ближайшие сроки перед анализом, или эти обследованные имеют повышенную чувствительность к действию факторов окружающей среды по сравнению с остальной популяцией.
Как известно, канцерогенез - сложный, многоступенчатый процесс, связанный с постепенным накоплением мутаций в определенных генах. По всей видимости, повышение общего уровня мутагенеза в соматических клетках будет способствовать этому процессу. Действительно, ранее было показано, что у лиц со злокачественными новообразованиями средняя частота клеток с генными мутациями по локусу Т-клеточного рецептора значительно выше, чем у здоровых лиц [20]. По нашим данным около 70% онкологических больных характеризуются повышенной частотой мутантных клеток по TCR- и/или GPA-локусам [21]. Это свидетельствует о повышенном мутагенезе по указанным локусам у онкологических больных и о возможности использования данных методов для формирования группы лиц с повышенным канцерогенным риском. Результаты проведенного исследования генных мутаций у жителей Орловской области с новообразованиями в ЩЖ подтверждают эту возможность, поскольку доброкачественные (в подавляющем большинстве случаев) новообразования, выявленные с помощью УЗИ, повышают риск злокачественной трансформации.
Заключение
-
1. Проведено сравнительное исследование частоты мутантных по локусу Т-клеточного рецептора клеток у 225 жителей 4 районов Орловской области и 32 контрольных - из незагрязненных радионуклидами районов РФ. Установлено статистически значимое увеличение средней величины этого показателя у жителей Орловской области независимо от наличия патологии ЩЖ. У пациентов с выявленными узловыми новообразованиями средняя частота TCR-мутантных клеток была статистически значимо выше, чем у обследованных без такой патологии.
-
2. Частота клеток с генными мутациями по локусу гликофорина А определена у 105 жителей Орловской области и 18 из контрольной группы из незагрязненных радионуклидами районов РФ. Установлено увеличение средней частоты GPA-мутантных клеток у обследованных жителей Орловской области по сравнению с контролем.
-
3. Полученные данные свидетельствуют о наличии более выраженных генетических изменений по двум локусам в соматических клетках обследованных с патологией щитовидной железы по сравнению с контролем.
Ввиду небольшого числа обследованных, результаты исследования являются предварительными, однако позволяют предположить наличие дополнительного генотоксического воздействия в малых дозах на всей территории Орловской области, следствием чего, вероятно, является повышение чувствительности части населения к действию факторов окружающей среды. Наиболее выраженные изменения отмечены у жителей Болховского района - наиболее загрязненного изотопами 131I и 137Cs. Дальнейшее накопление данных необходимо для изучения механизмов наблюдаемых генетических изменений в соматических клетках.
Список литературы Частота соматических клеток с генными мутациями у лиц, проживающих в загрязненных радионуклидами районах Орловской области
- Sources and effects of ionizing radiation. United Nations Scientific Committee on the Effects of Atomic Radiation Report to the General Assembly with Scientific Annexes. Vol. II: Effects. Annex G: Biological effects at low radiation doses. -New York, 2000. -P. 75-144.
- Cole J., Skopek T.R. Somatic mutant frequency, mutation rates and mutational spectra in the human population in vivo//Mutation Res. -1994. -V. 304. -P. 33-105.
- Саенко А.С., Замулаева И.А. Результаты и перспективы использования методов определения частоты мутантных клеток по локусам гликофорина А и Т-клеточного рецептора для оценки генотоксического действия ионизирующих излучений в отдаленные сроки после воздействия//Радиационная биология. Радиоэкология. -2000. -Т. 40, № 5. -С. 549-553.
- Saenko A.S., Zamulaeva I.A., Smirnova S.G. et al. Determination of somatic mutant frequencies at glycophorin A and T-cell receptor loci for biodosimetry of acute and prolonged irradiation//Applied Radiation and Isotopes. -2000. -V. 52. -P. 1145-1148.
- Lanza A., Robustelli della Guna F.S., Zibera C. et al. Somatic mutations at the T-cell antigen receptor in antineoplastic drug-exposed populations: comparison with sister chromatid exchange frequency//Int. Arch. Occup. Environ. Health. -1999. -V. 72. -P. 315-322.
- Bigbee W.L., Jensen R.H., Veidebaum T. et al. Biodosimetry of Chernobyl cleanup workers from Estonia and Latvia using the glycophorin A in vivo somatic cell mutation assay//Radiat. Research. -1997. -V. 147. -P. 215-224.
- Nakamura N., Umeki S., Hirai Y. et al. Evaluation of four somatic mutation assays for biological dosimetry of radiation-exposed people including atomic bomb survivors//New horizons in biological dosimetry. -1991. -Wiley-Liess, Inc. -P. 341-350.
- Саенко А.С., Замулаева И.А., Смирнова С.Г. и др. Определение частоты мутаций по локусам гликофорина А и Т-клеточного рецептора: информативность для биологической дозиметрии острого и пролонгированного облучения//Радиационная биология. Радиоэкология. -1998. -Т. 38, № 2. -С. 171-180.
- Langlois R.G., Bigbee W.L., Kyoizumi S. et al. Evidence for increased cell mutations at the glycoforin A locus in atomic bomb survivors//Science. -1987. -V. 236. -P. 445-448.
- Schiwietz J., Lorenz R., Scheubeck M. et al. Improved determination of variant erythrocytes at the glycophorin A (GPA) locus and variant frequency in patients treated with radioiodine for thyroid cancer//Int. J. Radiat. Biol. -1996. -V. 70, N 2. -P. 131-148.
- Kyoizumi S., Nakamura N., Hakoda M. et al. Detection of somatic mutations at the Glycophorin A locus in erythrocytes of Atomic bomb survivors using a single beam Flow sorter//Cancer Research. -1989. -V. 49. -P. 581-589.
- Kyoizumi S., Umeki S., Akiyama M. et al. Frequency of mutant T lymphocytes defective in the expression of the T-cell antigen receptor gene among radiation-exposed people//Mutat. Res. -1992. -V. 265. -P. 173-180.
- Hirota H., Kubota M., Adachi S. et al. Somatic mutations at T-cell antigen receptor and glycophorin A loci in pediatric leukemia patients following chemotherapy: comparison with HPRT locus mutation//Mutat. Res. -1994. -V. 315. -P. 95-103.
- Akiyama M., Kusunoki Y., Umeki S. et al. Evaluation of four somatic mutation assays as biological dosimeter in humans//Radiation Research: A Twentieth-Century Perspective. Vol. II: Congress Proceedings/Ed. by Dewey W.C. et al. -Academic Press, Inc., 1992. -P. 177-182.
- Langlois R.G., Nisbet B.A., Bigbee W.L. et al. An improved flow cytometric assay for somatic mutation at the glycophorin A locus in humans//Cytometry. -1990. -V. 11. -P. 513-521.
- Международный Чернобыльский проект: Технический доклад. Оценка радиологических последствий и защитных мер. -Вена: МАГАТЭ, 1992. -С. 667.
- Израэль Ю.А., Стукин Е.Д., Назаров И.М., Квасникова Е.В. Радиоактивное загрязнение природных сред после чернобыльской аварии. Радиационный мониторинг. -Чернобыль: 15 лет спустя/Под ред. Н.В. Герасимовой. -М.: Контакт-культура, 2001. -С. 82.
- Little J.B. Radiation-induced genomic instability//Int. J. Radiat. Biol. -1998. -V. 74, N 6. -P. 663-671.
- Бурлакова Е.Б., Голощапов А.Н., Жижина Г.Н., Конрадов А.А. Новые аспекты закономерностей действия низкоинтенсивного облучения в малых дозах//Радиационная биология. Радиоэкология. -1999. -Т.39, № 1. -С. 26-35.
- Akiyama M., Umeki S., Kusunoki Y. et. al. Somatic-cell mutation as a possible predictor of cancer risk//Health Phys. -1995. -V. 68. -P. 643-649.
- Замулаева И.А., Смирнова С.Г., Орлова Н.В. и др. Повышенная частота мутантных по локусам Т-клеточного рецептора и гликофорина А клеток как возможный критерий для формирования группы риска онкологических заболеваний//Российский онкологический журнал. -2001. -№ 1. -С. 23-25.


