Частотно-амплитудная структура фибрилляции желудочков собаки при ишемии и реперфузии: экспериментальное исследование
Автор: Гурьянов М.И., Харитонова Е.А., Яблонский П.К.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Экспериментальные статьи
Статья в выпуске: 1 т.28, 2024 года.
Бесплатный доступ
Актуальность. Фибрилляция желудочков — фатальная аритмия, приводящая к внезапной сердечной смерти. Остановка сердца как механизм внезапной сердечной смерти в абсолютном большинстве случаев (> 80 %) возникает в результате фибрилляции желудочков. Цель. Изучение частотно-амплитудной структуры фибрилляции желудочков при реперфузии после 30–240 с ишемии сердца собаки при фибрилляции желудочков. Методы. Провели 6 опытов на 12 собаках. В каждом опыте изолированное сердце одной собаки перфузировали кровью второй (поддерживающей) собаки. В 6 опытах выполнили по 9 эпизодов ишемии сердца при фибрилляции желудочков длительностью 30, 60, 90, 120, 150, 180, 210 и 240 с — всего 72 эпизода. До и после каждого эпизода ишемии проводили соответственно 10-минутную перфузию и 10-минутную реперфузию при фибрилляции желудочков. Регистрировали электрограмму сердца при фибрилляции желудочков. Выполняли спектральный анализ электрограммы методом быстрого преобразования Фурье в диапазоне 0,5–15 Гц и определяли частоту и удельный вес осцилляций 1–3-й по спектральной мощности частот при перфузии, ишемии и реперфузии (частота, Гц — мода; удельный вес, % — M ± SD; n = 270). Результаты. Частота и удельный вес доминирующих осцилляций фибрилляции желудочков были стабильными при перфузии: 9–10 Гц и 39–41 % — и статистически значимо не изменились при 30-секундной ишемии (p = 0,09; p = 0,07) и 10-минутной реперфузии (от p = 0,07 до p = 0,23; от p = 0,09 до p = 0,21). На 2-й мин ишемии частота доминирующих осцилляций снизилась до 8,5–9,0 Гц (p = 0,009), но их удельный вес статистически значимо не изменился (p = 0,06). На 3–4-й мин ишемии частота доминирующих осцилляций снизилась до 5,0–7,5 Гц (p = 0,002), их удельный вес — до 32–33 % (p = 0,001). После 1–2 мин ишемии частота доминирующих осцилляций при реперфузии возросла до 10,5–12,0 Гц (p = 0,03 и p = 0,002) на 1-й мин и снизилась до 9,5–10,5 Гц (p = 0,01 и p = 0,009) на 2-й мин. После 3–4 мин ишемии частота доминирующих осцилляций возросла до 12,5–14,0 Гц (p = 0,001) на 1-й мин реперфузии и снизилась до 10–11 Гц (p = 0,005 и p = 0,007) на 2-й мин. Удельный вес доминирующих осцилляций после 1–2 мин ишемии снизился до 33–36 % (p = 0,003 и p = 0,002) на 1-й мин реперфузии и возрос до 39 % (p = 0,005 и p = 0,001) на 2-й мин. После 3–4 мин ишемии удельный вес доминирующих осцилляций оставался сниженным (32–34 %) на 1-й мин реперфузии и возрос до 36–40 % (p = 0,005 и p = 0,007) на 2-й мин. Заключение. Организованная активность фибрилляции желудочков более чувствительна к реперфузии, чем к ишемии, что подтверждается тем, что частотно-амплитудная структура фибрилляции желудочков изменяется при реперфузии значительнее, чем при ишемии. Фибрилляция желудочков характеризуется взрывной (импульсной) дестабилизацией организованной активности при реперфузии, о чем свидетельствуют повышение частоты доминирующих осцилляций на 1-й мин реперфузии и их снижение на 2–3-й мин, снижение удельного веса доминирующих осцилляций на 1-й мин и их повышение на 2–3-й мин. Чем длительнее ишемия, тем значительнее дестабилизация организованной активности фибрилляции желудочков при реперфузии.
Ишемия сердца, реперфузия сердца, сердце собаки, фибрилляция желудочков, частотно-амплитудная структура фибрилляции желудочков
Короткий адрес: https://sciup.org/142240303
IDR: 142240303 | DOI: 10.21688/1681-3472-2024-1-50-58
Текст научной статьи Частотно-амплитудная структура фибрилляции желудочков собаки при ишемии и реперфузии: экспериментальное исследование
Цитировать: Гурьянов М.И., Харитонова Е.А., Яблонский П.К. Частотно-амплитудная структура фибрилляции желудочков собаки при ишемии и реперфузии: экспериментальное исследование. Патология кровообращения и кардиохирургия. 2024;28(1):50-58. https://doi. org/10.21688/1681-3472-2024-1-50-58
Фибрилляция желудочков (ФЖ) характеризуется гемодинамически неэффективными некоординированными сокращениями сердца, не способными поддержать кровообращение и приводящими к внезапной сердечной смерти. Остановка сердца как механизм внезапной сердечной смерти более чем в 80 % случаев возникает в результате ФЖ. Почти в половине случаев остановка сердца у лиц старше 40 лет происходит без известной сердечно-сосудистой патологии, но 75–80 % таких лиц имеют недиаг-ностированную ишемическую болезнь сердца [1–3].
ФЖ приводит к ишемии и снижению сократимости сердца, что неблагоприятно для восстановления гемодинамически эффективных координированных сокращений при дефибрилляции [4–6]. Чем длительнее ишемия при ФЖ, тем значительнее снижение сократимости и меньше вероятность успешной дефибрилляции: она снижается на 7–10 % за 1 мин ишемии [6; 7]. Поэтому реперфузия после ишемии сердца при ФЖ необходима для восстановления сократимости, что должно способствовать возобновлению гемодинамически эффективных координированных сокращений при дефибрилляции. Но реперфузия приводила к дестабилизации электрической активности ФЖ собаки [8; 9]. На дестабилизацию электрической активности ФЖ человека указывает повышение доминирующей частоты ФЖ с 4,7 до 7 Гц при реперфузии [10].
Дестабилизация электрической активности ФЖ отражает функциональную нестабильность сердца при реперфузии, что может снижать успех дефибрилляции и вызывать рефибрилляцию. Так, C. Xing и соавт. выявили частые рефибрилляции после успешных дефибрилляций, приводивших к восстановлению кровообращения после 1–4 мин ишемии сердца при фибрилляции желудочков [11].
Ранее нами [8; 9] и C.P. Bradley [10] была изучена реперфузия после 1–2 интервалов ишемии при ФЖ: после 60 и 180 с ишемии при ФЖ собаки и 150 с ишемии при ФЖ человека, что не отражает полную картину электрической активности ФЖ при реперфузии, так как количественные эффекты реперфузии были разными после разных интервалов ишемии. По-видимому, чем длительнее ишемия при ФЖ, тем значительнее эффекты реперфузии. Полную количественную картину электрической активности ФЖ при реперфузии можно получить при систематическом исследовании частотно-амплитудной структуры ФЖ собаки при реперфузии после 30, 60, 90, 120, 150, 180, 210 и 240 с ишемии. Такое исследование практически значимо для кардиологической практики, так как после 30–240 с ишемии сердца при ФЖ возможна успешная дефибрилляция [12]; результаты применимы к человеку, поскольку частотно-амплитудные параметры ФЖ сердца собаки близки к частотно-амплитудным параметрам ФЖ сердца человека [13].
Цель — изучить частотно-амплитудную структуру ФЖ при реперфузии после 30–240 с ишемии сердца собаки при фибрилляции желудочков.
Методы
Провели 6 опытов на 12 беспородных собаках обоих полов весом 20–30 кг в соответствии с рекомендациями Международного комитета по работе с лабораторными животными, поддержанными Всемирной организацией здравоохранения, директивой Европейского Парламента № 2010/63/EU от 22.09.2010 г. «О защите животных, используемых для научных целей». Этический комитет клиники «Семейный доктор» (ООО «АнтМед», Санкт-Петербург, Российская Федерация) одобрил исследование (протокол № 4 от 14.09.2023 г.). Проводили премедикацию: подкожно вводили атропина сульфат (0,1 мг/кг), внутримышечно — золетил (20–30 мг/кг) (VIRBAC S.A., Карро, Франция). Под внутривенным тиопенталовым наркозом (начальная доза 10–15 мг/кг, 4–7 мг/кг ежечасно) проводили искусственную вентиляцию легких и выделяли сердце из грудной клетки. Вставляли дренажные трубки в предсердия через верхнюю полую и легочную вены. Канюлировали аорту и перфузировали коронарные артерии кустодиолом (Dr. F. Köhler Chemie GmbH, Бенсхайм, Германия). Через 8–10 мин перфузировали сердце кровью поддерживающей собаки, которой проводили искусственную вентиляцию легких под тиопенталовым наркозом. Из бедренной артерии поддерживающей собаки кровь поступала в аорту изолированного сердца. Перфузионное давление в аорте было 90–100 мм рт. ст., что приводило к закрытию аортального клапана и перфузии коронарных артерий. Венозная кровь из предсердий изолированного сердца возвращалась в бедренную вену поддерживающей собаки. Для предотвращения тромбообразования в длительных экспериментах проводили гепаринизацию собак (начальная доза 500 МЕ/кг, 150 МЕ/кг ежечасно). Сердце помещали в закрытую камеру, в которой поддерживали температуру 37 °С.
Регистрировали электрограмму сердца до и во время ФЖ от игольчатых электродов в правом и левом желудочках на кардиографе «Кардиотехника-ЭКГ-8» (ООО «ТД «Инкарт», Санкт-Петербург, Россия)
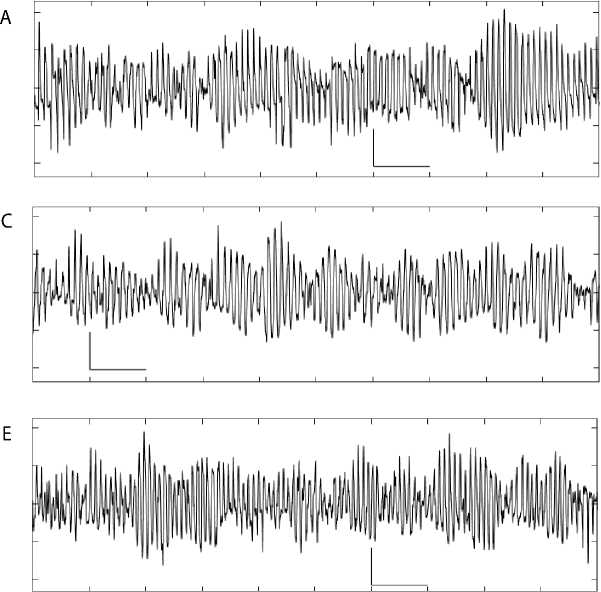
Рис. 1. Электрограммы сердца собаки при фибрилляции желудочков (A, C, E) и их спектрограммы (B, D, F): перфузия (A, B); 81–90-я с ишемии (C, D); 51–60-я с реперфузии (E, F)
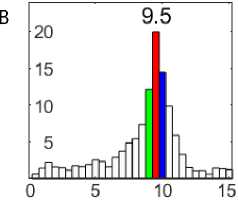
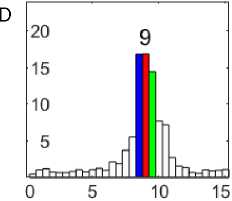
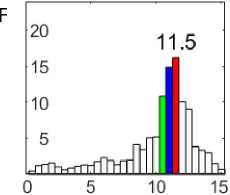
Примечание. Калибровка электрограмм: 2 мВ; 1 с. На спектрограммах: по оси абсцисс — частота, Гц; по оси ординат — амплитуда, мВ.
при частоте оцифровки 1 000 Гц. ФЖ вызывали частой электрической стимуляцией от электродов в верхушке сердца.
Критерий включения животных — отсутствие патологических изменений на электрограмме сердца до ФЖ. Во всех 6 опытах таких изменений не выявили, поэтому всех собак включили в исследование.
В 6 опытах выполнили 72 эпизода тотальной ишемии сердца при ФЖ: по 9 эпизодов длительностью 30, 60, 90, 120, 150, 180, 210 и 240 с. Перед каждым эпизодом ишемии проводили 10-минутную перфузию сердца при ФЖ, после каждого эпизода — 10-минутную реперфузию.
Проводили спектральный анализ 1-секундных отрезков электрограммы при перфузии, ишемии и реперфузии методом быстрого преобразования Фурье в 30 частотах полугерцовой ширины в диапазоне 0,5–15 Гц: 0,5, 1, 1,5, …, 15 Гц и определяли частоту и удельный вес осцилляций 1–3-й по спек- тральной мощности частот в 30-секундных интервалах ФЖ (частота, Гц — мода; удельный вес, % — M ± SD; n = 270).
Критерий включения эпизодов ишемии и реперфузии в исследование — стабильная частотно-амплитудная структура ФЖ при перфузии сердца до ишемии. Во всех эпизодах перфузии до ишемии определялась стабильная частотно-амплитудная структура ФЖ с доминированием осцилляций частотой 9–10 Гц и удельным весом 39–41 %. Эти параметры служили контролем, с которым сравнивали показатели ФЖ при ишемии и реперфузии.
Статистический анализ
Частоту и удельный вес осцилляций ФЖ при перфузии, ишемии и реперфузии сравнивали по непараметрическому критерию Вилкоксона в среде R (R Foundation for Statistical Computing, Вена, Австрия, . Статистически значимыми считали различия при p < 0,05.
Гц
А — 30 с ишемии
—*— 1 частота
↓↑
2 частота
3 частота

0 90 180 270 360 450 540 630 720
Интервал фибрилляции, с
Интервал фибрилляции, с
Интервал фибрилляции, с
Интервал фибрилляции, с
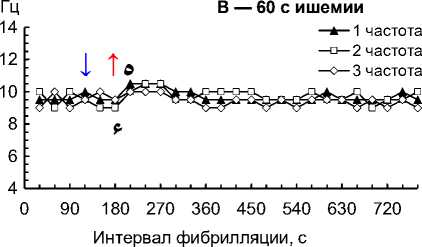
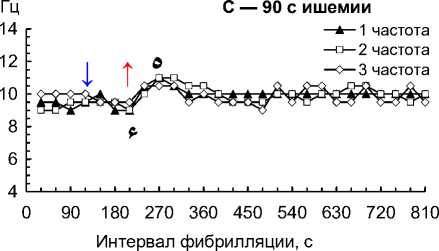
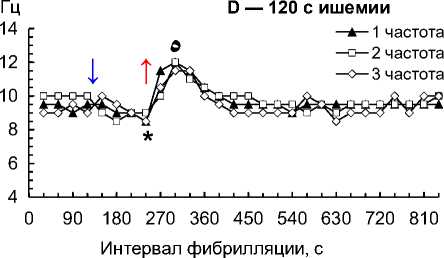
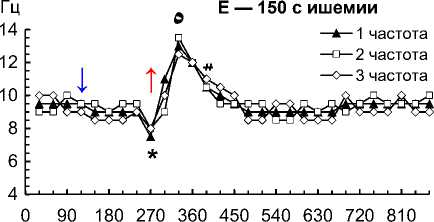
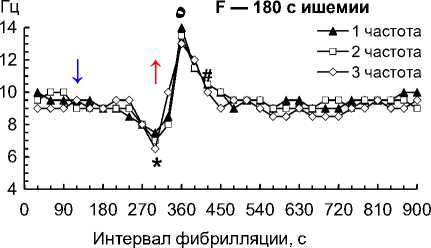
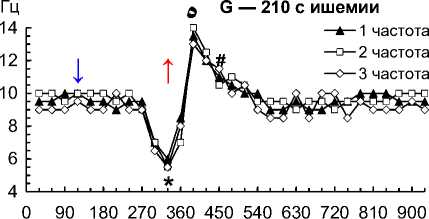
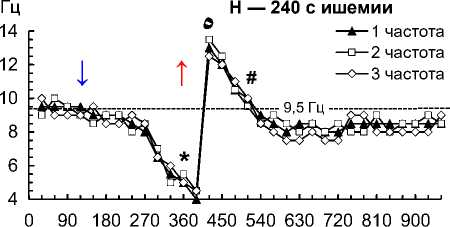
Рис. 2. Частота 1–3-й по спектральной мощности частот на 1–4-й мин ишемии и 1–10-й мин реперфузии сердца собаки при фибрилляции желудочков: 30 с ишемии (A); 60 с ишемии (B); 90 с ишемии (C); 120 с ишемии (D); 150 с ишемии (E); 180 с ишемии (F); 210 с ишемии (G); 240 с ишемии (H)
Примечание. Влево от стрелки вниз — перфузия до ишемии; стрелка вниз — начало ишемии; стрелка вверх — начало реперфузии. Данные представлены как мода; n = 270; ء — p < 0,01 при сравнении 1–3-й частот с 30-й и 60-й с реперфузии; * — p < 0,01 при сравнении 1–3-й частот с перфузией и 30–60-й с реперфузии; ٥ — p < 0,01 при сравнении 1–3-й частот со 120-й с реперфузии; # — p < 0,01 при сравнении 1–3-й частот со 180–600-й с реперфузии.
ишемии ишемии ишемии ишемии ишемии ишемии ишемии ишемии
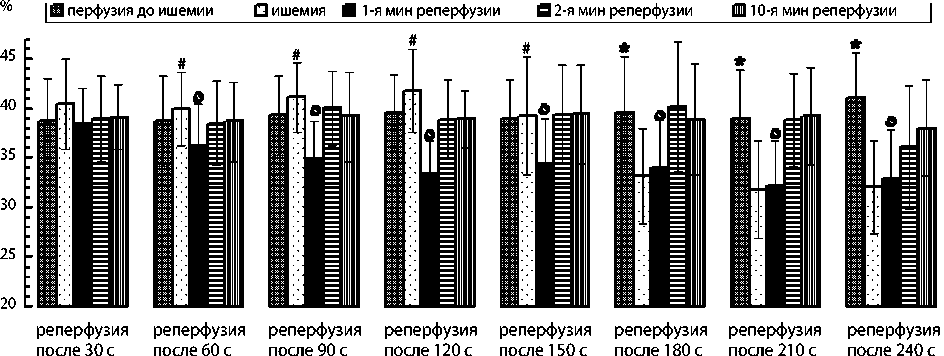
Рис. 3. Удельный вес осцилляций 1–3-й по спектральной мощности частот на 1–4-й мин ишемии и 1–10-й мин реперфузии сердца собаки при фибрилляции желудочков
Примечание. Данные представлены как M ± SD; n = 270; * — p < 0,01 при сравнении с ишемией; # — p < 0,01 при сравнении с 1-й мин реперфузии; ٥— p < 0,01 при сравнении со 2-й мин реперфузии.
Результаты
При перфузии сердца при ФЖ доминировали осцилляции 9–10 Гц (рис. 1, A, B). Частота доминирующих осцилляций снизилась до 8,5–9,5 Гц на 81–90-й с ишемии (рис. 1, C, D) и возросла до 10,5–11,5 Гц на 51–60-й с реперфузии (рис. 1, E, F).
Доминирующие частоты ФЖ, стабильные при перфузии (9–10 Гц), имели следующую динамику (рис. 2):
– при 30-секундной ишемии и 10-минутной реперфузии статистически значимо не изменились (p = 0,09; от p = 0,07 до p = 0,23 соответственно) (рис. 2, A);
– на 60-й с ишемии статистически значимо не изменились (p = 0,11), но при реперфузии возросли до 10,0–10,5 Гц (p = 0,03) на 30-й с, снизились до 9,5– 10,0 Гц (p = 0,01) на 120-й с и стабилизировались до 9–10 Гц на 180–600-й с (рис. 2, B);
– на 120-й с ишемии снизились до 8,5–9,0 Гц (p = 0,009), при реперфузии возросли до 10,0–11,5 Гц (p = 0,004) и 11,5–12,0 Гц (p = 0,002) соответственно на 30-й и 60-й с, снизились до 10,0–10,5 Гц (p = 0,009) на 120-й с и стабилизировались до 9–10 Гц на 180– 600-й с (рис. 2, D);
– на 180-й с ишемии снизились до 6,5–7,5 Гц (p = 0,002), при реперфузии возросли до 8–10 Гц (p = 0,004) и 13–14 Гц (p = 0,001) соответственно на 30-й и 60-й с, снизились до 10,0–10,5 Гц (p = 0,005) на 120-й с и стабилизировались до 9–10 Гц на 180– 600-й с (рис. 2, F);
– на 240-й с ишемии снизились до 5,0–5,5 Гц (p = 0,002), при реперфузии снизились до 4,0– 4,5 Гц (p = 0,001) на 30-й с, возросли до 12,5–13,5 Гц (p = 0,001) на 60-й с, снизились до 10,5–11,0 Гц (p = 0,007) на 120-й с и стабилизировались до 8–9 Гц на 180–600-й с (рис. 2, H).
Удельный вес доминирующих осцилляций ФЖ, стабильный при перфузии (39–41 %), продемонстрировал следующие изменения (рис. 3):
– при 30-секундной ишемии и 10-минутной реперфузии статистически значимо не изменился (p = 0,07; от p = 0,09 до p = 0,21 соответственно);
-
– на 60-й с ишемии статистически значимо не изменился (p = 0,09), но снизился до 36 % (p = 0,003) на 1-й мин реперфузии и возрос до 39 % (p = 0,005) на 2-й мин;
-
– на 120-й с ишемии статистически значимо не изменился (p = 0,06), но снизился до 33 % (p = 0,002) на 1-й мин реперфузии и возрос до 39 % (p = 0,001) на 2-й мин;
-
– на 3-й мин ишемии снизился до 33 % (p = 0,001), статистически значимо не изменился на 1-й мин реперфузии (p = 0,12), но возрос до 40 % (p = 0,005) на 2-й мин;
-
– на 4-й мин ишемии снизился до 32 % (p = 0,001), статистически значимо не изменился на 1-й мин реперфузии (p = 0,26), но возрос до 36–38 % (p = 0,007 и p = 0,002) на 2–10-й мин.
Обсуждение
Мы изучили частотно-амплитудную структуру ФЖ собаки при 1–4-минутной ишемии и 10-минутной реперфузии сердца при ФЖ. Все эпизоды ишемии и реперфузии имели доминантную структуру, что свидетельствует об организованной активности. В наших опытах методической новизной было то, что ишемии предшествовала 10-минутная перфузия сердца при ФЖ, тогда как ишемия сердца in situ начинается на первых секундах фибрилляции желудочков.
Организованная активность ФЖ устойчива к 2-минутной ишемии после 10 мин перфузии сердца при ФЖ — это подтверждается тем, что частота доминирующих осцилляций снизилась всего на 0,5– 1,0 Гц (рис. 2, A–D), а их удельный вес не изменился на 2-й мин ишемии (рис. 3). Но устойчивость организованной структуры ФЖ к ишемии не беспредельна, что подтверждают снижение частоты доминирующих осцилляций на 2–5 Гц (рис. 2, F–H) и снижение их удельного веса до 32–33 % на 3–4-й мин ишемии (рис. 3).
Организованная активность ФЖ устойчива к реперфузии после 30 с ишемии при ФЖ, что подтверждает отсутствие изменений частотно-амплитудных параметров ФЖ (рис. 2, A, рис. 3). Но организованная структура ФЖ чувствительна к реперфузии после более длительной ишемии, что подтверждает:
-
– повышение доминирующих частот ФЖ на 3 Гц на 1-й мин реперфузии и их снижение на 1,5 Гц на 2-й мин реперфузии после 2 мин ишемии (рис. 2, D);
-
– повышение доминирующих частот на 6 Гц на 1-й мин реперфузии и их снижение на 3–4 Гц на 2–3-й мин реперфузии после 3 мин ишемии (рис. 2, F);
-
– повышение доминирующих частот на 8–9 Гц на 1-й мин реперфузии и их снижение на 3–5 Гц на 2–3-й мин реперфузии после 4 мин ишемии (рис. 2, H);
-
– снижение удельного веса доминирующих осцилляций до 36 % на 1-й мин реперфузии и их повышение до 39 % на 2-й мин реперфузии после 1 мин ишемии (рис. 3);
– снижение удельного веса доминирующих осцилляций до 32–34 % на 1-й мин и их повышение до 36–40 % на 2-й мин реперфузии после 2–4 мин ишемии.
Приведенные факты свидетельствуют о дестабилизации организованной активности ФЖ при реперфузии, которая характеризуется взрывным (импульсным) повышением доминирующих частот ФЖ на 1-й мин реперфузии и их снижением на 2–3-й мин и импульсным снижением удельного веса доминирующих осцилляций на 1-й мин реперфузии и их по- вышением на 2-й мин. Чем длительнее ишемия при ФЖ, тем значительнее дестабилизация организованной активности ФЖ при реперфузии.
Наиболее мощной дестабилизацией организованной активности характеризовалась реперфузия после 4 мин ишемии при ФЖ, когда доминирующие частоты ФЖ снизились на 1 Гц на 30-й с реперфузии, возросли на 8–9 Гц на 60-й с и снизились на 4–5 Гц на 3-й мин, а удельный вес доминирующих осцилляций оставался сниженным (33 %) на 1-й мин реперфузии, но возрос до 36–38 % на 2–10-й мин (рис. 2, H, рис. 3). Отметим, что доминирующие частоты ФЖ стабилизировались только до 8–9 Гц, что на 1 Гц меньше доминирующих частот ФЖ при перфузии до ишемии — это свидетельствует о неполном восстановлении активности ФЖ при 10-минутной реперфузии после 4 мин ишемии.
На наш взгляд, частота рефибрилляций будет возрастать после успешной дефибрилляции, проведенной при импульсном повышении частоты доминирующих осцилляций ФЖ и снижении их удельного веса на 1-й мин реперфузии. Частота рефибрилляций будет также возрастать после успешной дефибрилляции, проведенной при импульсном снижении частоты доминирующих осцилляций и повышении их удельного веса на 2–3-й мин реперфузии. Это подтверждает исследование C. Xing [11], в котором не было ни одной рефибрилляции после успешной дефибрилляции, проведенной на 1–20-й с ФЖ собаки, но регистрировались частые рефибрилляции на 1–3-й мин успешной дефибрилляции, проведенной на 1–4-й мин ФЖ. Можно предположить, что частота рефибрилляций будет снижаться после успешной дефибрилляции, проведенной при стабилизации частоты и удельного веса доминирующих осцилляций ФЖ на 4–5-й мин реперфузии.
По-видимому, при реперфузии возрастает поток электронов по дыхательной цепи митохондрий, что приводит к повышению синтеза аденозинтрифосфата. Без этого нельзя объяснить повышение частоты осцилляций ФЖ, так как для генерации осцилляций необходима энергия. Энергетический потенциал электрона составляет 1,14 В при его радиусе 10-15 м, а редокс-пары коферментов дыхательной цепи имеют окислительно-восстановительные потенциалы от 0,03 до 0,2 В при расстоянии между коферментами 2–3 × 10-9 м [14; 15]. Следовательно, плотность энергии на электроне в 10–100 млн раз больше, чем на редокс-парах коферментов. На наш взгляд, при таком значительном градиенте плотности энергии может происходить энергетическое разрушение коферментов редокс-пар при замедлении движения электронов по дыхательной цепи, а это неизбежно при возрастании потока электронов при реперфузии, так как пропускная способность дыхательной цепи не беспредельна. Энергетическое разрушение коферментов дыхательной цепи может служить триггером, запускающим генерацию свободных радикалов и другие механизмы повреждения сердца при реперфузии [16; 17].
Повреждение сердца при реперфузии происходит во время кардиохирургической операции с использованием длительной кардиоплегии [18; 19]. В такой ситуации актуальна защита от реперфузионного повреждения [20–22]. Перфузия сердца при искусственно вызванной ФЖ, используемая вместо длительной кардиоплегии, может исключить реперфузионные осложнения при кардиохирургической операции. Но наши результаты получены в экспериментах на изолированном сердце собаки, а операции проводят на сердце человека in situ , поэтому перфузия сердца при ФЖ во время кардиохирургического вмешательства нуждается в дальнейшем изучении.
Ограничения
Ограничение работы — отсутствие группы контроля (сердец без ишемии и реперфузии). Контролем в каждом опыте служили электрограммы сердца, сделанные до ишемии и реперфузии при ФЖ. Исходные параметры ФЖ до ишемии служат общепринятым контролем в исследованиях ФЖ при ишемии и реперфузии [4–6; 8–11]. 3.
Заключение
Организованная активность ФЖ более чувствительна к реперфузии, чем к ишемии. Это подтверждается тем, что частотно-амплитудная структура ФЖ изменяется при реперфузии значительнее, чем при ишемии. ФЖ характеризуется взрывной (импульсной) дестабилизацией организованной активности при реперфузии, о чем свидетельствует повышение частоты доминирующих осцилляций на 1-й мин реперфузии и их снижение на 2–3-й мин, снижение удельного веса доминирующих осцилляций на 4. 1-й мин и повышение на 2–3-й мин. Чем длительнее ишемия при ФЖ, тем значительнее дестабилизация организованной активности ФЖ при реперфузии.
Список литературы Частотно-амплитудная структура фибрилляции желудочков собаки при ишемии и реперфузии: экспериментальное исследование
- Лебедев Д.С., Михайлов Е.Н., Неминущий Н.М., Голухова Е.З., Бабокин В.Е., Березницкая В.В., Васичкина Е.С., Гарькина С.В., Голицын С.П., Давтян К.В., Дупляков Д.В., Заклязьминская Е.В., Зенин С.А., Иваницкий Э.А., Ильдарова Р.А.-Г., Комолятова В.Н., Костарева А.А., Кучинская Е.А., Лайович (Нестеренко) Л.Ю., Лебедева В.К., Любимцева Т.А., Макаров Л.М., Мамчур С.Е., Медведев М.М., Миронов Н.Ю., Митрофанова Л.Б., Попов С.В., Ревишвили А.Ш., Рзаев Ф.Г., Романов А.Б., Татарский Р.Б., Термосесов С.А., Уцумуева М.Д., Харлап М.С., Царегородцев Д.А., Школьникова М.А., Шлевков Н.Б., Шляхто Е.В., Шубик Ю.В., Яшин С.М. Желудочковые нарушения ритма. Желудочковые тахикардии и внезапная сердечная смерть. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(7):4600. https://doi.org/10.15829/1560-4071-2021-4600 Lebedev D.S., Mikhailov E.N., Neminuschiy N.M., Golukhova E.Z., Babokin V.E., Bereznitskaya V.V., Vasichkina E.S., Garkina S.V., Golitsyn S.P., Davtyan K.V., Duplyakov D.V., Zaklyazminskaya E.V., Zenin S.A., Ivanitsky E.A., Ildarova R.A., Komolyatova V.N., Kostareva A.A., Kuchinskaya E.A., Lajovich (Nesterenko) L.Yu., Lebedeva V.K., Lyubimtseva T.A., Makarov L.M., Mamchur S.E., Medvedev M.M., Mironov N.Yu., Mitrofanova L.B., Popov S.V., Revishvili A.Sh., Rzayev F.G., Romanov A.B., Tatarsky R.B., Termosesov S.A., Utsumueva M.D., Kharlap M.S., Tsaregorodtsev D.A., Shkolnikova M.A., Shlevkov N.B., Shlyakhto E.V., Shubik Yu.V., Yashin S.M. Ventricular arrhythmias. Ventricular tachycardias and sudden cardiac death. 2020 Clinical guidelines. Rossiysky kardiologichesky zhurnal = Russian Journal of Cardiology. 2021;26(7):4600. (In Russ.) https://doi.org/10.15829/1560-4071-2021-4600
- Zeppenfeld K., Tfelt-Hansen J., de Riva M., Winkel B.G., Behr E.R., Blom N.A., Charron P., Corrado D., Dagres N., de Chillou C., Eckardt L., Friede T., Haugaa K.H., Hocini M., Lambiase P.D., Marijon E., Merino J.L., Peichl P., Priori S.G., Reichlin T., Schulz-Menger J., Sticherling C., Tzeis S., Verstrael A., Volterrani M.; ESC Scientific Document Group. 2022 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death. Eur Heart J. 2022;43(40):3997-4126. PMID: 36017572. https://doi.org/10.1093/eurheartj/ehac262
- Tsao C.W., Aday A.W., Almarzooq Z.I., Anderson C.A.M., Arora P., Avery C.L., Baker-Smith C.M., Beaton A.Z., Boehme A.K., Buxton A.E., Commodore-Mensah Y., Elkind M.S.V., Evenson K.R., Eze-Nliam C., Fugar S., Generoso G., Heard D.G., Hiremath S., Ho J.E., Kalani R., Kazi D.S., Ko D., Levine D.A., Liu J., Ma J., Magnani J.W., Michos E.D., Mussolino M.E., Navaneethan S.D., Parikh N.I., Poudel R., Rezk-Hanna M., Roth G.A., Shah N.S., St-Onge M.-P., Thacker E.L., Virani S.S., Voeks J.H., Wang N.-Y., Wong N.D., Wong S.S., Yaffe K., Martin S.S.; American Heart Association Council on Epidemiology and Prevention Statistics Committee and Stroke Statistics Subcommittee. Heart disease and stroke statistics – 2023 update: a report from the American Heart Association. Circulation. 2023;147(8):e93-e621. PMID: 36695182. https://doi.org/10.1161/CIR.0000000000001123
- Panitchob N., Li L., Huang J., Ranjan R., Ideker R.E., Dosdall D.J. Endocardial activation drives activation patterns during long-duration ventricular fibrillation and defibrillation. Circ Arrhythm Electrophysiol. 2017;10(12):e005562. PMID: 29247031; PMCID: PMC5737741. https://doi.org/10.1161/CIRCEP.117.005562
- Cheng K.-A., Dosdall D.J., Li L., Rogers J.M., Ideker R.E., Huang J. Evolution of activation patterns during long-duration ventricular fibrillation in pigs. Am J Physiol Heart Circ Physiol. 2012;302(4):H992-H1002. PMID: 22180655; PMCID: PMC3322740. https://doi.org/10.1152/ajpheart.00419.2011
- Venable P.W., Taylor T.G., Shibayama J., Warren M., Zaitsev A.V. Complex structure of electrophysiological gradients emerging during long-duration ventricular fibrillation in the canine heart. Am J Physiol Heart Circ Physiol. 2010;299(5):H1405-H1418. PMID: 20802138; PMCID: PMC2993199. https://doi.org/10.1152/ajpheart.00419.2010
- Szabó Z., Ujvárosy D., Ötvös T., Sebestyén V., Nánási P.P. Handling of ventricular fibrillation in the emergency setting. Front Pharmacol. 2020;10:1640. PMID: 32140103; PMCID: PMC7043313. https://doi.org/10.3389/fphar.2019.01640
- Яблонский П.К., Гурьянов М.И. Организованная активность фибрилляции желудочков собаки при реперфузии после одноминутной ишемии сердца. Вестник Санкт-Петербургского университета. Медицина. 2023;18(2):141-149. https://doi.org/10.21638/spbu11.2023.203 Yablonsky P.K., Gurianov M.I. Organized activity of canine ventricular fibrillation under reperfusion after 1-minute ischemia of the heart. Vestnik of Saint Petersburg University. Medicine. 2023;18(2):141-149. (In Russ.) https://doi.org/10.21638/spbu11.2023.203
- Гурьянов М.И., Яблонский П.К. Дестабилизация организованной структуры фибрилляции желудочков при реперфузии. Общая реаниматология. 2023;19(5):59-64. https://doi.org/10.15360/1813-9779-2023-5-2338 Gurianov M.I., Yablonsky P.K. Destabilization of the organized structure of ventricular fibrillation during reperfusion. Obshchaya reanimatologiya = General Reanimatology. 2023;19(5):59-64. (In Russ.) https://doi.org/10.15360/1813-9779-2023-5-2338
- Bradley C.P., Clayton R.H., Nash M.P., Mourad A., Hayward M., Paterson D.J., Taggart P. Human ventricular fibrillation during global ischemia and reperfusion. Paradoxical changes in activation rate and wavefront complexity. Circ Arrhythm Electrophysiol. 2011;4(5):684-691. PMID: 21841193. https://doi.org/10.1161/CIRCEP.110.961284
- Xing C., Jin Q., Zhang N., Liu S., Lin C., Wu Q., Luo Q., Liu A., Wu L. Effect of flunarizine on defibrillation outcomes and early refibrillation in a canine model of prolonged ventricular fibrillation. Exp Physiol. 2019;104(11):1630-1637. PMID: 31465138; PMCID: PMC6899960. https://doi.org/10.1113/EP087068
- Perkins G.D., Graesner J.-T., Semeraro F., Olasveengen T., Soar J., Lott C., Van de Voorde P., Madar J., Zideman D., Mentzelopoulos S., Bossaert L., Greif R., Monsieurs K., Svavarsdóttir H., Nolan J.P.; European Resuscitation Council Guideline Collaborators. European Resuscitation Council guidelines 2021: Executive summary. Resuscitation. 2021;161:1-60. PMID: 33773824. https://doi.org/10.1016/j.resuscitation.2021.02.003
- Sattler S.M., Skibsbye L., Linz D., Lubberding A.F., Tfelt-Hansen J., Jespersen T. Ventricular arrhythmias in first acute myocardial infarction: Epidemiology, mechanisms, and interventions in large animal models. Front Cardiovasc Med. 2019;6:158. PMID: 31750317; PMCID: PMC6848060. https://doi.org/10.3389/fcvm.2019.00158
- Самойлов В.О. Медицинская биофизика: учеб. для вузов. СПб.: СпецЛит, 2013. С. 166-203. Samoilov V.O. Medical Biophysics. Textbook. Saint-Petersburg: SpetsLit Publ.; 2013. P. 166-203. (In Russ.)
- Nelson D.L., Cox M.M. Oxidative phosphorylation and photophosphorilation. In: Nelson D.L., Cox M.M. Lehninger Principles of Biochemistry. New York: W.H. Freeman and Company; 2014. P. 707-772.
- Hansen H.M., Sadredini M., Hasic A., Eriksen M., Stokke M.K. Myocardial oxidative stress is increased in early reperfusion, but systemic antioxidative therapy does not prevent ischemia-reperfusion arrhythmias in pigs. Front Cardiovasc Med. 2023;10:1223496. PMID: 37823177; PMCID: PMC10562584. https://doi.org/10.3389/fcvm.2023.1223496
- Prag H.A., Murphy M.P., Krieg T. Preventing mitochondrial reverse electron transport as a strategy for cardioprotection. Basic Res Cardiol. 2023;118(1):34. PMID: 37639068; PMCID: PMC10462584. https://doi.org/10.1007/s00395-023-01002-4
- Jung J.C., Kim S.-I., Hwang H.Y., Sohn S.H., Choi J.W., Chung J.-H., Seo J.-W., Kim K.-B. Serial ultrastructural evaluation of myocardial ischemic injury after infusion of del Nido cardioplegia in the human heart. J Thorac Cardiovasc Surg. 2022;164(2):528-535. PMID: 33008580. https://doi.org/10.1016/j.jtcvs.2020.08.083
- Saclı H., Kara I., Diler M.S., Percin B., Turan A.I., Kırali K. The relationship between the use of cold and isothermic blood cardioplegia solution for myocardial protection during cardiopulmonary bypass and the ischemia–reperfusion injury. Ann Thorac Cardiovasc Surg. 2019;25(6):296-303. PMID: 31308305; PMCID: PMC6923728. https://doi.org/10.5761/atcs.oa.18-00293
- Nakai C., Zhang C., Kitahara H., Shults C., Waksman R., Molina E.J. Outcomes of del Nido cardioplegia after surgical aortic valve replacement and coronary artery bypass grafting. Gen Thorac Cardiovasc Surg. 2023;71(9):491-497. PMID: 36843184. https://doi.org/10.1007/s11748-023-01914-x
- Krasniqi L., Ipsen M.H., Schrøder H.D., Hejbøl E.K., Rojek A.M., Kjeldsen B.J., Riber L.P. Stone heart syndrome after prolonged cardioplegia induced cardiac arrest in open-heart surgery — a pilot study on pigs. Cardiovasc Pathol. 2022;60:107427. PMID: 35436604. https://doi.org/10.1016/j.carpath.2022.107427
- Whittaker A., Aboughdir M., Mahbub S., Ahmed A., Harky A. Myocardial protection in cardiac surgery: how limited are the options? A comprehensive literature review. Perfusion. 2021;36(4):338-351. PMID: 32736492. https://doi.org/10.1177/0267659120942656


