Циркулирующая опухолевая ДНК как маркер минимальной резидуальной болезни при немелкоклеточном раке легкого
Автор: Казаков Алексей М., Лактионов Константин К., Гордиев Марат Г., Ахмедов Бахром Б., Кузьмина Валерия А.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Обзоры и аналитика
Статья в выпуске: 2 т.12, 2022 года.
Бесплатный доступ
Циркулирующая опухолевая ДНК (цоДНК) - это небольшие фрагменты нуклеиновой кислоты (около 166 пар нуклеотидов), которые не связаны с клетками или клеточными фрагментами и свободно циркулируют в кровяном русле. Доказано, что цоДНК является маркёром так называемой минимальной резидуальной болезни (МРБ) - опухолевого процесса, который не может быть зафиксирован при помощи рутинных методов исследования. Использование цоДНК в качестве маркера МРБ объясняется тем, что опухолевые клетки при некрозе, апоптозе, а также целенаправленно (внеклеточные везикулы и др), выделяют свою ДНК в кровь, тем самым делая возможным её детекцию и позволяя выявить МРБ. Доля цоДНК от всей циркулирующей внеклеточной ДНК может составлять от 0,01% до нескольких процентов в зависимости от размера опухоли, её васкуляризации, биологических свойств. В настоящее время большое внимание уделяется выявлению минимальной резидуальной болезни после радикально проведенной операции по поводу немелкоклеточного рака легкого (НМРЛ), поскольку в ряде крупных исследований было показано, что наличие цоДНК в плазме пациентов после операции является негативным прогностическим признаком. В качестве примера можно привести исследование Chaudhuri et all, в котором при наличии цоДНК в послеоперационной плазме 36-месячная безрецидивная выживаемость (БРВ) приближалась к 0%, в то время как отсутствие цоДНК в послеоперационной плазме ассоциировалось с 90-99% 36-месячной БРВ. Интерес к определению статуса МРБ посредством обнаружения цоДНК в послеоперационной плазме также обусловлен и тем, что это в перспективе может быть критерием назначения или не назначения адъювантного лечения в послеоперационном периоде. По данным исследования DYNAMIC, пациенты с позитивным статусом МРБ (наличие цоДНК в плазме после операции), которые получили адъювантную терапию, имели БРВ 22,4 vs 9,25 месяца - для пациентов с положительным МРБ статусом и не получивших адъювантное лечение. Таким образом, определение статуса МРБ на основе обнаружения цоДНК в плазме после радикальной операции может позволить вырабатывать персонализированную тактику ведения пациентов, радикально прооперированных по поводу немелкоклеточного рака легкого (НМРЛ).
Циркулирующая опухолевая днк, минимальная резидуальная болезнь, немелкоклеточный рак легкого
Короткий адрес: https://sciup.org/140296291
IDR: 140296291 | DOI: 10.18027/2224-5057-2022-12-2-14-20
Текст научной статьи Циркулирующая опухолевая ДНК как маркер минимальной резидуальной болезни при немелкоклеточном раке легкого
ОБОСНОВАНИЕ ИСПОЛЬЗОВАНИЯ ЦИРКУЛИРУЮЩЕЙ ОПУХОЛЕВОЙ ДНК В КАЧЕСТВЕ МАРКЕРА РЕЦИДИВА ЗАБОЛЕВАНИЯ
В настоящее время большое внимание уделяется выявлению минимальной резидуальной болезни при помощи жидкостной биопсии (выявлении цоДНК в кровотоке после радикально проведенной операции). Минимальная резидуальная болезнь (МРБ) определяется как наличие остаточной опухолевой массы у пациента после радикального удаления опухоли, которые не могут быть обнаружены при помощи применяемых сегодня рутинных диагностических методов [1]. Концепция метода заключается в том, что у правильно простадированного и радикально прооперированного пациента с немелкоклеточным раком легкого (НМРЛ) I–IIIA стадий, после радикально проведенного оперативного лечения в организме, не должно остаться опухолевых клеток, которые могли бы быть источником поступления цоДНК в кровоток или их количество должно быть настолько незначительным, что суммарная концентрация каждого мутантного аллеля опухоли в плазме (Maximum somatic allele frequency (MSAF))
должна стремиться к нулю или быть ниже порога чувствительности тест-систем [2]. Кроме того, помимо суммарного определения доли цоДНК от всей циркулирующей ДНК, возможно определение изменения концентрации каждого отдельного мутантного аллеля опухоли (Variant allele frequency — VAF), в плазме до и после оперативного лечения, что также является признаком отсутствия или наличия МРБ [3]. Несколько исследований подтвердили роль обнаружения МРБ на основе цоДНК при раке легкого путем определения различий в дооперационных и послеоперационных уровнях цоДНК [4]. Эти изменения были продемонстрированы в исследовании с участием 41 пациента с НМРЛ, у которых концентрацию конкретных мутантных аллелей (VAF) шести генов-драйверов опухоли (EGFR, KRAS, TP53, BRAF, PIK3CA и ERBB2) в цоДНК измеряли до оперативного лечения и в сроки со 2 по 10 день после его проведения (данные о наличии мутаций были получены в результате генетического исследования операционного материала) [4]. В каждом конкретном случае проводилось определение концентрации одного или двух мутантных аллелей из шести перечисленных. Частота мутантного аллеля снизилась со среднего значения 8,88% до 0,28%, причем наиболее резкое снижение произошло у пациентов с I стадией заболевания, в том числе у одного пациента цоДНК в плазме перестала определяться. Эти данные подтверждают, что уровень цоДНК отражает объём опухолевой ткани в организме. В более позднем исследовании сообщалось об аналогичных результатах у 76 пациентов с I–III стадией НМРЛ, перенесших хирургическое вмешательство, при этом изначальная концентрация мутантных аллелей (VAF) снизилась с 1,2% до 0,28% (p <0,001) после радикальной операции [5].
Поскольку обнаружение цоДНК в плазме указывает на наличие МРБ, было предложено использовать этот биомаркер для прогнозирования рецидива после хирургического лечения НМРЛ. Chaudhuri et all, показали, что послеоперационное обнаружение цоДНК (в течении 4-х месяцев после операции — MRD landmark) у радиально прооперированных пациентов (N=40) IB–IIIA стадии было связано с 0% 36-месячной безрецидивной выживаемостью (БРВ), тогда как в случае отсутствия цоДНК 36-месячная БРВ составила 93%. Анализ общей выживаемости показал схожие результаты (рис. 1).
Кроме того, обнаружение цоДНК предшествовало рентгенологическому обнаружению прогрессирования у 72% пациентов в среднем на 5,2 месяца. Наличие цоДНК в этом исследовании было признано независимым прогностическим фактором рецидива заболевания [6]. Исследование DYNAMIC продемонстрировало, что БРВ в группе пациентов с НМРЛ IB–IIIA стадий, перенесших R0 оперативное лечение, также сильно различалась в зависимости от послеоперационного статуса цоДНК. Медиана безре-цидивной выживаемости на период наблюдения 26 месяцев составила, соответственно, 9,8 месяцев в группе МРБ положительных пациентов, тогда как в группе МРБ отрицательных пациентов медиана не была достигнута. Медиана ОВ также значительно отличалась между группами МРБ положительных и отрицательных пациентов, составив 15,6 месяцев против недостигнутых значений, соответственно ([7], рис. 2).
Кроме того, DYNAMIC показало, что наиболее корректным для оценки риска прогрессирования является определение уровня цоДНК в период времени от 3 дней до 1 месяца после операции, в то время как определение уровня цоДНК сразу после операции и на следующий день даёт минимальные различия в БРВ и ОВ. В исследовании TRACERx было проведено филогенетическое отслеживание и обнаружение минимальной остаточной болезни с использованием профилей цоДНК после R0 резекции у пациентов с I–III стадией НМРЛ. Было обнаружено, что из 45 пациентов, у которых был диагностирован рецидив, у 37 (82%) человек цоДНК была обнаружена в период клинического рецидива или до него. У этих 37 пациентов среднее время от обнаружения цоДНК до клинического рецидива составляло 151 день (диапазон 0–984 дня). У 10 из 10 пациентов, у которых во время наблюдения развился второй первичный рак, цоДНК не была обнаружена, что отражает специфичность анализа МРБ в отношении первичной опухоли. У 23 пациентов, у которых не было рецидива в течение 3,2 лет наблюдения в среднем, цоДНК была обнаружена в 1 из 199 проанализированных точек забора плазмы после операции, что также говорит о высокой специфичности анализа статуса МРБ при помощи цоДНК [8].
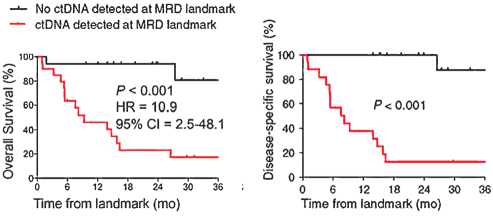
Рисунок 1. Зависимость БРВ и ОВ от наличия цоДНК в плазме взятой в течении 4-х месяцев после радикального оперативного лечения
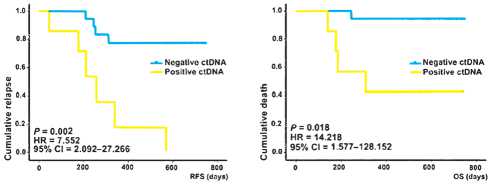
Рисунок 2. Зависимость БРВ и ОВ от цоДНК статуса после радикальной операции.
Обзоры и аналитика
ВЛИЯНИЕ КЛИНИКО-МОРФОЛОГИЧЕСКИХ ПАРАМЕТРОВ ОПУХОЛИ НА ЧАСТОТУ ОПРЕДЕЛЕНИЯ ЦИРКУЛИРУЮЩЕЙ ОПУХОЛЕВОЙ ДНК
Для того чтобы эффективно использовать цоДНК в качестве маркера МРБ, необходимо в первую очередь определить предоперационный статус цоДНК — положительный или отрицательный. Это важно, поскольку по данным исследования TRACERx, цоДНК при рецидиве заболевания была выявлена у 91% пациентов из тех, у которых она определялась в плазме крови до операции, и только у 64% больных у которых она не определялась в плазме до оперативного лечения. Существует ряд клинико-морфологических параметров, знание которых может быть полезным для интерпретации полученных результатов, а также мониторинга ложноотрицательных результатов предоперационной жидкостной биопсии.
Одним из таких параметров является стадия заболевания, отражающая распространенность опухолевого процесса. Чем выше стадия, тем больше опухолевая нагрузка и тем больше должна быть MSAF цоДНК в плазме, а также концентрация цоДНК в плазме (нг/мг) [9]. По данным подавляющего большинства исследований, с увеличением стадии увеличивалась и частота выявления цоДНК на дооперационном этапе [7,8,10,11].
Кроме того, увеличение опухолевой массы коррелирует с увеличением концентрации молекул внеклеточной ДНК (пг/мл), что положительно сказывается на вероятности обнаружения цоДНК в плазме [5].
Таблица 1. Частота выявления цоДНК до операции в зависимости от стадии в исследовании DYNAMIC
|
Стадия заболевания |
Частота выявления цоДНК до операции |
|
I |
9,4% |
|
II |
25,0% |
|
III |
65,6% |
По данным исследования DYNAMIC, наличие метастазов в регионарных лимфатических узлах являлось независимым фактором, увеличивающим частоту выявления цоДНК.
Другим параметром, влияющим на частоту выявления цоДНК, оказался морфологический тип опухоли. По данным ряда крупных исследований, цоДНК при локализованном НМРЛ до оперативного лечения намного чаще выявляется при плоскоклеточном раке (предположительно из-за более высокой частоты некрозов в опухоли), нежели при аденокарциноме [7,8,12].
Высокий индекс пролиферации (Ki-67) и наличие лимфоваскулярной инвазии также ассоциируются с повышением частоты выявления цоДНК [13,14].
Суммируя все вышеперечисленное, можно составить портрет пациента с наиболее высоким шансом выявления цоДНК: низкодифференцированный плоскоклеточный рак с наличием лимфоваскулярной инвазии, высоким индексом Ki67, II–III стадией заболевания с поражением регионарных лимфатических лимфоузлов. Наоборот, пациент с низким шансом выявления цоДНК будет иметь высокодифференцированную аденокарциному, отсутствие лимфоваскулярной инвазии, низкий индекс Ki67, I стадию заболевания или IIA стадию (без вовлечения регионарных лимфатических лимфоузлов).
ИСПОЛЬЗОВАНИЕ ДИНАМИЧЕСКОГО ИЗМЕНЕНИЯ УРОВНЯ ЦИРКУЛИРУЮЩЕЙ ОПУХОЛЕВОЙ ДНК В КАЧЕСТВЕ МАРКЕРА РЕЦИДИВА ЗАБОЛЕВАНИЯ
Динамическое изменение уровня цоДНК после оперативного лечения является современным, активно развивающимся методом определения МРБ при большом количестве онкологических заболеваний, в том числе при НМРЛ. Качественный и количественный анализ цоДНК в послеоперационной плазме позволяет судить о радикальности
Таблица 2. Частота выявления цоДНК до операции в зависимости от стадии в исследовании TRACERx
|
Стадия заболевания |
Частота выявления цоДНК до операции |
|
I |
37,0% |
|
II |
69,0% |
|
III |
57,1 % |
Таблица 3. Частота выявления цоДНК до операции в зависимости от стадии в исследовании Katrin Heider et al.
|
Стадия заболевания |
Частота выявления цоДНК до операции |
|
I |
52,0% |
|
II–III |
88,0% |
Таблица 4. Частота выявления цоДНК до операции в зависимости от стадии в исследовании Shuta Ohara et al.
|
Стадия заболевания |
Частота выявления цоДНК до операции |
|
I |
23,0% |
|
II–III |
71,0% |
Таблица 5. Частота выявления цоДНК на дооперационном этапе в зависимости от гистологического типа опухоли
Помимо выявления самого факта рецидива заболевания, цоДНК также может дать информацию от том, за счет какого именно клона опухолевых клеток произошел рецидив, и какие мутации представлены в циркулирующей опухолевой ДНК. В случае обнаружения в цоДНК какой-либо драйверной мутации появляется возможность назначения соответствующей таргетной терапии, а в случае выявления мутаций пассажиров — других опций лечения НМРЛ.
ВЛИЯНИЕ НАЛИЧИЯ ЦОДНК ПОСЛЕ ОПЕРАЦИИ НА ЭФФЕКТИВНОСТЬ АДЪЮВАНТНОГО ЛЕЧЕНИЯ
На данный момент нет никаких предикторов эффективности проводимой адъювантной ПХТ (аПХТ) или таргетной терапии ингибиторами EGFR (при наличии мутации в гене EGFR), за исключением косвенного влияния стадии заболевания. Определяя уровень цоДНК после радикального оперативного лечения, можно высказываться о наличии или отсутствии МРБ и, соответственно, в перспективе выделить на основании этого группы больных, которые получат преимущество от проведения адъювантной терапии (химиотерапии или таргетной терапии) [16]. Исследования, подтверждающие данную теорию, касались изучения уровня цоДНК при раке молочной железы, раке яичников, но наиболее показательные из них касались назначения адъювантной терапии после радикально пролеченного колоректального рака. Безрецидивная выживаемость (период наблюдения
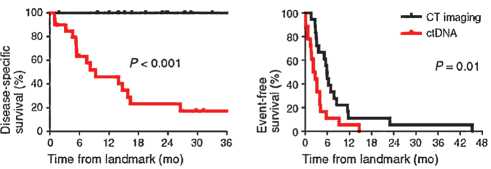
Рисунок 3. Зависимость бессобытийной выживаемости и времени до выявления прогрессирования от детекции цоДНК после радикальной операции [6].
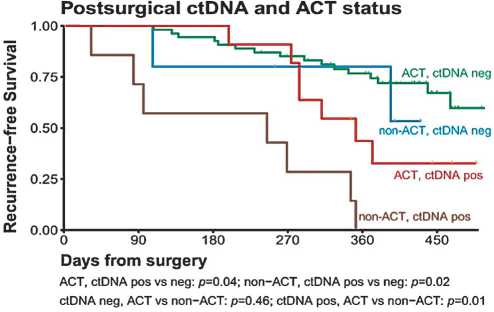
Рисунок 4. Зависимость безрецидивной выживаемости от статуса цоДНК и проведения или не проведения адъювантной полихимиотерапии
27 месяцев) у пациентов, радикально прооперированных по поводу колоректального рака II стадии, не получавших адъювантную ПХТ, у которых отсутствовала цоДНК после операции составила 90,2%, а для точно такой же группы пациентов, но с определяемой цоДНК после операции — 21% [17]. Результаты данного исследования показывают, что различный статус по цоДНК после радикального лечения оказывает сильное влияние на вероятность рецидивирования и может влиять на решение о назначении или отказе от адъювантного лечения. Что же качается рака легкого, работа, проведенная Bin Qiu, Wei Guo, Fan Zhang et al, показала значительное влияние послеоперационного статуса цоДНК на преимущество, полученное от проведения аПХТ. В исследовании участвовало 103 пациента с II–IIIA стадии НМРЛ. Они были разделены на группы в зависимости от послеоперационного статуса цоДНК и проведения или не проведения адъювантного лечения. Пациенты с положительным послеоперационным статусом цоДНК имели значительно более высокий риск рецидива по сравнению с цоДНК-негативными пациентами, как в группе аПХТ (p<0,05), так и в группе без аПХТ (p<0,05). Пациенты с отрицательным послеоперационным статусом цоДНК имели низкий риск рецидива, независимо от того, применялась ли аПХТ или нет (p = 0,46) ( [18], рис. 4).
Таким образом, послеоперационный статус цоДНК потенциально может разделить пациентов с НМРЛ на две группы: цоДНК-положительные пациенты, которые с большей вероятностью получат значимый выигрыш от проведения аПХТ, и цоДНК-отрицательные, для которых проведение аПХТ будет ассоциироваться с минимальным снижением риска прогрессирования заболевания.
ТЕКУЩИЕ ИССЛЕДОВАНИЯ
ИСПОЛЬЗОВАНИЯ ЦОДНК В КАЧЕСТВЕ ПРЕДИКТОРА АДЪЮВАНТНОЙ ТЕРАПИИ
В подтверждение перспективности использования цоДНК в качестве предиктора эффективности адъювантной терапии и стратификации пациентов по преимуществу, полученному от её проведения, можно привести в качестве примера 2 клинических исследования, идущих в настоящий момент.
Одно из них, CtDNALung — это открытое рандомизированное исследование фазы II с участием пациентов (≥18 лет), радикально прооперированных по поводу НМРЛ T1–3N0M0 с определяемым уровнем цоДНК после операции. Пациентам с детектируемым уровнем цоДНК до операции будет проведено тестирование на цоДНК через 3–6 недель после операции. Те, у кого в послеоперационном периоде будет обнаружена цоДНК, будут рандомизированы (1:1) для проведения адъювантного лечения или стандартного наблюдения. В когорте пациентов, получающих адъювантное лечение будет использоваться химиоиммунотерапия (платиновый дублет + ниволумаб). Основная цель — оценить влияние адъювантной терапии на безрецидивную выживаемость пациентов с НМРЛ T1–3N0M0 стадии с послеоперационным обнаружением МРБ. Дополнительные цели включают безопасность и переносимость адъювантной химиоиммунотерапии, общую выживаемость и изучение клиренса цоДНК на фоне проводимой терапии. Набор для скринингового исследования ctDNA начался в январе 2021 года [19].
Вторым исследованием является MErRMAID-1; оно будет исследовать эффективность и безопасность адъювантной химиотерапии + дурвалумаб по сравнению с химиотерапией + плацебо у пациентов с радикально прооперированным НМРЛ II/III стадии, чтобы оценить преимущества адъювантной терапии у пациентов с положительным статусом МРБ по данным послеоперационного анализа плазмы. Первичной конечной точкой является БРВ в когорте пациентов с положительным статусом МРБ [20].
ЗАКЛЮЧЕНИЕ
Определение статуса МРБ при помощи выявления цоДНК после радикального лечения пациентов с НМРЛ является актуальным и активно исследующимся направлением в онкологии. Данная методика может позволить более точно прогнозировать риск рецидива после радикального оперативного лечения и, тем самым, персонализировать послеоперационную тактику ведения больных с НМРЛ, основываясь, в том числе, на наличие или отсутствие признаков минимальной резидуальной болезни.


