Цитокиновые маркеры эффективности коррекции оксидативного стресса у больных ограниченной склеродермией
Автор: Тлиш М.М., Сорокина Н.В.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Дерматовенерология
Статья в выпуске: 3 т.11, 2015 года.
Бесплатный доступ
Цель; улучшение результатов лечения больных ОСД за счет повышения эффективности и сокращения сроков их лечения. Материал и методы. Проведено обследование и лечение 52 пациентов с ограниченной склеродермией. Методом адаптивной рандомизации из этих пациентов было сформировано две группы. В контрольной группе проводилось комплексное лечение согласно стандартам при данной нозологии. В основной группе пациенты дополнительно получали антиоксидантную терапию. Курс лечения в обеих группах составил 21 день. Результаты лечения оценивали в соответствии с динамикой кожного патологического процесса и цито-кинового профиля. Результаты. В процессе лечения положительная клиническая динамика у больных основной группы проходила быстрее и сопровождалась более выраженным снижением воспалительной активности сыворотки крови. Заключение. Полученные результаты свидетельствуют о том, что антиоксидантная терапия повышает эффективность и сокращает сроки лечения больных ограниченной склеродермией.
Ограниченная склеродермия, оксидативный стресс, цитокины
Короткий адрес: https://sciup.org/14918162
IDR: 14918162
Текст научной статьи Цитокиновые маркеры эффективности коррекции оксидативного стресса у больных ограниченной склеродермией
Существуют данные о важной роли нарушений клеточного иммунитета в развитии фиброза при ОСД. Так, у больных ОСД при биопсии здоровой на вид кожи вокруг очагов склероза обнаруживают ее периваскулярную и диффузную инфильтрацию преимущественно Т-лимфоцитами и макрофагами [10]. Еще одно подтверждение важной роли клеточного иммунитета в патогенезе данного заболевания — сходство кожных проявлений и хронической реакции «трансплантат против хозяина», которая, как известно, опосредована активированными Т-лимфоцитами. Иммунорегуляторный индекс (соотношение лимфоцитов CD4 и CD8) в крови больных ОСД обычно повышен за счет одновременного снижения числа лимфоцитов CD8 и повышения числа лимфоцитов CD4 [11].
В различных типах клеток стимуляция рецепторов для фактора некроза опухоли (ФНО) вызывает быстрое возрастание внутриклеточного уровня активных кислородных метаболитов (АКМ). Один из возможных механизмов образования АКМ при действии ФНО — нарушение функции митохондриальной цитохром-с-оксидазы. Энергетический дисбаланс в митохондриях приводит к снижению синтеза АТФ, усилению генерации АКМ и развитию оксида-тивного стресса [11, 12].
ФНО — основной, но далеко не единственный медиатор воспалительной реакции. По мере нарастания этой реакции в ней начинают участвовать интерлейкин (ИЛ) — 1, сходный с ФНО по своей био- логической активности, интерферон гамма (ИНФ-γ) и другие цитокины. Все они взаимодействуют между собой, усиливая действие друг друга и вызывая синтез и секрецию дополнительных медиаторов воспаления. Так, ИЛ-1 индуцирует синтез ИЛ-2 и ИЛ-4 — ростовых факторов, секретируемых T-хелперами. Кроме того, ИЛ-1 усиливает экспрессию рецепторов к ИЛ-2 и ИЛ-4, что создает условия для аутокринной регуляции пролиферации Т-хелперов. Повышенный уровень ИЛ-2 и свободных рецепторов ИЛ-2 на ранних стадиях склеродермии — признак прогрессирования заболевания. Выработка ИЛ-4 активированными Т-хелперами и тучными клетками стимулирует пролиферацию фибробластов и синтез коллагена, а также усиливает адгезию Т-лимфоцитов к эндотелию. Биологические эффекты ИЛ-6 сходны с таковыми ИЛ-1 и ФНОα. По многообразию клеточных источников продукции и мишеней биологического действия одним из наиболее активных цитокинов является ИЛ-6, который участвует в реализации воспалительной и иммунной реакций. Выраженным иммуносупрессорным эффектом обладает ИЛ-10, который снижает продукцию провоспалительных цитокинов, усиливает выработку антагониста рецептора ИЛ-1 и уменьшает адгезию лейкоцитов к эндотелиальным клеткам. Широко обсуждается роль ИЛ-17 в развитии аутоиммунных заболеваний за счет его способности запускать обширную тканевую реакцию, приводящую к миграции нейтрофилов в зону воспаления [11–14].
Тканевая ишемия и продукция некоторых провос-палительных цитокинов, в частности ФНО, способствуют формированию АКМ. Они, в свою очередь, индуцируют повреждение ДНК и эндотелиальных клеток, усиливают активацию тромбоцитов и приводят к повышенной секреции молекул адгезии или секреции воспалительных и профиброгенных цитокинов, стимулируют в низких концентрациях пролиферацию фибробластов кожи и повышенный синтез коллагена [15].
Изложенное свидетельствует о тесной взаимосвязи всех звеньев патогенеза ОСД и диктует необходимость коррекции оксидативных нарушений при данной нозологии. В этой связи представляет интерес «Цитофлавин» — препарат естественных метаболитов цикла Кребса, которые обуславливают метаболическую энергокоррекцию, антигипоксическую и антиоксидантную активность, оказывающую положительный эффект на процессы энергообразования в клетке, уменьшающую продукцию свободных радикалов и восстанавливающую активность ферментов антиоксидантной системы.
Цель: улучшение результатов лечения больных ОСД за счет повышения эффективности и сокращения сроков их лечения.
Материал и методы. Нами проведено обследование и лечение 52 пациентов (22 мужчин и 30 женщин) в возрасте 37±4,0 года с бляшечной формой ОСД. Длительность заболевания составляла 3,8±1,6 года. Прогрессирующая стадия дерматоза определена у подавляющего числа пациентов — 42 (80,8%) человек, стадия стабилизации — у 10 (19,2%). Методом адаптивной рандомизации из этих пациентов было сформировано две группы.
В первой группе (контрольная) 25 пациентам проводилось традиционное комплексное лечение согласно стандартам при данной нозологии: глюкокортикостероидные, противовоспалительные, анти-фиброзные, иммуномодулирующие, ферментные препараты, вазодилататоры, ангиопротекторы, анта- гонисты кальция и препараты, улучшающие метаболизм в тканях, витамины.
Во второй группе (основная) 27 больным, помимо традиционного лечения, дополнительно проводилась антиоксидантная терапия препаратом «Цитофла-вин» в режиме дозирования: по 760 мг двукратно — утром и вечером, с интервалом между приемами 8–10 часов, не позднее 17 часов, не менее чем за 30 мин до еды, не разжевывая и запивая водой.
Курс лечения в обеих группах составил 21 день.
Результаты лечения оценивали на 7-е, 14-е, 21-е сутки в соответствии с динамикой кожного патологического процесса:
значительное улучшение: исчезновение периферического венчика роста, уменьшение плотности и размеров очага, отсутствие субъективных ощущений (парестезии, чувства покалывания, жжения и дискомфорта в очаге);
улучшение: исчезновение периферического венчика роста, некоторое уменьшение плотности очага, прежние размеры поражения, отсутствие субъективных ощущений;
стабилизация: побледнение периферического венчика роста, отсутствие новых очагов поражения, прежние размеры и плотность очага, уменьшение субъективных ощущений;
без эффекта: отсутствие динамики;
ухудшение: прогрессирование патологического процесса, увеличение размеров очага или появление новых.
Выполняли иммунологические исследования пациентам обеих групп до и в конце лечения на 21-е сутки. Количественные показатели ФНО-а, ИЛ-1, ИЛ-2, ИЛ-4, ИЛ-6, ИЛ-10, ИЛ-17, ИНФ-у в сыворотке крови определяли методом иммуноферментного анализа с применением наборов реагентов, выпускаемых ЗАО «Вектор-Бест» (г. Новосибирск). Для получения сыворотки венозную кровь собирали в чистые пробирки с активатором свертывания в утреннее время с 9 до 11 часов (не ранее чем через 8 часов после приема пищи). Полученные результаты выражали в пикограмме вещества в 1 миллилитре плазмы (пг/мл).
Статистическую обработку результатов исследований проводили с использованием пакета статистических программ «Statistica 6.0» для персонального компьютера. Описательная статистика количественных признаков представлена средними и среднеквадратическими отклонениями. Для анализа нормально распределенных признаков применялись параметрические методы (t-критерий Стьюдента). Уровень достоверности соответствовал 95% (р<0,05).
Результаты. Динамика кожного патологического процесса у пациентов в обеих группах отличалась на каждом этапе обследования.
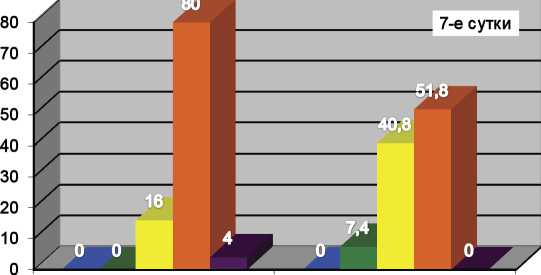
На 7-е сутки улучшение патологического процесса наблюдалось только в основной группе у 2 (7,4%) пациентов. Стабилизация кожного процесса в контрольной и основной группах констатирована соответственно у 4 (16,0%) и у 11 (40,8%) пациентов, отсутствие эффекта у 20 (80,0%) и у 14 (51,8%) (рис. 1а).
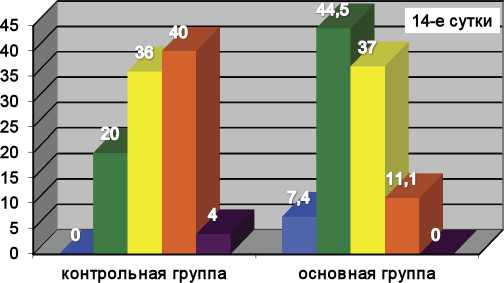
На 14-е сутки значительное улучшение отмечено только в основной группе у 2 (7,4%) пациентов. Улучшение в обеих группах (контрольной и основной) наблюдали у 5 (20,0%) и у 12 (44,5%), стабилизацию у 9 (36,0%) и у 10 (37,0%), отсутствие эффекта у 10 (40,0%) и у 3 (11,1 %) пациентов соответственно (рис. 1б).
контрольная группа основная группа
а)
б)
в)
-
■ значительное улучшение
-
■ улучшение
стабилизация без эффекта
-
■ ухудшение
■значительное улучшение
-
■ улучшение
стабилизация без эффекта
-
■ ухудшение
■значительное улучшение
-
■ улучшение
стабилизация без эффекта
-
■ ухудшение
Рис 1. Динамика кожного патологического процесса у больных ОСД:
-
а) динамика кожного патологического процесса у больных ОСД контрольной и основной групп на 7-е сутки; б) динамика кожного патологического процесса у больных ОСД контрольной и основной групп на 14-е сутки; в) динамика кожного патологического процесса у больных ОСД контрольной и основной групп на 21-е сутки.
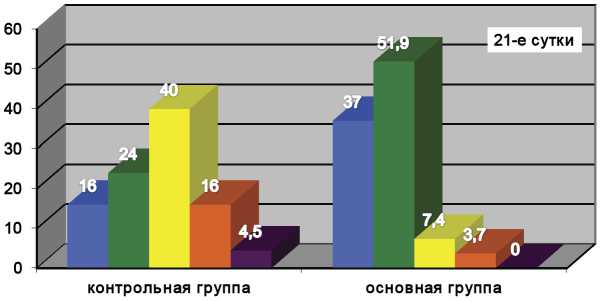
На 21-е сутки значительное улучшение в контрольной и основной группах зарегистрировано у 4 (16,0%) и у 10 (37,0%), улучшение у 6 (24,0%) и у 14 (51,9%), стабилизация у 10 (40,0%) и у 2 (7,4%), отсутствие эффекта у 4 (16,0%) и у 1 (3,7%) пациентов соответственно (рис. 1в).
Ухудшение патологического процесса отмечалось только у одного больного (4,0%) контрольной группы на протяжении всего периода лечения.
Следует также отметить, что динамика кожного процесса сопровождалась улучшением показателей цитокинового профиля. Результаты иммунологического исследования представлены в таблице.
Анализируя содержание провоспалительных цитокинов на 21-й день после проведенного лечения, мы выявили следующие изменения.
Содержание ИЛ-1 в сыворотке крови у пациентов с ОСД было повышено в среднем до 6,8±2,4 пг/ мл. На фоне проводимой стандартной терапии у 14 (56,0%) пациентов контрольной группы отмечена тенденция к снижению концентрации данного интерлейкина в среднем до 4,8±1,4 пг/мл. В основной груп-
Показатели цитокинового профиля крови больных ОСД до и после лечения в контрольной и основной группах
|
Показатель |
До лечения |
Контрольная группа (n=25) после лечения |
Основная группа (n=25) после лечения |
норма |
|
ИЛ-1 |
6,8±2,4 |
4,8±1,4 |
3,2±1,1* |
1,8±0,7 |
|
ИЛ-2 |
9,3±3,3 |
7,1±2,3 |
6,7±1,8 |
5,0±2,3 |
|
ИЛ-4 |
0,7±0,1 |
1,8±0,1* |
2,1 ±0,9* |
2,2±1,0 |
|
ИЛ-6 |
7,7±2,5 |
5,9±2,7 |
4,1±1,2* |
2,0±1,3 |
|
ИЛ-10 |
1,3±0,4 |
1,8±0,4 |
2,0±0,8 |
3,2±1,5 |
|
ИЛ-17 |
6,4±3,0 |
5,2±1,5 |
4,3±1,4 |
1,2±0,5 |
|
ФНО |
5,6±2,4 |
4,3±1,2 |
2,5±1,2* |
1,5±0,3 |
|
ИНФ-y |
6,7±2,3 |
6,1±2,4 |
4,5±1,3 |
2,0±1,2 |
П р и м еч а н и е : * — статистически значимые различия с группой пациентов до начала лечения, при р<0,05.
пе пациентов снижение данного показателя было более выраженным (М= 3,2±1,1 пг/мл) и наблюдалось у 21 пациента (77,8%), р<0,05.
Концентрация ИЛ-2 до начала терапии у пациентов обеих групп была повышена до 9,3±3,3 пг/мл. Достоверных изменений содержания ИЛ-2 в периферической крови после проведенной терапии нами выявлено не было. Однако отмечалась общая тенденция к снижению данного показателя в обеих группах (без достоверных различий между группами). Концентрация ИЛ-2 в сыворотке крови больных контрольной группы у 12 (48,0%) снижалась в среднем до 7,1±2,3 пг/мл. У пациентов основной группы снижение уровня ИЛ-2 выявлено у 17 больных (62,9%), при этом концентрация цитокина составила в среднем 6,7±1,8 пг/мл.
У 23 пациентов (85,2%) основной группы концентрация ИЛ-6 статистически значимо снижалась (в среднем до 4,1±1,2 пг/мл (р<0,05). В 25% случаев имела место тенденция к снижению (в среднем до 5,5±1,6 пг/мл) без статистически значимых отклонений. После проведенного стандартного комплекса лечения (контрольная группа) у 14 пациентов (56,0%) также отмечалась тенденция к снижению уровня ИЛ-6 (М=5,9±2,7 пг/мл), однако достоверных изменений выявлено не было.
Повышенное содержание ФНО до начала лечения у пациентов с ОСД (М=5,6±2,4 пг/мл) статистически значимо снижалось у 24 (88,9%) пациентов основной группы исследуемых больных (М=2,5±1,2 пг/мл). При этом в контрольной группе данный показатель имел тенденцию к снижению у 17 пациентов (68,0%), составив в среднем 4,3±1,2 пг/мл.
Содержание ИНФ — y у исследуемых пациентов было повышено до 6,7±2,3 пг/мл в первый день госпитализации. После проведенной терапии концентрация данного показателя имела тенденцию к снижению у 10 человек (40,0%) контрольной группы до 6,1±2,4 пг/мл и более выраженную у 16 человек (59,3%) основной группы до 4,5±1,3 пг/мл. Достоверных различий по группам получено не было.
Исследование уровня ИЛ-17 выявило исходное его повышение у пациентов с ОСД (6,4±3,0 пг/мл). После курса лечения также отмечается подавление синтеза цитокина у 11 человек (44,0%) контрольной группы и у 15 человек (55,6%) основной, более выраженное у пациентов второй группы (4,3±1,4 пг/мл).
Противовоспалительные цитокины, сниженные у пациентов с ОСД до начала лечения, после окончания его курса имели тенденцию к повышению концентрации в сыворотке крови. Так, содержание ИЛ-4 статистически значимо повышалось у 18 пациентов
(72,0%) контрольной группы и у 21 пациента (77,8%) основной группы (1,8±0,1 пг/мл и 2,1±0,9 пг/мл соответственно; р<0,05).
Концентрация ИЛ-10 повышалась после проведенной терапии в обеих исследуемых группах и составила в среднем 2,0±0,8 пг/мл у пациентов основной группы и 1,8±0,4 пг/мл у пациентов контрольной группы. При этом повышение концентрации цитокина было отмечено у 10 пациентов контрольной группы (40,0%) и у 16 пациентов (59,3%) основной. Статистически значимых отличий при сравнении групп по данному показателю выявлено не было.
Обсуждение. Таким образом, у пациентов основной группы, получавших в составе комплексного лечения «Цитофлавин», регресс дерматоза начинался в более ранние сроки и проходил более активно. Нами также выявлено повышение концентрации провоспалительных и снижение уровня противовоспалительных цитокинов у больных ОСД до начала лечения [10–14]. После проведенного курса терапии отмечено в обеих группах снижение воспалительной активности сыворотки крови, причем достоверное повышение концентрации противовоспалительных цитокинов (ИЛ-4) и снижение содержания провоспа-лительных цитокинов (ИЛ-1, ИЛ-6, ФНО) зафиксировано у пациентов основной группы, прошедших курс традиционной терапии в сочетании с препаратом «Цитофлавин».
В ходе проведения лечения каких-либо побочных действий и осложнений ни в одном клиническом случае выявлено не было.
Заключение. «Цитофлавин», обладая антиги-поксическим и антиоксидантным действием, способствует снижению провоспалительных и повышению противовоспалительных цитокинов, сокращает сроки терапии и повышает эффективность лечения больных ОСД.
Список литературы Цитокиновые маркеры эффективности коррекции оксидативного стресса у больных ограниченной склеродермией
- Dacczak-Pazdrowska A, Kowalczyk M, Szramka-Pawlak B, Gornowicz-Porowska J, etal. Clinical research lnterleukin-17A and interleukin-23 in morphea/Arch Med Sci 2012; 8 (6): 1089-1095 DOI (digital object identifier): 10.5114/aoms.2012.32421
- Kreuter A, Krieg T, Worm M, et al. Diagnosis and therapy of localized scleroderma. J Deutsch Dermatol Ges 2009; 7 (suppl. 6): S1-14
- Xie Y, Zhang X, Wakasugi S, Makino T, Inoue Y, Ihn H. Im-munohistochemical characterization of the cellular infiltrate in localized scleroderma. Int J Dermatol 2008; 47: 438-42
- Dziankowska-Bartkowiak B, Gerlicz-Kowalczuk Z, Waszczykowska E. Angiogenin and SDF-1 alpha serum concentration in patients with systemie sclerosis: In relation to clinical status. Arch Med Sci 2011; 7: 92-96
- Carolyn A., Bangert, Kim A, Jacobe H. Localized Sclero-derma. In: MayesMD (ed.) A Visual Guide to scleroderma and approach to Treatment Springer. DOI 10.1007/978-1-4939-0980-3. Science+Business Media New York, 2014; p. 5-21
- Hatomochi A, Ono M, Arakawa M, et al. Analysis of collagen gene expression by cultured fibroblasts in morphea. Br J Dermatol 1992; 126:216-221
- Scharffetter Kochanek K, Goldermann R, Lehmann P, et al. PUVA therapy in disabling pansclerotic morphea of children. Br J Dermatol 1995; 132: 830-831
- El-Mofty M, Zaher H, Basseila M. Low dose broad-band UVA in morphea using a new method for evaluation. Photoder-matol Photoimmunol Photomed 2000; 16: 43-49. DOI: 10.1034/j.1600-0781.2000.d01 -1.x
- Mayes MD, Lacey JV Jr, Beebe-Dimmer J, et al. Prevalence, incidence, survival and disease characteristics of systemic sclerosis in a large US population. Arthritis Rheum 2003; 48: 2246-2255
- Ягода A.B., Гладких H.H. Аутоиммунные аспекты нарушения коллагенового гомеостаза при недифференцированной дисплазии соединительной ткани. Медицинская иммунология 2007; 9(1): 61-68
- Козлова B.A., Сенникова С.В. Система цитокинов. Новосибирск: Наука, 2004; 324 с.
- Калинина Е.П., Иванов E.M., Исаченко Е.Г. Нарушения межсистемных взаимодействий при хроническом воспалительном процессе. Медицинская иммунология 2007; 9 (6): 581)
- Abbas АК, Lichtman АН. Basic Immunology 2-ed. Else-vier, 2004; 322 p.
- Иванов A.A., Гладких О.П., Кузнецова A.B., Данилова Т.И. Межклеточные и клеточно-матриксные взаимодействия в патологии. Молекулярная медицина 2005; 2: 16-21
- Sambo Р, Baroni SS, Luchetti М, et al. Oxidative stress in scleroderma: Maintenance of scleroderma fibroblast phenotype by the constitutive upregulation of reactive oxygen species generation through the NADPH oxidase complex pathway. Arthritis Rheum 2001; 44: 2653-2664.


