Цитологическая оценка удвоенных гаплоидов кабачка (Cucurbita pepo L.)
Автор: Домблидес Е.А., Кан Л.Ю., Химич Г.А., Коротцева И.Б., Домблидес А.С.
Журнал: Овощи России @vegetables
Рубрика: Селекция и семеноводство сельскохозяйственных растений
Статья в выпуске: 6 (44), 2018 года.
Бесплатный доступ
Из девяти отозвавшихся в культуре неопыленных семяпочек образцов кабачка в 2015-2017 годах было получено 147 новых генотипов. Для оценки уровня плоидности полученных растений-регенерантов RO кабачка необходимо проводить цитологический анализ. Малый размер митотических хромосом и их относительно большое количество в роде Cucurbita делает их трудными для точного подсчета, даже несмотря на то, что они, как правило, хорошо разделены. В результате проведенной работы была подобрана оптимальная методика окрашивания хромосом кабачка с использованием модернизированного нами пропионно-лакмоидного метода. При приготовлении давленных препаратов использовали меристемы стебля и кончиков корней. Кабачок оказался трудным в цитологическом плане объектом ввиду малой частоты митозов и небольшого числа метафаз с хорошим разбросом хромосом. В результате удалось получить микрофотографии хромосом кабачка C. pepo subsp. brevicaulis var. giraumons Duch и отдаленного гибрида (селекционный образец № 37) между кабачком сорта Корнишонный и твердокорой тыквой C...
Кабачок (cucurbita pepo l.), dh-растения, хромосомный анализ, культура неопыленных семяпочек in vitro, гиногенез, гаплоиды кабачка, цитологическая оценка, пропионо-лакмоидный метод анализа хромосом
Короткий адрес: https://sciup.org/140238392
IDR: 140238392 | УДК: 635.621.3: | DOI: 10.18619/2072-9146-2018-6-3-7
Текст научной статьи Цитологическая оценка удвоенных гаплоидов кабачка (Cucurbita pepo L.)
Домблидес Е.А.* – зав. лабораторией биотехнологии, кандидат с.-х. наук Кан Л.Ю. – с.н.с. лаборатории генетики и цитологии, кандидат с.-х. наук Химич Г.А. – с.н.с. лаборатории селекции тыквенных культур Коротцева И.Б. – зав. лабораторией селекции тыквенных культур, кандидат с.-х. наук Домблидес А.С. – зав. лабораторией генетики и цитологии, кандидат с.-х. наук
Кабачок относится к виду C. pepo, который отличается огромным многообразием форм. В связи с большой амплитудой изменчивости, присущей виду, Дюшен называл его Cucurbita polymorpha. Н.И. Вавилов отдавал пальму пер- венства этому виду, сравнивая его со всеми изученными видами диких и культурных растений, за макроскопичность варьирующих признаков. Он отмечал, что «…в пределах C. pepo L. мы имеем формы, легко скрещивающиеся между собой и в тоже время отличающиеся примерно в 1000 раз по весу плодов. Плоды некоторых декоративных тыкв не превышают размеров куриного яйца, и даже меньше, тогда как при тех же условиях можно вырастить формы C. pepo до 3 пудов весом. Трудно представить себе большее разнообразие форм, окрасок, вегетативных признаков, формы плода.» (Вавилов, 1925). В связи с этим, получение удвоенных гаплоидов у этой культуры весьма актуально не только по причине ускорения селекционного процесса, но и за счет реализации значительного потенциала гаметоклональной изменчивости, заложенной у этого вида.
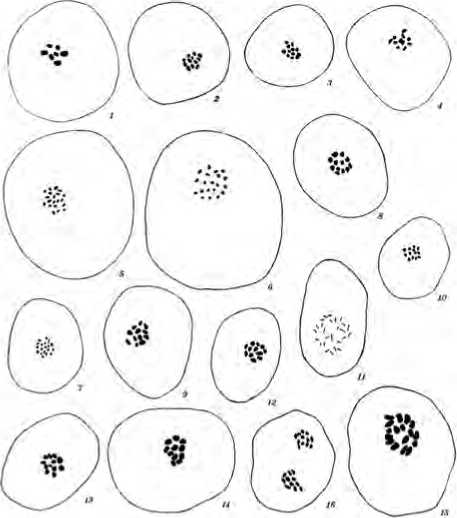
В России исследования по получению удвоенных гаплоидов тыквенных культур в лаборатории биотехнологии ФГБНУ ФНЦО (ранее ВНИИССОК) ведутся с 2008 года и уже достигнуты определенные успехи (Suprunova, Shmykova, 2008; Шмыкова, Супрунова, 2009; Шмыкова и др., 2011; Шмыкова и др., 2015; Домблидес и др., 2016; Domblides et al., 2017). Необходимо для определения плоидности проводить цитологический анализ полученных в культуре неопыленных семяпочек растений-регенерантов. Однако на этом этапе исследователи встречаются с определенными затруднениями. Хромосомы растений семейства Cucurbitaceae отличаются исключительно мелкими размерами, что затрудняет их подсчет. Еще в 1925 году Н.И. Вавилов в своей работе «О междуродовых гибридах дынь, арбузов и тыкв», опираясь на сведения, предоставленные профессором Левитским Г.А., описал кариотипы основных тыквенных культур, где для С. pepo количество хромосом варьировало от 40-42 до 44-46 (Вавилов, 1925) (рис.1). Малый размер митотических хромосом и их относительно большое количество в роде Cucurbita делает трудным их точный подсчет, даже несмотря на то, что они, как правило, хорошо разделены. Долгое время существовали разногласия между исследователями в количестве хромосом у различных представителей этого рода. Whitaker в 1933 году опубликовал работу, в которой привел данные кариотипического анализа материнских клеток микроспор 12 видов семейства Cucurbitaceae . Для C. pepo var. orange gourd гаплоидный набор хромосом был определен n = 20, и была представлена иллюстрация, где хромосомы были зарисованы в виде точек (Whitaker, 1933) (рис.2). Позже Whitaker and Davis (1962), Varghese (1973), Jeffrey (1980), Metwally et al. (1996) сообщили, что несмотря на то, что о цитологии рода Cucurbita мало известно, поскольку его цитологические исследования крайне затруднительны, все виды имеют диплоидный набор хромосом 2n = 40. Для огурца Cucumis sativus , относящемуся к другому роду семейства Cucurbitaceae и имеющему практически в три раза меньше набор хромосом (2n = 14), проводились исследования по кариотипическому анализу с использованием C- banding технологии, где подробно описаны размеры и приведены особенности каждой пары митотических хромосом (Chen et al., 1998). Нам не встретилось качественных иллюстраций кариотипического анализа представителей рода Cucurbita . В большинстве случаев на опубликованных фото были представлены сгустки хроматина в виде точек в клетке.
В связи с описанными выше трудностями большинство исследователей предпочитают использовать для определения плоидности растений метод проточной цитометрии либо косвенные методы (подсчет числа хлоропластов в замыкающих клетках устьиц, размер устьиц, количество устьиц на 1 мм2) (Kurtar ES, Balkaya A., 2010).
Цель этого исследования заключалась в цитологической оценке растений-регенерантов кабачка Cucurbita pepo L., полученных в культуре неопыленных семяпочек in vitro и подбор оптимальной методики окрашивания хромосом.
ЛИТОНОМИИ BII (Oil тыкв, дынь и ЛРВУЗОВ
Физиологическая .............)сть видов п родов тыквенных растении ПОДТПирждастся it различиями ИХ карнолш-имтини типа. Хромоспиц ТЫКПРНПЫХ рПСТСИИЙ ОТЛН'тЮТСМ ИсКЛЮЧКТВЛЬМоЙ МОЛ КОСТЬ*) И ТРУДНОСТЬЮ ДЛЯ ПОДСЧВТН. Цо СПСДОННЛМ. нобмпо С<юбЩОПИЫМ ИВЫ Проф. Г. А. .’lelUlT-
Дыни - СнемтЫ me/о характерпауются • -'* хромостыыя
Огурцы — £ысииН| M/tr*« .И•
Арбуз -Citron — CilruUue ralgarie . 22*
CuruH>iia р#р» — круипшьимиин гикни 44 ill •
C. pep** orifera ............. 40—42•
С. тикАаМ . . 44 —4B ■
C. maxima * , . . , . 44 «Я •
Пыльца отдельных родов тыквенных резко отличии и по размерам и l , форме (рис. I). Все виды тыквы характеризуются крупной пыльцой
С, maxima . - • • * ••
С. moechaia ..... ■ <-ц * **
С. maxima (Hubbard) . . • • • •*
Отдельные виды и ботанические группы отличаются ио поверхт-н. по шипикам и полоскам, покрывающим поверхность пыльцы, ни чж и форме ее нор.
Рис. 1. Фото из статьи Вавилова Н.И.
«О междуродовых гибридах дынь, арбузов и тыкв», 1925.
Fig.1. Photo from article of Vavilov N.I. ‘Intergeneric hybrids of melons, watermelons and squashes’, 1925.
Материалы и методы
Растительный материал и условия выращивания донорных растений
В работе использовали селекционные образцы кабачка из коллекции лаборатории тыквенных культур ФГБНУ ФНЦО. Донорные растения выращивали в 20152016 годах в Московской области в пленочных теплицах и в условиях открытого грунта.
Культура неопыленных семяпочек. Получение гино-генных растений кабачка проводили по методике, разработанной в лаборатории биотехнологии ФГБНУ ФНЦО (ВНИИССОК) (Шмыкова и др., 2015).
Выращивание растений-регенерантов
Растения с нормально развитыми листьями и корневой системой переносили в вегетационные сосуды, заполненные смесью торфа и перлита (7:3), накрывали перфорированными пластиковыми стаканчиками для адаптации растений к условиям in vivo. Выращивали растения-регенеранты в климатической камере при режиме 25°С круглосуточно, 16 ч день/8 ч ночь, освещение 9000 люкс.
Подсчет числа хромосом с использованием пропио-но-лакмоидного метода
Цитологическое исследование проводили путем приготовления давленых препаратов меристемы стебля и кончиков корней растений, корешков проростков, используя модифицированный нами пропионо-лакмоид-ным метод (Соловьева, 1982) окрашивания хромосом (Домблидес и др., 2016).
Препараты просматривали с помощью микроскопа Zeiss Scope.A1, оснащенного камерой Digital Camera Power Shot G10 Canon. Обработку изображений проводили с помощью программы Axio Vision, версия 4.8 (Carl Zeiss MicroImaging, Jena, Germany).
Figs,
г-10.—Fig. i,
Curiunis eatiws,
iM. 7 chromosomes; fig.
i.C. mda
van Golden Cnsaba, iM 12 chromosomes; fig. 3,
C тупосагрнх,
iM. 12 chromosome*, fig. 4,
Citr«lhi4 cotocyHthis,
iM. 11 chromosomes; fig. $,
Cururbitu рсЯ
var. Orange gourd, iM. ro chromosomes; fig. 6,
С. Я!*°
var- Orange gourdXLong Island Bush, iM. 20 chromosomes; fig. 7, С.
теккох^егта,
tM.
за
chromosomes; fig. K,
Bcnixciua hispida.
iM.
12
chromosomes; fig. 9,
Ecbaliium rlalcrit
Рис. 2. Иллюстрация кариотипического анализа материнских клеток микроспор 12 видов семейства Cucurbitaceae (по Whitaker, 1933).
Fig.2. Illustration of karyotype analysis of mother cells of microspore in 12 species of Cucurbitaceae (по Whitaker, 1933).
Результаты
В результате проведенной работы из 9 отозвавшихся в культуре неопыленных семяпочек образцов C. pepo в 20152017 годах было получено 147 новых генотипов, из которых при последующей регенерации развилось 346 растений-регенерантов. На этапе адаптации к условиям in vivo потери составили 25%. В дальнейшем потери наблюдались в связи с тем, что не всегда удавалось получить потомство от самоопыления у растений – регенерантов R0 (Домблидес и др., 2018). Причиной этого служили как физиологические особенности цветения этой культуры (неодновременное распускание мужских и женских цветков), так и нарушение плоидности полученных в культуре неопыленных семяпочек in vitro растений. Проведение цитологической оценки у этой культуры представляло определенные трудности в связи с мелкими размерами хромосом. Поскольку в литературе мы не смогли найти оптимальной методики для окраски хромосом у этой культуры, то нами было апробировано несколько методик с использованием ацетокармина (Паушева, 1988) и флуоресцентного красителя 4',6-Диамидино-2-фенилиндол дигидрохлорида (DAPI) (Пухальский и др, 2007). Оптимальной оказалась модернизированная нами методика окрашивания хромосом в меристемных клетках с использованием пропион-лакмоида, успешно применяемая при цитологическом анализе различных объектов овощных культур (Кан, 2008; Тимин и др., 2013). При приготовлении давленных препаратов использовали меристемы стебля и кончиков корней.
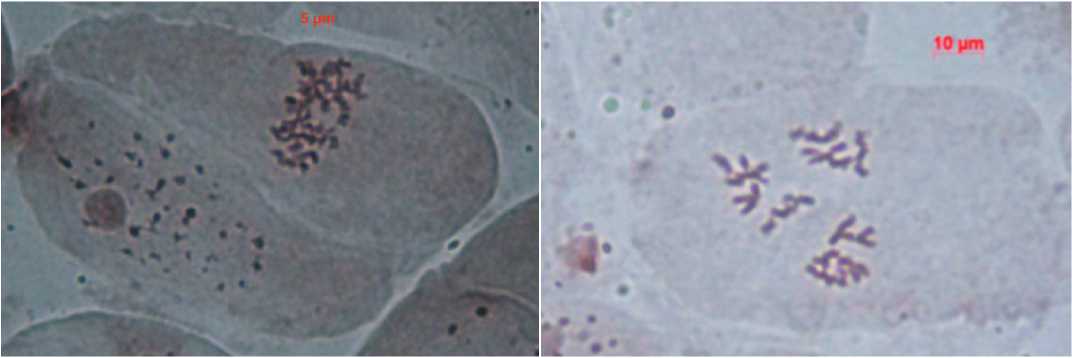
Кабачок оказался трудным в цитологическом плане объектом ввиду малой частоты митозов и небольшого числа метафаз с хорошим разбросом хромосом. В результате исследований удалось получить микрофотографии хромо- сом кабачка C. pepo subsp. brevicaulis var. giraumons Duch и отдаленного гибрида (селекционный образец №37) между кабачком сорта Корнишонный и твердокорой тыквой C. pepo subsp. longicaulis Greb. var. pepo, а также полученных из них удвоенных гаплоидов (рис.3). Несмотря на достаточно мелкие размеры (около 2 мкм), хромосомы достаточно четко видны и отличаются от опубликованных другими авторами клеток, где за хромосомы принимаются темноокра-шенные точки.
Практически все проанализированные растения-регенеранты, успешно прошедшие этап адаптации к условиям in vivo , оказались удвоенными гаплоидами 2n = 2х = 40 и в последующем успешно завязали семена при самоопылении.
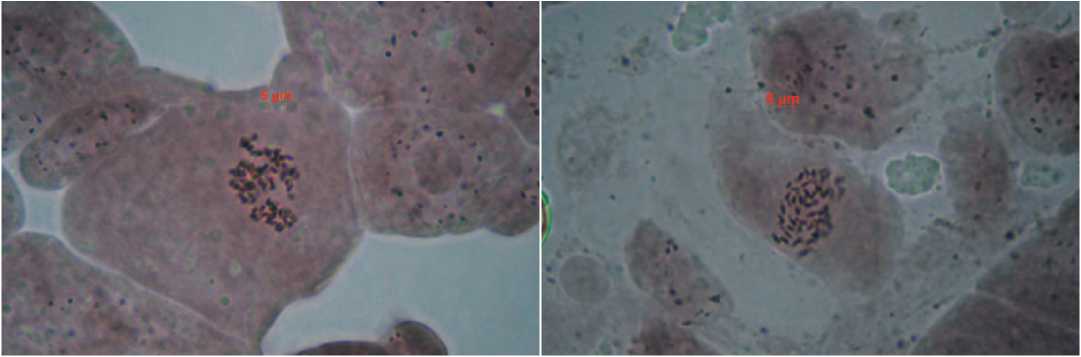
Около 20% из проанализированных растений R0 оказались миксоплоидами, то есть в меристемах этих растений одновременно присутствовали диплоидные и полиплоидные клетки (рис.4).
Доля предположительно гаплоидных растений составляла 7% от общего числа полученных растений-регенерантов, однако получить качественные фото их хромосом нам не удалось. Достаточно часто такие растения образовывали бутоны, находясь еще в культуральных сосудах (рис. 5), они были более мелкого размера, плохо укоренялись и адаптировались к условиям in vivo . Трудность проведения цитологической оценки у этих растений также была связана с очень мелкими размерами клеток и самих растений-гаплоидов, а также малым количеством активно делящихся меристем. Кроме того, растения были ослабленными и при отщипывании для анализа кончиков корней и пазушных меристем часто погибали, в связи с чем невозможно было провести повторный анализ.
АБ
В
Г
Рис. 3. Метафазы кабачка C. pepo subsp. brevicaulis var. giraumons Duch (А) и отдаленного гибрида
(селекционный образец №37) между кабачком сорта Корнишонный и твердокорой тыквой C. pepo subsp. pepo var. pepo (В), а также полученных из них удвоенных гаплоидов (Б, Г).
Fig. 3. Metaphase plate of C. pepo subsp. brevicaulis var. giraumons Duch (А) and distant hybrid (breeding accession N37)
between ‘Cornisoniy’ and winter squash C. pepo subsp. pepo var. pepo (В) and produced from them doubled haploids (Б, Г).
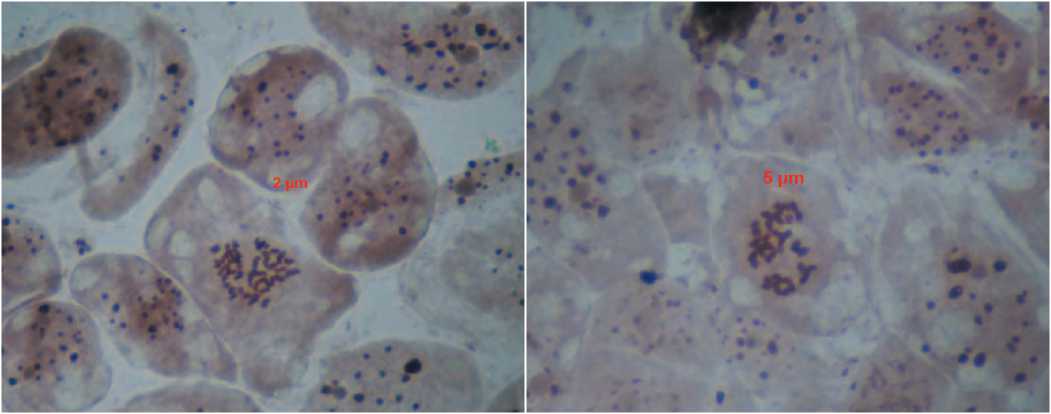
Рис.4. Метафазы в меристемах миксоплоидных растений.
Fig.5. Metaphase plates in meristems of mixploid plants.

АБ

В
Рис.5. Внешний вид гаплоидного (А, Б) и DH-растения кабачка (В, Г), находящихся на одинаковых фазах развития. Fig.5. Haploid plants (А, Б) and DH-plants of summer squash (В, Г) at same stages of development

Г
В результате проведенной работы нами была подобрана оптимальная методика окрашивания хромосом кабачка с использованием пропионно-лакмоидного метода. Проведенный цитологический анализ полученных растений регенерантов показал, что 7% из них были гаплоидными, около 20% из проанализированных растений R0 оказались миксоплоидами, а остальные были удвоенными гаплоидами (2n = 2х = 40).
Впервые были получены микрофотографии хромосом кабачка C. pepo subsp. brevicaulis var. giraumons Duch и его отдаленного гибрида с твердокорой тыквой C. pepo subsp. longicaulis Greb. var. pepo, а также полученных из них удвоенных гаплоидов.
Список литературы Цитологическая оценка удвоенных гаплоидов кабачка (Cucurbita pepo L.)
- Вавилов Н.И. (1925) О междуродовых гибридах дынь, арбузов и тыкв. Труды по прикладной ботанике и селекции. Т. 14. Вып. 1. C.1-35.
- Домблидес Е.А., Шмыкова Н.А., Заячковская Т.В., Химич Г.А., Коротцева И.Б., Кан Л.Ю., Домблидес А.С. Получение удвоенных гаплоидов в культуре неопыленных семяпочек кабачка (Cucurbita pepo L.). В сборнике: Биотехнология как инструмент сохранения биоразнообразия растительного мира (физиолого-биохимические, эмбриологические, генетические и правовые аспекты). Материалы VII Международной научно-практической конференции, посвященной 30-летию отдела биотехнологии растений Никитского ботанического сада. 2016. С.28-29.
- Домблидес Е.А., Шмыкова Н.А., Шумилина Д.В., Заячковская Т.В., Минейкина А.И., Козарь Е.В., Ахраменко В.А., Шевченко Л.Л., Кан Л.Ю., Бондарева Л.Л., Домблидес А.С. Технология получения удвоенных гаплоидов в культуре микроспор семейства капустные. ФГБНУ «Всероссийский НИИ селекции и семеноводства овощных культур». Москва, 2016.
- Домблидес Е.А., Шмыкова Н.А., Химич Г.А., Коротцева И.Б., Домблидес А.С. ОБРАЗОВАНИЕ АНОМАЛЬНЫХ ЦВЕТКОВ В ПОТОМСТВЕ УДВОЕННЫХ ГАПЛОИДОВ КАБАЧКА (CUCURBITA PEPO L.). Овощи России. 2018; (5): 13-17 DOI: 10.18619/2072-9146-2018-5-13-17
- Кан Л.Ю. Цитологические исследования в селекционной работе на основе межвидовой гибридизации в роде Allium L. «Хромосомы и эволюция». Симпозиум памяти Г.А. Левитского. Санкт-Петербург, 2008. С.53-55.
- Паушева З. П. Практикум по цитологии растений/З.П. Паушева. -Изд. 4-е, перераб. и доп. -Москва: Агропромиздат, 1988. 271 с.
- Пухальский В.А., Соловьев А.А., Бадаева Е.Д., Юрцев В.Н. Практикум по цитологии и цитогенетике растений. М.: Изд-во "КолосС". 2007.
- Соловьёва Л.В. Практикум по цитологии плодовых растений. -М.: Изд-во МГУ,1982. -54 с.
- Тимин Н.И., Пышная О.Н., Агафонов А.Ф., Мамедов М.И., Титова И.В., Кан Л.Ю., Логунова В.В., Романов В.С., Шмыкова Н.А., Тимина Л.Т., Гуркина Л.К., Джос Е.А., Супрунова Т.П., Кривошеев С.М., Енгалычева И.А. Межвидовая гибридизация овощных растений (Allium L. -лук, Daucus L. -морковь, Capsicum L. -перец). Москва, 2013.
- Шмыкова Н.А., Супрунова Т.П. Индукция гиногенеза в культуре in vitro неопыленных семяпочек Cucumis sativus L. Гавриш. 2009. № 4. С. 40-44.
- Шмыкова Н.А., Шумилина Д.В., Кушнерёва В.П., Химич Г.А. Индукция гиногенеза в культуре неопыленных семяпочек тыквы. Овощи России. 2011. № 1 (10). С. 28-31.
- Шмыкова Н.А., Химич Г.А., Коротцева И.Б., Домблидес Е.А. (2015) Перспективы получения удвоенных гаплоидов растений семейства Сcurbitaceae. Овощи России. 2015; (3-4): 28-31 https://doi.org/10.18619/2072-9146-2015-3-4-28-31
- Chen, J., Staub, J. E., & Jiang, J. (1998). Genetic Resources and Crop Evolution, 45(4), 301-305 DOI: 10.1023/a:1008603608879
- Domblides E.A., Shmykova N.A., Shumilina D.V., Zayachkovskaya T.V., Vjurtts T.S., Kozar E.V., Kan L.Yu., Romanov V.S., Domblides A.S., Pivovarov V.F., Soldatenko A.V. Biotechnological approaches for breeding programs in vegetable crops. Agrosym 2017. Book of proceedings. 2017. P.452-460.
- Jeffrey C. (1980). A review of the Cucurbitaceae. Botanical Journal of the Linnean Society, 81(3), 233-247 DOI: 10.1111/j.1095-8339.1980.tb01676
- Kurtar E.S., Balkaya A. (2010) Production of in vitro haploid plants from in situ induced haploid embryos in winter squash (Cucurbita maxima Duchesne ex Lam.) via irradiated pollen. Plant Cell Tissue Org Cult 102(3): 267-277.
- Metwally E.I., Haroun S.A., El-Fadly G.A. (1996) Interspecific cross between Cucurbita pepo L. and Cucurbita martinezii through in vitro embryo culture. Euphytica 90: 1-7.
- Suprunova T., Shmykova N. In vitro induction of haploid plants in unpollinated ovules, anther and microspore culture of Cucumis sativus//Cucurbitaceae 2008. Proceedings of the IXth EUCARPIA meeting on genetics and breeding of Cucurbitaceae. 21-24 May 2008 Avignon, France. P.371-374.
- Varghese B.M. (1973) Studies on the cytology and evolution of south Indian Cucurbitaceae. Ph.D. Thesis Kerala Univ., India.
- Whitaker, T.W. (1933). Cytological and Phylogenetic Studies in the Cucurbitaceae. Botanical Gazette, 94(4), 780-790 DOI: 10.1086/334347
- Whitaker T.W., Davis G.N. (1962) Cucurbits. Interscience Pub., Inc.,New York.


