Цитологические методы анализа гаплоидных растений-регенерантов капусты белокочанной (Brassica oleracea L.), полученных in vitro
Автор: Киракосян Рима Нориковна, Калашникова Елена Анатольевна
Журнал: Овощи России @vegetables
Рубрика: Селекция и семеноводство сельскохозяйственных растений
Статья в выпуске: 4 (48), 2019 года.
Бесплатный доступ
Актуальность В настоящее время в генетических исследованиях и селекции капустных культур широко применяют биотехнологические методы создания чистых линий - удвоенных гаплоидов в культуре пыльников и в культуре изолированных микроспор. Общая особенность этих технологий заключается в том, что получаемые in vitro растения обладают разным уровнем плоидности и наряду с удвоенными гаплоидами встречаются гаплоидные, тетраплоидные и миксоплоидные формы. Поэтому применение новых цитологических методов анализа гаплоидных растений остается актуальной проблемой. Материал и методика Цель настоящей работы - установить генетическую природу растений-регенерантов Brassica oleracea L., полученных из репродуктивных органов in vitro. Изолированные пыльники и завязи капусты белокочанной культивировали на твердых питательных средах, содержащих минеральные соли по прописи Мурасиге и Скуга (МС). У полученных растений-регенерантов был проведен подсчет числа хромосом в меристеме корня, а также числа хлоропластов в клетках замыкающих устьиц листьев с помощью нового универсального метода приготовления препаратов хромосом растений - «SteamDrop»...
Капуста белокочанная, гаплоидные растения, цитологические методы
Короткий адрес: https://sciup.org/140240727
IDR: 140240727 | УДК: 635.342:001.891:573.6 | DOI: 10.18619/2072-9146-2019-4-13-15
Текст научной статьи Цитологические методы анализа гаплоидных растений-регенерантов капусты белокочанной (Brassica oleracea L.), полученных in vitro
Received: 21.05.2019
Accepted: 25.08.2019
Cytological methods of analysis of haploid plants-regenerants of cabbage ( Brassica oleracea L.) obtained in vitro
ANNOTATION
Relevance
Currently, in genetic studies and selection of cabbage cultures, biotechnological methods for creating clean lines — doubled haploids in the culture of anthers and in the culture of isolated microspores are widely used. A common feature of these technologies is that the plants obtained in vitro have different levels of ploidy and along with doubled haploids there are haploid, tetraploid and mixoploid forms. Therefore, the use of new cytological methods of analysis of haploid plants remains an urgent problem.
Material and method
The aim of this work is to establish the genetic nature of regenerated plants of Brassica oler-acea L., obtained from reproductive organs in vitro . Isolated anthers and ovaries of white cabbage were cultivated on solid nutrient media containing mineral salts according to the recipe Murashige and Skoog (MS). The obtained regenerated plants were used to calculate the number of chromosomes in the root meristem, as well as the number of chloroplasts in the cells of the closing stomata of leaves using the new universal method of preparing preparations of plant chromosomes – “SteamDrop”.
Results
As a result of the research, the dependence of the level of ploidy on the cultivation conditions was studied. It has been shown that plants-regenerants of white cabbage, obtained in vitro from reproductive organs, had a different set of chromosomes (n, 3n, 5n). It was established that the number of chloroplasts in the stomatal cells of regenerated plants was from 9 to 45, while the original donor plants had 18–20.
Введение
Внастоящее время в генетических исследованиях и селекции капустных культур широко применяют биотехнологические методы создания чистых линий – удвоенных гаплоидов в культуре пыльников и в культуре изолированных микроспор [1, 2, 3]. Общая особенность этих технологий заключается в том, что получаемые in vitro растения обладают разным уровнем плоидности, и наряду с удвоенными гаплоидами встречаются гаплоидные, тетраплоидные и миксоплоид-ные формы [4].
Определение плоидности растений-регенерантов относится к обязательным элементам технологии получения удвоенных гаплоидов [5, 6]. Описаны разнообразные методы анализа плоидности растений, различающиеся по точности, трудоемкости и стоимости: подсчет числа хромосом (микроскопирование цитологических препаратов) [7]; количественное определение содержания хроматина в ядрах клеток (проточная цитометрия) [8]; анализ комплекса косвенных признаков растений – морфологических особенностей, величины замы- кающих клеток устьиц, их числа в расчете на единицу площади листовой поверхности, числа хлоропластов в замыкающих клетках устьиц (ЧХЗКУ), величины пыльцевого зерна и числа пор на его экзине, фертильности и завязываемости семян [9]. Подсчет числа хромосом в митотических клет- ках корневых меристем — кропотливая и трудоемкая работа, так как хромосомы капустных мелкие, а число метафазных пластинок зависит от роста корня. Такой подсчет невозможно выполнить при большом числе анализируемых растений, поэтому он остается лабораторным методом [5].
Проточная цитометрия считается одним из наиболее эффективных и точных методов определения уровня плоидности, она удобна, простые приемы подготовки материала позволяют анализировать несколько сотен образцов за один рабочий день, кроме того, при анализе используется минимальное количество ткани листа. Однако существенным ограничением остается очень высокая стоимость прибора и, как следствие, себестоимость одного анализа [10].
Фенотипическая идентификация по таким отличительным признакам гаплоидных растений, как мужская стерильность, меньший размер вегетативных органов, узкие листья и другие морфологические особенности, неудобна и продолжительна, так как требует культивирования растений на протяжении нескольких месяцев до достижения стадии цветения [11]. Определение плоидности растений по ЧХЗКУ легко в исполнении, дешево и применяется в практической селекции растений долгое время. У озимого рапса (B. napus) на растениях, полученных в культуре пыльников, показано варьирование числа хлоропластов в замыкающих клетках устьиц в пределах от 12,0 до 14,0 шт. у гаплоидов и от 19,5 до 20,9 шт. – у дигаплоидов [12,18,19]. Сообщалось, что у капусты пекинской (B. campestris ssp. pekinensis) у гаплоидных растений число хлоропластов на одну замыкающую клетку устьица состав- ляет 2-4, у диплоидных – 4-6, у тетра-плоидных – 8-10 шт. [5,18,19]. В другом исследовании показано, что число хлоропластов в паре замыкающих клеток устьица у капусты пекинской варьирует от 6,1 до 8,6 шт. у гаплоидов, от 10,1 до 12,7 шт. – у диплои-дов и от 15,9 до 17,8 шт. – у тетра-плоидов [13]. По данным S.J.C. Dias [11], растения B. oleracea ssp. в гаплоидном состоянии имеют 6-9 хлоропластов в замыкающих клетках устьиц, в диплоидном – 10-15 и тетрапло-идном – 20-25 шт. В работе S. Yuan с соавт. [14], у растений капусты белокочанной (B. oleracea var. capitata), брокколи (B. oleracea var. italica) и листовой капусты (B. oleracea var. alboglabra), полученных в культуре изолированных микроспор, в паре замыкающих клеток установлено ЧХЗКУ у гаплоидных растений не более 10 шт. (при среднем для одного растения от 6,96 до 7,67), диплоидных – 11-15 шт. (в среднем от 12,36 до 13,89) и полиплоидных – более 15 шт. (со средним от 16,96 до 17,61 для триплоида и от 22,61 до 24,97 для 198 тетраплоида), при этом точность метода определения плоидности составила 93,93 % и не зависела от условий роста растений в теплице [14].
Цель настоящей работы – установить генетическую природу растений-регенерантов Brassica oleracea L., полученных из репродуктивных органов in vitro.
Материалы иметоды исследований
Исcледования проводили на селекционных образцах капусты белокочанной ( Brassica oleracea L.), полученных в лаборатории селекции и семеноводства капустных культур ФГБНУ ФНЦО. Объектом исследования служили изолированные пыльники и завязи капусты белокочанной, которые культивировали на твердых питательных средах, содержащих минеральные соли по прописи Мурасиге и Скуга (МС) [15], витамины, сахарозу и агар. В зависимости от цели, поставленной в эксперименте, в состав питательной среды также входили фитогормоны (препарат Дропп в концентрации 0,01 мг/л и НУК – 1 мг/л), аминокислоты и растительные экстракты.
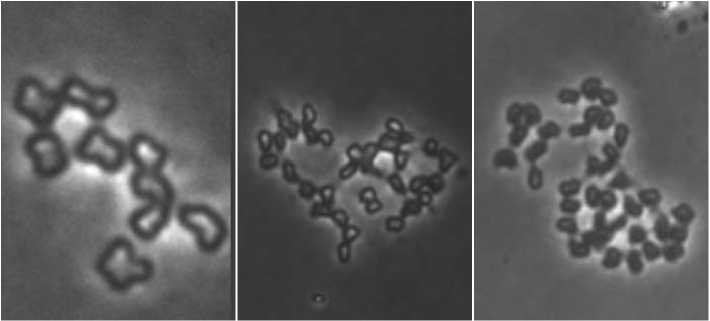
n 3n 5n
Рис. 1. Цитологический анализ набора хромосом растений-регенерантов капусты белокочанной, полученных из репродуктивных органов (одинарный (n=9), триплоидный (3n=27) и пентаплоидный (5n=45))
Fig.1. Cytological analysis of a set of chromosomes of regenerated plants of white cabbage obtained from reproductive organs (n=9, 3n=27, 5n=45)
С целью установления генетической природы растений-регенерантов, полученных в культуре репродуктивных органов, был проведен подсчет числа хромосом в меристеме корня, а также числа хлоропластов в клетках замыкающих устьиц листьев. Так как у представителей рода Brassica хромосомы мелкие и подсчет их затруднен, то был применен новый универсальный метод приготовления препаратов хромосом растений – «SteamDrop» [16]. Эксперименты проводили в трех биологических и 2-3 аналитических повторностях.
Результаты исследований
По литературным данным известно, что у растений миксоплоидной природы число хромосом в ядрах клеток меристемы различное – от гаплоидного набора до полиплоидного [17]. В результате цитологических исследований нами показано, что растения-регенеранты капусты белокочанной, полученные in vitro из репродуктивных органов, имели разный уровень плоид-ности (n, 3n, 5n). Это присуще половым и соматическим клеткам, так как они представляют собой гетерогенные популяции и находятся в стрессовых условиях при культивировании в условиях in vitro (рис.1).
Для косвенного доказательства гаплоидной природы полученных растений капусты белокочанной применен метод подсчета количества хлоропластов в замыкающих клетках устьиц. Установлено, что количество хлоропластов в клетках устьиц растений-регенерантов составило от 9 до 45 шт., в то время как у исходных донорных растений их было 18-20 шт. (рис.2).
Полученные растения-регенеранты, обладающие разным уровнем плоидности, были подготовлены для адаптации in vivo . Адаптацию растений проводили в контейнерах, содержащих проавтоклавированный субстрат. В работе использовали питательные субстраты из дерновой почвы и вермикулита в соотношении 1:1, которые позволили достичь 89% приживаемости растений. При этом рост растений активизировался на 16 сутки с начала адаптации. Это проявлялось в формировании стебля и листьев с нормальной морфологией.
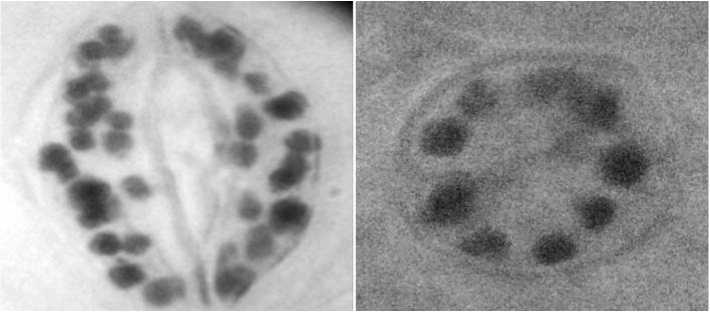
а
б
Рис. 2. Хлоропласты в замыкающих клетках устьиц: а – 5n растения-регенеранты белокочанной капусты; б – гаплоидные растения-регенеранты Pic. 2. Chloroplasts in the stoma stomata hloroplasts in the stoma stomata: а – 5n regenerated plants of white cabbage; b – haploid regenerated plants
Через 3 месяца после адаптации гаплоидные растения продолжали нормально развиваться и достигли фазы цветения. Однако сформировавшиеся цветки были стерильные и семена не образовывались. Для получения фертильных растений применяли метод колхицинирова-ния. Растения были переданы в Федеральный научный центр овощеводства для дальнейших исследований.
Заключение
Таким образом, в результате проведенных исследований нами была изучена зависимость уровня плоидности от условий культивирования. Показано, что растения-регенеранты капусты белокочанной, полученные in vitro из репродуктивных органов, имели разный набор хромосом (n, 3n, 5n).
Об авторах:
Rima N. Kirakosyan – PhD in Biotechnology Associate Professor Department of Genetics, Biotechnology, Plant Breeding and
Seed Science of Russian Timiryazev State Agrarian University
Elena A. Kalashnikova – Doctor in Biological Sciences, Professor, Department of Genetics, Biotechnology, Plant Breeding and Seed Science of Russian Timiryazev State Agrarian University
-
• Литература
-
1. Pink Bailey D. L., McClement S., et al. Double haploids, markers and QTL analysis in vegetable brassicas // Euphytica. 2008. Vol. 164. P. 509-514.
-
2. Ferrie A.M.R., Mцllers C.Haploids and doubled haploids in Brassica spp. for genetic and genomic research // Plant Cell Tissue and Organ Culture. 2011. Vol. 104. P. 375-386.
-
3. Monakhos S., Uwiragiye A., Zhao J., et al. Generation of doubled haploids through microspore culture from vegetable and oilseed Brassica rapa crops // Izv. TAA. 2010. Vol. 7. P. 128-135.
-
4. Smykalova, I., V e trovcova M., Klima M., et al. Efficiency of Microspore Culture for Doubled Haploid Production in the Breeding Project “Czech Winter Rape” // Czech J. Genet. Plant Breed. 2006. Vol. 42. P. 58–71.
-
5. Hamaoka Y., Fujita Y., Iwai S. Number of chloroplasts in haploids and diploids produced via anther culture in Brassica campestris // Plant Tis. Cult. 217 Let. 1991. Vol. 2 8(2). P.67-72.
-
6. Murovec J. Haploids and doubled haploids in plant breeding / J. Murovec, B. Bohanec // Plant Breeing / I. Abdurakhmonov. InTech, 2012. P.87-106.
-
7. Maluszynska, J. Cytogenetic tests for ploidy level analyses–chromosome counting // Doubled haploid production in crop plants: a manual. Dordrecht: Kluwer, 2003. P.391-395.
-
8. Bohanec B. Ploidy determination using flow cytometry // Doubled haploid production in crop plants: a manual. Dordrechts: Kluwer, 2003. P.397-403.
-
9. Dunwell, J.M. Haploids in flowering plants: origins and exploitation // J. Plant Biotech. 2010. Vol. 8. P.377-424.
-
10. Cousin A. Heel K., Cowling W.A., et al. An Efficient Highthroughput Flow Cytometric Method for Estimating DNA Ploidy Level in Plants // 214 Cytometry. 2009. Vol. 75(12). P.1015-1019.
-
11. Dias S.J.C. Protocol for broccoli microspore culture // Doubled haploid production in crop plants: a manual. Dordrecht: Kluwer, 2003. P.195-204.
-
12. Soroka A.I. Differentiation of haploid and dihaploid rape plants at the cytological and morphological levels // Cytol. Genet. 2013. Vol. 47(2). P.88-92. 222.
-
13. Woo J.G, Kim H.D., Oh B.S. Estimation of the ploidy of anther derived Chinese cabbage Brassica campestris ssp. pekinensis by the number of chloroplasts in the guard cells // Res. Rep. Rur. Dev. Adm. 1991. Vol. 33. P.35-39.
-
14. Yuan S., Liu Y., Fang Z., et al. Study on the relationship between the ploidy level of microspore-derived plants and the number of chloroplast in stomatal guard cells in Brassica oleracea // Agr. Sci. in China. 2009. Vol. 8. P.939-946.
-
15. Murashige T.A., Skoog F. Revised medium for rapid growth and bioassays with tobacco tissue cultures // Physiologia Plantarum. 1962. V.15. P.473-497.
-
16. Kirov I., Divashuk M., Laere K.V., et al. An easy “SteamDrop” method for high quality plant chromosome preparation // Plant molecular cytogenetics in genomic and postgenomic era, Katowice, Poland. 2014. P. 61.
-
17. Qin X., Rotino G.L. Chloroplast number in Guard cells as ploidy indicator of in vitro grown androgenic peper plantlets // Plant Cell, Tissue Organ Cult. 1995. V. 41. P. 153-160.
-
18. Domblides E.A., Shmykova N.A., Shumilina D.V., Zayachkovskaya T.V., Mineykina A.I., Kozar E.V., Akhramenko V.A., Shevchenko L.L., KanL.Yu., Bondareva L.L., Domblides A.S. Technology of doubled haploid plant production through isolated microspore cultivation in Brassicaceae family. Federal State Budgetary Scientific Research Institution «All-Russian Scientific Research Institute of vegetable breeding and seed production», Moscow, 2016 (In Russ.)
-
19. Domblides E.A., Shmykova N.A., Shumilina D.V., Zayachkovskaya T.V., Vjurtts T.S., Kozar E.V., Kan L.Yu., Romanov V.S., Domblides A.S., Pivovarov V.F., Soldatenko A.V. Biotechnological approaches for breeding programs in vegetable crops. Agrosym 2017. Book of proceedings. 2017. P.452-460.
-
-
• References
-
1. Pink Bailey D. L., McClement S., et al. Double haploids, markers and QTL analysis in vegetable brassicas // Euphytica. 2008. Vol. 164. P. 509-514.
-
2. Ferrie A.M.R., Mцllers C.Haploids and doubled haploids in Brassica spp. for genetic and genomic research // Plant Cell Tissue and Organ Culture. 2011. Vol. 104. P. 375-386.
-
3. Monakhos S., Uwiragiye A., Zhao J., et al. Generation of doubled haploids through microspore culture from vegetable and oilseed Brassica rapa crops // Izv. TAA. 2010. Vol. 7. P. 128-135.
-
4. Smykalova, I., V e trovcova M., Klima M., et al. Efficiency of Microspore Culture for Doubled Haploid Production in the Breeding Project “Czech Winter Rape” // Czech J. Genet. Plant Breed. 2006. Vol. 42. P. 58–71.
-
5. Hamaoka Y., Fujita Y., Iwai S. Number of chloroplasts in haploids and diploids produced via anther culture in Brassica campestris // Plant Tis. Cult. 217 Let. 1991. Vol. 2 8(2). P.67-72.
-
6. Murovec J. Haploids and doubled haploids in plant breeding / J. Murovec, B. Bohanec // Plant Breeing / I. Abdurakhmonov. InTech, 2012. P.87-106.
-
7. Maluszynska, J. Cytogenetic tests for ploidy level analyses–chromosome counting // Doubled haploid production in crop plants: a manual. Dordrecht: Kluwer, 2003. P.391-395.
-
8. Bohanec B. Ploidy determination using flow cytometry // Doubled haploid production in crop plants: a manual. Dordrechts: Kluwer, 2003. P.397-403.
-
9. Dunwell, J.M. Haploids in flowering plants: origins and exploitation // J. Plant Biotech. 2010. Vol. 8. P.377-424.
-
10. Cousin A. Heel K., Cowling W.A., et al. An Efficient Highthroughput Flow Cytometric Method for Estimating DNA Ploidy Level in Plants // 214 Cytometry. 2009. Vol. 75(12). P.1015-1019.
-
11. Dias S.J.C. Protocol for broccoli microspore culture // Doubled haploid production in crop plants: a manual. Dordrecht: Kluwer, 2003. P.195-204.
-
12. Soroka A.I. Differentiation of haploid and dihaploid rape plants at the cytological and morphological levels // Cytol. Genet. 2013. Vol. 47(2). P.88-92. 222.
-
13. Woo J.G, Kim H.D., Oh B.S. Estimation of the ploidy of anther derived Chinese cabbage Brassica campestris ssp. pekinensis by the number of chloroplasts in the guard cells // Res. Rep. Rur. Dev. Adm. 1991. Vol. 33. P.35-39.
-
14. Yuan S., Liu Y., Fang Z., et al. Study on the relationship between the ploidy level of microspore-derived plants and the number of chloroplast in stomatal guard cells in Brassica oleracea // Agr. Sci. in China. 2009. Vol. 8. P.939-946.
-
15. Murashige T.A., Skoog F. Revised medium for rapid growth and bioassays with tobacco tissue cultures // Physiologia Plantarum. 1962. V.15. P.473-497.
-
16. Kirov I., Divashuk M., Laere K.V., et al. An easy “SteamDrop” method for high quality plant chromosome preparation // Plant molecular cytogenetics in genomic and postgenomic era, Katowice, Poland. 2014. P. 61.
-
17. Qin X., Rotino G.L. Chloroplast number in Guard cells as ploidy indicator of in vitro grown androgenic peper plantlets // Plant Cell, Tissue Organ Cult. 1995. V. 41. P. 153-160.
-
18. Domblides E.A., Shmykova N.A., Shumilina D.V., Zayachkovskaya T.V., Mineykina A.I., Kozar E.V., Akhramenko V.A., Shevchenko L.L., KanL.Yu., Bondareva L.L., Domblides A.S. Technology of doubled haploid plant production through isolated microspore cultivation in Brassicaceae family. Federal State Budgetary Scientific Research Institution «All-Russian Scientific Research Institute of vegetable breeding and seed production», Moscow, 2016 (In Russ.)
-
19. Domblides E.A., Shmykova N.A., Shumilina D.V., Zayachkovskaya T.V., Vjurtts T.S., Kozar E.V., Kan L.Yu., Romanov V.S., Domblides A.S., Pivovarov V.F., Soldatenko A.V. Biotechnological approaches for breeding programs in vegetable crops. Agrosym 2017. Bookofproceedings. 2017. P.452-460.
-
Список литературы Цитологические методы анализа гаплоидных растений-регенерантов капусты белокочанной (Brassica oleracea L.), полученных in vitro
- Pink Bailey D.L., McClement S., et al. Double haploids, markers and QTL analysis in vegetable brassicas // Euphytica. 2008. Vol. 164. P. 509-514.
- Ferrie A.M.R., Mцllers C.Haploids and doubled haploids in Brassica spp. for genetic and genomic research // Plant Cell Tissue and Organ Culture. 2011. Vol. 104. P. 375-386.
- Monakhos S., Uwiragiye A., Zhao J., et al. Generation of doubled haploids through microspore culture from vegetable and oilseed Brassica rapa crops // Izv. TAA. 2010. Vol. 7. P. 128-135.
- Smykalova, I., Vetrovcova M., Klima M., et al. Efficiency of Microspore Culture for Doubled Haploid Production in the Breeding Project “Czech Winter Rape” // Czech J. Genet. Plant Breed. 2006. Vol. 42. P. 58-71.
- Hamaoka Y., Fujita Y., Iwai S. Number of chloroplasts in haploids and diploids produced via anther culture in Brassica campestris // Plant Tis. Cult. 217 Let. 1991. Vol. 2 8(2). P. 67-72.
- Murovec J. Haploids and doubled haploids in plant breeding/J. Murovec, B. Bohanec//Plant Breeing/I. Abdurakhmonov. InTech, 2012. P. 87-106.
- Maluszynska, J. Cytogenetic tests for ploidy level analyses-chromosome counting//Doubled haploid production in crop plants: a manual. Dordrecht: Kluwer, 2003. P. 391-395.
- Bohanec B. Ploidy determination using flow cytometry//Doubled haploid production in crop plants: a manual. Dordrechts: Kluwer, 2003. P. 397-403.
- Dunwell, J.M. Haploids in flowering plants: origins and exploitation//J. Plant Biotech. 2010. Vol. 8. P. 377-424.
- Cousin A. Heel K., Cowling W.A., et al. An Efficient Highthroughput Flow Cytometric Method for Estimating DNA Ploidy Level in Plants//214 Cytometry. 2009. Vol. 75(12). P. 1015-1019.
- Dias S.J.C. Protocol for broccoli microspore culture//Doubled haploid production in crop plants: a manual. Dordrecht: Kluwer, 2003. P. 195-204.
- Soroka A.I. Differentiation of haploid and dihaploid rape plants at the cytological and morphological levels//Cytol. Genet. 2013. Vol. 47(2). P. 88-92. 222.
- Woo J.G, Kim H.D., Oh B.S. Estimation of the ploidy of anther derived Chinese cabbage Brassica campestris ssp. pekinensis by the number of chloroplasts in the guard cells//Res. Rep. Rur. Dev. Adm. 1991. Vol. 33. P. 35-39.
- Yuan S., Liu Y., Fang Z., et al. Study on the relationship between the ploidy level of microspore-derived plants and the number of chloroplast in stomatal guard cells in Brassica oleracea//Agr. Sci. in China. 2009. Vol. 8. P. 939-946.
- Murashige T.A., Skoog F. Revised medium for rapid growth and bioassays with tobacco tissue cultures//Physiologia Plantarum. 1962. V.15. P. 473-497.
- Kirov I., Divashuk M., Laere K.V., et al. An easy "SteamDrop" method for high quality plant chromosome preparation//Plant molecular cytogenetics in genomic and postgenomic era, Katowice, Poland. 2014. P. 61.
- Qin X., Rotino G.L. Chloroplast number in Guard cells as ploidy indicator of in vitro grown androgenic peper plantlets//Plant Cell, Tissue Organ Cult. 1995. V. 41. P. 153-160.
- Domblides E.A., Shmykova N.A., Shumilina D.V., Zayachkovskaya T.V., Mineykina A.I., Kozar E.V., Akhramenko V.A., Shevchenko L.L., Kan L.Yu., Bondareva L.L., Domblides A.S. Technology of doubled haploid plant production through isolated microspore cultivation in Brassicaceae family. Federal State Budgetary Scientific Research Institution «All-Russian Scientific Research Institute of vegetable breeding and seed production», Moscow, 2016 (In Russ.)
- Domblides E.A., Shmykova N.A., Shumilina D.V., Zayachkovskaya T.V., Vjurtts T.S., Kozar E.V., Kan L.Yu., Romanov V.S., Domblides A.S., Pivovarov V.F., Soldatenko A.V. Biotechnological approaches for breeding programs in vegetable crops. Agrosym 2017. Book of proceedings. 2017. P. 452-460.


