Цитологические особенности мононуклеарных лейкоцитов, культивированных в присутствии полиаминов
Автор: Морозов И.А., Годовалов А.П.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Иммунология
Статья в выпуске: 3, 2023 года.
Бесплатный доступ
Рассмотрены количественные и качественные изменения в клеточном составе после инкубации с путресцином и кадаверином. Цель исследования - изучение изменений цитологических характеристик лейкоцитов после их инкубации с кадаверином и путресцином. Оценивали количество, типы клеток, размеры, наличие вакуолей и включений у лейкоцитов периферической крови (n = 15) после их предынкубации с кадаверином (5 и 25 ммоль/л) и путресцином (5 и 25 ммоль/л) в течение 72 ч при 37ºС. Показано, что по мере увеличения концентрации путресцина общее количество лейкоцитов снижается, при этом кадаверин дозозависимо повышал этот показатель. В то же время после воздействия путресцина увеличилась доля больших по размеру лимфоцитов и количество вакуолей в цитоплазме. Кадаверин в концентрации 25 ммоль/л значимо снижал количество клеток с признаками цитолиза. Таким образом, в ходе проведенных исследований установлено, что кадаверин и путресцин, продуцируемые преимущественно прокариотическими клетками, оказывают влияние как на численность, так и на цитологические характеристики иммунокомпетентных клеток.
Полиамины, кадаверин, путресцин, микробная агрессия, лейкоциты
Короткий адрес: https://sciup.org/147241926
IDR: 147241926 | УДК: 571.27 | DOI: 10.17072/1994-9952-2023-3-280-286
Текст научной статьи Цитологические особенности мононуклеарных лейкоцитов, культивированных в присутствии полиаминов
Разносторонние биологические эффекты действия полиаминов на функции и жизнедеятельность как прокариотических, так и эукариотических клеток [Годовалов, Карпунина, 2022] обусловливают нарастающий интерес к их изучению. Известно, что полиамины регулируют синтез белка бактериями, их устойчивость к антимикробным препаратам, формирование биопленок, quorum sensing и т.д. [Бухарин, 2018, Нестерова, Негорелова, Ткаченко, 2019]. Показано, что применение путресцина per os приводит к увеличению активности лизоцима и щелочной фосфатазы, уровня иммуноглобулинов М, а также снижает уровень продукции фактора некроза опухоли-α в кишечном содержимом [Liu et al., 2019]. Кроме того, установлено, что полиамины регулируют дифференцировку макрофагов в М2 и оказывают супрессию толерогенных дентритных клеток [Carriche et al., 2021]. В ряде других экспериментов описано ингибирование путресцином и кадаверином продукции IFNγ, а также увеличение продукции IL-4 митоген-активированными клетками [Годовалов и др., 2019]. Продемонстрировано участие полиаминов в регуляции активации и дифференцировки Т- и В-лимфоцитов [Hesterberg, Cleveland, Epling-Burnette, 2018]. Так, дефицит орнитиндекарбоксилазы, фермента, необходимого для синтеза полиаминов, приводит к нарушению дифференцировки CD4+ Т-хелперов из-за снижения концентрации субстрата для дезоксигипузин-синтазы [Puleston et al., 2021]. Ранее было показано, что в очаге воспаления, там, где наблюдается активное размножение условно патогенных микроорганизмов, нарастает уровень полиаминов [Shah et al., 2011; Морозов, Карпунина, Годовалов, 2018; Годовалов, Карпунина, 2022]. Однако изменение активности клеток иммунной системы в таких условиях не изучено. В связи с этим наибольшее внимание исследователей привлекают полиамины, синтезируемые условно патогенными микроорганизмами, как, например, путресцин и кадаверин. Эти полиамины относятся к классу низкомолекулярных алифатических поликатионных аминов, состоящих из насыщенных углеводородных цепей различной длины с аминогруппами [Hesterberg, Cleveland, Epling-Burnette, 2018]. Известно, что полиамины могут активно проникать через цитоплазматическую мембрану клеток при участии специфического переносчика [Mei et al., 2007; Kurihara, 2022] и (или) за счет пассивной диффузии [Силачев, Плотников, Горюнов, 2018]. После проникновения полиаминов в клетку наблюдается процесс их связывания с полианионными соединениями (белки, нуклеиновые кислоты, фосфолипиды, глюкозаминогликаны), а более 90% всех полиаминов находятся в связанном с ДНК и РНК состоянии [Mei et al., 2007; Hesterberg, Cleveland, Epling-Burnette, 2018]. Внутриклеточные функции полиаминов многообразны: стабилизация плазматических мембран, суперсперилизация структуры ДНК, индуцирование транскрипции, связывание с рибосомами, активация ДНК-лигаз, эндонуклеаз, протеинкиназ. Связавшись с нуклеиновыми кислотами, полиамины влияют на структуру хроматина, регулируя тем самым экспрессию генов [Shah, Swiatlo, 2008]. Однако исследований морфологических особенностей эукариотических клеток относительно мало.
Цель исследования – оценка изменений цитологических характеристик лейкоцитов после их инкубации с кадаверином и путресцином.
Материалы и методы
У практически здоровых доноров брали пробы венозной крови с последующим выделением моно-нуклеарной фракции лейкоцитов путем центрифугирования на градиенте плотности фикола-верографина (1.077 г/см3). Рабочее количество лейкоцитов – 200 мононуклеарных клеток на 1 мкл. В стерильные круглодонные планшеты внесли полиамины в концентрациях 5 и 25 ммоль/л. Использовали путресцина гидрохлорид, кадаверина гидрохлорид. В контрольные лунки вносили равный объем среды. Использовали полную культуральную среду, включающую RPMI-1640, 10% эмбриональной телячьей сыворотки, 20 мМ HEPES , 0.05 мМ 2-меркаптоэтанола, 50 мкг/мл гентамицина и 2 мМ L -глютамина. Культивирование осуществляли в следующих условиях: влажная атмосфера с 5%-ным СО 2 при 37ºС в течение 72 ч. После этого готовили микропрепараты из клеточного осадка и фиксировали их по методу Май-Грюнвальда с последующей окраской по методу Романовского – Гимза. В препаратах учитывали типы клеток, определяли их размеры, а также наличие вакуолей и включений.
Статистическую обработку результатов выполняли с помощью парного варианта t -критерия Стьюдента. За пороговый уровень значимости принимали величину p <0.05.
Результаты
Установлено, что по мере увеличения концентрации путресцина в пробах, общее количество моно-нуклеарных лейкоцитов не увеличивается относительно аналогичного показателя в контрольных пробах, что, возможно, обусловлено ингибированием пролиферативной активности этих клеток путресцином. При этом существенных различий между пробами с 5 и 25 ммоль/л не выявлено (рис. 1). В случае культивирования клеток в присутствии кадаверина выявлено увеличение численности моноцитов. При этом в пробах с 5 ммоль/л наблюдается незначительное увеличение их числа, а с увеличением концентрации кадаверина – статистически значимое отличие от контрольных проб (рис. 1). Кроме того, численность клеток в пробах с 5 и 25 ммоль/л кадаверина статистически значимо различалась.
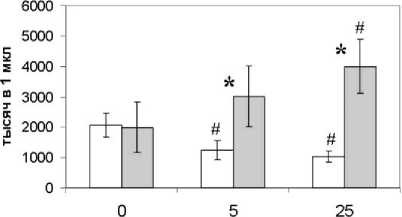
концентрация полиаминов, ммоль/л
□ путресцин □ кадаверин
Рис. 1. Численность мононуклеарных клеток в пробах с полиаминами к 72 ч культивирования.
* – p <0.05 при сравнении кадаверина и путресцина; # – p <0.05 при сравнении с пробами без соответствующего полиамина. Результаты представлены в виде среднего арифметического и его ошибки
[The number of mononuclear cells in samples with polyamines by 72 hours of cultivation.
* – p<0.05 when comparing cadaverine and putrescine; # – p<0.05 when comparing with samples without the corresponding polyamine. The results are presented in the form of an arithmetic mean and its error]
С помощью окрашивания трипановым синим в пробах с разными концентрациями путресцина не выявлено снижения числа жизнеспособных клеток, а также увеличения числа мертвых клеток. При этом в микропрепаратах наблюдается увеличение относительного числа клеток с признаками цитолиза согласно повышению уровня путресцина. При концентрации этого поликатиона 5 ммоль/л – 4.6±0.6%, а при 25 – 5.8±0.6% (в контрольных пробах – 2.6±0.7%, p = 0.051 к пробам с 5 ммоль/л и p = 0.032 к пробам с 25 ммоль/л путресцина).
К 72 ч культивирования клеток с путресцином установлено, что с увеличением концентрации этого поликатиона увеличивается доля моноцитарных клеток, а численность лимфоцитов снижается относительно аналогичных показателей в образцах без полиаминов (рис. 2).
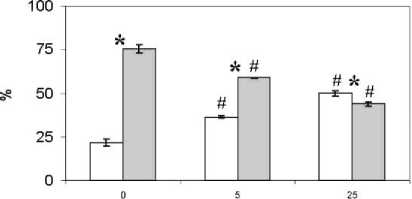
концентрация путресцина, ммоль/л
-
□ моноциты □ лимфоциты
Рис. 2. Лимфоцитарно-моноцитарное соотношение при культивировании клеток в присутствии путресцина.
-
* – p <0.05 при сравнении кадаверина и путресцина; # – p <0.05 при сравнении с пробами без соответствующего полиамина. Результаты представлены в виде среднего арифметического и его ошибки
[Lymphocyte-monocyte ratio in cell culture in the presence of putrescine.
* – p<0.05 when comparing cadaverine and putrescine; # – p<0.05 when comparing with samples without the corresponding polyamine. The results are presented in the form of an arithmetic mean and its error]
При увеличении уровня путресцина в пробах возрастало количество больших по размеру лимфоцитов до 22.1±2.4% при 5 ммоль/л и 34,5±2.9% при 25 ммоль/л (в контроле – 5.3±1.7%, p = 0.001 к пробам с 5 и 25 ммоль/л). Отмечено дозозависимое увеличение клеток, содержащих вакуоли: 20.2±2.3% при 5 ммоль/л; 33.4±1.4% при 25 ммоль/л (в контроле – 10.9±1.5%; p = 0.001 к пробам с 5 и 25 ммоль/л). Однако число клеток, содержащих прочие включения, оставалось наименьшим при 25 ммоль/л (18.9±1.2%) и наибольшим – в контрольных пробах (41.6±7.9%; p = 0,049).
При подсчете клеток с трипановым синим в пробах с разными концентрациями кадаверина установлено увеличение числа жизнеспособных клеток при повышении концентрации этого поликатиона. В микропрепаратах, полученных из культуральной взвеси после 72 ч инкубации в присутствии 25 ммоль/л кадаверина число клеток с признаками цитолиза существенно меньше, чем таковое в контрольных пробах (1.3±0.2 и 3.7±0.6% соответственно; p = 0.02). Изменения лимфоцитарно-моноцитарного соотношения в пробах мононуклеарных лейкоцитов, культивированных в присутствии разных концентраций кадаверина, представлены на рис. 3.
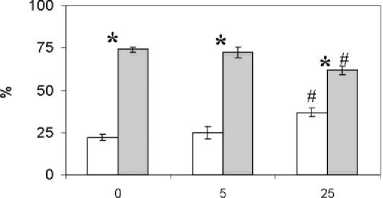
концентрация кадаверина, ммоль/л
□ МО ноциты □ лимфоциты
Рис. 3. Лимфоцитарно-моноцитарное соотношение при культивировании клеток в присутствии кадаверина.
* – p <0.05 при сравнении между кадаверином и путресцином; # – p <0.05 при сравнении с пробами без соответствующего полиамина. Результаты представлены в виде среднего арифметического и его ошибки
[Lymphocyte-monocyte ratio in cell culture in the presence of cadaverine.
* – p<0.05 when compared between cadaverine and putrescine; # – p<0.05 when compared with samples without the corresponding polyamine. The results are presented in the form of an arithmetic mean and its error]
Отмечено значительное уменьшение количества малых лимфоцитов (до 9.0±0.8%) и повышение лимфоцитов большого размера (до 20.9±1.0%) при уровне кадаверина 25 ммоль/л (в контрольных пробах – 22.3±1.0%, p = 0.001 и 9.6±0.9%, p = 0.001 соответственно). Кроме того, в пробах с 25 ммоль/л кадаверина выявлено значимое увеличение доли клеток, содержащих вакуоли и включения – 26.9±3.0% (в контроле – 9.5±1.6%, p = 0.001).
Обсуждение
Известно, что в метаболизме моноцитарно-макрофагальных клеток существенное значение играют полиамины, однако большинство исследователей сконцентрированы на изучении влияния спермина и спермидина, являющихся продуктами эукариотических клеток. Кроме этого, есть сведения, что концентрация полиаминов увеличивается при воспалении, особенно в случае наличия полиамин-синтезирующих видов бактерий, среди которых следует выделить представителей семейства Enterobacte-riaceae , рода Neisseria и других [Tabor, Tabor, 1985; Lavizzari et al., 2010]. Однако эти виды микроорганизмов синтезируют другие поликатионы – кадаверин и путресцин, о влиянии которых на иммунокомпетентные клетки относительно мало сведений.
Путресцин оказывает большее влияние на моноциты, чем кадаверин, поскольку может включаться в метаболизм этих клеток с последующим образованием спермина и спермидина [Kurihara, 2022]. Известно, что рост числа клеток с вакуолями среди моноцитов может указывать на их активацию [Сидельников, Начева, 2016; Бархина, Гущин, Алексеев, 2018; Kurihara, 2022], которая, как показано в настоящем исследовании длится дольше, поскольку число клеток с включениями существенно не изменяется. Кроме того, в проведенных ранее исследованиях установлено, что путресцин оказывает преимущественное влияние на фагоцитарную активность нейтрофилов, но не моноцитов [Годовалов и др., 2019].
Зарегистрированное повышение числа жизнеспособных клеток при их инкубации с кадаверином обусловлено протективным действием этого полиамина при наличии факторов, инициирующих цитолиз клеток, что можно наблюдать в искусственных условиях. Увеличение числа клеток с включениями можно рассматривать как отражение увеличения поглотительной активности моноцитов, что подтверждается проведенными нами ранее исследованиями [Морозов, Карпунина, Годовалов, 2018; Годовалов и др., 2019].
Наблюдаемая в настоящем исследовании вакуолизация цитоплазмы, вероятно, не является признаком развивающейся клеточной смерти, а относится к побочным эффектам действия полиаминов [Shubin, Demidyuk, Komissarov, 2016]. От эндоплазматического ретикулюма отщепляются вакуоли, что повышает емкость этого органоида, в том числе для белка. Более того вакуоли аккумулируя бактериальные токсины снижают их патогенный эффект (например, токсины E. coli Stx2 и SubAB, токсин M. pneumoniae CARDS и некоторые другие [Shubin, Demidyuk, Komissarov, 2016]). Можно предположить, что такая ситуация будет способствовать внутриклеточной персистенции бактерий-продуцентов полиаминов.
Заключение
Таким образом, в ходе проведенных исследований установлено, что кадаверин и путресцин, продуцируемые преимущественно прокариотическими клетками, оказывают влияние как на численность, так и на цитологические характеристики иммунокомпетентных клеток.
Список литературы Цитологические особенности мононуклеарных лейкоцитов, культивированных в присутствии полиаминов
- Бархина Т.Г., Гущин М.Ю., Алексеев Ю.В. Ультраструктурный анализ различных популяций клеток крови при аллергопатологии и воздействии светокислородного и фотодинамического эффектов // Вестник новых медицинских технологий. 2018. Т. 12, № 4. С. 218–224.
- Бухарин О.В. Адаптивные стратегии взаимодействия возбудителя и хозяина при инфекции // Вестник Российской академии наук. 2018. Т. 88, № 7. С. 637–643.
- Годовалов А.П., Карпунина Т.И. Влияние полиаминов бактериального происхождения на продукцию ключевых цитокинов в культуре мононуклеарных лейкоцитов человека // Медицинская иммунология. 2022. Т. 24, № 2. С. 257–262.
- Годовалов А.П. и др. Полиамины как рецептор-независимые факторы агрессии условно-патогенных микроорганизмов // Иммунопатология, аллергология, инфектология. 2019. № 3. С. 91–94.
- Годовалов А.П. и др. Люминолзависимая хемилюминесценция как средство выявления маркеров окислительного стресса // Высокие технологии, определяющие качество жизни: материалы II Междунар. науч. конф. Пермь, 2018. С. 201–203.
- Морозов И.А., Карпунина Т.И., Годовалов А.П. Кадаверин как регулятор активности про- и эукариотических клеток // Аллергология и иммунология. 2018. Т. 19, № 3. С. 149–150.
- Нестерова Л.Ю., Негорелова Е.В., Ткаченко А.Г. Биогенные полиамины как модуляторы активности Quorum sensing системы и биопленкообразования Vibrio harveyi // Вестник Пермского университета. Сер. Биология. 2019. Вып. 3. C. 300–308.
- Сидельникова А.А., Начева Л.В. Морфологические изменения периферической крови в динамическом наблюдении при остром описторхозе у экспериментальных животных // Современные проблемы науки и образования. 2016. № 6. С. 504–512.
- Силачев Д.Н., Плотников Е.Ю., Горюнов К.В. Роль полиаминов в жизнедеятельности клеток репродуктивной системы // Цитология. 2018. Т. 60, № 3. С. 164–172.
- Carriche G.M. et al. Regulating T-cell differentiation through the polyamine spermidine // The journal of allergy and clinical Immunology. 2021. Vol. 147, № 1. Р. 335–348.
- Equi A.M. et al. Oxidation of putrescine and cadaverine derivatives by diamine oxidases // Tetrahedron. 1991. Vol. 47, № 3. Р. 507–518.
- Fujiswa S., Kadoma Y. Kinetic evaluation of polyamines as radical scavengers // Anticancer Research. 2005. Vol. 25, № 2A. Р. 965–970.
- Hesterberg R.S., Cleveland J.L., Epling-Burnette P.K. Role of polyamines in immune cell functions // Medical sciences (Basel, Switzerland). 2018. Vol. 6, № 1. 22. doi: 10.3390/medsci6010022.
- Kurihara S. Polyamine metabolism and transport in gut microbes // Bioscience, biotechnology, and bio-chemistry. 2022. Vol. 86, № 8. P. 957–966.
- Lavizzari T. et al. Histamine, cadaverine, and putrescine produced in vitro by enterobacteriaceae and pseudomonadaceae isolated from spinach // Journal of food protection. 2010. Vol. 73, № 2. Р. 385–389.
- Liu G. et al. Putrescine enhances intestinal immune function and regulates intestinal bacteria in weaning piglets // Food Function. 2019. Vol. 10. Р. 4134–4142.
- Mei Y. et al. A sequential injection analysis chemiluminescent plant tissue-based biosensor system for the determination of diamine // Biosens. Bioelectron. 2007. Vol. 22, № 6. Р. 871–876.
- Puleston D.J. et al. Polyamine metabolism is a central determinant of helper T cell lineage fidelity // Cell Vol. 2021. Vol. 184. Р. 4186–4202.
- Shah P. et al. Polyamine biosynthesis and transport mechanisms are crucial for fitness and pathogenesis of Streptococcus pneumoniae // Microbiology. 2011. Vol. 57, № 2. Р. 504–515.
- Shah P., Swiatlo E. A multifaceted role for polyamines in bacterial pathogens // Molecular microbiology. 2008. Vol. 68, № 1. р. 4–16.
- Shubin A.V., Demidyuk I.V., Komissarov A.A. Cytoplasmic vacuolization in cell death and survival // Oncotarget. 2016. Vol. 7, № 34. р. 55863–55889.
- Tabor C.W., Tabor H. Polyamines in microorganisms // Microbiological Reviews. 1985. Vol. 49, № 1. Р. 81–99.


