Цитопатические эффекты бор-нейтронозахватной терапии на ускорительном источнике эпитепловых нейтронов для культуры клеток глиобластомы человека
Автор: Бывальцев Вадим Анатольевич, Завьялов Евгений Леонидович, Каныгин Владимир Владимирович, Касатова Анна Исмагиловна, Кичигин Александр Иванович, Разумов Иван Алексеевич, Сычева Татьяна Викторовна, Таскаев Сергей Юрьевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 4 т.18, 2019 года.
Бесплатный доступ
Бор-нейтронозахватная терапия (БНЗТ) - экспериментальный метод лучевой терапии, основанный на селективном повреждении клеток злокачественных опухолей за счет реакции между изотопом бор-10 и нейтроном. Клинические исследования на ядерных реакторах доказали эффективность данного вида терапии для пациентов с глиомами высокой степени злокачественности. Считается, что широкое внедрение методики в клиническую практику обеспечит компактные источники нейтронов на основе ускорителей заряженных частиц. Во всем мире ведется активная разработка новых ускорительных источников нейтронов, в том числе и в России: в Институте ядерной физики СО РАН был предложен и создан такой источник, на котором в настоящее время проводят доклинические испытания БНЗТ. Цель исследования - определить цитопатические эффекты БНЗТ на ускорителе эпитепловых нейронов для культуры клетки глиобластомы человека U87 и выбрать концентрацию препаратов бора, не оказывающую токсического влияния на клетки до облучения in vitro. Материал и методы. Клетки линии U87 инкубировали с борфенилаланином (BPA) и боркаптатом (BSH) в течение 1, 2 и 10 сут в различных концентрациях. Оценку цитопатических эффектов препаратов бора проводили с помощью МТТ-теста и клоногенного теста. Эффективность БНЗТ на клеточной линии U87 определяли на основании клоногенного теста. Результаты. МТТ-тест показал снижение выживаемости клеток при концентрации изотопа бора-10 в среде 160 мкг/мл через 48 ч и 640 мкг/мл через 24 ч инкубации для BPA. Цитопатические эффекты BSH проявляются при концентрации бора 80 мкг/мл после 48-часовой инкубации, а доля выживших клеток снижается до 89 % по сравнению с контролем. Согласно клоногенному тесту, цитотоксические эффекты препаратов BSH и BPA при концентрации бора в среде 40 мкг/мл составили 79,6 и 84 % соответственно. При облучении клеток эпитепловыми нейтронами в присутствии BPA доля выживших клеток составила 18 ± 2 %, в присутствии BSH - 13 ± 2 %. Гибель клеток без препаратов бора обусловлена упругим рассеянием нейтронов, ядерными реакциями поглощения тепловых нейтронов водородом и азотом и сопутствующим Y-излучением. Заключение. Проведенное исследование наглядно показало уменьшение доли выживших клеток линии U87 после БНЗТ на ускорительном источнике эпитепловых нейтронов в ИЯФ СО РАН в присутствии препаратов BSH и BPA, обогащенных изотопом 10В.
Клеточная линия глиобластомы u87, бнзт, ускорительный источник эпитепловых нейтронов, препараты бора, мтт-тест, клоногенный тест, опухоли головного мозга, гибель клетки, лучевая терапия
Короткий адрес: https://sciup.org/140254271
IDR: 140254271 | УДК: 616-006.484-08:615.849.1]-092.4 | DOI: 10.21294/1814-4861-2019-18-4-34-42
Текст научной статьи Цитопатические эффекты бор-нейтронозахватной терапии на ускорительном источнике эпитепловых нейтронов для культуры клеток глиобластомы человека
Бор-нейтронозахватная терапия (БНЗТ) является одной из перспективных методик лечения ряда онкологических заболеваний, в частности злокачественных опухолей головного мозга. Определяющим фактором является возможность селективно уничтожать опухолевые клетки. Основой метода является облучение нейтронами клеток с накопленным изотопом 10В. В результате поглощения нейтрона бором происходит ядерная реакция, продукты которой, альфа-частица и ядро лития, обладают большой энергией для летального повреж- дения ДНК клетки и ее гибели [1]. Считается, что уничтожаться будут только клетки, содержащие 10В, поскольку длина пробега продуктов распада, альфа-частицы и ядра лития, не превышает размеров клетки. В мировой практике для адресной доставки бора используют два соединения: L-p-борфенилаланин (ВРА) и боркаптат (BSH) [2]. BPA активно транспортируется в опухолевые клетки с помощью L-транспортной системы аминокислот, на фоне повышенной пролиферации и белкового синтеза [3, 4]. Накопление BSH в ткани опухолей головного мозга наблюдается при повреждении гематоэнцефалического барьера в совокупности с богатым кровоснабжением опухоли [5, 6].
В качестве источников нейтронов для БНЗТ до последнего времени использовались ядерные реакторы. Так, исследования влияния БНЗТ in vitro на клеточные линии глиом человека (U87, U251, T98G, SHG44, F98, 9L) показали, что БНЗТ более эффективно подавляет пролиферативную активность и рост исследуемых линий глиом по сравнению со стандартным облучением [1, 7–10].
На ядерных реакторах методикой БНЗТ пролечили чуть более 1500 больных, преимущественно с положительными результатами. Однако широкое внедрение методики БНЗТ в клиническую практику может быть осуществлено только с применением ускорителей заряженных частиц. Кроме того, что ядерный реактор нельзя установить в клинику в центре города, а также того факта, что после аварий в Чернобыле и Фукусиме в массовом сознании сформировалась радиофобия, существенным преимуществом ускорителей для лечения опухолей глубинного залегания является возможность получать терапевтический пучок нейтронов лучшего качества – преимущественно эпитепловых, с меньшим вкладом быстрых и тепловых нейтронов и γ-излучения. В настоящее время в мире разрабатывается несколько источников эпитепловых нейтронов на основе разного типа ускорителей заряженных частиц с использованием бериллиевой или литиевой мишени [11], в том числе источник нейтронов в ИЯФ СО РАН на основе ускорителя-тандема с вакуумной изоляцией и литиевой мишени [12, 13]. На этом источнике проведен ряд исследований по изучению влияния нейтронного излучения на жизнеспособность клеточных культур U251, T98G, CHO-K1, V-79 [14]. Показано, что облучение клеток 4 линий, культивируемых в присутствии BPA, уменьшает их колониеобразующую способность по сравнению с контролем. Также было изучено влияние эпитепловых нейтронов в различных дозах на жизнеспособность опухолевых клеток глиобластомы U87. Увеличение дозы с 1,9 до 4,1 Зв за 2–3 ч облучения способствовало гибели опухолевых клеток [15].
Целью исследования является подбор оптимальной концентрации препаратов бора, не оказывающей токсического влияния на клетки U87 до облучения in vitro , с последующей оценкой эффективности БНЗТ на ускорительном источнике.
Материал и методы
Культура клеток глиобластомы человека U87 была получена в ЦКП «Центр генетических ресурсов лабораторных животных» ИЦИГ СО РАН. Клетки культивировались на среде DMEM/ F12 (1:1) (Биолот, Россия) с добавлением 10 % фетальной бычьей сыворотки (Gybco, США) и гентамицина 50 мкг/мл (Дальхимфарм, Россия) при температуре 37 ºС с 5 % СО2. Клетки куль- тивировались во флаконах 75 см2 и за 2–3 сут до проведения БНЗТ пересевалась на два 6-луночных планшета: в одном находились клетки, которые подвергались облучению, в другом – контрольные образцы без облучения.
Для приготовления раствора BPA (Katchem, Чехия), обогащенного 10В, использовалась фруктоза в молярном избытке согласно протоколу Rossini et al. [16]. Концентрация стокового раствора BPA составила 2,5 мг/мл. BSH (Katchem, Чехия), обогащенный 10В, был растворен в 0,9 % растворе NaCl. Концентрация стокового раствора BSH составила 1,6 мг/мл.
В логарифмическую фазу роста за 18 ч до облучения в планшеты с клетками были добавлены препараты бора (BPA и BSH) в концентрации 10В 40 мкг/мл. Клетки из группы контроля и группы облученного контроля инкубировались без препаратов бора.
По окончании времени инкубации среда с препаратами бора была заменена на среду без препарата. Транспортировка планшетов с клетками на ускоритель нейтронов и обратно осуществлялась в термоизолирующем контейнере, температура в котором находилась в интервале от 18 до 30 °С. Эта процедура была проведена для клеток из всех групп, включая контрольные. Вне условий СО2 инкубатора клетки находились не более 3 ч. Во время облучения клетки линии U87 опытных и контрольных групп находились в монослое на 6-луночных планшетах.
Облучение проведено на ускорительном источнике эпитепловых нейтронов ИЯФ СО РАН [12] в течение 25 мин при энергии протонов 2 МэВ и токе 2,6 мА. Перед облучением планшет с U87 помещали внутрь фантома из оргстекла на глубину 36 мм от поверхности и ставили под нейтроногенерирующую мишень. Над 6-луночным планшетом располагали золотую активационную фольгу, степень активации которой использовали для контроля поглощенной дозы. Проведенные расчёты показали, что группы БНЗТ с концентрацией 10В в образцах 40 мкг/мл получили дозу 5,74 Гр экв, облученные образцы без бора – 1,1 Гр экв.
В основе определения цитотоксичности методом МТТ лежит способность митохондриальных ферментов живых клеток восстанавливать желтый бромид 3-(4,5-диметилтиазол-2-ил)-2,5-тетразолия (МТТ) в пурпурно-синие внутриклеточные кристаллы МТТ-формазана, далее растворяемые в диметилсульфоксиде (ДМСО).
Были оценены ранние (24 и 48 ч) и поздние (10 сут) цитотоксические эффекты БНЗТ в возрастающих концентрациях на клеточную линию U87. Интактные клетки, которые инкубировались без препаратов бора, были приняты за контроль. Клеточная линия высеивалась в 96-луночный планшет по 5×103–104 клеток на лунку. Через сутки в разные лунки были добавлены препараты бора в зависи- мости от группы (BSH или BPA) в концентрациях 10В – 5, 10, 20, 40, 80, 160, 320, 640, 1280 мкг/мл по 4 повторения, с которыми клетки инкубировались в двух временных интервалах – 24 и 48 ч. Затем среду с препаратом заменяли на среду без сыворотки и добавляли 10 мкл раствора МТТ (в концентрации 5 мг/мл) в каждую лунку. Клетки инкубировали еще 4 ч и затем среду удаляли и вносили ДМСО по 100 мкл/лунку с последующим ресуспендированием раствора и его инкубацией в течение 5 мин при температуре 37 °С в термостате. После инкубации измеряли оптическую плотность полученного раствора на BioRad iMark Microplate reader при длине волны 490 нм. В качестве нулевого контроля использовали лунки без клеток с раствором ДМСО без добавления МТТ-реагента. По полученным результатам рассчитывали долю выживших клеток и ЛД50-концентрацию препаратов бора, которая вызвала 50 % гибель клеток по сравнению с контролем.
Клоногенный анализ для определения цитотоксичности BPA и BSH и эффективности БНЗТ. В логарифмическую фазу роста клетки U87 пересевали в 6-луночные культуральные планшеты. Через сутки среду меняли на содержащую BPA и BSH и инкубировали в течение 18 ч. Содержание 10В в лунках было равно 10, 20, 40 и 80 мкг/мл, контрольная лунка не содержала препаратов бора. Через 18 ч клетки отмывали, снимали трипсином и высевали по 200 клеток на лунку 12-луночного планшета в 3 повторах. После облучения клетки также высевали по 200 на лунку 12-луночного планшета в 3 повторах и культивировали в СО2-инкубаторе. Планшеты инкубировали в CO2-инкубаторе и ежедневно контролировали состояние и количество клеток в колониях. На 10-е сут, когда колонии достигли достаточного размера (более 50 клеток), их фиксировали 10 % формалином (Panreac AppliChem, Германия) и окрашивали раствором Гимза (Sigma, США). Эффективность клонирования клеток в контрольной группе составляла 81 и была принята за 100 %. В экспериментальных группах эффективность клонирования определяли как процент от клонирования в контрольной группе. Подсчет проводился при помощи светового инвертированного микроскопа Zeiss Primo Vert (Германия).
Статистическую обработку данных проводили c помощью программного обеспечения Microsoft Excel 2010 и STATISTICA 10. Категориальные переменные выражали в процентах. Сравнительный анализ значений в сравнивапемых группах выполняли при помощи Манна – Уитни теста и критерия χ2 Пирсона. Полученные значения выражали как среднее ± SD.
Результаты
Определение цитотоксичности BPA и BSH для клеток U87 в МТТ тесте
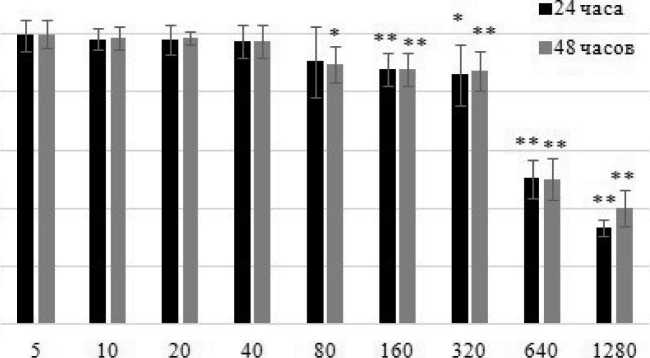
Впервые цитопатические эффекты BSH проявлялись при концентрации бора 80 мкг/мл только после 48-часовой инкубации, когда доля выживших клеток снижалась до 89 % по сравнению с контролем (Mann – Whitney test: Z=2,36, р=0,018). Доля выживших клеток при концентрации бора 160 и 320 мкг/мл практически не изменялась: 87,8 % (Mann – Whitney test: Z=2,85, р=0,004) и 85,9 % (Mann – Whitney test: Z=2,49, р=0,013) как после 24-часовой инкубации, так и после 48 ч: 87,8% (Mann – Whitney test: Z=2,85, р=0,004) и 87,1 % (Mann – Whitney test: Z=2,61, р=0,009) соответственно. Скачкообразное снижение до 50 % наблюдалось только при 640 мкг/мл до 50,2 % для 24-часовой инкубации (Mann – Whitney test: Z=2,85, р=0,004) и 49,9 % для 48 ч (Mann – Whitney test: Z=2,85, р=0,004). Далее при 1280 мкг/мл доля выживших клеток снижалась до 33,5 % после 24 ч (Mann – Whitney test: Z=2,85, р=0,004) и 40,2 % после 48 ч инкубации (Mann – Whitney test: Z=2,85, р=0,004) (рис. 1).
Иная картина наблюдалась для препарата BPA (рис. 2). Инкубация клеток в течение 24 и 48 ч при концентрации бора в среде 80 мкг/мл не приводила к достоверному снижению выживаемости клеток: 95,8 % (Mann–Whitney test: Z=1,15, р=0,25) и 95,3 % (Mann – Whitney test: Z=1,15, р=0,25) соответственно. Достоверное снижение выживаемости клеток наблюдалось при концентрации
Концентрация бора (мкгВЮ/мл)
Рис. 1. Определение дозозависимых цитотоксических эффектов BSH при помощи МТТ-теста через 24 и 48 ч с начала инкубации, x ± SD.
Примечание: * – р ≤ 0,05; ** – р ≤ 0,01
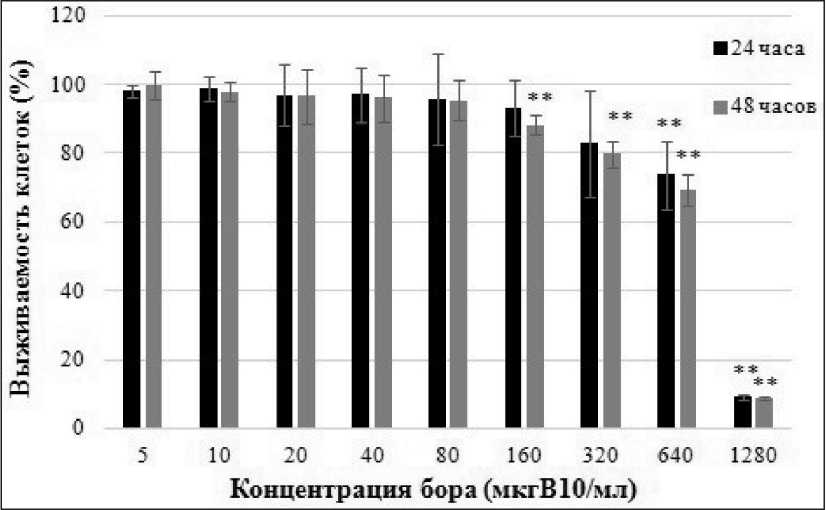
Рис. 2. Определение дозозависимых цитотоксических эффектов BPA при помощи МТТ-теста через 24 и 48 ч с начала инкубации, x ± SD.
Примечание: ** – р≤0,01
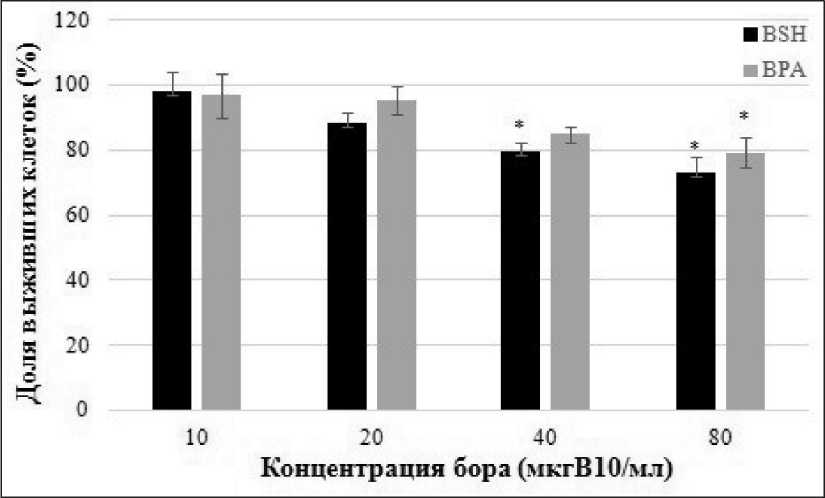
Рис. 3. Определение при помощи клоногенного теста поздних цитотоксических эффектов BSH и BPA на 10-е сут при разных концентрациях борсодержащих препаратов в среде.
Примечание: * – р≤0,05
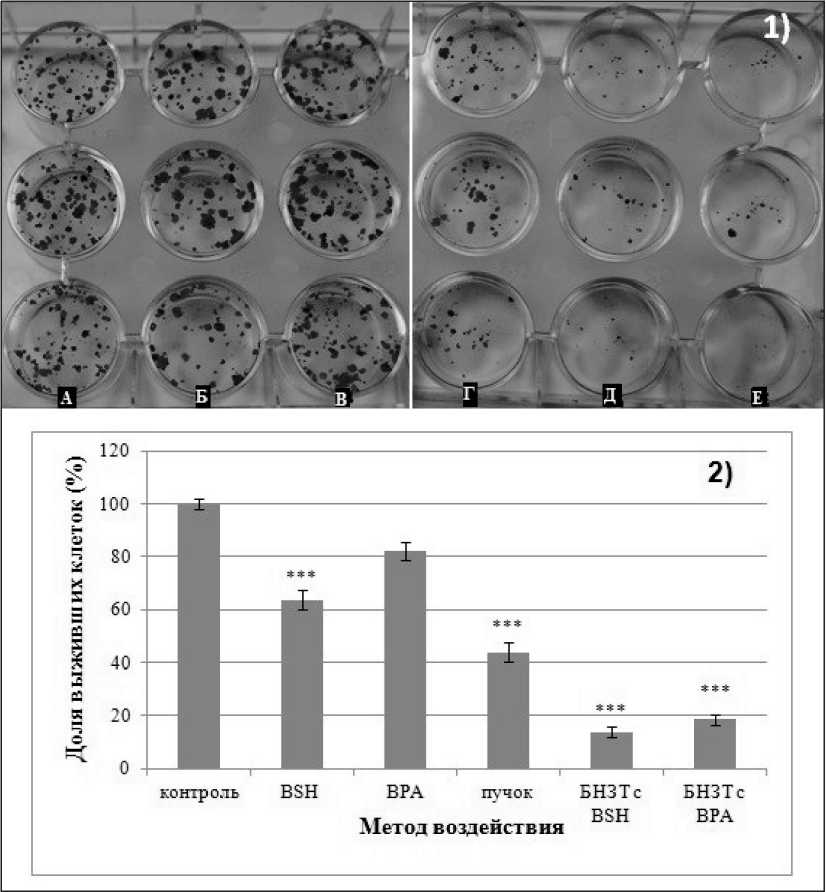
Рис. 4. Эффекты БНЗТ на клетки глиобластомы человека U87:
-
1) Фотографии лунок с колониями клеток U87, окрашенными раствором Гимза в различных группах. Необлученный контроль:
A – клетки U87 без инкубации с препаратами бора, Б – клетки U87, инкубированные с BSH, В – клетки U87, инкубированные с BPA.
Облученные группы:
Г – клетки линии U87 без препаратов бора, Д – клетки U87, инкубированные с BPA, Е – клетки U87, инкубированные с BSH;
-
2) Определение при помощи клоногенного анализа эффективности выживания клеток линии U87 после различных вариантов воздействия.
Примечание: *** – р≤0,001
изотопа бора в среде 160 мкг/мл и 320 через 48 ч инкубации (Mann – Whitney test: Z=2,85, р=0,004 и Z=2,85, р=0,004 соответственно). Причем в отличие от BSH, при 640 мкг/мл выживаемость клеток незначительно снижалась – до 73,7 % (Mann – Whitney test: Z=2,85, р=0,004) для 24 ч и 69,3 % (Mann – Whitney test: Z=2,85, р=0,004) для 48 ч инкубации. Тогда как при концентрации бора 1280 мкг/мл выживаемость резко снижалась – до 9,1 % (Mann – Whitney test: Z=2,85, р=0,004) для 24 ч и 8,7 % (Mann – Whitney test: Z=2,85, р=0,004) для 48 ч инкубации.
Определение цитотоксичности BPA и BSH при помощи клоногенного теста
Оба исследуемых вещества оказывали значительное воздействие на жизнеспособность и пролиферативную активность клеток глиобластомы U87 (рис. 3). В концентрации 10В 40 мкг/мл доля выживших клеток составила 79,6 % для BSH (χ2=4,16, р=0,0414) и 84,9 % для BPA (χ2=2,13, р=0,1385), тогда как при самой высокой используемой концентрации бора в инкубационной среде (80 мкг/мл) при инкубации с BSH количество колоний снижалось до 73 % (χ2=7,6, р=0,0058), а с BPA – до 79,2 % (χ2=4,37, р=0,0373).
Оценка эффектов БНЗТ на клетки U87 при помощи клоногенного теста
После облучения клеток глиобластомы эпитепловыми нейтронами, поглощенная доза для которых была равна 5,74 Гр, доля выживших клеток через 24 ч после облучения составила 43 ± 3,7 % (рис. 4 А,Б). При облучении клеток эпитепловыми нейтронами доля выживших клеток, предварительно проинкубированных с BPA при концентрации бора в среде 40 мкг/мл, снизилась более чем в 2 раза и составила 18 ± 2 % (χ2=18,17, p=0). Аналогичная ситуация наблюдалась при облучении клеток U87, которые предварительно инкубировались с BSH: 13 ± 2 % (χ2=21,54, p=0). Цитотоксические эффекты препаратов BSH и BPA при концентрации бора в среде 40 мкг/мл в этом эксперименте составили 63,7 % (χ2=13,91, р=0,0002) и 82,1 % (χ2=2,76, р=0,097) соответственно.
Обсуждение
Многие исследования подтверждают высокую эффективность БНЗТ в отношении глиобластомы человека, когда стандартные методы лучевой терапии не дают терапевтического эффекта [17–19]. Несмотря на успешные результаты, БНЗТ остается экспериментальным методом лечения. В первую очередь это обусловлено отсутствием безопасного и доступного источника нейтронов с требуемыми характеристиками. Второй причиной невозможности введения этого подхода в широкую медицинскую практику является недостаточная селективность накапливающихся в опухоли препаратов бора, а также их токсичность. Поиск новых и безопасных источников нейтронов привел к созданию компактной установки ускорительного типа, конструктивные возможности которой позволяют надеяться, что она будет применяться в клинической практике [20]. В отношении препаратов бора проводятся исследования от определения оптимальных терапевтических концентраций до разработки новых способов их доставки в опухолевые клетки [11].
Для оценки эффектов БНЗТ, особенно при исследованиях in vitro , в первую очередь необходима оценка цитотоксического эффекта препарата бора. Так, мы уже оценили ранее максимально нетоксичные концентрации BPA на линию U251, используя МТТ-тест. Самая низкая токсичность наблюдалась в диапазоне от 10 до 40 мкг 10В/мл, самый низкий уровень пролиферации составил 84 % при максимальной концентрации бора 320 мкг/мл [21]. Цитотоксичность BPA была также оценена на опухолевых линиях D384 (астроцитома), SH-SY5Y (нейробластома) и фибробластах F26: через 24 ч были отмечены дозозависимые цитотоксические эффекты, начиная с концентрации 40 мкг 10В/мл, на туморогенные клетки, в то время как в группе фибробластов жизнеспособность снизилась лишь при инкубации с BPA в течение 48 ч в концентрации 100 мкг 10В/мл. Клоногенный тест также выявил дозозависимое уменьшение размера и количества колоний в сравнении с контролем [21]. Некоторые авторы также использовали клоногенный анализ для определения токсичности препаратов бора: сравнительный анализ группы с добавлением BPA в концентрации 100 ppm относительно интактного контроля не выявил достоверных различий [14]. Проведенные ранее исследования по оценке цитотоксичности наиболее широко используемых для БНЗТ препаратов BSH и BPA на различных клеточных линиях [21, 22] во многом совпадают с нашим исследованием.
Однако дозозависимых исследований на установке ускорительного типа до сих пор не проводилось. В представленном исследовании мы постарались наиболее широко определить дозозависимые эффекты цитотоксичности препаратов BSH и BPA, для чего исследовали не только их влияние на функцию митохондрий с помощью МТТ-теста, но и на репродуктивную функцию с помощью клоногенного теста. Наше исследование также подчеркивает важность оценки эффектов от длительного воздействия препаратов. Так, было выявлено, что препараты BSH и BPA оказывают цитотоксический эффект при длительном воздействии в высоких концентрациях. Токсические эффекты были отмечены уже для 80 мкг10В/мл в МТТ-тесте при инкубации с BSH и 160 мкг10В/мл с BPA, в клоногенном тесте концентрации 40 и 80 мкг10В/мл достоверно ингибируют процесс колониеобразования. Полученные различия объясняются тем, что клоногенный тест является более чувствительным, так как оценивает долгосрочные эффекты воздействия препаратов на репродуктивную функцию клетки. Действительно, по данным ряда авторов, концентрация 40 мкг10В/мл считается эффективной для БНЗТ [14, 23]. Некоторые авторы используют меньшие концентрации бора для проведения БНЗТ: японские исследователи инкубировали культуру U87 с 20 мкг10В/мл в течение 24 ч с последующим облучением на реакторе JRR-4. В качестве доставщиков бора применяли BSH и новые препараты [24]. Coderre et al. в эксперименте на крысиной глиосаркоме использовали BSH, BPA и борную кислоту, когда концентрация бора в среде составила около 25 мкг10В/мл [9].
Поскольку концентрация 40 мкг10В/мл борсодержащего препарата была определена как минимально токсическая доза, ее далее использовали для проведения БНЗТ. Время инкубации с препаратами бора перед БНЗТ было выбрано исходя из данных литературных источников. Максимальное накопление BPA клетками достигается через 4 ч и незначительно увеличивается через 24 ч после начала инкубации [25]. Однако концентрация бора во время инкубации с BSH остается неизменной, вероятно, вследствие накопления препарата путем пассивной диффузии [24], поэтому время инкубации не является значимым параметром для BSH.
Проведенные нами эксперименты по облучению клеточной культуры линии U87 на ускорительном источнике эпитепловых нейтронов в ИЯФ СО РАН показали достоверное уменьшение жизнеспособно- сти клеток, инкубированных с BPA или BSH, более чем на 90 % популяции в сравнении с контрольной группой. Однако отмечено, что в контрольной группе, где проводилось облучение потоком нейтронов без добавления препарата бора, выживаемость клеток снизилась более чем на 50 %. Гибель клеток обусловлена упругим рассеянием нейтронов, преимущественно быстрых, на ядрах вещества, ядерными реакциями поглощения тепловых нейтронов ядрами водорода и азота и сопутствующим γ-излучением. Полученные в исследовании данные актуализируют необходимость радиобиологической оценки воздействия пучка. В целом результаты, полученные на ускорительном источнике, сопоставимы или во многом коррелируют с результатами проведённых in vitro исследований по БНЗТ глиальных опухолей на реакторах [7–10].
Список литературы Цитопатические эффекты бор-нейтронозахватной терапии на ускорительном источнике эпитепловых нейтронов для культуры клеток глиобластомы человека
- Sauerwein W., Wittig A., Moss R., Nakagawa Y. Neutron Capture Therapy: Principles and Applications. Springer, 2012. 533.
- Barth R.F., Zhang Z., Liu T. A realistic appraisal of boron neutron capture therapy as a cancer treatment modality. Cancer Commun (Lond). 2018 Jun 19; 38(1): 36. DOI: 10.1186/s40880-018-0280-5
- Sun T., Zhang Z., Li B., Chen G., Xie X., Wei Y., Wu J., Zhou Y., Du Z. Boron neutron capture therapy induces cell cycle arrest and cell apoptosis of glioma stem/progenitor cells in vitro. Radiat Oncol. 2013 Aug 6; 8(1): 195. DOI: 10.1186/1748-717X-8-195
- Kubota R., Yamada S., Ishiwata K., Tada M., Ido T., Kubota K. Cellular accumulation of 18F-labelled boronophenylalanine depending on DNA synthesis and melanin incorporation: a double-tracer microau-toradiographic study of B16 melanomas in vivo. Br J Cancer. 1993 Apr; 67(4): 701-705. DOI: 10.1038/bjc.1993.129
- Yang F.Y., Chen Y.W., Chou F.I., Yen S.H., Lin Y.L., Wong T.T. Boron neutron capture therapy for glioblastoma multiforme: enhanced drug delivery and antitumor effect following blood-brain barrier disruption induced by focused ultrasound. Future Oncol. 2012; 8(10): 1361-1369. DOI: 10.2217/fon.12.118


