Цитотоксические эффекты комбинированного действия ионизирующего излучения и конъюгатов доксорубицина с дендритным полимером и векторным белком на опухолевые клетки in vitro
Автор: Замулаева И.А., Чурюкина К.А., Матчук О.Н., Яббаров Н.Г., Никольская Е.Д., Макаренко С.А., Жунина О.А., Кондрашева И.Г., Северин Е.С.
Рубрика: Научные статьи
Статья в выпуске: 3 т.25, 2016 года.
Бесплатный доступ
Дендритные полимеры (дендримеры) являются перспективными наноконтейнерами для направленной транспортировки противоопухолевых препаратов в клетки-мишени. Однако комбинированное действие ионизирующего излучения и дендримеров, конъюгированных с противоопухолевыми препаратами и векторными молекулами, практически не исследовано, поэтому является целью данной работы. Нами были использованы полиамидоаминовые (РАМАМ) дендримеры второго поколения (G2), ковалентно конъюгированные с доксорубицином (Докс) и векторным белком (рекомбинантным фрагментом третьего домена альфа-фетопротеина - 3D). Сравнивали цитотоксическое действие и внутриклеточное накопление Докс при одиночном и комбинированном действии ионизирующего излучения, свободного Докс, немодифицированных дендримеров второго поколения, нагруженных Докс (G2-Докс), и конъюгатов тех же дендримеров с векторным белком и Докс (3D-G2-Докс) на клетки рака молочной железы двух линий in vitro (MCF-7 и MCF-7/MDR1). Для линии MCF-7 использование конъюгатов Докс с дендримерами в комбинации с облучением оказалось не эффективным, поскольку не усиливало цитотоксическое действие облучения. Для линии MCF-7/MDR1 показан синергический характер комбинированного действия G2-Докс или 3D-G2-Докс и облучения. Таким образом, с точки зрения общего цитотоксического действия на стабильные линии опухолевых клеток использование изученных конъюгатов Докс с дендримерами является оправданным только в комбинации с облучением и только в случае высокой экспрессии Р-гликопротеина, определяющей множественную лекарственную устойчивость опухолевых клеток линии MCF-7/MDR1.
Доксорубицин, дендримеры, ионизирующее излучение, цитотоксическое действие, альфа-фетопротеин, опухолевые клетки, рак молочной железы, проточная цитометрия
Короткий адрес: https://sciup.org/170170260
IDR: 170170260 | DOI: 10.21870/0131-3878-2016-25-3-46-56
Текст научной статьи Цитотоксические эффекты комбинированного действия ионизирующего излучения и конъюгатов доксорубицина с дендритным полимером и векторным белком на опухолевые клетки in vitro
Направленная доставка противоопухолевых препаратов (ПП) в клетки-мишени является одним из наиболее эффективных способов совершенствования химиотерапии онкологических больных. Предполагается, что средства такой доставки могут быть использованы также при комбинированном химиолучевом лечении, если транспортируемый препарат способен усиливать повреждающее действие радиации. Важно, что при этом препарат не будет попадать в нормальные клетки и, следовательно, не будет увеличивать радиационное повреждение здоровых тканей. В настоящее время осуществляется экспериментальная проверка этой привлекательной идеи на основе использования наноконтейнеров с различной химической структурой. В частности, недавно были получены обнадёживающие результаты при комбинированном использовании липосом, нагруженных цисплатином, бромдезоксиуридином, доксорубицином (Докс) и др. препаратами [1-4].
Замулаева И.А.* – зав. отделом, д.б.н., проф.; Чурюкина К.А. – мл. научн. сотр; Матчук О.Н. – научн. сотр.; Яббаров Н.Г. – ст. научн. сотр., к.б.н.; Никольская Е.Д. – лаб.-исслед.; Макаренко С.А. – научн. сотр. МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИРЦ» Минздрава России. Жунина О.А. – ст. научн. сотр., к.б.н.; Кондрашева И.Г. – директор по инновационному развитию, к.б.н.; Северин Е.С. – ген. директор, д.х.н., чл.-корр. РАН. АНО «ИМОДИ».
Не менее перспективным представляется использование в роли наноконтейнеров дендритных полимеров (дендримеров), которые характеризуются строго контролируемой структурой, определённым молекулярным весом, монодисперсностью, биосовместимостью, а также возможностью контроля их биоразложения [5]. Дендримеры обладают древовидно-ветвящейся структурой и состоят из ядра, которое является центром ветвления, отдельных ветвей и концевых химических групп. Ковалентное связывание лекарственных препаратов с поверхностными группами дендримера позволяет ввести в молекулу достаточно большие количества лекарственного препарата. В то же время, используя специальные сшивающие агенты, можно контролировать высвобождение препарата из конъюгата. Гидролиз таких линкеров проходит под воздействием специфических условий (кислые значения pH или присутствие специфических протеаз), что приводит к быстрому внутриклеточному высвобождению лекарственного препарата, сохраняющего исходную структуру. В такие комплексы, помимо препарата, за счёт большого количества терминальных химических групп можно вводить векторные молекулы, обеспечивающие доставку препарата в клетки-мишени. В последние годы дендримеры всё чаще используют в качестве носителей для транспортировки в клетки биологически активных соединений, в ом числе ПП, а также для контролируемого высвобождения доставляемых веществ.
Однако возможность использования дендримеров, конъюгированных с векторными молекулами, при комбинированном химиолучевом воздействии ранее не изучалась. Поэтому целью данной работы является исследование цитотоксических эффектов комбинированного действия ионизирующего излучения и конъюгатов дендримеров второго поколения (G2) с ПП и векторной молекулой в двух модельных системах in vitro , различающихся по чувствительности к ПП. Объектом исследования были выбраны стабильные культуры клеток рака молочной железы человека линии MCF-7 и линии MCF-7/MDR1 с высокой экспрессией Р-гликопротеина, который, главным образом, и обеспечивает множественную лекарственную устойчивость этой клеточной линии. В качестве ПП выбран Докс, который входит в традиционные схемы лечения рака молочной железы и, как известно, обладает радиосенсибилизирующим действием за счёт своей способности снижать эффективность репарации сублетальных и потенциально летальных радиационно-индуцированных повреждений ДНК, а также накапливать опухолевые клетки в радиочувствительных G2+M–фазах клеточного цикла [6-8]. В качестве векторной молекулы использован фрагмент (третий домен – 3D) онкофетального белка альфа-фетопротеина (АФП). Рецепторы к АФП были обнаружены в клетках злокачественных новообразований различной локализации, но не в нормальных клетках [9], поэтому лиганд АФП рецептора – полноразмерный белок АФП или его фрагмент могут быть использованы в качестве вектора для адресной доставки ПП в опухолевые клетки, повышая, таким образом, селективность и эффективность их действия.
В целом, работа носила сравнительный характер: оценивались эффекты действия свободного Докс, дендримеров второго поколения, нагруженных Докс (G2-Докс), и конъюгатов тех же дендримеров с векторным белком и Докс (3D-G2-Докс). Основным критерием оценки являлось количество опухолевых клеток, выживших в течение 24 часов после одиночного и комбинированного действия указанных препаратов и облучения. Кроме того, в работе также контролировали внутриклеточное накопление и распределение указанных препаратов к моменту облучения, а также их удаление из опухолевых клеток в течение 24 часов культивирования в среде без препаратов, т.е. процессы, объясняющие цитотоксичность изучаемых воздействий.
Материалы и методы
Анализ цитотоксического действия и внутриклеточного содержания препаратов
Клетки линии MCF-7 и MCF-7/MDR1 культивировали по стандартной методике в полной питательной среде DMEM (ПанЭко, РФ) с добавлением 10% фетальной сыворотки крупного рогатого скота (Gibco, USA). Клеточные культуры в логарифмической стадии роста инкубировали с препаратами Докс (свободным Докс, G2-Докс и 3D-G2-Докс) в концентрации 2,5 мкМ по Докс в среде DMEM без сыворотки в течение 2 часов. Затем клетки подвергали воздействию γ-излучения (60Со) на установке «Луч-1» (Россия) в дозах 4 Гр (MCF-7) или 6 Гр (MCF-7/MDR1). Мощность дозы в обоих случаях составляла 0,9 Гр/мин. Часть клеток облучали без препаратов, или инкубировали с препаратами, но не облучали. Контролем служили не облучённые и необработанные препаратами клетки. Далее среду с препаратами удаляли, к клеткам приливали полную питательную среду с сывороткой и культивировали ещё 24 часа, после чего клетки снимали с подложки в 0,01 М фосфатный буфер (PBS) и определяли их количество во флаконах с помощью камеры Горяева. В отдельной серии экспериментов анализировали содержание Докс в клетках через 2 часа инкубации с препаратами (на момент облучения) и через 24 часа инкубации без препаратов. Для этого клетки снимали с подложки и немедленно анализировали на проточном цитофлуориметре FACS Calibur или FACS Vantage (Becton Dickinson Immunocytometry Systems - BDIS, США) при λ возбуждения =488 нм, λ эмиссии >650 нм.
Субклеточную локализацию Докс изучали с помощью лазерной сканирующей микроскопии при λ возбуждения =488 нм, λ эмиссии =600-700 нм через 24 часа инкубации с препаратами. Для анализа использовали микроскоп Leica 4000 TCS SPE (Leica Microsystems, Германия).
Синтез конъюгата G2 дендримера с Докс (G2-Докс)
В работе использованы полиамидоаминовые дендримеры 2-го поколения с 16 терминальными NH 2 -группами и ядром на основе этилендиамина (“Dendritech”, США). Ковалентные конъюгаты G2-Докс (“Sigma-Aldrich”, США) синтезировали с использованием кислотолабильного линкера цис-аконитового ангидрида в соответствии с ранее описанной методикой [10]. Чистоту полученного продукта анализировали с помощью высокоэффективной жидкостной хроматографии. Содержание Докс в конъюгате определяли путём фотоколориметрического измерения поглощения Докс при 481 нм.
Получение рекомбинантного 3D АФП и его конъюгата с дендримером G2 и Докс
3D АФП получали посредством бактериальной системы экспрессии, а именно с помощью штамма E. coli BL21DE3, трансформированного конструктом на основе плазмиды pET28a+, содержащей последовательность, кодирующую целевой белок. Получение конъюгата 3D-G2-Докс осуществляли с помощью Cu1+-катализируемой реакции циклоконденсации в несколько стадий, как подробно описано в статье [11]. Количество доксорубицина в конъюгате определяли путём фотоколориметрического измерения поглощения Докс при 481 нм. Гомогенность конъюгата, чистоту и молекулярную массу конечного конъюгата определяли с помощью аналитической гель-эксклюзионной хроматографии на колонке TSK gel G2000SWxl на хроматографической системе Shimadzu LC-20 Promience.
Статистическая обработка
Для описательной статистики использовали среднее значение и стандартную ошибку (SE), вычисленные с помощью программы «Statistica 6.0» (StatSoft., Inc.). Групповое сравнение полученных данных проводили по критерию Манна-Уитни в той же программе. Различия считали статистически значимыми при р<0,05. Построение графиков выполняли с помощью программы «Origin 6.0» (Microcal Software, Inc.). Для расчёта коэффициентов синергизма использовали формулу, предложенную Петиным В.Г. и соавт. [12].
Результаты и обсуждение
Цитотоксическое действие изучаемых препаратов на культуру линии MCF-7
При одиночном применении препаратов Докс наиболее выраженный цитотоксический эффект в отношении клеток MCF-7 обнаружен в случае свободного Докс (рис. 1). Конъюгаты дендримеров с Докс продемонстрировали относительно слабый цитотоксический эффект, что согласуется с данными по удалению изучаемых препаратов из клеток. Так, клетки этой линии, накопившие препараты в течение 2 часов (рис. 2), исключали Докс с разной интенсивностью: через 24 часа инкубации без препаратов внутриклеточное содержание Докс было статистически значимо выше в случае свободного Докс, чем G2-Докс или 3D-G2-Докс (рис. 3). Эти различия могут объясняться разной субклеточной локализацией Докс, поступившего в клетку в форме свободного Докс, G2-Докс или 3D-G2-Докс. Как показывают результаты лазерной микроскопии, в первом случае практически весь Докс находился в ядрах, в то время как в двух последних - в цитоплазме (данные не показаны).
р=0,01
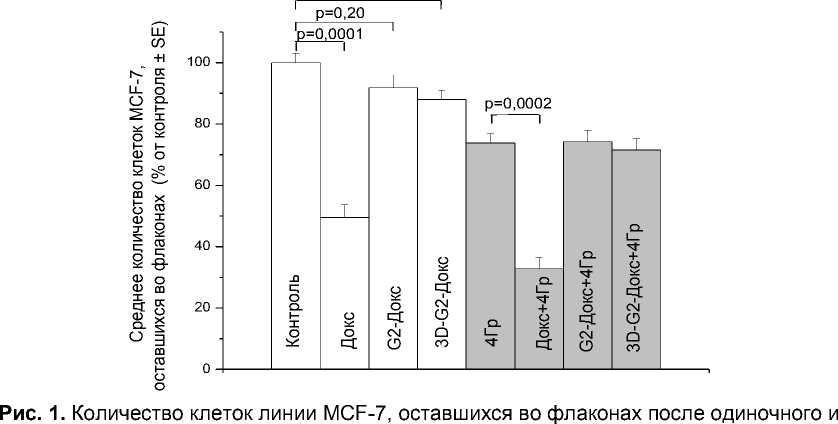
комбинированного действия препаратов Докс (2,5 мкМ) и ионизирующего излучения в дозе 4 Гр.
Представлены данные в процентах от количества клеток в контроле, принятого за 100%. Указана величина р - вероятность отсутствия различий между сравниваемыми группами.
При комбинированном действии препаратов Докс и Y-излучения получены сходные результаты: свободный Докс снижал количество облучённых клеток в наибольшей степени (К синергизма= 1,11), G2-Докс или 3D-G2-Докс практически не влияли на этот показатель (рис. 1).
Причина наблюдаемых различий та же, что при одиночном применении препаратов: значительно более интенсивное удаление из клеток Докс в двух последних случаях (рис. 3). Как видно на этом рисунке, облучение не оказывало существенного влияния на процесс удаления Докс из клеток, но увеличивало аутофлуоресценцию клеток.

Рис. 2. Накопление препаратов Докс в клетках линий MCF-7 и MCF-7/MDR1 в течение 2 часов. *р<0,0001 по сравнению с группой «Контроль» соответствующей линии клеток; ^p<0,001 по сравнению с группой «Докс» соответствующей линии клеток.
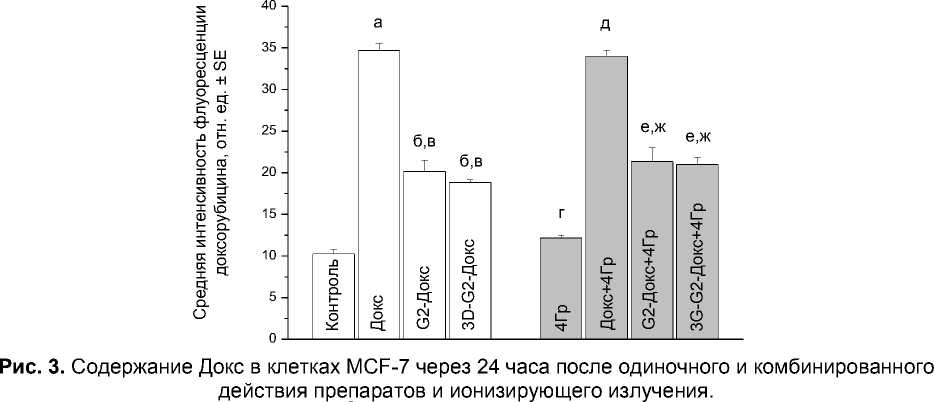
ар<0,00001 по сравнению с контролем; бр<0,00002 по сравнению с контролем; вр<0,00001 по сравнению с группой «Докс»; гр=0,01 по сравнению с контролем; др<0,00001 по сравнению с группой «4Гр»; ер<0,0003 по сравнению с группой «4Гр»; жр<0,00002 по сравнению с группой «Докс+4Гр».
Цитотоксическое действие изучаемых препаратов на культуру линии MCF-7/MDR1
Как ожидалось, клетки линии MCF-7/MDR1 продемонстрировали относительную резистентность к свободному Докс: через 24 часа после инкубации с этим препаратом во флаконах оставалось в 1,5 раза больше клеток по сравнению с линией MCF-7 (рис. 4). Накопление свободного Докс в клетках MCF-7/MDR1 было значительно (в 4 раза) ниже, чем в клетках чувствительной линии MCF-7 (р<0,0001, рис. 2). При этом накопленный Докс был локализован в цитоплазме, а не в ядрах, где находится основная (хотя и не единственная) мишень его действия – ядерная ДНК. И что очень важно, через 24 часа инкубации без препарата весь Докс, поступивший в клетки в свободной форме, удалялся из них.
р=0,003
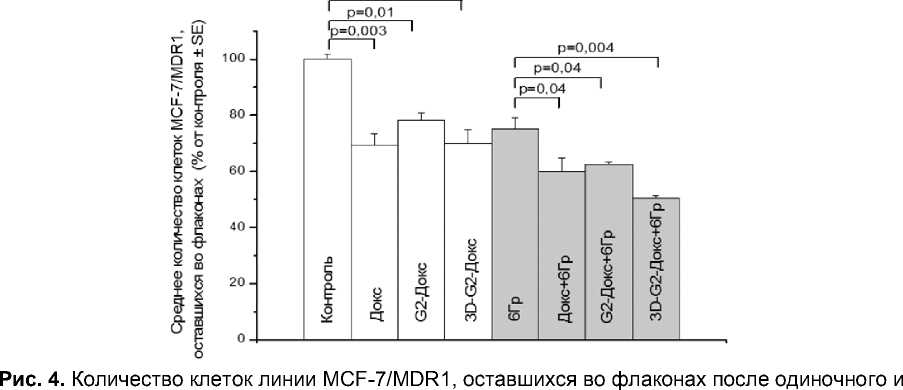
комбинированного действия препаратов Докс (2,5 мкМ) и ионизирующего излучения в дозе 4 Гр. Представлены данные в процентах от количества клеток в контроле, принятого за 100%. Указана величина р – вероятность отсутствия различий между сравниваемыми группами.
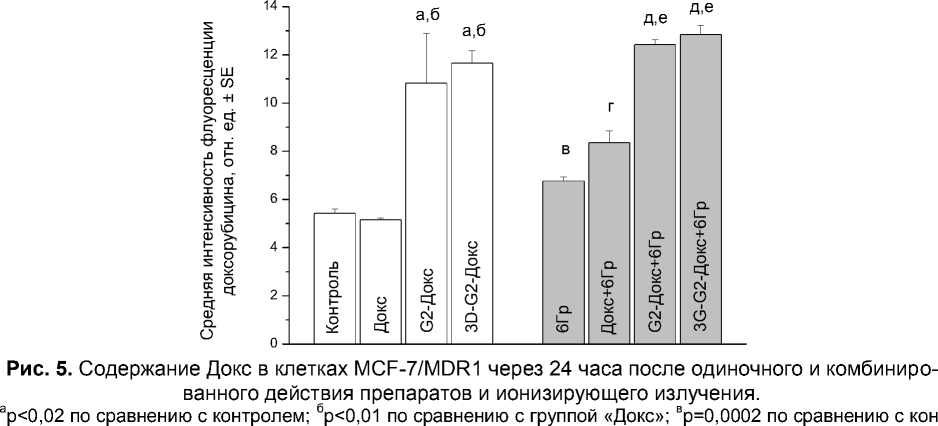
тролем; гр=0,02 по сравнению с группой «6Гр»; др<0,00001 по сравнению с группой «6Гр»; ер<0,0001 по сравнению с группой «Докс+6Гр».
На клетки линии MCF-7/MDR1 свободный Докс и 3D-G2-Докс оказывали одинаковое цитотоксическое действие при одиночном применении (рис. 4). G2-Докс снижал количество клеток этой линии в несколько меньшей степени, чем свободный Докс или 3D-G2-Докс. При этом по данным проточной цитометрии конъюгаты дендримеров с Докс накапливались в клетках лучше, а удалялись хуже, чем свободный Докс (рис. 5). Однако субклеточная локализация Докс была одинаковой: во всех случаях флуоресценция Докс отмечалась в цитоплазме и практически не затрагивала ядра. Поскольку основной мишенью действия Докс является ядерная ДНК неудивительно, что все препараты оказывали относительно слабое и притом одинаковое цитотоксическое действие на клетки MCF-7/MDR1.
Интересно, что облучение повышало аутофлуоресценцию клеток MCF-7/MDR1, однако не влияло на специфическую флуоресценцию Докс (рис. 5). Клетки этой линии обладают более высокой резистентностью не только к действию химиопрепаратов, но и ионизирующего излучения. В предварительных экспериментах было показано, что облучение клеток MCF-7/MDR1 в дозе 6 Гр оказывало такое же цитотоксическое действие, как облучение клеток MCF-7 в дозе 4 Гр. Поэтому для экспериментов по комбинированному воздействию на клетки MCF-7/MDR1 была выбрана изоэффективная доза 6 Гр. Как показано на рис. 4, облучение в этой дозе снижало количество живых клеток на 25% по сравнению с контролем (p<0,001), комбинированное воздействие приводило к ещё более выраженному уменьшению этого показателя. Максимальный цитотоксический эффект был обнаружен при комбинированном действии 3D-G2-Докс и ионизирующего излучения (в этом случае количество выживших клеток составляло 50% от контроля). Коэффициент синергизма составил для свободного Докс 0,8, для G2-Докс - 1,1 и для 3D-G2-Докс - 1,1.
Как известно, клетки химиорезистентной линии MCF-7/MDR1 характеризуются высокой экспрессией Р-гликопротеина - трансмембранного белка, обеспечивающего обратный транспорт многих ПП (в том числе Докс) во внеклеточную среду. Это свойство данной клеточной линии хорошо объясняет низкое накопление и быстрое удаление свободного Докс из клеток, которое наблюдалось в нашем исследовании и в работах других авторов [13]. При этом, как и следовало ожидать, высокая экспрессия Р-гликопротеина в значительно меньшей степени влияла на накопление и удаление Докс, поступающего в клетки в составе дендримеров.
Установлено, что Р-гликопротеин экспрессируется не только на клеточной мембране, но и на ядерной, а также на мембранах митохондрий, аппарата Гольджи, вследствие чего этот транспортный белок влияет не только на общее накопление Докс, но и его распределение по внутриклеточным компартментам [14-16]. Именно высокая экспрессия Р-гликопротеина на ядерной мембране, по крайней мере, частично объясняет отсутствие Докс в ядрах при наличии его в цитоплазме клеток, обработанных G2-Докс и 3D-G2-Докс. Другой причиной отсутствия Докс в ядрах этих клеток может быть недостаточно эффективное высвобождение Докс из конъюгатов. В любом случае в клетках резистентной линии MCF-7/MDR1 мы не зарегистрировали ядерной флуоресценции Докс при использовании свободного Докс, G2-Докс или 3D-G2-Докс. Следовательно, можно полагать, что цитотоксическое действие этих препаратов, как и их радиомодифицирующие свойства, не связаны с основным механизмом действия Докс - интеркаляцией в ядерную ДНК и ингибированием топоизомеразы II, что приводит в конечном итоге к появлению двойных разрывов ДНК и клеточной гибели. Очевидно, в данном случае цитотоксическое и радиомодифицирующее действие препаратов реализуется через окислительный стресс, индуцируемый Докс благодаря его способности продуцировать свободные радикалы при взаимодействии с рядом митохондриальных белков, как было показано в ранних работах [17-19].
В клетках линии MCF-7 Докс, поступивший в клетки в составе конъюгатов с дендримерами, также был локализован в цитоплазме в отличие от свободного Докс, который быстро накапливался в ядрах. По-видимому, вследствие разного внутриклеточного распределения цитотоксическое действие конъюгатов на клетки этой линии было выражено значительно слабее, чем в случае свободного доксорубицина, который связывался с ядерной ДНК и вызывал клеточную гибель путём ингибирования топоизомеразы II. Конъюгаты Докс с дендримерами не оказывали радиомодифицирующего действия на клетки линии MCF-7 (в отличие от MCF-7/MDR1). Причины этого различия требуют дальнейших исследований.
Заключение
В целом, использованные нами конъюгаты Докс с немодифицированными дендримерами второго поколения при одиночном применении оказывали на клетки обеих изучаемых линий определённое цитотоксическое действие, заключающееся в уменьшении количества опухолевых клеток по сравнению с контролем. При этом свободный Докс оказывал более выраженное цитотоксическое действие на клетки линии MCF-7 и одинаковое на клетки химиорезистентой линии MCF-7/MDR1 по сравнению с конъюгатами. Установленные различия объясняются особенностями клеток разных линий (MDR1+ и MDR1-), отличающихся по накоплению и удалению препаратов Докс из клеток, а также особенностями внутриклеточного распределения Докс и конъюгатов Докс с дендримерами.
Для линии MCF-7 использование конъюгатов Докс с дендримерами в комбинации с облучением оказалось не эффективным, поскольку не усиливало цитотоксическое действие облучения. В то же время эффект комбинированного действия свободного Докс и ионизирующего излучения носил синергический характер.
В отличие от клеток MCF-7, для линии MCF-7/MDR1 показан синергический характер комбинированного действия конъюгатов Докс и облучения. Напротив, свободный Докс в комбинации с облучением не приводил к усилению цитотоксического действия облучения.
Учитывая накопление конъюгатов Докс с дендримерами в цитоплазме, но не в ядрах клеток обеих линий, можно полагать, что механизмы цитотоксического действия этих препаратов, по-видимому, связаны с развитием окислительного стресса, а не с механизмом, опосредованным интеркаляцией Докс в ядерную ДНК.
Таким образом, с точки зрения общего цитотоксического действия на опухолевые клетки in vitro использование изученных конъюгатов Докс с дендримерами является оправданным только в комбинации с облучением и только в случае высокой экспрессии Р-гликопротеина, определяющей множественную лекарственную устойчивость опухолевых клеток. Закономерности цитотоксического действия конъюгатов Докс с модифицированными дендримерами требуют дальнейших исследований.
Исследование выполнено за счёт гранта Российского научного фонда (проект № 1515-10013).
Список литературы Цитотоксические эффекты комбинированного действия ионизирующего излучения и конъюгатов доксорубицина с дендритным полимером и векторным белком на опухолевые клетки in vitro
- Hagtvet E., Røe K., Olsen D.R. Liposomal doxorubicin improves radiotherapy response in hypoxic prostate cancer xenografts//Radiat. Oncol. 2011. V. 6. P. 135.
- Peters T., Grunewald C., Blaickner M., Ziegner M., Schütz C., Iffland D., Hampel G., Nawroth T., Langguth P. Cellular uptake and in vitro antitumor efficacy of composite liposomes for neutron capture therapy//Radiat. Oncol. 2015. V. 10. P. 52.
- Jung J., Jeong S.Y., Park S.S., Shin S.H., Ju E.J., Choi J., Park J., Lee J.H., Kim I., Suh Y.A., Hwang J.J., Kuroda S., Lee J.S., Song S.Y., Choi E.K. A cisplatin-incorporated liposome that targets the epidermal growth factor receptor enhances radiotherapeutic efficacy without nephrotoxicity//Int. J. Oncol. 2015. V. 46, N 3. P. 1268-1274.
- Kato S., Kimura M., Miwa N. Enhanced radiosensitization by the cationic liposome-encapsulated thymidine analogue BrdU through the increased intracellular BrdU-uptake on human melanoma as compared to anionic or nonionic liposomal or free BrdU//J. Biomed. Nanotechnol. 2014. V. 10, N 11. P. 3280-3290.
- Gillies E.R., Fréchet J.M. Dendrimers and dendritic polymers in drug delivery//Drug. Discovery Today. 2005. V. 10, N 1. P. 35-43.
- Bonner J.A., Lawrence T.S. Doxorubicin decreases the repair of radiation-induced DNA damage//Int. J. Radiat. Biol. 1990. V. 57, N 1. P. 55-64.
- Lawrence T.S., Blackstock A.W., McGinn C. The mechanism of action of radiosensitization of conventional chemotherapeutic agents//Seminars in Radiation Oncology. 2003. V. 13. P. 13-21.
- Supiot S., Gouard S., Charrier J., Apostolidis C., Chatal J-F., Barbet J., Davodeau F., Cherel M. Mechanisms of cell sensitization to alpha radioimmunotherapy by doxorubicin or paclitaxel in multiple myeloma cell lines//Clin. Cancer. Res. 2005. V. 11, N 19. P. 7047-7052.
- Ницветов М.Б., Москалева Е.Ю., Посыпанова Г.А., Макарова О.В., Степанов В.А., Рогов К.А., Коромыслова И.А., Караулов А.В., Северин С.Е., Северин Е.С. Изучение экспрессии рецептора АФП в опухолевых и нормальных тканях человека с помощью иммуногистохимического метода//Иммунология. 2005. Т. 26, № 2. С. 122-125.
- Yabbarov N.G., Posypanova G.A., Vorontsov E.A., Popova O.N., Severin E.S. Targeted delivery of doxorubicin: Drug delivery system based on PAMAM dendrimers//Biochemistry (Moscow). 2013. V. 78, N 8. P. 1128-1140.
- Abdullah A.H.A.F., Fazren A., Mariusz S., Istvan T. Peptide conjugation via CuAAC ‘click’ chemistry//Molecules. 2013. V. 18, N 11. P. 13148-13174.
- Петин В.Г., Жураковская Г.П., Комарова Л.Н. Радиобиологические основы синергических взаимодействий в биосфере. М: Геос, 2012. 219 с.
- Zhang J., Zhou F., Wu X., Zhang X., Chen Y., Zha B.S., Niu F., Lu M., Hao G., Sun Y., Sun J., Peng Y., Wang G. Cellular pharmacokinetic mechanisms of adriamycin resistance and its modulation by 20(S)-ginsenoside Rh2 in MCF-7/Adr cells//Brit. J. Pharmacol. 2012. V. 165. P 120-134.
- Baldini N., Scotlandi K., Serra M., Shikita T., Zini N., Ognibene A., Santi S., Ferracini R., Maraldi N.M. Nuclear immunolocalization of P-glycoprotein in multidrug-resistant cell lines showing similar mechanisms of doxorubicin distribution//Eur. J. Cell. Biol. 1995. V. 68. P. 226-239.
- Gong Y., Duvvuri M., Krise J.P. Separate roles for the Golgi apparatus and lysosomes in the sequestration of drugs in the multidrug-resistant human leukemic cell line HL-60//J. Biol. Chem. 2003. V. 278. P. 50234-50239.
- Munteanu E., Verdier M., Grandjean-Forestier F., Stenger C., Jayat-Vignoles C., Huet S., Robert J., Ratinaud M.H. Mitochondrial localization and activity of P-glycoprotein in doxorubicin-resistant K562 cells//Biochem. Pharmacol. 2006. V. 71. P. 1162-1174.
- Myers C.E., McGuire W.P., Liss R.H., Ifrim I., Grotzinger K., Young R.C. Adriamycin: the role of lipid peroxidation in cadiac toxicity and tumor response//Science. 1977. V. 197, N 4299. P. 165-167.
- Doroshow J.H. Anthracycline antibiotic-stimulated superoxide, hydrogen peroxide, and hydroxyl radical production by NADH dehydrogenase//Cancer Res. 1983. V. 43. P. 4543-4551.
- Ravid A., Rocker D., Machlenkin A., Rotem C., Hochman A., Kessler-Icekson G., Liberman U.A., Koren R. 1,25-Dihydroxyvitamin D3 enhances the susceptibility of breast cancer cells to doxorubicin-induced oxidative damage//Cancer Res. 1999. V. 59. P. 862-867.


