Цитотоксические свойства нанолистовых структур на основе оксидных и гидроксидных фаз алюминия в отношении опухолевых клеток
Автор: Ложкомоев А.С., Бакина О.В., Казанцев С.О., Иванова Л.Ю., Августинович А.В., Афанасьев С.Г., Спирина Л.В., Добродеев А.Ю.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 4 т.20, 2021 года.
Бесплатный доступ
Введение. Применение наночастиц и наноструктур в качестве компонентов терапии опухолей является предметом большого количества научных исследований. Одним из наиболее перспективных подходов подавления жизнеспособности опухолевых клеток является изменение величины водородного показателя рН их микроокружения при добавлении наночастиц и наноструктур. Гидроксиды и оксиды алюминия имеют ряд преимуществ перед другими частицами благодаря развитой поверхности, низкой токсичности и термической стабильности. Целью исследования явилось изучение влияния кислотно-основных свойств нанолистовых структур на основе гидроксидов алюминия с различным фазовым составом на жизнеспособность широкого спектра опухолевых клеток: Hela, mda, pymt, А549, B16F10. Материал и методы. В качестве прекурсора для получения наноструктур различного фазового состава использовали наночастицы алюмонитридной композиции. Наночастицы алюминия были получены электрическим взрывом алюминиевой проволоки в атмосфере азота. Такие наночастицы реагируют с водой уже при температуре 60 °Ϲ. В результате формируются пористые наноструктуры, которые представляют собой агломераты нанолистов с планарным размером до 200 нм и толщиной 5 нм. Фазовый состав наноструктур варьировали температурой прокаливания. Изменение фазового состава наноструктур приводило к изменению кислотно-основного покрова их поверхности. Для оценки количества кислотных и основных центров на поверхности наноструктур использовали адсорбцию индикаторов Гаммета. Количество адсорбированных красителей определяли спектрофотометрически. Результаты. Отличия кислотно-основных характеристик поверхности синтезированных наноструктур приводят к изменению их цитотоксичности в отношении опухолевых клеток. У гидроксида алюминия в фазе γ-al2o3 основных центров было в 6,5 раза больше, чем кислотных, что обусловливает его способность проявлять более выраженные антацидные свойства, т.е. дольше нейтрализовать протоны, выделяемые опухолевыми клетками. Данный образец обладает наибольшей активностью в отношении всех клеточных линий. Заключение. Противоопухолевая активность синтезированных наноструктур обусловлена не только повышением величины рН микроокружения клеток, но и возможностью дольше поддерживать щелочность микроокружения за счет адсорбции протонов, выделяемых опухолевыми клетками.
Наноструктуры, цитотоксичность, кислотно-основные свойства, опухолевые клетки
Короткий адрес: https://sciup.org/140254536
IDR: 140254536 | УДК: 576.3:546.62:57.085.23 | DOI: 10.21294/1814-4861-2021-20-4-73-83
Текст научной статьи Цитотоксические свойства нанолистовых структур на основе оксидных и гидроксидных фаз алюминия в отношении опухолевых клеток
Уникальные свойства наночастиц и наноструктур открывают новые перспективы для лечения злокачественных новообразований. Для противоопухолевой терапии были разработаны многочисленные системы на основе наночастиц в качестве носителей лекарств для целевой терапевтической доставки [1–6] и проводники для создания гипертермии [7]. Кроме того, наночастицы с определенным размером, морфологией, фазовым составом и другими физико-химическими свойствами могут оказывать прямое влияние на биологические функции раковых клеток [8–10]. Одним из перспективных подходов в борьбе с опухолевыми клетками может стать подавление их жизнеспособности через изменение параметров микроокружения клеток, в том числе изменение водородного показателя рН. В работе Y. Li et al. [11] показаны перспективы использования металлфуллереновых наночастиц Gd@C82(OH)22 при воздействии на опухоль через ингибирование ангиогенеза, антиоксидантной и иммунной активации. В экспериментах in vitro показана возможность подавления пролиферации клеток оксидом магния (MgO) повышением рН микроокружения клеток [12, 13]. Известно, что кислотность опухолевых клеток вызвана увеличением генерации протонов в результате анаэробного метаболизма за счет сверхэкспрессии димерного изофермента пируваткиназы M2-PK [14]. Благодаря этому опухоли имеют значительно более низкий внеклеточный водородный показатель (рН∼6,5–7,1) по сравнению с нормальными тканями (рН=7,4) [15–17]. Разница кислотности микроокружения нормальных и опухолевых клеток также используется для направленной доставки и контролируемого высвобождения химиотерапевтических препаратов в опухоли [18–21].
Благодаря кислому микроокружению опухолевые клетки в большей степени устойчивы ко многим стандартным лекарственным средствам, которые являются слабыми основаниями. Препараты быстро нейтрализуются кислым микроокружением опухолевой клетки. Для нейтрализации кислотности внеклеточной среды в настоящее время используются ингибиторы протонного насоса (PPIs), с помощью которых увеличивается эффективность химиотерапии [22]. Последние исследования показывают, что изменение внеклеточного рН убивает опухолевые клетки, уменьшает метастазирование и снижает устойчивость опухолевых клеток к лекарственным препаратам [23]. Это позволяет рассматривать данный подход в качестве перспективного метода лечения рака, в том числе при использовании субоптимальных концентраций химиопрепаратов.
Перспективными материалами для нейтрализации кислого рН микроокружения клеток могут стать наноструктуры на основе оксидов и гидроксидов алюминия. Известно, что гидроксиды алюминия являются нейтрализаторами кислот и адъювантами. Кроме того, они обладают высокой адсорбционной емкостью и пористостью. В зависимости от способа получения можно синтезировать наноструктуры на основе оксидных и гидроксидных фаз алюминия, обладающие различной формой, размером, кислотно-основными свойствами, фазовым составом, дзета-потенциалом и др. Изменение фазового состава наноструктур – это основной фактор, регулирующий кислотноосновной покров поверхности. В настоящей работе фазовый состав наноструктур варьировали температурой прокаливания. Кроме того, было изучено влияние агломератов нанолистовых структур на основе гидроксидов алюминия с различным фазовым составом на жизнеспособность опухолевых клеток.
Цель исследования – изучение влияния кислотно-основных свойств нанолистовых структур на основе гидроксидов алюминия с различным фазовым составом на жизнеспособность широкого спектра опухолевых клеток: HeLa, MDA, PyMT, А549, B16F10.
Материал и методы
Синтез нанолистовых структур на основе гидроксидов алюминия осуществляли окислением водой нанопорошка AlN/Al, полученного методом электрического взрыва алюминиевой проволочки в атмосфере азота [24, 25]. Для этого навеску порошка массой 10 г помещали в емкость с дистиллированной водой объемом 1000 мл и нагревали суспензию при постоянном перемешивании при 60 °С в течение 60 мин. В результате нагрева суспензии происходит гидролиз и окисление наночастиц AlN/Al. После реакции осадок отфильтровывали при помощи мембраны с диаметром пор 0,44 мкм и сушили при 120 °С в течение 2 ч. После сушки порошок разделяли на три части, одну из которых оставляли неизменной, вторую прокаливали в муфельной печи при 650 °С, третью – при 900 °С.
Морфологию синтезированных образцов нанолистовых структур исследовали с помощью просвечивающей электронной микроскопии ПЭМ (JEM-2100, Япония) и сканирующей электронной микроскопии СЭМ (Zeiss Ultra-Plus FEG-SEM, Германия). Метод тепловой десорбции азота использовали для определения площади удельной поверхности и распределения пор по размеру. Измерения дзета-потенциала проводили с использованием анализатора Zetasizer Nano ZSP (Великобритания). Изменение рН водных суспензий наноструктур в зависимости от количества добавленной кислоты изучали с помощью многофункциональной системы автоматического титрования MPT-2 (Великобритания), интегрированной с прибором Zetasizer Nano ZSP. Рентгеноструктурный анализ (РФА) проводили на дифрактометре Shimadzu XRD 6000 (Япония), работающем с CoKa-излучением при 40 кВ и 30 мА. Качественный анализ был выполнен с использованием базы данных PDF-2 Release 2014. Свойства поверхности образцов исследовали методом ИК-спектроскопии с помощью спектрометра Nicolet 5700, США. Измерения рН проводили с помощью рН-метра Мультитест ИПЛ-103 (Россия).
Концентрацию кислотных и основных центров на поверхности нанолистовых структур определяли с помощью адсорбции одноосновных красителей (индикаторов Гаммета) спектрофотометрическим методом. Анализ позволяет определить содержание активных центров с данным значением рКа на поверхности исследуемого образца по формуле
\dq-dt\ | |Dq-d2| mL — т2 ’
С- л * V-^md vmd ------------*
9 =
Do
где D0 – оптическая плотность исходного водного раствора индикатора заданной концентрации; D1 – оптическая плотность водного или спиртового раствора индикатора, содержащего навеску заданной массы исследуемого вещества после адсорбции в течение 24 ч; D2 – водный или спиртовой раствор содержащего навеску заданной массы исследуемого вещества с добавленным через 24 ч индикатором; Cind – концентрация индикатора в растворе; Vind – объем раствора индикатора, взятый для анализа; m1 и m2 – массы соответствующих навесок; знак «±» соответствует разнонаправленному изменению D1 и D2 относительно D0 .
Для изучения адсорбции кислотных и основных индикаторов образцы нанолистовых структур массой m1 =0,1 ± 0,001 г помещали в сухие емкости, заливали 3 мл раствора индикатора с определенной концентрацией, перемешивали и выдерживали в течение 24 ч. После этого разбавляли 2 мл дистиллированной воды, выдерживали 10 мин и измеряли значение оптической плотности ( D1 ) при
Таблица 1/table 1
Основные характеристики индикаторов Гаммета
Main characteristics of gammet indicators
|
Название/Name |
Молекулярная масса/ Molecular mass |
Константа диссоциации ( pKα )/ Dissociation constant (pKα) |
Длина волны в максимуме поглощения (λmax)/ The wavelength at the absorption maximum (λmax) |
|
Метиловый фиолетовый/ Methyl violet |
364,91 г/моль |
0,3 |
585 нм |
|
Бриллиантовый зеленый/ Brilliant green |
482,64 г/моль |
1,3 |
610 нм |
|
Метилоранж/ Methyl orange |
327,33 г/моль |
3,5 |
464 нм |
|
Метиловый красный/ Methyl red |
269,3 г/моль |
5,2 |
530 нм |
|
Бромтимоловый синий/ Bromothymol blue |
669,97 г/моль |
7,3 |
540 нм |
|
Ализариновый красный/ Alizarin red |
240,2 г/моль |
10,5 |
425 нм |
|
Индигокармин/Indigocarmine |
422,38 г/моль |
12,8 |
610 нм |
Таблица 2/table 2
Основные характеристики тестовых клеточных культур Main characteristics of test cell cultures
|
Название/ Name |
Описание/Description |
|
HeLa |
Карцинома шейки матки, морфология клеток эпителиальная/ Cervical carcinoma, epithelial cell morphology |
|
А549 |
Аденокарцинома, морфология клеток эпителиальная/ Adenocarcinoma, epithelial cell morphology |
|
PyMT |
Первичные клетки опухоли молочной железы/ Primary breast tumor cells |
|
MDA |
Аденокарцинома, морфология клеток эпителиальная/ Adenocarcinoma, epithelial cell morphology |
|
B16F10 |
Меланома, клетки веретенообразные и эпителиальные/ Melanoma, fusiform and epithelial cells |
Условия культивирования/Cultivation conditions
Питательная среда MEM с добавлением 10 % фетальной бычьей сыворотки, 2мМ L-глутамина и 1 % пенициллин/стрептомицина/
MEM culture medium supplemented with 10 % fetal bovine serum, 2 mM L-glutamine and 1 % penicillin / streptomycin
Питательная среда DMEM с добавлением 10 % фетальной бычьей сыворотки, 2мМ L-глутамина и 1 % пенициллин/стрептомицина/
DMEM culture medium supplemented with 10 % fetal bovine serum, 2 mM L-glutamine and 1 % penicillin / streptomycin длине волны (λmax), соответствующей максимуму поглощения каждого индикатора. Параллельно брали навеску структур (m2) помещали в сухую емкость, заливали 2 мл дистиллированной воды и выдерживали в течение 24 ч. После чего раствор декантировали в другую емкость и приливали 3 мл раствора индикатора, выдерживали 10 мин и измеряли значение оптической плотности (D2). В сухую емкость приливали 3 мл раствора индикатора и приливали 2 мл дистиллированной воды. Выдерживали 10 мин и измеряли значение оптической плотности (D0). Оптическую плотность растворов определяли в кюветах с длиной оптического пути 1 см.
Для исследований применяли ряд красителей Гаммета (табл. 1), которые позволяют регистрировать кислотно-основные центры в диапазоне pKα от 0,3 до 12,8. Кроме того, использованы различные линии опухолевых клеток (табл. 2), полученные из Американской коллекции типовых культур. Культивирование клеток проводили в 96-луночных планшетах при температуре 37 ± 1 °С и 5 % CO2 в течение 24 ч. Конечная концентрация клеток составила 1×104 клеток/100 мкл в лунке 96-луночного планшета.
Анализ жизнеспособности клеток in vitro проводили при помощи теста PrestoBlue™ Cell Viability Reagent, основанного на использовании ароматического соединения резазурина, который при добавлении к живым клеткам восстанавливается в розовый флуоресцирующий резофурин. Суспензии нанолистовых структур в клеточной среде подготавливали в концентрациях от 0,001 мг/мл до 10 мг/мл. Клетки со структурами инкубировали в 96-луночных микропланшетах при температуре 37 ± 1 °С и 5 % CO2 в течение 24 ч. После инкубирования питательную среду осторожно удаляли при помощи аспиратора и два раза промывали клетки раствором фосфатного буфера Дульбекко. Для проведения теста в каждую лунку добавляли по 100 мкл питательной среды и по 10 мкл раствора PrestBlue. Проводили инкубацию при 37 ± 1 °С и 5 % CO2 в течение 1 ч, затем определяли флуоресценцию при помощи микропланшетного фотометра Tecan (Австрия). Дополнительно токсичность исследовали при помощи метода CellTiter-Glo Luminescent Cell Viability Assay. Анализ проводили аналогично, за исключением того, что планшеты использовались непрозрачные. В обоих экспериментах контрольной группой служили клетки без добавления структур.
Количественные данные представлены как средние и стандартные ошибки. Статистическую значимость различий между группами оценивали с помощью t-критерия Стьюдента.
Результаты
В результате окисления водой электровзрывного порошка AlN/Al был получен образец в фазе бемита AlOOH, представляющий собой складчатые нанолисты псевдобемита, равномерно собранные в агломераты размером 0,5–2 мкм с морфологией наноцветов (рис. 1a, б). Планарный размер отдельных нанолистов агломератов достигал 200 нм, толщина нанолистов до 5 нм. При дальнейшем прокаливании образца AlOOH при 650 °С происходило удаление адсорбированной и кристаллизационной воды и был получен образец γ-Al2O3, морфология нанолистов бемита практически не изменялась (рис. 1в, г). При прокаливании образца AlOOH при 1000 °С получали образец θ-Al2O3. Для данного образца происходило уменьшение планарного размера нанолистов до 100 нм (рис. 1д, е).

Рис. 1. Изображения образцов, полученные при помощи ПЭМ (а, в, д) и СЭМ (б, г, е) нанолистовых структур: AlООH (a, б); γ-Al2О3 (в, г) Fig. 1. Images of samples obtained using TEM (a, c, e) and SEM (b, d, f) of nanosheet structures: AlООH (a, b); γ-Al2О3 (c, d)

Рис. 2. ПЭМ-изображения нанолистовых структур: AlООH (a); γ-Al2О3 (б) и θ-Al2О3 (в) Fig. 2. TEM images of nanosheet structures: AlООH (a); γ-Al2О3 (b) and θ-Al2О3 (c)
При детальном исследовании морфологии образцов при помощи ПЭМ высокого разрешения (рис. 2) установлено, что в то время как для образцов AlOOH (рис. 2а) и γ-Al2O3 (рис. 2б) толщина нанолистов не изменялась и составляла 2–5 нм, в образце θ-Al2O3 тонкие фрагменты нанолистов (2–5 нм) практически полностью исчезали и толщина нанолистов увеличивалась до 20 нм (рис. 2в). При этом на вставках к рис. 2 видно, что форма и размер доменов, из которых состоят нанолисты, не изменялись. Полученные результаты хорошо согласуются с данными, описанными в работе S.V. Tsybulya et al. [26], где показано, что при прокаливании низкотемпературных форм оксида алюминия первичная структура и размер доменов сохраняются.
По данным рентгенофазового анализа синтезированных образцов основные пики на дифрак-тограмме образца AlOOH (рис. 3a) соответствуют кристаллическому бемиту (PDF № 00-05-0190). В результате термической обработки структур AlOOH происходят фазовые переходы, характерные для оксидов и гидроксидов алюминия. На рентгенограмме образца, прокаленного при 650 °С (рис. 3б), появляется новый набор рефлексов, относящийся к фазе γ-Al2O3 (PDF № 00-029-0063). При дальнейшем повышении температуры до 1000 °С происходит переход γ-Al2O3 в новое фазовое состояние. На рентгенограмме образца, прокаленного при 1000 °С (рис. 3в), основные рефлексы соответствуют θ-Al2O3 (PDF № 00-035-0121). Отсутствие кристаллических линий и рефлексов на картине электронной микродифракции AlOOH (рис. 1а) и γ-Al2O3 (рис. 1в), а также уширение пиков, на соответствующих рентгенограммах (рис. 3a, б), свидетельствуют об отсутствии дальнего порядка в расположении атомов и аморфной структуре образцов. Для θ-Al2O3 характерна более упорядоченная структура. Однако на картине микродифракции θ-Al2O3 (рис. 1д) наблюдались рефлексы, принадлежащие плоскостям с разной ориентацией, что говорит о сохранении слоистой структуры θ-Al2O3.
Таким образом, в результате прокаливания синтезированных нанолистовых структур сохраняется
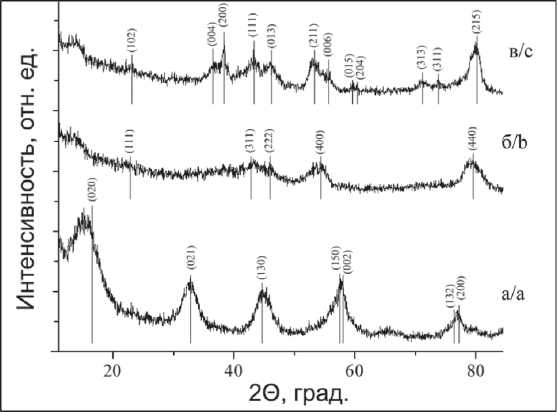
Рис. 3. Рентгеноструктурный анализ образцов нанолистовых структур: AlООH (a); γ-Al2О3 (б) и θ-Al2О3 (в)
Fig. 3. X-ray structural analysis of samples of nanosheet structures: AlООH (a); γ-Al2О3 (b) and θ-Al2О3 (c)
морфология образцов, при этом изменяется фазовый состав и увеличивается степень кристалличности. В результате прокаливания также происходит снижение величины удельной поверхности. Удельная поверхность AlOOH, рассчитанная методом БЭТ, составила 284 м2/г, для γ-Al2O3 – 246 м2/г, для θ-Al2O3 – 199 м2/г. Кроме того, с увеличением температуры прокаливания происходило уменьшение объема пор и увеличение их среднего размера с 4 до 12 нм. Вероятно, это обусловлено удалением кристаллической воды из межслоевого пространства и спеканием нанолистов.
Поверхность образцов была исследована методом ИК-спектроскопии (рис. 4). Для γ-Al2O3 и θ-Al2O3 наблюдались изменения в области 3700– 3000 см-1, которая соответствует валентным колебаниям ОН-групп. Для AlOOH, помимо широкой полосы в области 3200–3500 см-1, обусловленной валентными колебаниями ОН-групп в молекулах H2O, характерны поверхностные ОН-группы, связанные с тремя атомами алюминия (3090 см-1), входящими в состав краевых фрагментов плоскости (201). Для образцов γ-Al2O3 и θ-Al2O3 полоса
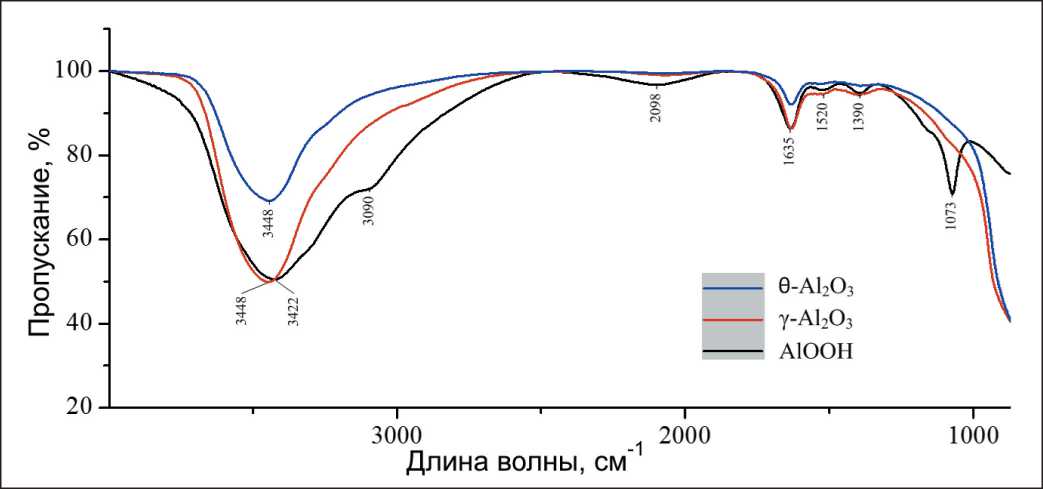
Рис. 4. ИК-спектры образцов нанолистовых структур Fig. 4. IR spectra of samples of nanosheet structures
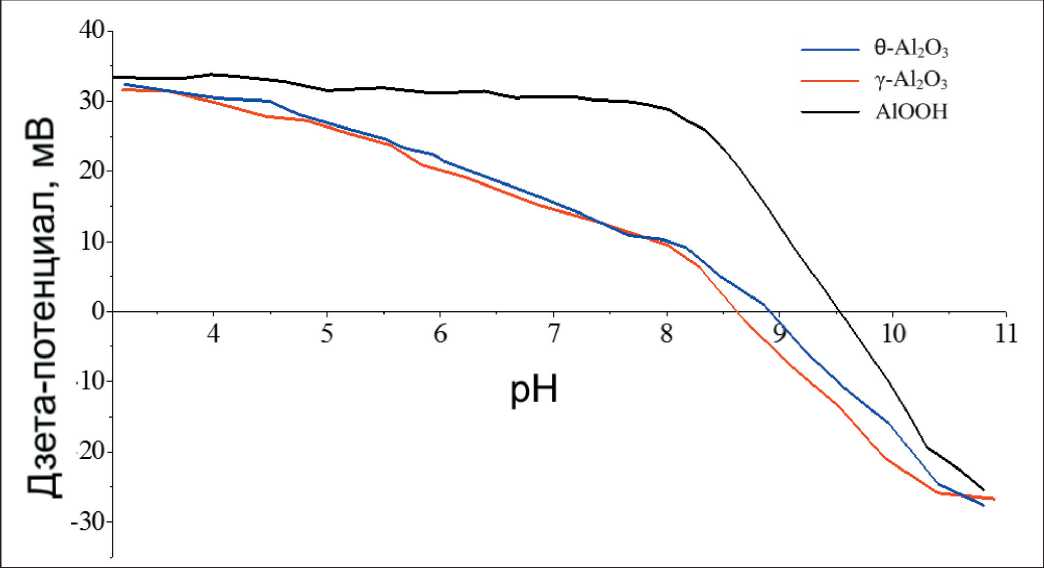
Рис. 5. Дзета-потенциал образцов нанолистовых структур Fig. 5. Zeta potential of samples of nanosheet structures
поглощения для ОН-групп, связанных с тремя атомами алюминия, и полоса поглощения в области 1073 см-1, обусловленная деформационными колебаниями ОН-групп, отсутствовали. Снижение интенсивностей полос для γ-Al2O3 и θ-Al2O3 может быть связано с частичным удалением поверхностных ОН-групп при прокаливании.
Величина дзета-потенциала наночастиц и наноструктур определяет эффективность их взаимодействия с биологическими объектами. На рис. 5
представлены зависимости дзета-потенциала синтезированных нанолистовых структур от рН среды. Все синтезированные наноструктуры при рН=7,2 и температуре 37 °С имели положительный дзета-потенциал. Дзета-потенциал AlOOH составил 30,8 ± 0,2 мВ, γ-Al2O3 и θ-Al2O3– 12,5 ± 0,3 мВ. Следует отметить, что дзета-потенциал AlOOH практически не изменялся в широком диапазоне рН (от 3 до 8), в то время как дзета-потенциал γ-Al2O3 и θ-Al2O3 уменьшался с увеличением рН в приведенном диапазоне. Синтезированные наноструктуры также характеризуются различным рН изоэлектрического состояния (pHТНЗ). Для псевдобемита pHТНЗ=9,52, для γ-Al2O3 pHТНЗ=8,61, для θ-Al2O3 pHТНЗ=8,92.Как видно, дзета-потенциал γ-Al2O3 и θ-Al2O3, а также pHТНЗ меньше, чем у AlOOH, что может быть обу- словлено появлением большего числа основных центров или уменьшением числа кислотных центров на поверхности данных оксидов в результате термообработки.
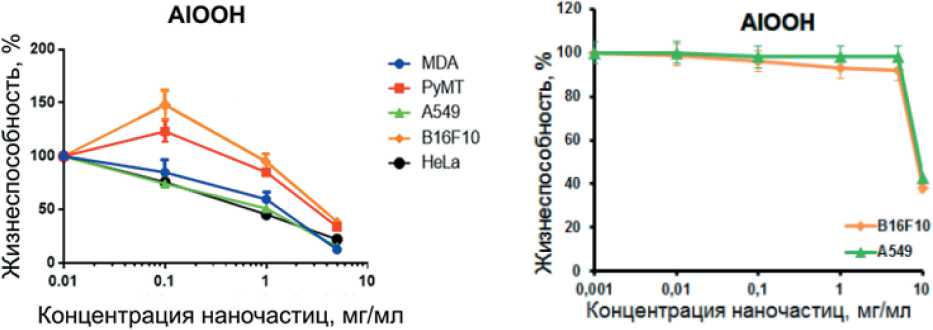
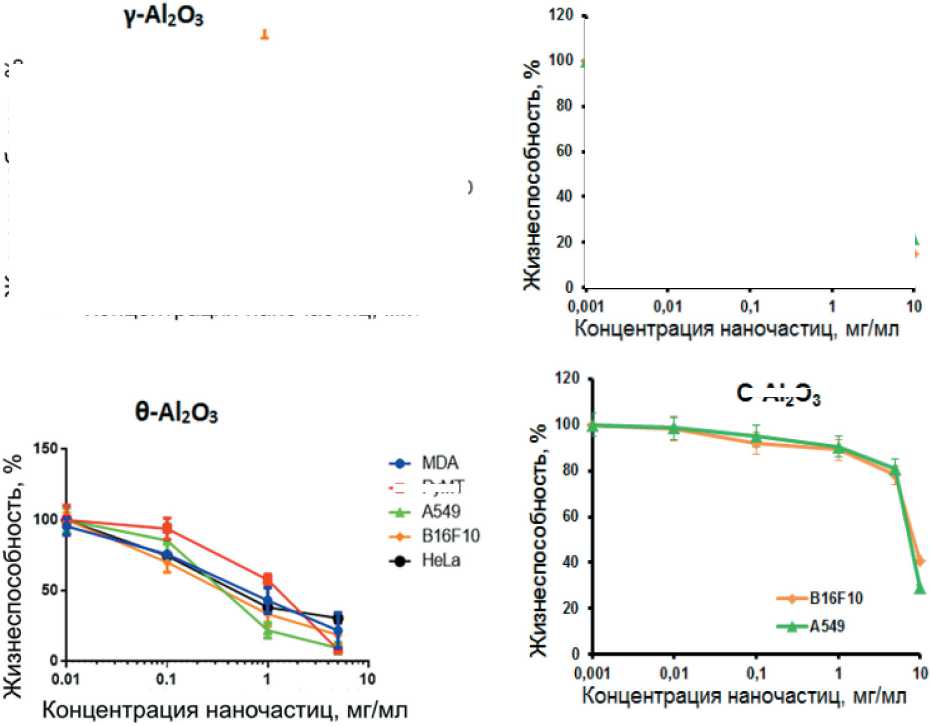
В экспериментах по исследованию цитотоксичности in vitro на примере 5 клеточных линий опухолевых клеток было установлено, что все синтезированные нанолистовые структуры подавляли жизнеспособность опухолевых клеток (рис. 6, кривые AlOOH). Следует отметить, что синтезированные структуры имели довольно крупные размеры (0,4–2,5 мкм), не позволяющие им проникать внутрь клетки [27, 28].
Подавление жизнеспособности клеточных линий достигалось при использовании концентрации структур в питательной среде от 1 мг/мл. В меньшей концентрации нанолистовые структуры не оказывали цитотоксического действия и даже стимулировали рост клеток (рис. 6). При исследовании изменения рН клеточной среды в присутствии нанолистовых структур было установлено, что все синтезированные структуры практически в равной степени изменяли рН питательной среды. При концентрации наноструктур 5 мг/мл величина рН питательной среды увеличивается с увеличением времени выдержки по параболическому закону и
0-АЬО
* РуМТ
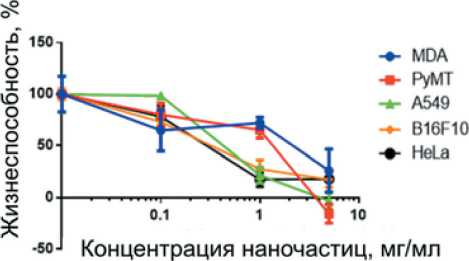
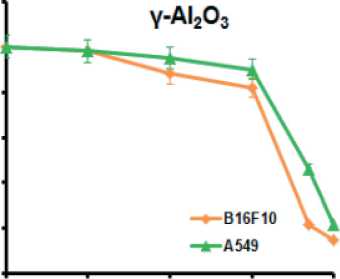
Рис. 6. Цитотоксичность нанолистовых структур, определенная при помощи тестов PrestoBlue™ Сell Viability Reagent (а) и СellTiter-Glo (б)
Fig. 6. Сytotoxicity of nanosheet structures determined using the PrestoBlue ™ Сell Viability Reagent (a) and СellTiter-Glo (b) tests
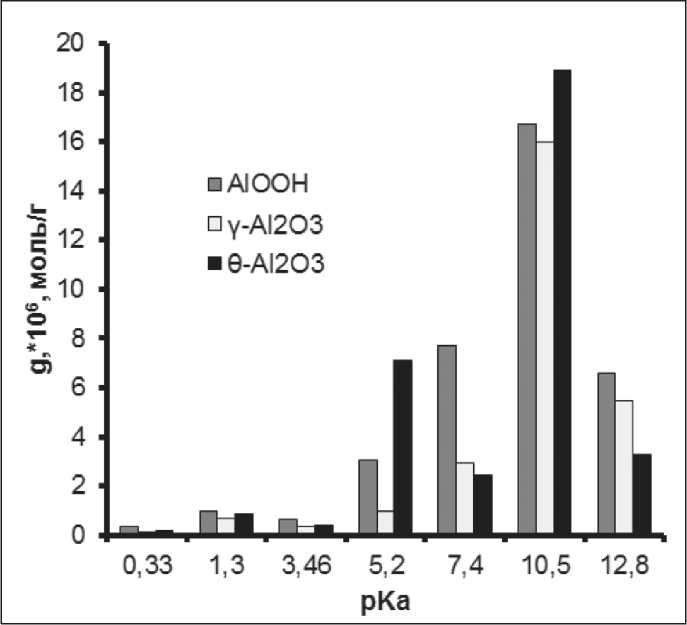
Рис. 7. Распределение кислотно-основных центров на поверхности нанолистовых структур
Fig. 7. Distribution of acid-base centers on the surface of nanosheet structures
выходит на постоянные значения рН через 8 ч экспозиции. Это свидетельствовало о том, что синтезированные структуры в питательной среде проявляли основные свойства. При этом в начальный момент времени (до 40 мин) скорость роста рН была максимальной в присутствии AlOOH и минимальной в присутствии θ-Al2O3. После 40 мин экспозиции скорость роста рН питательной среды становилась максимальной в присутствии γ-Al2O3. Через 500 мин экспозиции AlOOH поднимал рН питательной среды до 9,04, γ-Al2O3 – до 9,12, θ-Al2O3 – до 9,05. Полученные данные коррелировали с данными адсорбции индикаторов на поверхности синтезированных структур (рис. 7).
Анализ результатов цитологических экспериментов показывает, что наибольшее влияние на жизнеспособность клеточных линий оказали структуры γ-Al2O3. Такой эффект может реализовываться за счет ряда механизмов или их совокупности и включать повреждение клеточной мембраны, недостаток питательных веществ за счет их адсорбции на пористых структурах, деполяризацию мембраны.
На поверхности всех полученных структур присутствовали основные бренстедовские центры 3 типов: слабоосновные (близкие к нейтральным) с рК 7,4; основные центры средней силы с рК 10,5 и сильные основные центры с рК 12,8. Количество слабоосновных центров на поверхности было значительно больше у структур AlOOH (7,7×10-6 моль/г). Основные центры средней силы незначительно преобладали на поверхности θ-Al2O3 (18,9×10-6 моль/г) по сравнению с γ-Al2O3 (16,01×10-6 моль/г) и AlOOH (16,7×10-6 моль/г). Сильноосновные центры преобладали на поверхности AlOOH (6,6×10-6 моль/г) по сравнению с γ-Al2O3 (5,4×10-6 моль/г) и θ-Al2O3 (3,2×10-6 моль/г). Кислотных центров Бренстеда на поверхности синтезированных структур было значительно меньше, чем основных. Стоит отметить, что на поверхности находились преимущественно слабокислотные центры в концентрациях: θ-Al2O3 – 7,09×10-6 моль/г, γ-Al2O3 – 0,99×10-6 моль/г и AlOOH – 3,05×10-6 моль/г.
Обсуждение
Согласно полученным в исследовании данным, цитотоксический эффект нанолистовых структур прежде всего связан со свойствами их поверхности, такими как заряд, высокая удельная поверхность, адсорбционные и кислотно-основные свойства. Все вышеперечисленные свойства способны нарушить ионный баланс и кислотность микроокружения опухолевых клеток. Главное отличие кислотно-основных характеристик поверхности
Список литературы Цитотоксические свойства нанолистовых структур на основе оксидных и гидроксидных фаз алюминия в отношении опухолевых клеток
- Davis M.E., Chen Z.G., Shin D.M. Nanoparticle therapeutics: an emerging treatment modality for cancer. Nat Rev Drug Discov. 2008 Sep; 7(9): 771-82. https://doi.org/10.1038/nrd2614.
- Cho Y., Lee J.B., Hong J. Controlled release of an anti-cancer drug from DNA structured nano-films. Sci Rep. 2014 Feb 12; 4: 4078. https://doi.org/10.1038/srep04078.
- Shu Y., Shu D., Haque F., Guo P. Fabrication of pRNA nanoparticles to deliver therapeutic RNAs and bioactive compounds into tumor cells. Nat Protoc. 2013 Sep; 8(9): 1635-59. https://doi.org/10.1038/nprot.2013.097.
- Hauert S., Bhatia S.N. Mechanisms of cooperation in cancer nanomedicine: towards systems nanotechnology. Trends Biotechnol. 2014 Sep; 32(9): 448-55. https://doi.org/10.1016/j.tibtech.2014.06.010.
- Mikhaylov G., Klimpel D., Schaschke N., Mikac U., Vizovisek M., Fonovic M., Turk V., Turk B., Vasiljeva O. Selective targeting of tumor and stromal cells by a nanocarrier system displaying lipidated cathepsin B inhibitor. Angew Chem Int Ed Engl. 2014 Sep 15; 53(38): 10077-81. https://doi.org/10.1002/anie.201402305.
- Mikhaylov G., Mikac U., Magaeva A.A., Itin V.I., Naiden E.P., Psakhye I., Babes L., Reinheckel T., Peters C., Zeiser R., Bogyo M., Turk V., Psakhye S.G., Turk B., Vasiljeva O. Ferri-liposomes as an MRI-visible drugdelivery system for targeting tumours and their microenvironment. Nat Nanotechnol. 2011 Aug 7; 6(9): 594-602. https://doi.org/10.1038/nnano.2011.112.
- Kumar C.S., Mohammad F. Magnetic nanomaterials for hyperthermia-based therapy and controlled drug delivery. Adv Drug Deliv Rev. 2011 Aug 14; 63(9): 789-808. https://doi.org/10.1016/j.addr.2011.03.008.
- Verma A., Stellacci F. Effect of surface properties on nanoparticle-cell interactions. Small. 2010 Jan; 6(1): 12-21. https://doi.org/10.1002/smll.200901158.
- Patra H.K., Dasgupta A.K. Cancer cell response to nanoparticles: criticality and optimality. Nanomedicine. 2012 Aug; 8(6): 842-52. https://doi.org/10.1016/j.nano.2011.10.009.
- Petros R.A., DeSimone J.M. Strategies in the design of nanoparticles for therapeutic applications. Nat Rev Drug Discov. 2010 Aug; 9(8): 615-27. https://doi.org/10.1038/nrd2591.
- Li Y., Tian Y., Nie G. Antineoplastic activities of Gd@C(OH) nanoparticles: tumor microenvironment regulation. Sci China Life Sci. 2012 Oct; 55(10): 884-90. https://doi.org/10.1007/s11427-012-4387-7.
- Li M., Ren L., Li L., He P., Lan G., Zhang Y., Yang K. Cytotoxic Effect on Osteosarcoma MG-63 Cells by Degradation of Magnesium. J Materials Scien Technol. 2014; 30(9): 888-93. https://doi.org/10.1016/j.jmst.2014.04.010.
- Zhang Y., Ren L., Li M., Lin X., Zhao H., Yang K. Preliminary study on cytotoxic effect of biodegradation of magnesium on cancer cells. J Materials Scien Technol. 2012; 28(9): 769-72. https://doi.org/10.1016/S1005-0302(12)60128-5.
- Sonveaux P., Végran F., Schroeder T., Wergin M.C., Verrax J., Rabbani Z.N., De Saedeleer C.J., Kennedy K.M., Diepart C., Jordan B.F., Kelley M.J., Gallez B., Wahl M.L., Feron O., Dewhirst M.W. Targeting lactate-fueled respiration selectively kills hypoxic tumor cells in mice. J Clin Invest. 2008 Dec; 118(12): 3930-42. https://doi.org/10.1172/JCI36843.
- Gillies R.J., Raghunand N., Garcia-Martin M.L., Gatenby R.A. pH imaging. A review of pH measurement methods and applications in cancers. IEEE Eng Med Biol Mag. 2004; 23(5): 57-64. https://doi.org/10.1109/memb.2004.1360409.
- De Milito A., Canese R., Marino M.L., Borghi M., Iero M., Villa A., Venturi G., Lozupone F., Iessi E., Logozzi M., Della Mina P., Santinami M., Rodolfo M., Podo F., Rivoltini L., Fais S. pH-dependent antitumor activity of proton pump inhibitors against human melanoma is mediated by inhibition of tumor acidity. Int J Cancer. 2010 Jul 1; 127(1): 207-19. https://doi.org/10.1002/ijc.25009.
- Spugnini E.P., Buglioni S., Carocci F., Francesco M., Vincenzi B., Fanciulli M., Fais S. High dose lansoprazole combined with metronomic chemotherapy: a phase I/II study in companion animals with spontaneously occurring tumors. J Transl Med. 2014 Aug 21; 12: 225. https://doi.org/10.1186/s12967-014-0225-y.
- Meng H., Mai W.X., Zhang H., Xue M., Xia T., Lin S., Wang X., Zhao Y., Ji Z., Zink J.I., Nel A.E. Codelivery of an optimal drug/siRNA combination using mesoporous silica nanoparticles to overcome drug resistance in breast cancer in vitro and in vivo. ACS Nano. 2013; 7(2): 994-1005. https://doi.org/10.1021/nn3044066.
- Khawar I.A., Kim J.H., Kuh H.J. Improving drug delivery to solid tumors: priming the tumor microenvironment. J Control Release. 2015 Mar 10; 201: 78-89. https://doi.org/10.1016/j.jconrel.2014.12.018.
- Kim S.S., Rait A., Kim E., Pirollo K.F., Chang E.H. A tumortargeting p53 nanodelivery system limits chemoresistance to temozolomide prolonging survival in a mouse model of glioblastoma multiforme. Nanomedicine. 2015 Feb; 11(2): 301-11. https://doi.org/10.1016/j.nano.2014.09.005.
- Kanamala M., Wilson W.R., Yang M., Palmer B.D., Wu Z. Mechanisms and biomaterials in pH-responsive tumour targeted drug delivery: A review. Biomaterials. 2016 Apr; 85: 152-67. https://doi.org/10.1016/j.biomaterials.2016.01.061.
- Taylor S., Spugnini E.P., Assaraf Y.G., Azzarito T., Rauch C., Fais S. Microenvironment acidity as a major determinant of tumor chemoresistance: Proton pump inhibitors (PPIs) as a novel therapeutic approach. Drug Resist Updat. 2015 Nov; 23: 69-78. https://doi.org/10.1016/j.drup.2015.08.004.
- Walsh M., Fais S., Spugnini E.P., Harguindey S., Abu Izneid T., Scacco L., Williams P., Allegrucci C., Rauch C., Omran Z. Proton pump inhibitors for the treatment of cancer in companion animals. J Exp Clin Cancer Res. 2015 Sep 4; 34(1): 93. https://doi.org/10.1186/s13046-015-0204-z.
- Bakina O.V., Svarovskaya N.V., Glazkova E.A., Lozhkomoev A.S. Flower-shaped ALOOH nanostructures synthesized by the reaction of an AlN/Al composite nanopowder in water. Advanced Powder Technology. 2015; 26(6): 1512-19. https://doi.org/10.1186/s13046-015-0204-z.
- Lerner M.I., Pervikov A.V., Lozhkomoev A.S., Bakina O.V. Synthesis of Al nanoparticles and Al/AlN composite nanoparticles by electrical explosion of aluminum wires in argon and nitrogen. Advanced Powder Technology. 2016; 295: 307-314. https://doi.org/10.1016/j.powtec.2016.04.005.
- Tsybulya S.V., Kryukova G.N. Nanocrystalline transition aluminas: Nanostructure and features of x-ray powder diffraction patterns of low-temperature Al2O3 polymorphs. Physical Review B. 2008; 77(2); 024112-024125. https://doi.org/10.1103/PhysRevB.77.024112.
- Zhang S., Li J., Lykotrafitis G., Bao G., Suresh S. Size-Dependent Endocytosis of Nanoparticles. Adv Mater. 2009; 21: 419-424. https://doi.org/10.1002/adma.200801393.
- Jiang W., Kim B.Y., Rutka J.T., Chan W.C. Nanoparticle-mediated cellular response is size-dependent. Nat Nanotechnol. 2008 Mar; 3(3): 145-50. https://doi.org/10.1038/nnano.2008.30.


