CКОРОСТНОЙ СПЕКТРОФЛУОРИМЕТР СФЛ-С
Автор: В. Г. Кривенко, Ю. Л. Ходасевич, С. Н. Пантуз, В. И. Емельяненко, Н. И. Борисова, Е. А. Пермяков
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Приборы и системы
Статья в выпуске: 2 т.31, 2021 года.
Бесплатный доступ
В Институте биологического приборостроения РАН разработан экспериментальный многофункциональный скоростной спектрофлуориметр СФЛ-С. Спектрофлуориметр предназначен для измерения спектров возбуждения и излучения растворов и суспензий биологических молекул и клеток в ультрафиолетовой, видимой и ближней инфракрасной областях спектра в ходе проведения фундаментальных и прикладных исследований в области физико-химической и клеточной биологии, биофизики, биохимии и медицины. Особенностями прибора являются: возможность скоростной регистрации спектров с помощью многоканальной регистрирующей системы (32 канала, более 20 спектров в секунду), возможность управления изменением температуры исследуемого раствора по заданному алгоритму (от 0 до 100 °С), а также возможность осуществления микротитрования исследуемого раствора в кювете прибора с помощью автоматизированного микродозатора.
Спектрофлуориметр, спектр, люминесценция, флуоресценция, возбуждение, скоростные измерения
Короткий адрес: https://sciup.org/142226577
IDR: 142226577 | УДК: 520.35 | DOI: 10.18358/np-31-2-i2334
Текст научной статьи CКОРОСТНОЙ СПЕКТРОФЛУОРИМЕТР СФЛ-С
Метод люминесценции (флуоресценции) уже давно является широко распространенным спектральным методом, применяющимся в различных областях физики, химии и биологии. Особенно широкое применение этот метод нашел в физикохимической биологии, биофизике, биохимии и отчасти в медицине [1–3]. Многие органические молекулы содержат сопряженные двойные связи, способные поглощать кванты света в ультрафиолетовом и видимом спектральных диапазонах, а затем излучать кванты света с более низкой энергией (фотолюминесценция). Параметры излучения (положение максимума спектра, квантовый выход излучения и т.д.) зависят от свойств ближайшего окружения излучающей молекулы, что можно использовать для различных целей. Например, широко известно использование естественных и искусственных флуоресцентных зондов и меток для исследования биополимеров — белков и нуклеиновых кислот [1–3].
Для измерения спектров излучения и возбуждения различных соединений используют специальные приборы, называемые спектрофлуоримет-рами. Обычно спектрофлуориметр для измерения стационарных спектров состоит из источника возбуждающего света, монохроматора возбуждающего света, ячейки для исследуемого образца, системы сбора света с образца, анализирующего монохроматора, фотоэлектронного умножителя и системы регистрации и анализа спектра излучения [1–3]. Ведущие зарубежные фирмы-изготовители спектрофлуориметров, такие как Horiba, Perki-nElmer, Thermo, Shimadzu, Hitachi, выпускают преимущественно приборы для измерения стационарной флуоресценции, непрерывно обновляя и развивая семейства выпускаемых ими приборов. В приборах используются современные элементы микроэлектронной техники, новые материалы и перспективные конструкторские решения (см., например, [4, 5]). В нашей стране спектрофлуори-метры, пригодные для изучения биологических объектов, не выпускаются. В Институте биологического приборостроения РАН были проведены работы по поиску технических решений, позволяющих разработать достаточно дешевый универсальный спектрофлуориметр, способный быстро измерять спектры излучения биологических объектов в широком диапазоне температур и пригодный для проведения титрования исследуемого жидкого образца малыми добавками различных соединений.
УСТРОЙСТВО ПРИБОРА
Спектрофлуориметр СФЛ-С, общий вид которого представлен на рис. 1, построен по классической схеме регистрации, когда излучение изучаемого образца собирается под углом 90° по отношению к направлению пучка возбуждающего света. При этом возбуждающий поток формируется монохроматизацией непрерывного спектра излучения ксеноновой лампы XBO 150W/GROFR фирмы OSRAM.

Рис. 1. Общий вид спектрофлуориметра СФЛ-С с открытой кюветной камерой
В состав спектрофлуориметра СФЛ-С входят спектрофлуориметрический блок, титрационное устройство, приставка для быстрого смешения растворов и управляющий компьютер. Спектро-флуориметрический блок объединяет оптикомеханическую систему прибора и электронные средства, обеспечивающие процесс управления спектрофлуориметром.
На рис. 2 приведена упрощенная блок-схема спектрофлуориметрического блока СФЛ-С. Этот блок состоит из следующих функциональных узлов: источник возбуждающего света, монохроматоры возбуждения и регистрации, узел фотоэлектронного преобразователя (ФЭП) и многоканального фотоэлектронного преобразователя (МФЭП), кюветное отделение, источники питания лампы, силовых, аналоговых и цифровых цепей, платы контроллера и измерения, программируемый термостат, плата контроллера многоканального ФЭУ, средства вентиляции спектрофлуориметрического блока.
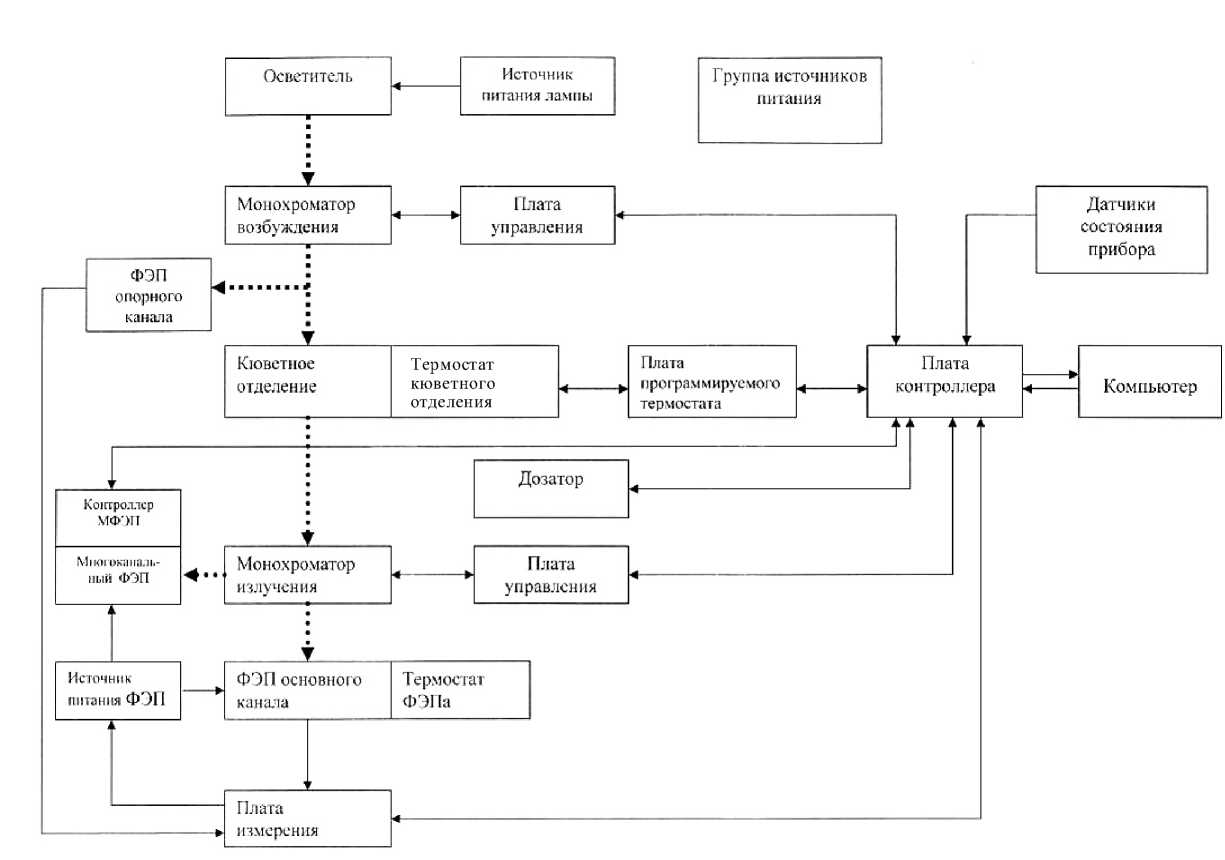
Рис. 2. Упрощенная блок-схема спектрофлуориметра СФЛ-С
В монохроматорах возбуждения и регистрации использованы вогнутые голографические дифракционные решетки с числом штрихов 1200 на мм, радиусом 150 мм и рабочей спектральной областью 200–900 нм, обеспечивающие высокое пропускание и низкий уровень рассеянного света. Монохроматоры выполнены в виде самостоятельных конструктивных сборок, включающих в себя как оптические и механические элементы, так и электронные модули, обеспечивающие работу этих узлов.
Для обеспечения равномерной перестройки монохроматора по длинам волн в процессе сканирования и, соответственно, для линейности шкалы прибора по оси длин волн измеряемого спектра использовали синусный механизм и цифровой микроконтроллер, управляющий шаговым двигателем привода дифракционной решетки. Для регистрации стационарных спектров излучения с механической разверткой использовали фотоумножитель R6356 фирмы Hamamatsu, имеющий высокую чувствительность детектирования в области 185–900 нм и минимальный темновой ток на уровне 0.1 нА при номинальном усилении.
Важнейшей особенностью спектрофлуориметра является возможность введения в канал регистрации излучения исследуемого образца многоканального приемного устройства в виде 32-канального фотоумножителя H7260 фирмы Hamamatsu для быстрой регистрации спектров.
Для исследования взаимодействий различных соединений друг с другом нами разработан дозатор, способный по заданной программе добавлять в измерительную ячейку малые объемы растворов различных веществ. Дозирование реагентов в дозаторе обеспечивается путем пошагового перемещения плунжера прецизионного микрошприца. Конструкция дозатора рассчитана на использование микрошприцев фирмы Hamilton серии 1700, исполнения N или TLL. Возможно применение микрошприцев других производителей, имеющих аналогичные конструктивные характеристики. Шаговый привод дозатора обеспечивает перемещение плунжера микрошприца не менее чем на 50 мм. При этом минимальное перемещение плунжера микрошприца (единичный шаг) составляет 6.3 мкм, а время выполнения дозатором этого перемещения составляет не более 2 мс.
Для осуществления возможности быстрого смешения растворов в измерительной ячейке мы использовали приставку быстрого смешивания RX2000 (AppliedPhotophysics). Минимальные объемы смешивания составляют 0.3 мл. Смешивание образцов производится пневматически, мертвое время порядка 6 мс. Необходимая температура образцов в шприцах и кювете обеспечивается с помощью внешнего водяного термостата.
СИСТЕМА УПРАВЛЕНИЯ ПРИБОРОМ
Верхний уровень управления
Система управления спектрофлуориметром СФЛ-С включает в себя три уровня. Верхний уровень, представляющий из себя управляющий компьютер прибора, обеспечивает общее управление спектрофлуориметром. Через диалоговые окна монитора компьютера можно выбрать режим измерений, ввести уставки выбранного режима, запустить процесс измерения и представления результатов. В процессе измерений программное обеспечение верхнего уровня формирует набор управляющих команд, соответствующих выбранному режиму измерений, поддерживает получение потока информации в процессе измерений, производит необходимую математическую обработку полученных массивов. После завершения цикла измерений осуществляется сохранение результатов в выбранной форме.
Второй уровень управления
Роль второго уровня управления прибором осуществляет плата контроллера спектрофлуори-метрического блока, выполненная на 8-битном AVR микроконтроллере ATmega128-16AU фирмы Atmel с улучшенной RISC архитектурой, имеющем 53 входа/выхода и 128 кбайт программируемой памяти. В задачи второго уровня входит: обеспечение обмена данными с верхним уровнем управления, управление процессом инициализации устройств спектрофлуориметрического блока и микротитратора, поддержание циклических процессов измерения интенсивности по основному и опорному каналам, контроль температуры кюве-тодержателя и непосредственно исследуемого образца с помощью датчиков температуры, поддержание процесса измерения в установленном режиме в соответствии с уставками, определенными для данного режима системой управления верхнего уровня.
Третий уровень управления
Роль третьего уровня управления спектрофлуо-риметром выполняют 8-битные AVR микроконтроллеры ATmega8-16AU фирмы Atmel, имеющие 23 входа/выхода и 8 кбайт программируемой памяти, установленные на платах управления функциональных узлов спектрофлуориметриче-ского блока. Роль этого уровня управления заключается в управлении драйверами исполнительных механизмов функциональных узлов, что разгружает контроллер фотометрического блока от рутинных процедур. Кроме того, контроллеры таких устройств, как плата контроллера многоканального ФЭУ и программируемый термостат кюветного отделения, обеспечивают автономное управление процессами на уровне этих узлов.
Пользовательский интерфейс
Управление спектрофлуориметром запускается программой SFL1.exe. На мониторе открывается главное окно программы. На рис. 3 приведен пример окна программы с установленными режимом, уставками и результатами измерений. Условия измерений задаются выбором в меню необходимого режима и подрежима. На главной панели уставок, расположенной в верхней части рабочего окна, производится установка монохроматоров на заданные длины волн, установка щелей монохроматоров, установка спектрального интервала монохроматоров, шага сканирования и времени накопления точек спектра, установка напряжения, питающего ФЭУ, и коэффициентов усиления регистрирующего тракта, установка температуры измерения. В нижней строке состояния рабочего окна программы можно контролировать уровень интенсивности флуоресценции, регистрируемой измерительным трактом спектрофлуориметра.
На главной панели уставок производится также установка постоянной времени регистрирующего тракта, скорости перемешивания магнитной мешалки в кюветодержателе, количество повторов и форма представления результатов измерения в режиме точечных измерений. Сигнал ФЭУ выводится в цифровой и гистограммной формах.
СПЕКТРАЛЬНЫЕ И ТЕХНИЧЕСКИЕ ХАРАКТЕРИСТИКИ ПРИБОРА
-
> Рабочий спектральный диапазон канала возбуждения 220–800 нм, канала регистрации 240– 900 нм. Погрешность установки длин волн монохроматоров не превышает + 1 нм.
^ Выделяемый спектральный интервал монохроматоров обоих каналов имеет фиксированные значения 1, 2, 5, 10 и 20 нм.
-
> Шаг сканирования в режиме механической развертки спектра имеет значения 0.2, 1.0, 2.0 и 5.0 нм.
-
> Время накопления точек спектра: 0.04, 0.2, 1.0 и 5.0 с.
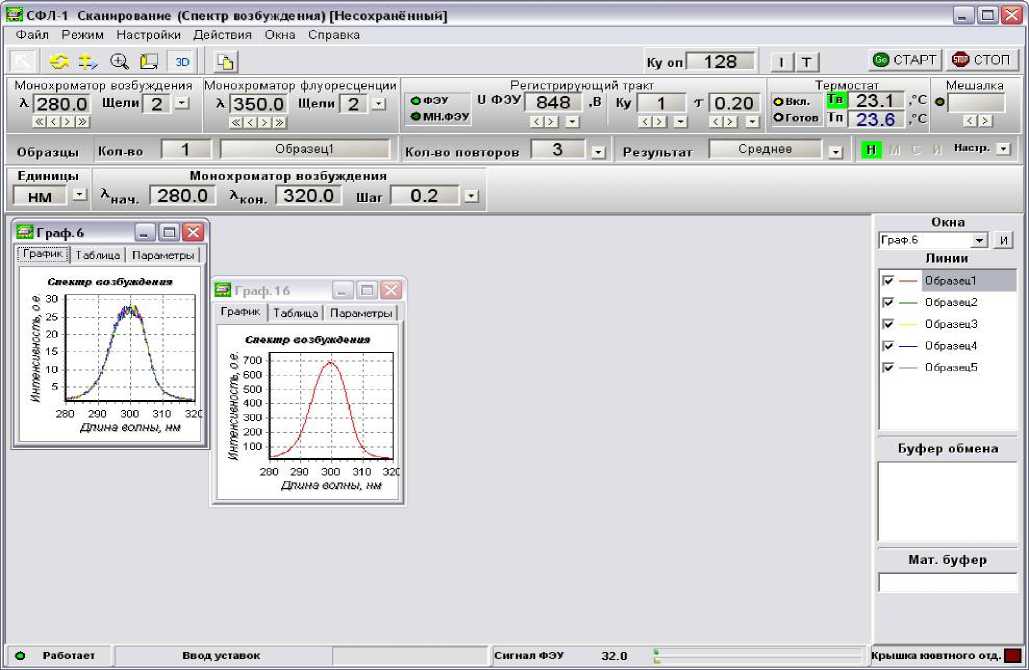
Рис. 3. Главное окно программы с выводом результатов измерений
-
> Минимальное время между последовательной регистрацией двух спектров из 32 точек в режиме многоканальной регистрации 0.04 с.
-
> Соотношение сигнал-шум порядка 200 при регистрации спектра комбинационного рассеяния воды при времени накопления канала регистрации 1 с и спектральных интервалах монохроматоров обоих каналов 10 нм.
ДЕМОНСТРАЦИЯ РАБОТЫ
СПЕКТРОФЛУОРИМЕТРА В РАЗЛИЧНЫХ РЕЖИМАХ
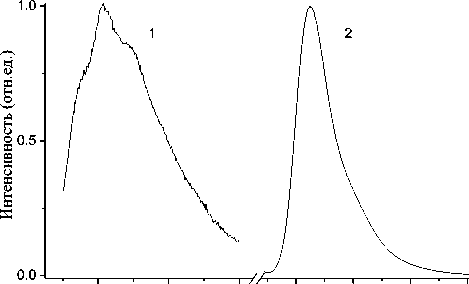
На рис. 4 приведены спектры флуоресценции водных растворов фенилаланина (1) и флуоресцеина (2), измеренные в режиме механической развертки спектра. Спектр фенилаланина, ароматической аминокислоты, входящей в состав большинства белков, измерен при концентрации 0.08 мг/мл и напряжении на ФЭУ 800 В при возбуждении светом с длиной волны 265 нм и спектральными щелями монохроматоров возбуждения и регистрации 5 и 2 нм соответственно. Квантовый выход флуоресценции фенилаланина в водном растворе очень невысок и составляет около 0.04 [3]. В спектре флуоресценции фенилаланина прослеживается хорошо известная колебательная структура [2, 3]. Спектр излучения флуоресцеина измерен при его предельно низкой концентрации 5∙10–6 мг/мл и напряжении ФЭУ 600 В, щелями монохроматоров возбуждения и регистрации 5 нм. Это показывает, что по чувствительности и спектральным характеристикам спектрофлуориметр СФЛ-С в УФ и видимой областях не уступает лучшим зарубежным приборам.
На рис. 5 представлены результаты модельного титрометрического эксперимента с применением прилагаемого к прибору автоматизированного дозатора.
280 300 320 500 550 600 650
нм
Рис. 4. Спектры флуоресценции водных растворов фенилаланина (1) и флуоресцеина (2).
Условия: для (1) — концентрация 0.08 мг/мл, напряжение на ФЭУ 800 В, длина волны возбуждения 265 нм, ширина спектральных щелей монохроматоров возбуждения и излучения 5 и 2 нм соответственно; для (2) — концентрация 5∙10–6 мг/мл, напряжение на ФЭУ 600 В, возбуждение 460 нм, ширина спектральных щелей монохроматоров 5 нм
0 10 20 30 40 50 60 70 80
Добавленный объем,мкл
б
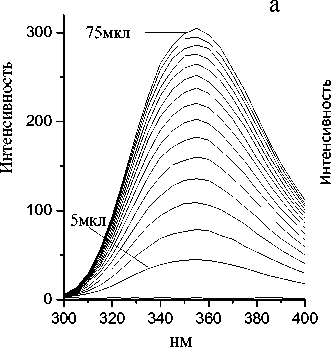
Рис. 5. Модельный эксперимент по титрованию 2 мл воды маточным раствором триптофана (концентрации 0.3 мг/мл) с помощью автоматизированного дозатора.
а — спектры флуоресценции; б — зависимость интенсивности флуоресценции триптофана при 350 нм от добавленного объема, длина волны возбуждения 280 нм, напряжение на ФЭУ 600 В
Представленные спектры флуоресценции получены при автоматическом добавлении в кювету с 2 мл воды через заданный интервал времени 5 мкл раствора триптофана, ароматической аминокислоты, содержащейся в большинстве белков, с концентрацией 0.3 мг/мл в режиме работающей магнитной мешалки. Концентрация триптофана в кювете после первой добавки составляет 0.75∙10–3 мг/мл, конечная равна 0.047 мг/мл. Длина волны возбуждающего света 280 нм, длина волны регистрации 350 нм. Напряжение на ФЭУ 600 В. Щели монохроматоров 5 нм.
Для измерения температурной зависимости интенсивности флуоресценции изучаемого образца в главном меню рабочего окна необходимо выбрать пункт меню "РЕЖИМ", затем из выпадающего подменю выбрать режим "Температурная зависимость", а затем подрежим "Точечные измерения". На рис. 6 представлена зависимость интенсивности флуоресценции при 350 нм водного раствора триптофана, измеренная в режиме программируемого управления изменением температуры с шагом 2 °С.
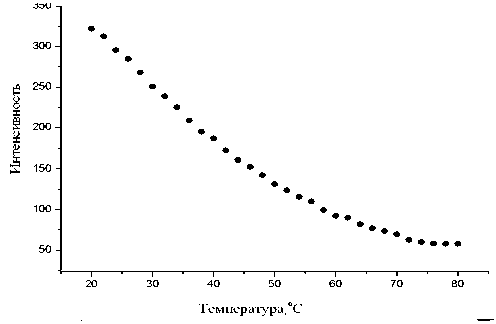
Рис. 6. Температурная зависимость интенсивности флуоресценции при 350 нм водного раствора триптофана, измеренная в режиме программируемого прогрева раствора с шагом 2 °С.
Длина волны возбуждения 280 нм. Напряжение ФЭУ 600 В, ширина спектральных щелей монохроматоров 5 нм
A ,отн.ед
6 8 10
Время, с
280 320 360 400 440
нм
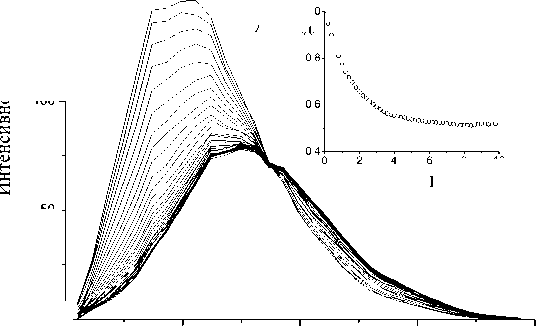
Рис. 7. Кинетика изменения спектров флуоресценции парвальбумина трески при диссоциации кальция под действием хелатора двухвалентных катионов ЭДТА.
Использована приставка быстрого смешивания RX2000 (AppliedPhotophysics) при регистрации многоканальным ФЭУ H7260 (Hamamatsu). Концентрация белка 50 мкМ, 0.05 M Hepes, рН 8.1. Длина волны возбуждения 280 нм, напряжение на ФЭУ 700 В, ширина спектральных щелей монохроматоров 5 нм. Интервал между спектрами 0.2 с. На вставке представлена кинетика изменения относительной площади А под спектрами излучения
На рис. 7 представлены результаты эксперимента по изучению кинетики диссоциации ионов кальция из кальцийсвязывающего белка — парвальбумина трески [6]. Парвальбумин трески (молекулярная масса около 12 кДа) обладает двумя сильными центрами связывания ионов кальция. Параметры флуоресценции его единственного остатка триптофана (положение максимума спектра и квантовый выход флуоресценции) сильно зависят от степени заполненности его центров связы- вания кальцием [7]. При быстром смешивании раствора кальцийнасыщенного парвальбумина с хелатором двухвалентных катионов ЭДТА (эти-лендиамин-тетрауксусная кислота) при рН 8.1 с помощью приставки быстрого смешивания RX2000 (AppliedPhotophysics Ltd, Leatherhead, UK) ионы кальция уходят с белка и переходят на хелатор. Этот быстрый процесс хорошо прослеживается по изменению спектров триптофановой флуоресценции парвальбумина при регистрации многоканальным ФЭУ H7260 (Hamamatsu, Japan)
с временем шага между последовательно измеренными спектрами 0.2 с. При удалении кальция из парвальбумина происходит длинноволновый сдвиг максимума спектра триптофановой флуоресценции почти на 30 нм и резкое падение квантового выхода флуоресценции, что соответствует перемещению его единственного остатка триптофана из внутренней части белка на его поверхность в водное окружение [2, 3, 7]. Отметим, что для изучения кинетики методом остановленного потока в современных спектрофлуориметрах обычно регистрируют излучение при одной длине волны. На вкладке рис. 7 показано изменение площади под спектрами излучения в зависимости от времени. Приведенные экспериментальные результаты позволяют измерить константы скорости диссоциации ионов кальция из центров связывания парвальбумина, что очень важно для понимания механизмов функционирования этого белка.
ЗАКЛЮЧЕНИЕ
Впервые в России разработан скоростной спек-трофлуориметр, который по спектрально-техническим характеристикам не уступает аналогичным приборам зарубежных фирм (см., например, [4, 5, 8, 9].
Спектрофлуориметр СФЛ-С регистрирует спектры флуоресценции исследуемых растворов по 32 каналам (точкам спектральной кривой) одновременно со скоростью более 20 спектров в секунду. При этом оснащение прибора позволяет одновременно с многоканальной регистрацией флуоресценции осуществлять изменение температуры исследуемого образца по заранее определенному алгоритму, а также осуществлять микротитрование растворов в кювете прибора с помощью управляемого автоматизированного микродозатора. Комплексность прибора существенно расширяет возможности проведения с его помощью сложных биохимических и биофизических экспериментов.
Список литературы CКОРОСТНОЙ СПЕКТРОФЛУОРИМЕТР СФЛ-С
- 1. Паркер С. Фотолюминесценция растворов. М.: Мир, 1972. 510 с.
- 2. Permyakov E.A. Luminescent Spectroscopy of Proteins. CRC Press, Boca Raton, Ann Arbor, London, Tokyo, 1993. 164 p.
- 3. Пермяков Е.А. Метод собственной люминесценции белка. М.: Наука, 2003. 189 с.
- 4. RF-6000 Fluorescence Spectrofluorometer URL: https://www.ssi.shimadzu.com/products/fluorescencespectroscopy/rf-6000.html
- 5. Спектрофлуориметр FluoroLog 3. URL: http://www.nytek.ru/catalog/spectrofluorometers/fluorolog-3/
- 6. Permyakov E.A. Parvalbumin. Nova Science Publishers. New York, 2006. 196 p.
- 7. Permyakov E.A., Yarmolenko V.V., Emelyanenko V.I., Burstein E.A., Gerday C., Closset J. Fluorescence studies of the calcium binding to whiting (Gadusmerlangus) parvalbumin // Eur. J. Biochem. 1980. Vol. 109, no. 1. P. 307-315.
- 8. Cary Eclipse Fluorescence Spectrophotometer. URL: https://www.agilent.com/en/product/molecularspectroscopy/fluorescence-spectroscopy/fluorescencesystems/cary-eclipse-fluorescence-spectrophotometer
- 9. Fluorescence Spectrophotometer F-7100. URL: https://www.hitachihightech.com/global/product_detail/?pn=ana-f7100


