COVID-19 и дисфункция эндотелия (обзор литературы)
Автор: Абдурахимов Абдухалим Холиддин Угли, Эргашева Зумрад Абдукаюмовна, Хегай Любовь Николаевна
Журнал: Life Sciences and Agriculture.
Рубрика: Медицинские науки
Статья в выпуске: 2 (6), 2021 года.
Бесплатный доступ
Обзор посвящен вопросам патогенеза COVID-19, при которым лежит эндотелиальная дисфункция (ЭД). ЭД определяется как патологическое состояние, характеризующееся прогрессирующим повреждением клеток эндотелия и сопровождающееся нарушением его функций. Эндотелиальная дисфункция является важным патогенетическим звеном широкого круга заболеваний, что обуславливает высокую практическую значимость разработки методов ее диагностики.
Эндотелий, оксид азота, медиаторы воспаления, эндотелин, ангиотензин іі, тромбоксан а2
Короткий адрес: https://sciup.org/14125794
IDR: 14125794
Текст обзорной статьи COVID-19 и дисфункция эндотелия (обзор литературы)
Введение. Патогенез COVID-19 во многом объясняется входными воротами возбудителя и последствиями его внедрения в клетки. В настоящее время обсуждается возможность нескольких мембранных белков для внедрения вируса. Было высказано предположение о том, что внедрение SARS-CoV-2 в клетки человека опосредовано ангиотензин-превращающим ферментом-2 (АПФ2). АПФ2 – особый фермент ренин-ангиотензиновой системы. Его активное изучение началось после 2002 г. на фоне исследований, связанных с эпидемией, вызванной другой коронавирусной инфекцией – SARS-CoV – возбудителем тяжелого острого респираторного синдрома (атипичной пневмонии). Для вируса SARS-CoV-2 этот белок также является входными воротами [1, 20, 26].
АПФ2 входит в ренин-ангиотензиновую систему (РАС), являясь частью сбалансированного механизма ее регуляции для уменьшения действия ангиотензина-II.
Хорошо известно, что АТ-II через первый тип рецепторов вызывает вазоконстрикцию, провоспалительное действие, стимуляцию пролиферации и некоторые другие эффекты. Посредством воздействия на рецепторы 2-го типа ангиотензин-II ограничивает вазоконстрикцию и другие эффекты активации рецепторов 1 -го типа, но не менее важное значение имеет и механизм, реализуемый через АПФ2. АПФ2 имеет структуру, на 42 % сходную с АПФ1 и превращает АТ-II в ангиотензин (1-7), обладающий собственной активностью посредством взаимодействия с Mas-рецептором, что приводит к эффектам, противоположным основному действию AT-II (рисунок). Более того, АТ(1-7) способен связываться с ангиотензиновыми рецепторами 2-го типа, хотя и в 5 раз слабее, чем АТ-II [4]. АПФ2 также способен превращать и АТ-1 в неактивный метаболит АТ(1-9). Поэтому АПФ2 рассматривается как один из важных компонентов регуляции РАС [1, 20].
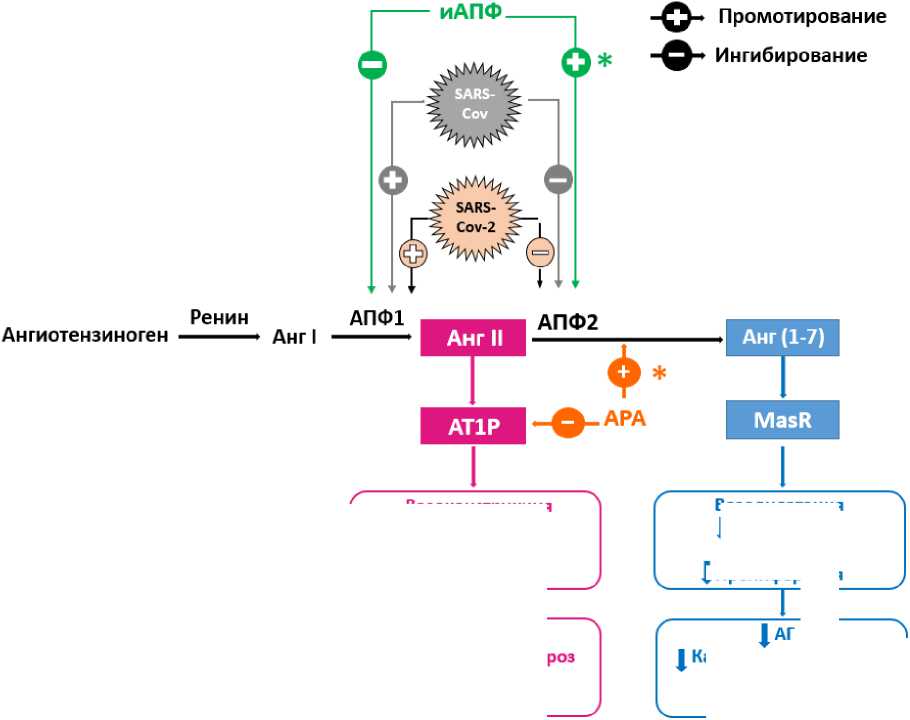
Вазоконстрикция Воспаление Фиброз Пролиферация t АГ
| Кардиальный ф
1 Тромобоз
1 ОРДС
,иальный фиброз
^Тромбоз
10РДС
Вазодилатация | Апоптоз ^Фиброз
1 Пролиферация
Система гемостаза - сложная, лабильная и многокомпонентная защитная система организма. Цитокиновый ответ играет одну из важных пусковых ролей в системе гемостаза. Развитие цитокинового шторма способствует производству нейтрофилами внеклеточных ловушек (НВЛ), за счет активации эндотелиальных клеток и нейтрофилов провоспалительными цитокинами. НВЛ, в свою очередь, стимулируют образование тромба.1 Доказано, что интерлейкин-6 (ИЛ-6) играет значимую роль в возникновении коагулопатий. Стимуляция эндотелиальных клеток ИЛ-6 приводит к экспрессии ряда сывороточных и тканевых факторов, обладающих коагуляционной активностью, способствующих «прилипанию» лейкоцитов и моноцитов к эндотелию сосудов [16].
Таблица 1.Основные функции эндотелия и механизмы их реализации
|
Функции эндотелия |
Основные механизмы |
|
Вазомоторная |
Вазоконстрикторы: эндотелин-1 (ET-1), тромбоксан А2, 20-НЕТЕ (20 – гидроксиэйкозотетраеновая кислота), ангиотензин II; Вазодилататоры: оксид азота (NO), простациклин (PGI2), эндотелиальный гиперполяризующий фактор (EDHF), натрийуретические пептиды (BNP, C-type NP), адреномедуллин |
|
Гемостатическая |
Тромборезистентность сосудистой стенки: NO, PGI2, простагландин Е2, тромбомодулин (TM), ингибитор пути тканевого фактора (TFPI), тканевой активатор плазминогена (t-PA), урокиназа, рецепторы для плазминогена и урокиназы, антитромбин III, рецепторы для протеина С, протеин S, аннексин A5. Тромбогенность сосудистой стенки: фактор Виллебранда (vWF), тканевой фактор(TF), ингибиторы активатора плазминогена (PAI-1 и PAI-2) |
|
Адгезионная |
Адгезивные молекулы суперсемейства иммуноглобулинов (ICAM-1 (Intercellularadhesion molecule, CD54a), ICAM-2 (CD102), РЕCAM-1 (Рlatelet/endothelial cell adhesion molecule, CD31), VCAM-1 (Vascular cellular adhesion molecule, CD106)), Селектины (E-селектин, P-селектин) |
|
Ангиогенная |
Фактор роста сосудистого эндотелия (VEGF), фактор роста фибробластов (bFGF), фактор роста тромбоцитов (PDGF), инсулиноподобный фактор роста (IGF-1), трансформирующий фактор роста (TGF-β) и др. |
По мнению Петухова В. А. (2008), Головченко, Ю. И.и М. А. Трещинской (2008) [9, 26] все вещества, синтезируемые эндотелиоцитами, можно классифицировать по типу действия (табл. 2).
Повреждение эндотелия. Присутствие на эндотелии и гладкомышечных клетках сосудов АПФ2 – причина вовлечения сердечно-сосудистой системы в системное повреждение, которое отмечается почти у всех больных с COVID-19. При этом возникает выраженная дисфункция эндотелия, связанная с внедрением вируса в клетки. Это сопровождается повреждением эндотелия, эндотелиальной дисфункцией, а также периваскулярным воспалением, которое усиливает повреждение эндотелия.
Несмотря на большую плотность экспрессии АПФ2 на эндотелиальных клетках, есть данные об органных особенностях распределения белка АПФ2 на эндотелии. В настоящее время имеется единственная работа, в которой исследовался клинический материал, полученный при биопсии или аутопсии. В общей сложности было исследовано распределение АПФ2 в тканях 15 органов от 93 пациентов с различными диагнозами. Авторы отметили, что АПФ2 присутствует на эндотелии как артериальных, так и венозных сосудов практически всех органов.
Более того, АПФ2-положительную окраску показали гладкомышечные клетки артериальных сосудов. АПФ2 был найден даже на эндотелии и гладкомышечных клетках сосудов головного мозга, притом что в других клетках мозга не был обнаружен. Однако на эндотелии синусоидных капилляров печени АПФ2 не экпрессируется. Таким образом, присутствие на эндотелии сосудов рецептора для внедрения вируса делает его одной из важнейших мишеней для SARS-CoV-2. Кроме эндотелия и гладкомышечных клеток, АПФ2 в значительном количестве экспрессируется на мембране перицитов, что также способствует развитию сосудистых нарушений.
Основными проявлениями ЭД являются нарушение биодоступности оксида азота (NO), основного вазодилататора, через подавление эндотелиальной NO-синтазы (NOS) и снижение вследствие этого синтеза NO.
Таблица 2.
Факторы, синтезируемые эндотелиоцитами и регулирующие их функцию
|
Факторы, влияющие на тонус гладкой мускулатуры сосудов |
|
|
Констрикторы |
Дилататоры |
|
Эндотелин |
Оксид азота |
|
Ангиотензин ІІ |
Простациклин (PGI 2 ) |
|
Тромбоксан А 2 |
Эндотелиальный фактор деполяризации |
|
(EDHF) |
|
|
Факторы гемостаза |
|
|
Протромбогенные |
Антитромбогенные |
|
Тромбоцитарный ростовой фактор (PDGF) |
Оксид азота |
|
Ингибитор активатора плазминогена |
Тканевой активатор плазминогена |
|
Фактор Виллебранда |
Простациклин (PGI 2 ) |
|
Ангиотензин IV |
|
|
Эндотелин-1 |
|
|
Факторы, влияющие на рост и пролиферацию |
|
|
Стимуляторы |
Ингибиторы |
|
Эндотелин-1 |
Оксид азота |
|
Ангиотензин ІІ |
Простациклин (PGI 2 ) |
|
Супероксидные радикалы |
С-натриуретический пептид |
|
Факторы, влияющие на воспаление |
|
|
Стимуляторы |
Ингибиторы |
|
Фактор некроза опухоли (TNF-α) |
Оксид азота |
|
Супероксидные радикалы |
С-натриуретический пептид |
|
Cупероксидные радикалы |
|
В физиологических условиях между вазоконстрикторами, секретируемыми эндотелием, и вазодилататорами существует равновесие, нарушение которого приводит к локальному спазму и повышению сосудистого тонуса. В итоге происходит постепенное истощение компенсаторной способности эндотелия, приводящее к нарушению достаточно сложной регуляции естественных механизмов расширения и сужения сосудистого русла.
Эндотелий играет ключевую роль в поддержании сосудистого гомеостаза посредством выделения биологически активных веществ (табл. 2), но также восприимчив к воздействию внешних регуляторов [13]:
-
— тучных клеток, высвобождающих гепарин и гистамин;
-
— тромбоцитов, содержащих факторы роста эндотелия
сосудов и факторы свертывания крови, и др.;
-
— гормонов и нейропептидов (адреналина, ацетилхолина, гистамина, брадикинина и др.).
Пути медикаментозной коррекции эндотелиальной дисфункции, несмотря на известные механизмы регуляции, требуют дальнейшего всестороннего изучения и оценки в силу невысокой эффективности и наличия негативных побочных эффектов. В качестве одного из вариантов нормализации функционального состояния эндотелия рассматривают физиотерапевтические процедуры [13].
У пациента с COVID-19, осложненным мезентериальной ишемией с последующей резекцией участка кишки, при гистологическом исследовании резецированного участка был выявлен выраженный «эндотелиит» сосудов подслизистого слоя с признаками прямого поражения эндотелиоцитов вирусом, явлениями апоптоза, периваскулярного воспаления и мононуклеарной инфильтрацией. Авторы предполагают, что индуцированное COVID-19 повреждение эндотелия может объяснить системное нарушение микроциркуляторной функции в различных органах у пациентов с COVID-19 [20].
Патогенез возникновения COVID-19-ассоциированной коагулопатии, может быть проиллюстрирован на примере вековой концепции триады Вирхова (эндотелиальная дисфункция, гиперкоагуляция, изменененный кровоток). Таким образом, эндотелиальная дисфункция представлена SARS-CoV-2-индуцированным эндотелиитом, иммуноопосредованой активацией эндотелиальных клеток, гипоксимией, повышением проницаемости сосудистой стенки. Второй компонент триады - гиперкоагуляция - формированием НВЛ, активацией тромбоцитов, тканевого фактора, увелечением образования тромбина и фибринов, и резким снижением фибринолиза. Изменененный кровоток, в свою очередь, представлен формированием легочного микротромбоза и микрососудистой окклюзии [16].
Генерализованная эндотелиопатия приводит к выбросу фактора Виллебранда, что, в свою очередь, дополнительно стимулирует плазменный и тромбоцитарный пути свертывания крови. У большинства больных реакция на вирус сопровождается иммунной системной воспалительной реакцией, внутрисосудистым свертыванием, диффузным повреждением альвеол, патологическими изменениями в других органах и тканях, формированием септического шока [10]. И наконец, развивается системный васкулит в виде поражения сосудов мелкого и среднего калибра.
На этом этапе возможно появление антифосфолипидных антител, усугубляющих ДВС-синдром. Дополнительную тяжесть состоянию могут добавлять вирусиндуцированные аутоиммунные реакции. ДВС-синдром сопровождается образованием фибриновых тромбов как в микроциркуляторном русле, так и в более крупных сосудах – венах нижних конечностей, приводящих к возникновению тромбоэмболии легочной артерии, первичному тромбозу легочных и коронарных артерий, артерий и вен головного мозга и кишечника, правых отделов сердца. В целом, проявления ДВС-синдрома при COVID-19 носят классический характер с развитием не только тромбозов, но и геморрагий в виде кровоиз лияний в тканях и диапедеза эритроцитов [14].
Заключение. Важным механизмом участия повреждения эндотелия в развитии COVID-19 инфекции является угнетение активности АПФ2, вызванное вирусом. Это приводит к нарушению регуляции ренин-ангиотензиновой системы и повышению АТ-II, что, в свою очередь, нарушает регуляцию тонуса сосудов, стимулирует пролиферацию и оказывает провоспалительное действие. Уменьшение активности АПФ2, а также активация АПФ, увеличение АТ-II и его воздействия на рецепторы 1-го типа усиливают повреждение легких в эксперименте и способствуют развитию острого респираторного дистресс-синдрома.
Одним из основных изменений в организме при COVID-19 является нарушение функционирования системы гемостаза, которое определяется как гиперкоагуляционный статус, претромботическое состояние, комбинация слабовыраженного синдрома диссеминированного внутрисосудистого свертывания (ДВС-синдром) с тромботической микроангиопатией, сочетание эндотелиопатии и активации тромбоцитов.
Системная дисфункция эндотелия и коагулопатия при COVID-19 ассоциированы с повышением риска летального исхода, вследствие венозной (около 70 % пациентов, находящихся в критическом состоянии) или артериальной тромбоэмболии, значительно реже – геморрагических осложнений. Риск тромбоэмболических осложнений повышается при длительной иммобилизации и наличии сопутствующих заболеваний, при которых имеет место дисфункция эндотелия (сахарный диабет и др.).
Множественный тромбоз сосудов и системные нарушения ведут к полиорганной недостаточности, характерной для тяжелого течения COVID-19. Роль дисфункции эндотелия как одного из ключевых факторов патогенеза COVID-19 общепризнана. Впервые на тесную связь между состоянием эндотелия и свертываемостью крови обратил внимание [20].
Список литературы COVID-19 и дисфункция эндотелия (обзор литературы)
- Абдурахимов Абдухалим, Эргашева Зумрад, Нугманов Озодбек, Усманов Хумоюн. COVID-19: патогенез и возможные решения проблемы (обзор литературы) //Re-health journal, no. 2-2 (6), 2020, pp. 171-173.
- Афонасьева Т. М. "Эндотелиальная дисфункция. Возможности ранней диагностики //Медико-фармацевтический журнал "Пульс" 18.11 (2016).
- Васина, Л. В., Н. Н. Петрищев, Т. Д. Власов. Эндотелиальная дисфункция и ее основные маркеры //Регионарное кровообращение и микроциркуляция 16.1 (2017): 4-15.
- Воробьев П. А. и др. Синдром диссеминированного внутрисосудистого свертывания крови при инфекции COVID-19 //Терапия. - 2020. - Т. 6. - №. 5. - С. 25-34.
- Галстян Г. М. Коагулопатия при COVID-19 //Пульмонология. - 2020. - Т. 30. - №. 5. - С. 645-657.


