COVID-19 klinik ko'rinishlarida renin-angiotenzin-aldosteron tizimining tarkibiy qismlarining roli
Автор: Xegay Lyubov Nikolaevna, Sayfullaeva Saida Akramjonovna, Abdurahimov Abduxalim Xoliddin Ugli
Журнал: Re-health journal @re-health
Рубрика: Патофизиология
Статья в выпуске: 1 (9), 2021 года.
Бесплатный доступ
Maqolada COVID-19 va renin-angiotensin-aldosteron tizimining o'rtasidagi munosabat tahlil qilingan. Renin-angiotensin-aldosteron tizimi inson fiziologiyasida muhim rol o'ynaydigan vazoaktiv peptidlarning elegant kaskadi hisoblanadi.
Covid-19, sarc–cov-2, raat, apf-2, apf ingibitori, angiotenzin ii retseptorlari antagonistlari, yurak-qon tomir tizimi
Короткий адрес: https://sciup.org/14125615
IDR: 14125615 | DOI: 10.24411/2181-0443/2021-10038
Текст обзорной статьи COVID-19 klinik ko'rinishlarida renin-angiotenzin-aldosteron tizimining tarkibiy qismlarining roli
Введение. Стало известно, что возбудитель COVID-19 («COronaVIrus Disease 2019») представляет собой одноцепочечный РНК-содержащий вирус, относится к семейству Coronaviridae, относится к линии Beta-
CoV [1, 18]. Сродство S-гликопротеина вируса SARC–CoV-2 с ангиотензинпревращающим ферментом-2 (АПФ2) приводит к преимущественному первичному повреждению рецепторов к данному ферменту, которые затем будут служить точкой проникновения вируса внутрь клетки. Специфические рецепторы к АПФ2 находятся в некоторых тканях организма человека, главным образом на мембранах пневмоцитов II типа, энтероцитов тонкого кишечника, эндотелиальных клеток артерий и вен, а также гладкомышечных клеток большинства внутренних органов,в клетках коры головного мозга, полосатого тела, гипоталамуса и ствола головного мозга.
Развитие неврологических симптомов при коронавирусной инфекции объясняется наличием рецепторов к АПФ2 в нейронах головного мозга и глии, что делает эти клетки чувствительными к инфицированию вирусом SARS-CoV-2. Под действием вируса подавляется АПФ2 и это приводит к токсическому избыточному накоплению ангиотензина II и брадикинина [1].
Роль РААС в патогенезе. Одним из основных ключевых патогенетических механизмов COVID-19 является ренин-ангиотензин-альдостероновая система (РААС).
Ренин-ангиотензин- альдостероновая система представляет собой элегантный каскад вазоактивных пептидов, которые играют ключевую роль в физиологии человека [1, 26] (рис. 1).
Рисунок 1
Роль ангиотензинпревращающего фермента-2 в ренин-ангиотензин-альдостероновой системе
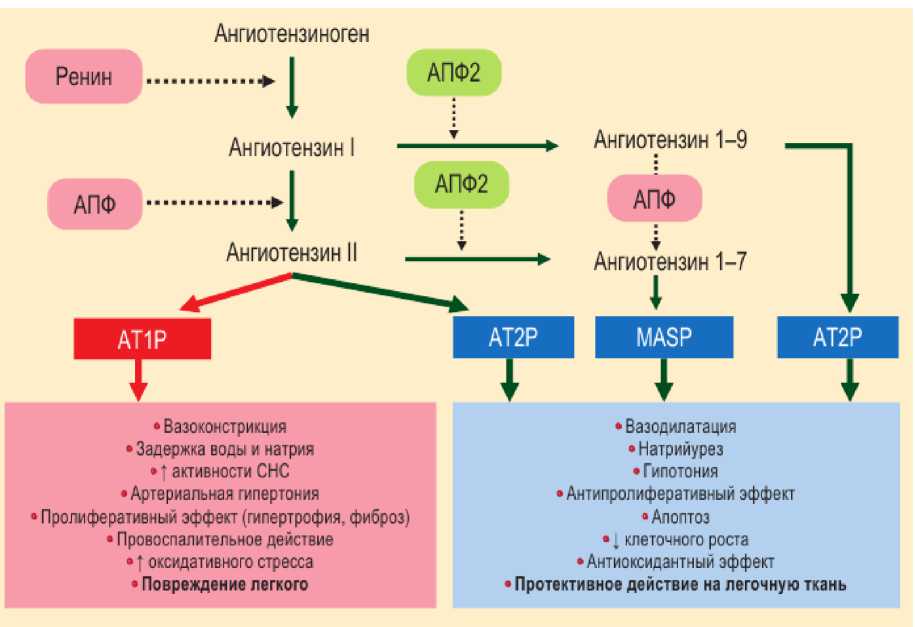
Примечание: АПФ – ангиотензинпревращающий фермент; АТР – ангиотензиновые рецепторы, ↓ – снижение; ↑ – повышение.
Figure 1. The role of angiotensin-converting enzyme 2 (ACE2) in the rennin-angiotensin-aldosterone system
Note: ↓ – decrease; ↑ – increase.
Каскад патологических процессов реализуется через основные компоненты этой системы – ренин, проренин, ангиотензин II (АТ II), альдостерон, которые как циркулируют в плазме крови (циркулирующая РААС), так и синтезируются непосредственно в органах и тканях (сердце, почки, лёгкие, глаза, жировая ткань, поджелудочная железа), определяя поражение органов-мишеней гиперактивностью локальных (тканевых) РААС.
Ангиотензинпревращающий фермент (АПФ) стимулирует синтез ангиотензина II, обладающего мощным вазоконстрикторным, пролиферативным и провоспалительным действиями, усиливающимися с возрастом [14, 23] (см. ниже).
АТ II связывается преимущественно с АТ1-рецепторами, локализованными на эндотелиальных и гладкомышечных клетках, что приводит к вазоконстрикторному, пролиферативному, провоспалительному эффектам и в целом – к развитию склеротических изменений тканей и сосудов, формированию дисфункции эндотелия и сосудистого ремоделирования.
Ангиотензинпревращающий фермент 2 (АПФ 2) отвечает за преобразование ангиотензина II в ангиотензин 1–7, обладающий противоспалительными свойствами и стимулирующий увеличение синтеза оксида азота, который, в свою очередь, обладает вазодилатирующими и вазопротекторными свойствами (рис. 1) [1, 14, 23].
АПФ 2 был открыт в 2000 году как гомолог ангиотензинпревращающего фермента [19, 27-29]. АПФ2
представляет собой трансмембранный белок I типа, который состоит из 805 аминокислот и 2 доменов: N- и C-концевого доменов. АПФ2 экспрессируется в сердце человека, почках, легких, печени, яичках и кишечнике и может находиться как в свободной форме (в крови), так и фиксированным к мембране клеток, становясь, таким образом, рецептором [19, 28, 29]. В сердце и крупных сосудах АПФ2 локализуется на поверхности эндотелиальных клеток и клеток гладких мышц. В легких АПФ2 в основном находится на альвеолоцитах 2го типа II, реже на альвеолоцитах 2-го типа I и эпителиальных клетках дыхательных путей [19, 27].
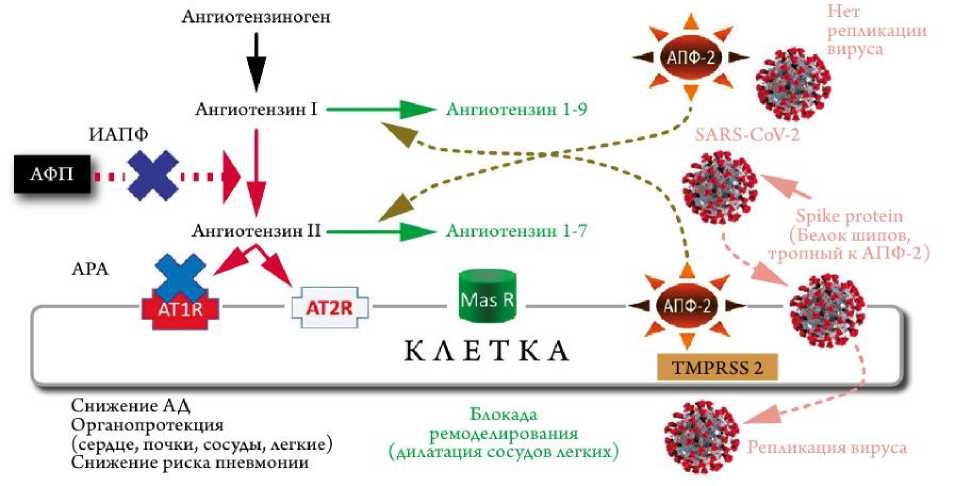
В свою очередь, SARS-CoV-2 использует АПФ 2 как функциональный рецептор для проникновения в основные клетки-мишени альвеолярного эпителия – альвелиоциты II типа, в цитоплазме которых происходит репликация вируса [25]. После эндоцитоза вирусной частицы происходит подавление экспрессии АПФ 2 на поверхности клеточной мембраны, приводящее к неконтролируемому накоплению АТ II и активации РААС.
Местная активация РААС может опосредовать повреждение лёгочной ткани при вирусной инфекции. Действие вируса вызывает повышение проницаемости клеточных мембран и усиленный транспорт жидкости, богатой альбумином, в интерстициальную ткань лёгкого и просвет альвеол. При этом разрушается сурфактант, что ведет к коллапсу альвеол, в результате резкого нарушения газообмена развиваются острый респираторный дистресс-синдром, тяжелые пневмонии (рис. 3) [1, 14, 23].
Рисунок 2
Противоположные кардиоваскулярные эффекты двух пептидов РААС -ангиотензина II и ангио тензина (1-7) с участием АПФ-2
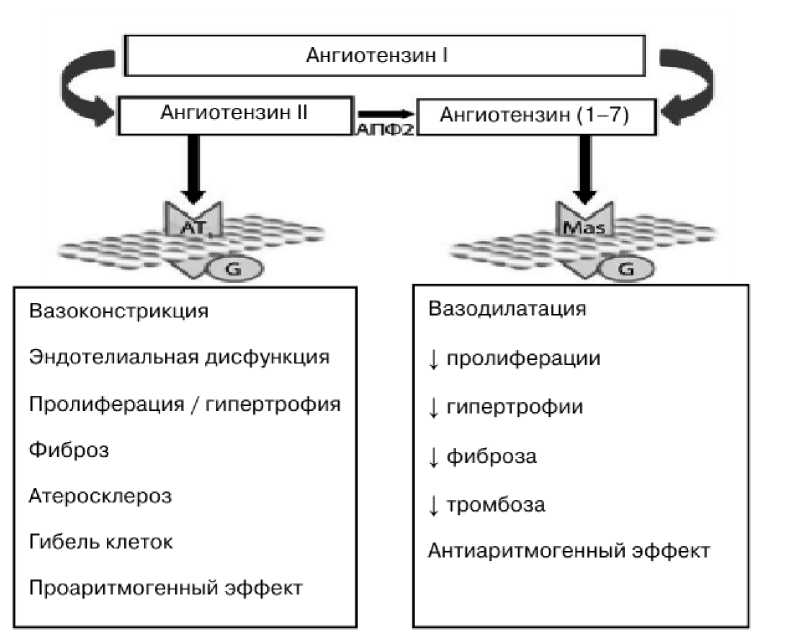
Вазодилатация
| пролиферации
| гипертрофии
| фиброза
| тромбоза
Антиаритмогенный эффект
Ангиотензин II ■
1АПФ2
Ангиотензин(1-7)
Вазоконстрикция
Эндотелиальная дисфункция
Пролиферация / гипертрофия
Фиброз
Атеросклероз
Гибель клеток
Проаритмогенный эффект
Ангиотензин I
Механизм проникновения вируса SARS-CoV2 в клетки
Рисунок 3
Возрастные особенности РААС. С возрастом и особенно при наличии АГ и СД активность основных компонентов РААС, в том числе ангиотензина II, существенно возрастает [4–6] и происходит дисбаланс между провоспалительным ангиотензином 2 и противоспалительным ангиотензином 1–7 [7, 8]. У пациентов более молодого возраста активность ангиотензина II и ангиотензина 1–7 [8], а также, по всей видимости, АПФ и АПФ2, сохраняется на нормальном уровне, баланс вазоконстрикторных и воспалительных факторов, стимулируемых ангиотензином II, с одной стороны, и образование оксида азота и блокада интерлейкина-6, поддерживаемые ангиотензином 1–7, с другой, сохранен. Это является одним из факторов более легкого течения болезни. Тем не менее ворота для проникновения вируса открыты, а значит заболеваемость и контагиозность молодых пациентов высокая.
Пожилые пациенты (старше 60 лет и с сопутствующими АГ и СД 2 типа) имеют гораздо более тяжелое течение заболевания из-за системного воспаления, поддерживаемого преобладающей активностью АПФ и синтезом большего количества ангиотензина II.
Пол и РААС. В экспериментальных и клинических исследованиях продемонстрировано существование гендерных различий в содержании компонентов РААС [4]:
-
- ангиотензиногена мРНК выше в печени и почках самцов крыс по сравнению с особями женского пола. Показано, что содержание мРНК ангиотензиногена снижается после кастрации и возрастает после инъекции тестостерона. Отмечено, что введение эстрадиола сопровождается повышением количества мРНК ангиотензиногена в печени и
- концентрации ангиотензиногена в плазме крови;
-
- отмечены более высокие уровни активности ренина плазмы крови у особей мужского пола по сравнению с самками;
-
- у здоровых лиц активность АПФ выше у мужчин [39]. В то же время, у женщин репродуктивного возраста [40] и в период постменопаузы [17] содержание АПФ в плазме крови не отличается от таковой мужчин, сопоставимых по возрасту;
-
- в исследовании J.A. Miller и соавторов, включавшем нормотензивных мужчин и женщин (средний возраст – 28±1 год), показано, что у женщин содержание альдостерона в крови были ниже, чем у мужчин, однако по концентрации ангиотензина II в плазме крови различий не выявлено.
Активация РААС при патологии.
Экспрессия белка АПФ2 снижается в почках в животных моделях АГ и сахарного диабета [19, 33, 34]. L. S. Zisman et al. (2003) отметили, что экспрессия АПФ2 значительно увеличивается в миокарде при хронической сердечной недостаточности и кардиомиопатиях [19, 33]. По данным S. J. Brake и соавторов (2020), высокие концентрации АПФ2 находят в тканях легких пациентов с хронической обструктивной болезнью легких и у курильщиков с нормальной функцией легких [34].
Действия препаратов, влияющих на РААС. Некоторые опубликованные лабораторные исследования показали, что вероятность инвазии SARS-CoV-2 и повреждающее действие вируса в отношении легочного эпителия связаны с рецепторами АПФ в легочной ткани. Поскольку прием иАПФ или сартанов является компонентом базисной терапии ишемической болезни сердца, гипертонической болезни и хронической сердечной недостаточности, то эти препараты используются у большинства больных с ССЗ, обеспечивая контроль показателей гемодинамики и органопротекцию. Одновременная принадлежность таких пациентов к группе высокого риска неблагоприятного исхода COVID-19 (пожилой возраст, коморбидность) определяет высокую актуальность изучения механизмов влияния ингибирования РААС на течение коронавирусной инфекции.
COVID-19, компоненты РААС и его блокаторы
Рисунок 4
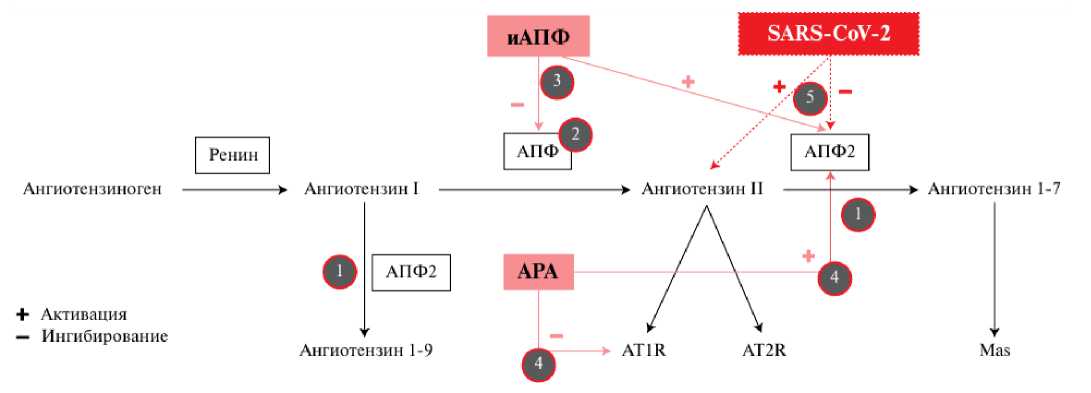
Первично в эксперименте показано, что лечение иАПФ может значительно снизить легочное воспаление и высвобождение цитокинов, вызванное коронавирусной инфекцией [3, 24].
Ингибиторы АПФ подавляют образование ангиотензина II, а АРА — взаимодействие ангиотензина II с его рецепторами (рис. 5). Исследования показали, что иАПФ и АРА обладают способностью усиливать экспрессию
АПФ2 в дополнение к их основному действию. Обнаружено, что при лечении АРА уровни ангиотензина I и ангиотензина II значительно повышаются, что индуцирует увеличение экспрессии АПФ2 и его активности в образовании ангиотензина 1-7, внося тем самым значительный вклад в защиту сердечно-сосудистой системы, мозга и почек [6].
Рисунок 5
Роль АПФ2 в защите органов

ИАПФ/АРА
-Ангиотензин II4-АПФ2Т
ИАПФ/АРА
Ангиотензин II Т АПФ2ф
Защита органов
Повреждение легких
Легочная вазоконстрикция и ремоделирование
Предотвращение артериовенозных шунтов в легких
11овреждение СС системы
Антиатеросклеротическое, антиоксидантное действие
Снижение АД
Уменьшение гипертрофии миокарда
Обратное ремоделирование желудочков
Повреждение органов
Повреждение легких
Повышение проницаемости .легочных сосудов
Отек легких
ОРД С
Повреждение СС системы
Атеросклероз, окислительный стресс
Повышение АД, гипертрофия миокарда
Миграция гладкомышечных клеток сосудов
Ремоделирование миокарда: сердечная недостаточность
Сообщения [19], главным образом основанные на данных экспериментальных исследований, из которых следует, что ингибиторы ангиотензинпревращающего фермента (ИАПФ) и блокаторы рецепторов ангиотензина II (БРА) могут увеличить экспрессию рецептора АПФ2, привели к опасениям, что лица, принимающие эти препараты, могут иметь повышенную восприимчивость к SARS-CoV-2 или тяжесть COVID-19.
Выводы:
-
1. Вирус SARS-CoV-2 представляет собой одноцепочечный РНК-вирус с положительной цепью из семейства Coronaviridae рода Betacoronavirus и из-за сродство S-гликопротеина вируса с АПФ2, АПФ2 является функциональным рецептором проникновения SARS-CoV-2 в клетки организма.
-
2. Экспрессия АПФ2 облегчает проникновение и репликацию вируса в клетках, которые бы в ином с лучае были более устойчивы к вирусу.
-
3. Прогноз тяжести COVID-19 связан с возрастом и полом : экспрессия АПФ2 снижается с возрастом и ее уровень у молодых людей выше, чем у пожилых, а у женщин выше, чем у мужчин (эти данные не соответствуют характеристике тяжелобольных пациентов с COVID-19, основную массу которых составляют мужчины пожилого возраста?).
-
4. Дисбаланс между АПФ1/ангиотензин-II/AT1R
-
5. Восстановление баланса системы за счет ослабления действия АПФ1 и усиления действия АПФ2 путем приема иАПФ и АРА является ценной стратегией для минимизации вредного воздействия SARS-CoV-2 на легкие.
и АПФ2/ангиотензин-1-7/AT2R/рецепторы-MAS способствует патогенезу ОРДС и острой легочной недостаточности у пациентов с COVID-19.
Список литературы COVID-19 klinik ko'rinishlarida renin-angiotenzin-aldosteron tizimining tarkibiy qismlarining roli
- Абдурахимов А. и др. COVID-19: Патогенез и возможные решения проблемы (обзор литературы) //Re-health journal. - 2020. - №. 2.2 (6).
- Бабенко А. Ю., Лаевская М. Ю. Сахарный диабет и COVID-19. Как они связаны? Современные стратегии борьбы //Артериальная гипертензия. - 2020. - Т. 26. - №. 3.
- Барбараш О. Л. и др. Новая коронавирусная болезнь (COVID-19) и сердечно-сосудистые заболевания //Комплексные проблемы сердечно-сосудистых заболеваний. - 2020. - Т. 9. - №. 2.
- Беловол А. Н., Князькова И. И., Цыганков А. И. Гендерные особенности ренин-ангиотензин-альдостероновой системы: клиническое значение при артериальной гипертензии. - 2014.
- Бубнова М. Г., Аронов Д. М. COVID-19 и сердечно-сосудистые заболевания: от эпидемиологии до реабилитации //Пульмонология. - 2020. - Т. 30. - №. 5. - С. 688-699.


