CYP2D6-генотипирование в оценке эффективности терапии тамоксифеном у больных гормонопозитивным раком молочной железы
Автор: Любченко Людмила Николаевна, Филиппова Маргарита Геннадьевна, Мехтиева Нигяр Исмаиловна, Шендрикова Татьяна Анатольевна, Семьянихина Александра Владимировна, Снеговой Антон Владимирович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 6 т.16, 2017 года.
Бесплатный доступ
Тамоксифен является препаратом выбора при эндокринотерапии гормоноположительного рака молочной железы у женщин в репродуктивном периоде. Метаболическая активность тамоксифена в организме определяется активностью фермента CYP2D6, кодируемого одноименным геном: под действием фермента тамоксифен переходит в метаболически активную форму - эндоксифен. Фармакогенетическое тестирование гена CYP2D6 у пациентов с гормоноположительным раком молочной железы поможет прогнозировать эффективность терапии и оценить риск развития побочных эффектов в целях улучшения отдаленных результатов лечения.
Рак молочной железы, тамоксифен, фармакогенетическое тестирование, ген cyp2d6
Короткий адрес: https://sciup.org/140254154
IDR: 140254154 | УДК: 616.19-006.6-08:615.357:575.113 | DOI: 10.21294/1814-4861-2017-16-6-73-85
Текст обзорной статьи CYP2D6-генотипирование в оценке эффективности терапии тамоксифеном у больных гормонопозитивным раком молочной железы
Рак молочной железы (РМЖ) занимает 1-е место среди злокачественных заболеваний у женщин в России – 20,9 % случаев за 2015 г. В структуре смертности в 2012 г. РМЖ также занимал 1-е место [1]. Рак молочной железы представляет собой фенотипическое и генотипическое сложное онкологическое заболевание, при котором клиническая симптоматика, результаты лечения и прогноз зависят от подтипа и подгруппы опухоли, определяемых на основании комплексных методик с привлечением инструментальных методов, традиционных морфологических маркеров, постоянно развивающихся методов иммуногистохимии и молекулярной генетики. Методы терапии также прошли длительный путь от сложных схем комбинированного и комплексного лечения до монотерапии целевого назначения. Эндокриноте-рапия занимает важное место в лечении рецептор-положительного РМЖ, позволяя получать хорошие результаты при низкой токсичности. Тамоксифен широко используется в химиотерапии и при профилактике рецидивов эстрогензависимых (ER+) форм РМЖ. Продолжительные исследования показали, что его применение снижает риск рецидива и смерти на 30 % (независимо от использования систематической химиотерапии), по другим данным, – на 50 %. Ингибиторы ароматазы (анастрозол и летрозол) эффективнее тамоксифена, но из-за значительного количества побочных реакций подходят гораздо меньшему числу пациентов.
Доля гормоноположительного РМЖ составляет 65–75 % всех случаев инвазивного РМЖ [2]. С начала 1980-х гг. тамоксифен, селективный модулятор эстрогеновых рецепторов, является «золотым стандартом» в лечении эстрогенположительного РМЖ. В качестве стандарта длительности гормонотерапии определен срок в 5 лет с возможностью дальнейшего продления лечения еще на 5 лет. В исследовании АТLAS (Adjuvant Tamoxifen-Longer Against Shorter), которое особенно актуально для
женщин в репродуктивном периоде, оценивались преимущества приема тамоксифена в течение 10 лет по сравнению с 5-летним приемом. Во 2-й «пятилетке» не получено достоверных различий в общей и безрецидивной выживаемости в сравниваемых группах. Однако в последующие после окончания приема пять лет риск летального исхода от РМЖ был ниже на 2,8 % в группе, в которой тамоксифен применялся в течение 10 лет, чем в группе его пятилетнего приема [3]. Преимущество 10-летнего использования тамоксифена также было продемонстрировано в исследовании aTTom (adjuvant Tamoxifen – to offer more?) [4]. Однако у некоторых больных, несмотря на иммуногистохимически подтвержденный гормоноположительный статус опухоли, применение тамоксифена не демонстрирует ожидаемой эффективности.
Фармакогенетика тамоксифена
Метаболизм тамоксифена осуществляется преимущественно в печени, где он подвергается 4-гидроксилированию, в результате чего образуется активный метаболит тамоксифена – эндок-сифен. По данным разных авторов, у больных гормоноположительным РМЖ при приеме тамоксифена в стандартной дозе 20 мг/сут концентрация 4-гидрокситамоксифена составляет 10–20 % от концентрации эндоксифена, который примерно в 100 раз легче связывается с рецепторами эстрогенов, чем его предшественники [5–8].
Фармакологическая активность тамоксифена зависит от его преобразования ферментами цитохрома Р450 (CYP2D6, CYP3A4, CYP3A5, CYP2C9, CYP2C19) [9, 10]. Цитохром Р450 (CYP-450) – суперсемейство гемопротеинов, катализирующих реакции монооксигеназ у всех живых существ. У эукариотических организмов эти протеины являются мембранными и участвуют в метаболизме эндогенных соединений, токсинов и экзогенных веществ (лекарственных средств (ЛС)). Ферменты метаболизма суперсемейства CYP-450 участвуют в I фазе метаболизма ЛС. В начале 60-х гг. прошлого века CYP-450 считался одним из ферментов, вовлеченным в метаболизм ксенобиотиков и стероидов. В 70-х годах было выделено 6 энзимов CYP-450, затем группа ученых под руководством F.J. Gonzales выделила первый изолят комплементарной ДНК – кодирующий белок CYP-450 [11, 12].
Белки цитохрома Р450 распределены в семейства и подсемейства в зависимости от идентичности аминокислотной последовательности. Ферменты, идентичные на 40 %, объединены в семейства и обозначаются арабскими цифрами, а ферменты, идентичные на 55 %, составляют подсемейства и обозначаются буквой латинского алфавита [12, 13]. По данным K.A. Phillips et al., 56 % ЛС с нежелательными побочными реакциями метаболизируются полиморфными ферментами I фазы метаболизма, среди которых 86 % составляют ферменты CYP-450 [14]. Такие межиндивидуальные различия в ответе на лекарственное лечение, как нежелательные лекарственные реакции (НЛР) и отсутствие терапевтического эффекта, связаны с генетическими особенностями метаболизма ЛС и являются серьезной клинической проблемой. По данным метаанализа, проведенного в США, частота выраженных побочных эффектов составляет 6,7 %, а количество смертей от НЛР в год достигает 100 тыс. [15–17], что определяет необходимость фармакогенетического тестирования для индивидуального подбора терапии.
CYP2D6 – одна из главных изоформ CYP Р450, играющая ключевую роль в метаболизме различных ЛС (тамоксифен, антидепрессанты, антипсихотики, антиаритмики, опиоиды и др.) [18–20]. Ген CYP2D6 крайне полиморфичен – для него описано более 100 аллелей. Нормальную метаболическую активность энзима кодируют некоторые из аллельных вариантов: CYP2D6 *1 , *2 , *33 , *35 , тогда как низкую активность определяют аллели CYP2D6 *9 , *10 , *17 , *29 , *36 , *41 , *69 , неактивными являются аллели CYP2D6 *3 , *4 , *6 , *7 , *8 , *11–15 , *19–21 , *31 , *38 , *40 , *42 , высокую активность демонстрируют аллели *2NX , *35X2 .
Аллелям гена CYP2D6 свойственна различная частота встречаемости в популяции в зависимости от ее этнических характеристик. По некоторым данным, 6–10 % лиц европеоидной расы имеют генотип с 2 неактивными аллелями, как правило, *4 и *5, менее 40 % – генотип с 2 активными аллелями, более 50 % – смешанные генотипы с активным и неактивным или малоактивным аллелями. CYP2D6*4 – самый распространенный неактивный аллель среди представителей европейской популяции, частота которого составляет 20–25 %. Для азиатской популяции распространенным аллельным вариантом является CYP2D6*10 [20–22]. Согласно данным, полученным при изучении российской популяции, частота распространения CYP2D6*4 в гомо- и гетерозиготном состоянии сопоставима с таковой в европейской популяции и составляет 30 %. [23]. Вклад этнической вариативности в общую генетическую детерминированность метаболизма тамоксифена изучен недостаточно, поскольку большинство исследований было проведено на этнически однородных группах [24].
По данным исследования in vitro , CYP2D6 метаболизирует более 75 ксенобиотиков, что составляет приблизительно 25 % наиболее часто назначаемых ЛС, многие из которых имеют узкое терапевтическое применение [25–27]. Метаболическая активность тамоксифена в организме определяется активностью фермента CYP2D6, кодируемого одноименным геном: под действием фермента тамоксифен переходит в метаболически активную форму – эндоксифен [28, 29].
Каталитическая активность CYP2D6 влияет на концентрацию эндоксифена, определяя тера- певтическую эффективность [30]. В отличие от CYP2D6, полиморфизм генов CYP2B6, CYP2C9, CYP2C19, CYP3A4/5 не влияет на фармакокинетику и фармакодинамику тамоксифена [8, 9, 29, 31]. В зависимости от того, к каким последствиям для скорости биотрансформации ЛС приводит гетерозиготное/гомозиготное носительство или отсутствие полиморфизмов гена CYP2D6, пациенты подразделяются на группы в соответствии с генотипами:
-
- Распространенные метаболайзеры (extensive metabolizers, ЕМs) – пациенты с нормальной скоростью биотрансформации тамоксифена, не несущие однонуклеотидных полиморфизмов по гену CYP2D6. Для этих пациентов применяют стандартные режимы дозирования средних доз тамоксифена.
-
- Медленные метаболайзеры – пациенты со сниженной скоростью биотрансформации тамоксифена, которые являются гомозиготами (poor metabolizers, РМ) или гетерозиготами (intermedium metabolizers, IMs) по однонуклеотидным полиморфизмам гена CYP2D6 (2549delА, 1846G>A, 1707delT, 2935A>C, 1758G>T). У таких пациентов происходит синтез дефектного фермента со сниженной активностью.
-
- Сверхактивные или быстрые метаболайзеры (ultraextensive metabolizers, UMs) - носители дупликаций или мультипликаций функционально нормальных аллелей CYP2D6*1 , CYP2D6*2 . У этой категории пациентов регистрируют низкую, недостаточную для достижения терапевтического эффекта, концентрацию ЛС. Для UM доза ЛС-субстрата CYP2D6 должна быть выше, чем для ЕМ.
В ряде ретроспективных исследований было показано, что пациенты с генотипом CYP2D6*4/*4 имели значимо более короткий безрецидивный период, чем пациенты с генотипами, содержащими активный аллель wild type (wt) – *4/wt и wt/wt, хотя по показателям общей выживаемости достоверных различий не обнаружено. Кроме того, у пациентов с *4/*4 гомозиготным генотипом, как и у пациентов, принимавших в течение 2–3 лет ингибиторы CYP2D6 (например, селективный ингибитор обратного захвата серотонина (ИОЗС)), риск рецидива был значительно выше.
В отношении тамоксифена, который является пролекарством, у UMs образуется больше активного метаболита эндоксифена. Таким пациентам требуется снижение дозы пролекарства или полное прекращение его использования во избежание побочных эффектов. Например, применение у пациентов с дупликацией гена CYP2D6 анальгетика трамадола, который также является пролекарством, приводит к увеличению концентрации активного метаболита в крови и более высокой частоте и выраженности побочных реакций - тошноте, дыхательным нарушениям и др. [20, 32–34]. Было показано, что у IMs и PMs концентрация эндок-сифена была ниже на 60 и 74 %, чем у EM. Ген-дозазависимый эффект также продемонстрирован для тамоксифена и соотношения метаболитов N-дисметилтамоксифен/эндоксифен [35–37].
Скрининг аллельных вариантов CYP2D6 рекомендован Dutch Pharmacogenetics Working Group (DPWG, Нидерланды) в качестве обязательного теста перед назначением адъювантной гормональной терапии. В соответствии с рекомендациями DPWG пациенткам со сниженным уровнем метаболизма рекомендуется избегать приема ингибиторов CYP2D6, а при наступлении постменопаузы – рассматривать применение ингибиторов ароматазы вместо тамоксифена; для пациенток из группы с низким уровнем метаболизма – учитывать повышенный риск развития рецидива заболевания и при наступлении постменопаузы рассматривать применение ингибиторов ароматазы.
Определение индивидуальной чувствительности к тамоксифену у пациенток с гормонопозитивным РМЖ на основе CYP2D6 -генотипирования
В исследованиях, выполненных в Германии и США, проведен ретроспективный анализ данных 1325 больных РМЖ I–III стадий, из которых у 95,4 % пациенток на момент постановки диагноза уже наступила менопауза. Критериями включения являлись положительный статус по рецепторам эстрогенов, отсутствие метастазов на момент включения в исследование, прием тамоксифена адъювантно и отсутствие химиотерапии. ДНК выделяли из лимфоцитов периферической крови больных и из опухолевой ткани. Аллельные варианты гена CYP2D6 *10 , *41 коррелировали со сниженной активностью фермента, а аллели *3 , *4 , *5 были отнесены к неактивным. Медиана наблюдения составила 6,3 года. В течение 9 лет частота возникновения рецидивов составила 14,9, 20,9 и 29,0 % у ЕМs, IMs и РМs соответственно. В группах IMs и PMs был значительно повышен риск развития рецидива по сравнению с EMs (время до развития рецидива, относительный риск (ОР) 1,40 и 1,90 соответственно). Различия показателей общей выживаемости между этими группами были статистически недостоверны, тогда как без-рецидивная выживаемость и выживаемость без признаков заболевания у IMs и PMs по сравнению с ЕМs была меньше [38]. На основании полученных данных авторы сделали вывод о том, что пациентки с PMs не должны получать тамоксифен.
Результаты ряда других исследований не показали подобной взаимосвязи. В масштабном исследовании BIG (Breast International Group) 1–98 (табл. 1) оценивалась эффективность адъювантной гормонотерапии тамоксифеном у женщин в зависимости от носительства полиморфизмов гена CYP2D6 . В исследование были включены 4 393
Таблица 1
Результаты международных исследований по изучению эффективности тамоксифена в зависимости от генотипа CYP2D6
|
Исследование |
Лечение |
Выделение ДНК |
Распределение больных |
Медиана наблюдения, лет |
Риск развития рецидива |
БРВ |
Выживаемость без признаков заболевания |
Общая выживаемость |
|
13
, 5? S fl 1—1 “ S ^ o 5 щ £ g о |
Тамоксифен без химиотерапии Тамоксифен/ летрозол |
Опухолевые блоки Опухолевые блоки |
ЕМ IM – *10, *41 PM – *3, *4, *5 EM – все аллели, кроме IM, PM IM –*41 PM –*3, *4, *6, *7 |
6,3 5,0 |
Повышен для IM и PМ по сравнению с ЕМ ОР 1,40; 95 % ДИ 1,04–1,90 ОР 1,90; 95 % ДИ 1,10–3,28 Снижен для PM и IM по сравнению с ЕМ (ОР 0,86; 95 % ДИ 0,60–1,24) |
Меньше у IM и PM по сравнению с ЕМ (ОР 1,33; 95 % ДИ 1,06–1,68) – |
Меньше у IM и PM по сравнению с ЕМ (ОР 1,29; 95 % ДИ 1,03– 1,61) Различия между группами не значимы |
Различия незначительны (ОР 1,15; 95 % ДИ 0,88–1,15) - |
|
3 §^ 141 -11 < ^ U |
Тамоксифен/ анастрозол |
Опухолевые блоки |
– |
10,0 |
PM при сравнении с ЕМ: ОР 0,99; 95 % ДИ 0,48–2,08; p=0,099 |
PM при сравнении с ЕМ: ОР 1,25; 95 % ДИ 0,55–3,15; p=0,064 |
Различия между группами не оценены |
– |
|
I 9 У ,o । 1 —■ s s < |
Тамоксифен |
Опухолевые блоки/ нативная ткань в блоках |
– |
2,5 |
– |
CYP2D6 *4, *41 и фенотип (РМ при сравнении с ЕМ: ОР 1,33; 95 % ДИ 0,52–3,43; p=0,55) не связаны с БРВ |
– |
– |
|
1 ^ So « s & 5 о < И 8 — о О 00 3 >, ^ -о ti U д (л < |
Тамоксифен/ тамоксифен + анастро-зол |
Опухолевые блоки |
ЕМ – все аллели, кроме IM и PM IM – *10, *41 PM – *3, *4, *6 |
5,0 |
Повышен для РМ по сравнению с ЕМ (ОР 2,45; 95 % ДИ 1,05–5,73; р=0,04) |
– |
– |
– |
|
S 13 сЗ |
– |
Опухолевые блоки/кровь |
– |
5,0 |
– |
Меньше у IM/IM, IM/ PM, PM/PM по сравнению с EM/ EM, EM/ IM, EM/PM (ОР 2,19; 95 % ДИ 1,15–4,18; p=0,017) |
– |
Меньше у IM/IM, IM/ PM, PM/PM по сравнению с EM/ EM, EM/ IM, EM/PM (ОР 2,79; 95 % ДИ 1,12–6,99; p=0,028) |
Примечание: ЕМ – extensive metaboliser, распространенные метаболайзеры; IM – intermedium metaboliser, медленные метаболайзеры, гетерозиготы; PM – poor metaboliser, медленные метаболайзеры, гомозиготы; БРВ – безрецидивная выживаемость.
женщины в постменопаузе с гормоноположительным РМЖ, которые рандомизированы двойным слепым методом и получали тамоксифен и/или летрозол. Для исследования была выделена ДНК из опухолевой ткани. Медиана наблюдения составила 5 лет. У больных с РМs и IMs был статистически незначимо снижен риск развития рецидива РМЖ по сравнению с EMs. Результаты исследования не подтвердили наличия ассоциации генотипа CYP2D6 с безрецидивным периодом у пациенток, получавших тамоксифен в монотерапии без предшествующей химиотерапии [39].
Похожим по дизайну и задачам явилось клиническое исследование АТАС (Arimidex, Tamoxifen, Alone or Combination) (табл. 1), в котором пациенты (n=1203) с гормоноположительным РМЖ I, II и IIIA стадий были рандомизированы в группы больных, принимавших тамоксифен (n=588) и анастрозол (n=615). Генотипирование CYP2D6 выполнено на ДНК, выделенной из опухолевой ткани под контролем патоморфолога. Медиана наблюдения составила 10 лет. По результатам исследования статистически значимой корреляции генотипа CYP2D6 с развитием рецидива РМЖ при лечении тамоксифеном и анастрозолом не обнаружено [40].
Результаты данных широкомасштабных исследований привели к выводу о нецелесообразности выполнения генетического тестирования в клинической практике. Однако позже исследователи BIG 1–98 опубликовали сообщение о возможной методологической ошибке в отношении сбора материала – использования ДНК, полученной не из нативной, а из опухолевой ткани, что могло привести к получению недостоверных результатов по причине потери гетерозиготности в опухолевой ткани [41].
Группа ученых из Нидерландов в рамках международного исследования TEAM (Tamoxifen Exemestan Adjuvant Multinational) (табл. 1), включившего в общей сложности 9779 пациенток в периоде постменопаузы с гормоноположительным ранним РМЖ, показала различия в частоте аллелей CYP2D6 при тестировании ДНК, выделенной из опухолевой ткани, полученной из срезов парафиновых блоков (n=746), и герминальной ДНК, полученной из нативной ткани и/или периферической крови. Результаты исследования также не подтвердили значимых различий между носительством аллелей гена CYP2D6, ассоциированных с медленным метаболизмом, и уменьшением времени до развития рецидива заболевания. Однако авторы не исключают погрешности в результатах генотипирования CYP2D6 в опухолевой ткани [42].
В проспективном исследовании ABCSG 8 (Austrian Breast and Colorectal Cancer Study Group 8) (табл. 1), изучавшем корреляции генотипа CYP2D6 с эффективностью тамоксифена, продемонстрировано, что у женщин, относящихся к группе PM
( CYP2D6*3 , *4 , *6 ) и получавших на протяжении 5 лет тамоксифен в качестве препарата адъювантной гормонотерапии в дозе 20 мг/сут, вероятность развития рецидива или смерти была статистически выше по сравнению с группой EM (все аллели, не относящиеся к PM и IM; ОР 2,45). К группе IM отнесли аллели CYP2D6*10 , *41 . Пациенты гетеро- и гомозиготы по медленным аллелям гена CYP2D6 также имеют более высокие риски возникновения рецидива. Этот эффект не наблюдался у больных, переведенных на анастрозол после 2-летнего приема тамоксифена, что позволяет предположить, что влияние генотипа CYP2D6 может быть замаскировано, если пациенты получают тамоксифен непродолжительное время или другие препараты помимо тамоксифена, тем самым изменяя риск развития рецидива [43].
В работе J. Karle et al. (табл. 1) проанализированы данные пациентов с распространенным гормоноположительным РМЖ, получавших тамоксифен ранее или постоянно с паллиативной целью. Критерием исключения из исследования явилась сопутствующая терапия ингибиторами CYP2D6 . Ретроспективно проанализированы такие данные, как эффективность лечения тамоксифеном, безрецидивная и общая выживаемость, лечение, предшествовавшее терапии тамоксифеном, количество и локализация метастазов, сопутствующая терапия. Период наблюдения длился от момента начала приема тамоксифена при возникновении метастазов до наступления смерти или до окончания исследования. Для выделения ДНК использовали периферическую кровь (n=51) и клетки опухоли, фиксированные в парафиновых блоках (n=43). По результатам исследования безрецидив-ная выживаемость была ниже в группе пациентов – носителей нефункциональных аллелей: медиана составила 9 мес для пациентов групп IMs и PMs и 14 мес – для группы EMs. Общая выживаемость была существенно меньше для группы пациентов с неактивными аллелями (IMs, PMs) по сравнению с группой EMs. Общая 5-летняя выживаемость составила 76,3 % в группе EM и 45,8 % в группах IMs и PMs [44].
В метаанализе, изучавшем влияние полиморфизма гена CYP2D6 на исходы РМЖ, проведенном китайскими учеными, подтверждена взаимосвязь между безрецидивной выживаемостью пациентов, получавших тамоксифен, и генотипом CYP2D6. В анализ были включены данные 11 701 пациентки из 20 различных исследований. Безрецидивная и общая выживаемость была лучше в группе IM по сравнению с PMs (р=0,002 и 0,021 соответственно). При разделении пациентов на подгруппы безрецидивная выживаемость оказалась значительно меньше в группе IMs по сравнению с ЕМs (р=0,035), в азиатской популяции (р=0,001), при продолжительности терапии тамоксифеном 5 лет (р=0,006), в группе с сопутствующей химиотера- пией (р=0,025), а также при монотерапии тамоксифеном (р=0,045) [45].
Результаты изучения генетической гетерогенности CYP2D6 в плазме крови больных РМЖ
Проспективные фармакологические исследования последовательно демонстрируют разницу концентрации эндоксифена в плазме крови в зависимости от носительства аллельных вариантов гена CYP2D6 . Действие тамоксифена реализуется в зависимости от длительности приема и дозы [3, 4, 7]. Одним из таких исследований явилась работа W.J. Irvin et al., в которой изучалось влияние активности метаболита тамоксифена – эндоксифена в зависимости от выбранного режима дозирования. В исследовании участвовали 119 больных РМЖ, получавших тамоксифен в течение >4 мес без сопутствующей терапии ингибиторами CYP2D6 . В зависимости от носительства аллельных вариантов гена CYP2D6 пациенты были подразделены на группы: EMs ( CYP2D6*1 , *2 , *35 ), IMs ( CYP2D6*9 , *10 , *17 , *29 , *41 ) и PMs ( CYP2D6*3 , *4 , *5 , *6 ). Базовый уровень эндоксифена в плазме крови у пациентов группы EM в среднем составил 34,3 нг/мл, что оказалось значительно выше, чем у пациентов групп IMs и РМs – 18,5 (р=0,00045) и 4,2 нг/мл (р=0,001) соответственно. На основании полученных данных пациенты групп IMs и PMs были переведены с дозы приема тамоксифена 20 на 40 мг/сут, в результате чего концентрация эндок-сифена в плазме крови значительно возросла – на 7,6 нг/мл в группе IMs (от 0,6 до 23,9 нг/мл базовой концентрации; р=0,0001) и на 6,1 нг/мл в группе РМs (от 2,6 до 12,5 нг/мл базовой концентрации; р=0,020) (рис. 1) [46].
Японские ученые проанализировали изменение концентрации метаболитов тамоксифена в зависимости от генотипа и изменения дозы препарата. В исследовании приняли участие 98 больных, получавших тамоксифен в стандартной дозе 20 мг/сут. Пациенты были разделены на 3 группы: EMs, IMs, PMs, у которых суточная доза тамоксифена составила 20, 30 и 40 мг соответственно. Длительность исследования составила 8 нед. Доза препарата была увеличена у 51 пациента – носителя нефункциональных аллелей. У пациентов с генотипом CYP2D6*10/*10 при повышении дозы тамоксифена с 20 до 40 мг/сут концентрация эндоксифена увеличилась в 1,69 раза – с 9,3 нг/мл до 15,8 нг/мл, (р=0,001). У пациентов с генотипом CYP2D6*1/*10 доза тамокифена была увеличена до 30 мг/сут, что повысило концентрацию эндоксифена в плазме крови в 1,41 раза (22,4 нг/мл; р=0,001). У пациентов с CYP2D6*1/*1 при дозе тамоксифена 20 мг/ сут концентрация эндоксифена в плазме составила 19,7 нг/мл (р=0,076). Больные с гетерозиготным генотипом CYP2D6*10 и нулевым аллелем, включая *5, *21, *36, показали схожие результаты с пациентами – носителями генотипа CYP2D6*10/*10 -увеличение в 1,94 раза концентрации эндоксифена в плазме крови. При оценке развития побочных эффектов не выявлено существенных различий между пациентами с генотипом CYP2D6*1/*1, получавшими дозу тамоксифена 20 мг/сут, и теми, у кого доза была увеличена до 30 и 40 мг/сут (р=0,32) [47].
В работу L. Madlensky et al. были включены женщины (n=1370) из исследования WHEL (Women’s Healthy Eating and Living) c положительным статусом РМЖ по рецепторам эстрогенов. Оценивалась корреляция концентрации эндоксифена в сыворотке крови с генотипом CYP2D6 . Исследовалась возможность ассоциации развития рецидива РМЖ с уровнем концентрации тамоксифена, 4-гидрокситамоксифена, N–дисметиламоксифена. По результатам исследования не обнаружено различий в уровне тамоксифена в плазме крови в зависимости от генотипа CYP2D6 . Однако для концентрации эндоксифена, 4-гидрокситамоксифена и N–дисметиламоксифена отмечена устойчивая взаимосвязь с исследуемым генотипом CYP2D6 (р=0,35). Концентрация эндоксифена в плазме крови >5,97 нг/мл снижала на 30 % риск возникновения новых случаев РМЖ [37].
Единственное исследование было посвящено изучению частоты НЛР, связанных со сверхбыстрым метаболизмом (UMs) у пациентов с ранним
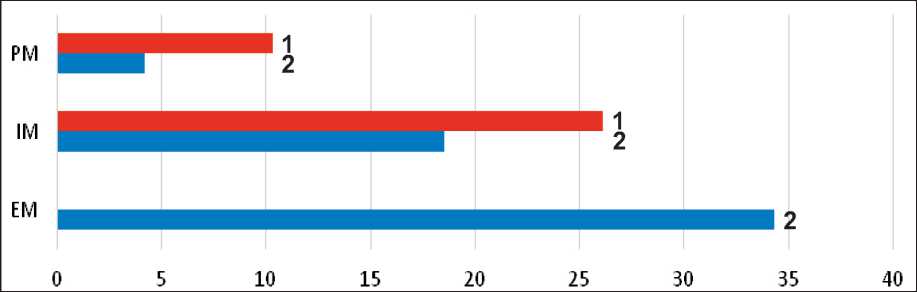
Рис. 1. Изменение концентрации эндоксифена у пациентов групп IM и PM при смене режима дозирования тамоксифена. Шкала 1: базовый уровень концентрации эндоксифена через 4 мес (доза тамоксифена – 40 мг/сут). Шкала 2: базовый уровень концентрации эндоксифена (доза тамоксифена – 20 мг/сут). PM – poor metaboliser, медленные метаболайзеры, гомозиготы;
IM – intermedium metaboliser, медленные метаболайзеры, гетерозиготы; ЕМ – extensive metaboliser, распространенные метаболайзеры (адаптировано из [46])
РМЖ, получавших монотерапию тамоксифеном. Авторами исследования зафиксированы 2 и более нежелательные реакции на тамоксифен по сравнению с пациентами групп EMs, IMs и PMs (р=0,030) [48].
Данные проведенных исследований позволяют предположить возможные преимущества от увеличения дозы у IMs и PMs, однако необходимо учитывать частоту развития нежелательных лекарственных реакций при более высоких дозах. Для получения достоверных результатов анализа нежелательных лекарственных реакций важным является оценка соматической патологии и сопутствующей лекарственной терапии перед включением в исследование для устранения некорректной оценки и искажения фактических результатов [49, 50].
В другом исследовании, включавшем 493 пациентки, получивших химиотерапию и продолживших лечение тамоксифеном в течение >6 мес. Генотипирование проводили по аллели CYP2D6*4 . Проанализированы время до прогрессирования, частота местных рецидивов, регионарного и отдаленного метастазирования, контралатерального РМЖ и выживаемость без прогрессирования. По результатам исследования не обнаружено существенной разницы во времени до прогрессирования и безрецидивной выживаемости между генотипом CYP2D6*4 в общей когорте пациентов. В подгруппе пациентов PM по CYP2D6*4 , получивших химиотерапию, отмечалось меньшее время до прогрессирования. В этой группе среднее время до прогрессирования и безрецидивной выживаемости у носителей CYP2D6*4 / *4 составило 1 год, у носителей CYP 2D6*1 / *4 – 6,3 года и у носителей CYP2D6*1 / *1 – 4,93 года (р=0,104) [51].
M.J. Bijl et al., изучавшие полиморфизм CYP2D6*4 и его влияние на лечение тамоксифеном, показали, что у носителей неактивных аллелей фермента CYP2D6 повышен риск смерти от РМЖ. В исследование были включены пациентки в возрасте 55 лет и старше. Образцы ДНК получены из плазмы крови. Период наблюдения составил 14 лет (1991–2005). Пациенты были классифицированы в зависимости от генотипа как гомозиготы *4 / *4 (PMs), *1 / *1 (EMs) и гетерозиготы *1 / *4 (IMs). Ассоциация CYP2D6 со смертностью от РМЖ изучалась в зависимости от генотипа (* 1 /* 1 , * 1 /* 4, * 4 /* 4 ) и его зиготности ( *1 /* 4 и * 4 /* 4 по сравнению с * 1 /* 1 ; * 4 /* 4 по сравнению с * 1 /* 4 и *1 /* 1 ). При анализе генотипов выявлено, что риск смерти от РМЖ увеличивался с каждым дополнительным нефункциональным аллелем (р=0,015), риск смерти при носительстве * 4 /* 4 был выше (р=0,041) по сравнению с вариантом * 1 /* 1 , но не был увеличен в группе гетерозигот * 1 /* 4 (р=0,075). При анализе гомозигот и гетерозигот по аллелю * 4 риск смерти от РМЖ составил 2,1 (р=0,031). Также в этом исследовании проанализировано совместное применение препаратов, конкурентно ингибирующих
CYP2D6 , при котором снижение эффективности тамоксифена не подтверждено [52].
Схожие данные демонстрирует другое исследование, в котором сравнивались безрецидивная и общая выживаемость больных, получавших тамоксифен в качестве гормонотерапии при РМЖ (n=206), и пациентов, не принимавших тамоксифен (n=280). ДНК выделяли из нормальной ткани молочной железы. В зависимости от типа метаболизма пациентов разделили на 3 группы: ЕМs, PMs и IMs. Анализировали носительство аллельных вариантов гена CYP2D6*4 , *5 , *10 и *41 . По результатам исследования CYP2D6 нулевые аллели *4 , *5 были ассоциированы с более высоким риском рецидива (р=0,03). Риск развития рецидива был в 2 раза выше у РМs ( *4 , *5 ) и РМs/IMs ( 0 / *10 , 0 / *41 ) (р=0,02) [53].
Несмотря на различный дизайн исследований, подтверждающих взаимосвязь генотипа CYP2D6 и эффективности тамоксифена, в некоторых из них не установлена прогностическая значимость изучения аллельных вариантов CYP2D6*4 [54–56].
В настоящее времени нет критериев исключения женщин в репродуктивном и премено-паузальном периодах из группы пациентов, для которых стандартная адъювантная гормонотерапия тамоксифеном может быть неэффективной ввиду медленного метаболизма на фоне сопутствующей терапии ингибиторами CYP2D6 (табл. 2). Данные приведенных исследований по определению активности аллельных вариантов гена CYP2D6 помогут в принятии решения о назначении тамоксифена и подборе индивидуальной дозы препарата.
Влияние лекарственных средств – ингибиторов CYP2D6 на терапию тамоксифеном
При применении тамоксифена одними из побочных эффектов могут быть приливы, вазомоторные нарушения и депрессия [57]. Использование ингибиторов обратного захвата серотонина (ИОЗС) способствует ослаблению этих симптомов. Существует мнение о том, что совместное применение тамоксифена и ИОЗС снижает эффективность первого. Это связано с тем, что оба препарата метаболизируются в печени в свою активную форму цитохромом CYP2D6 , в результате чего происходит ингибирование CYP2D6 антидепрессантом и, как следствие, отсутствие противоопухолевого эффекта тамоксифена. На основании этого был проведен ряд клинических исследований, оценивающих эффект от совместного применения ИОЗС и тамоксифена. По результатам таких исследований ЛС были разделены на препараты с сильным и слабым эффектом в отношении подавления активности CYP2D6 (табл. 2) [58].
В исследовании нидерландских ученых проанализирована замена антидепрессантов с потенциально сильной активностью в отношении
Таблица 2
Лекарственные средства, конкурентно ингибирующие CYP2D6
|
Класс лекарственных средств |
Сильные ингибиторы CYP2D6 |
Умеренные ингибиторы CYP2D6 |
|
Селективные ингибиторы обратного |
Пароксетин Флюоксетин |
Сертралин Циталопрам Флувоксамин Десвенлафаксин Эсциталопрам |
|
захвата серотонина |
Бупропион Дулоксетин |
|
|
Кломипрамин |
||
|
Доксепин |
||
|
Трициклические антидепрессанты |
– |
Дезипрамин Имипрамин |
|
Амитриптилин Нортиптилин |
||
|
Тиоризадин |
Хлорпромазин |
|
|
Антипсихотики |
Перфеназин |
Флуфеназин |
|
Пимозид |
Галоперидол Амиодарон Никардипин |
|
|
Препараты для лечения сердечно- |
Кинидин |
Верапамил Амлодипин Фелодипин |
|
сосудистой патологии |
Тиклопидин |
|
|
Нифедипин |
||
|
Лабеталол |
||
|
Препараты для лечения инфекционных заболеваний |
Терфенадин |
Ритонавир Галофантрин |
|
Хлорохин |
||
|
Н2-антигистаминные средства |
– |
Циметидин Цлемастин |
|
Трипеленнамин |
||
|
Н1-антигистаминные средства |
– |
Прометазин Гидроксизин |
|
Дифенилпиралин |
||
|
Противогрибковые препараты |
Тербинафин |
– |
|
Антипаратиреиодные средства |
– |
Цинакалцет |
|
Селективные агонисты бетта 3 адрено- |
– |
Мирабегрон |
|
рецепторов Нестероидные противовоспалительные средства |
– |
|
|
Целекоксиб |
||
|
Препараты бензодиазепинового ряда |
– |
Клобазон |
ингибирования CYP2D6 (пароксетин, флюоксе-тин) на антидепрессанты со слабой подавляющей активностью энзима CYP2D6 (эсциталопрам, венфлаксин) и влияние этой замены на уровень концентрации метаболитов тамоксифена в плазме крови. Фармакологический мониторинг проводился в течение 24 ч. В результате замены концентрация эндоксифена в плазме крови увеличилась примерно в 3 раза (р=0,012). Отношение эндоксифена к N-дисметилтамоксифену и 4-гидрокситамоксифена к тамоксифену увеличилось в 3,3 и 1,5 раза соответственно с повышением активности энзимов CYP2D6. Смена антидепрессантов не повлияла на развитие побочных эффектов или усиление психологических проблем [59]. Схожие результаты были получены и в других исследованиях [58, 60–62]. Вместе с тем в 2 исследованиях, проведенных в США, сообщается об отсутствии ассоциации ре- цидива со смертностью от РМЖ даже при приеме сильных ингибиторов CYP2D6. Однако ни в одной из этих работ не рассмотрено конкурентное использование слабых ингибиторов CYP2D6 и исходов РМЖ [63, 64].
Фармакогенетическая рабочая группа Королевской голландской ассоциации фармацевтов оценила терапевтические рекомендации выбора дозы тамоксифена на основании генотипа CYP2D6 . Для генотипов PMs и IMs рекомендовано рассмотреть возможность назначения ингибиторов ароматазы для женщин в постменопаузе в связи с повышенным риском развития рецидива РМЖ при приеме тамоксифена, для IM рекомендовано избегать одновременного назначения тамоксифена и ингибиторов CYP2D6 (табл. 2) [65]. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drugs
Administration, FDA) в 2006 г. рекомендовало внести изменения в инструкцию применения тамоксифена в целях отражения риска развития рецидива РМЖ у PM по CYP2D6 [66].
Таким образом, результаты многочисленных проведенных исследований по поиску взаимосвязи между носительством аллельных вариантов гена CYP2D6 и реализацией противоопухолево- го эффекта тамоксифена продемонстрировали корреляцию медленного метаболизма с прогрессированием РМЖ на фоне гормонотерапии тамоксифеном. Фармакогенетическое тестирование гена CYP2D6 у больных гормоноположительным РМЖ поможет прогнозировать эффективность терапии и оценить риск развития побочных эффектов в целях улучшения отдаленных результатов лечения.
Список литературы CYP2D6-генотипирование в оценке эффективности терапии тамоксифеном у больных гормонопозитивным раком молочной железы
- Давыдов М.И., Аксель Е.М. Статистика злокачественных новообразований в России и странах СНГ в 2012 г. М., 2014. 226.
- Goldhirsch A., Wood W.C., Gelber R.D., Coates A.S., Thürlimann B., Senn H.J.; 10th St. Gallen conference. Progress and promise: highlights of the international expert consensus on the primary therapy of early breast cancer Ann Oncol. 2007 Jul; 18 (7): 1133-44.
- Davies C., Pan H., Godwin J., Gray R., Arriagada R., Raina V., Abraham M., Medeiros Alencar V.H., Badran A., Bonfill X., Bradbury J., Clarke M., Collins R., Davis S.R., Delmestri A., Forbes J.F., Haddad P., Hou M.F., Inbar M., Khaled H., Kielanowska J., Kwan W.H., Mathew B.S., Mittra I., Müller B., Nicolucci A., Peralta O., Pernas F., Petruzelka L., Pienkowski T., Radhika R., Rajan B., Rubach M.T., Tort S., Urrútia G., Valentini M., Wang Y., Peto R.; Adjuvant Tamoxifen: Longer Against Shorter (ATLAS) Collaborative Group. Long-term effects of continuing adjuvant tamoxifen to 10 years versus stopping at 5 years after diagnosis of oestrogen receptor-positive breast cancer: ATLAS, a randomized trial. Lancet. 2013; 381 (9869): 805-16. DOI: 10.1016/S0140-6736(12)61963-1
- Gray R.G., Rea D., Handley K., Bowden S.J., Perry P., Earl H.M., Poole C.J., Bates T., Chetiyawardana S., Dewar S.A., Fernando I.N., Grieve R., Nicoll J., Rayter Z., Robinson A., Salman A., Yarnold J., Bathers S., Marshall A., Lee M. Long-term effects of continuing adjuvant tamoxifen to 10 years versus stopping at 5 years in 6,953 women with early breast cancer. J Clin Oncol. 2013; 31 (18S): 5.
- Lim Y.C., Desta Z., Flockhart D.A., Skaar T.C. Endoxifen (4-hydroxy-N-desmethyltamoxifen) has anti-estrogenic effects in breast cancer cells with potency similar to 4-hydroxytamoxifen. Cancer Chemother Pharmacol. 2005; 55 (5): 471-8. DOI: 10.1007/s00280-004-0926-7


