D-димер, как лабораторный предиктор развития медикаментозно ассоциированного остеонекроза челюсти
Автор: Виноградова Н.Г., Епифанов С.А., Харитонова М.П., Львов К.В.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Оригинальные статьи
Статья в выпуске: 2 т.18, 2023 года.
Бесплатный доступ
Цель исследования - выявить лабораторный прогностический критерий вероятности развития и рецидива медикаментозно ассоциированного остеонекроза челюсти. Материалы и методы. Выполнено нерандомизированное сравнительное когортное исследование. В основную группу были включены 39 пациентов, находящихся на лечении в отделении челюстно-лицевой хирургии ГАУЗ СО «ЦГКБ №23 г. Екатеринбурга» с диагнозом медикаментозно ассоциированный остеонекроз челюсти, среди них 23 женщины (60,5%), 15 мужчин (39,5%), средний возраст пациентов составил 66,2±10,1 год. В группу сравнения были включены пациенты, получающие химиотерапию в том числе и остеомодифицирующими агентами по поводу злокачественных новообразований различной локализации в дневном стационаре ГАУЗ СО «ЦГКБ №23 г. Екатеринбурга» без клинических проявлений МОНЧ, среди обследованных было 20 женщин (58,8%) и 14 мужчин (41,2%), средний возраст составлял 65,7±9,4 лет. Концентрацию D-димера в плазме крови определяли методом трехфазного иммуноферментного анализа реактивами «Вектор-Бест», производство г. Новосибирск, Россия. Общесоматический статус оценивали с применением шкалы общего состояния онкологического пациента (ECOG), а также по лабораторным общеклиническим показателям. Расчеты для статистического анализа проводили с помощью пакета анализа MS Excel 10. Определяли среднее значение (М), медиану (Ме) и стандартное отклонение (а). Нормальность распределения оценивали показателями асимметрии и эксцесса. Для выявления зависимости между факторами рассчитывали коэффициент корреляции Пирсона. Для оценки статистической разницы между группами использовали t-критерий Стьюдента и критерий согласия Пирсона х2. Уровень надежности 95% (р function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Остеонекроз челюсти, d-димеры, остеомодифицирующие агенты
Короткий адрес: https://sciup.org/140301992
IDR: 140301992 | DOI: 10.25881/20728255_2023_18_2_79
Текст научной статьи D-димер, как лабораторный предиктор развития медикаментозно ассоциированного остеонекроза челюсти
Актуальность
Медикаментозно ассоциированный остеонекроз (МОНЧ) является осложнением применения остеомодифицирующих агентов (ОМА) (бисфосфонаты и деносу-маб) при лечении костных метастазов из злокачественных новообразований (ЗНО) различной локализации. Впервые это заболевание было описано R. Marx в 2003 году [1]. Зарубежные исследователи сообщают, что частота МОНЧ у пациентов, получающих золедронову кислоту колеблется от 0,4% до 2,3% через три года лечения и от 0,5% до 3,2% при лечении деносумабом [2]. За прошедший период изучения выведено несколько слагаемых патогенеза этого заболевания — изменение ремоделирования костной ткани, обильная контаминация микроорганизмами, местная токсичность и антиангиогенные эффекты препаратов [3–6]. Доказанно, что пусковым фактором является повреждение слизистой оболочки альвеолярных отростков (удаление зуба, пролежень от съемного протеза, имплантация зубов). После обнажения кости происходит обильное обсеменение микрофлорой как патогенной, так и условно-патогенной, что приводит к воспалению непосредственно в самой кости [7–9]. Травмированная слизистая оболочка длительное время не заживает, а дефект становится больше, несмотря на проводимое лечение. Данный факт свидетельствует о нарушенных процессах регенерации мягких тканей, которые могут быть обусловлены токсическим действием препаратов как на мягкие ткани, так и непосредственно на кость. Роль микроциркуляции в процессах пролиферации неоспорима и описана во многих литературных источниках. Нарушения в этом звене ведут к задержке процессов репарации и возникновению рецидивов заболеваний [10]. Принимая во внимание тот факт, что система микроциркуляции чувствительна к сдвигам гомеостаза, то для оценки репаративных способностей тканей рациональным представляется использовать лабораторные показатели тканевой перфузии.
Цель — выявить лабораторный прогностический критерий вероятности развития и рецидива МОНЧ.
Материалы и методы
Данное исследование является этапом работы, по изучению клиники, лечению МОНЧ. Выполнено нерандомизированное сравнительное когортное исследование. Было обследовано 39 пациентов, находящихся на лечении в отделении челюстно-лицевой хирургии ГАУЗ СО «ЦГКБ №23 г. Екатеринбурга» с диагнозом МОНЧ. Среди них 23 женщины (60,5%), 15 мужчин (39,5%). Средний возраст пациентов составил 66,2±10,1 год. Все пациенты получали терапию ОМА по поводу костных метастазов при ЗНО различной локализации и остеопороза в соответствии с Клиническими рекомендациями в специализированных стационарах [11]. Пациенты получали химиотерапию (адъювантную, либо монотерапию), согласно Клиническим рекомендациям для каждой нозологии.
Табл. 1. Распределение пациентов основной группы по локализации первичного очага
|
Первичный очаг ЗНО |
Количество пациентов |
|
|
абс. |
% |
|
|
Предстательная железа |
7 |
18,5 |
|
Молочная железа |
10 |
26,3 |
|
Почка |
9 |
23,7 |
|
Матка |
4 |
10,5 |
|
Миеломная болезнь |
4 |
10,5 |
|
Легкое |
1 |
2,6 |
|
Остеопороз |
2 |
5,3 |
|
Остеобластокластома |
1 |
2,6 |
|
Итого |
38 |
100 |
Распределение пациентов по локализации первичного очага представлено в таблице 1.
Состояние по шкале оценки общего состояния онкологического пациента (ECOG) у 10 (26,3%) пациентов было 0 баллов, у 19 (50%) — 1 балл, у 9 (23,7%) — 2 балла.
Для установки диагноза МОНЧ использовали критерии, описанные в литературе — наличие обнаженной кости в полости рта в течение 8 недель и более; лечение ОМА в настоящее время или в прошлом; отсутствие в анамнезе лучевой терапии [12].
Пациенты этой группы предъявляли жалобы на интенсивные боли в челюсти, иррадиирующие по ходу ветвей тройничного нерва, интенсивность болевого синдрома по визуально-аналоговой шкале (ВАШ) по нашим наблюдениям составляла 6,12 (±1,96) балла. При объективном обследовании лицо было симметрично, либо имелся незначительный отек на стороне поражения, кожа физиологической окраски. Открывание рта в полном объеме или незначительно ограничено. При осмотре полости рта выявлены свищевые ходы с гнойным отделяемым, либо дефект слизистой оболочки различного диаметра на альвеолярном отростке челюсти, в дефекте кость серого цвета с гнилостным запахом (Рис. 1, 2).
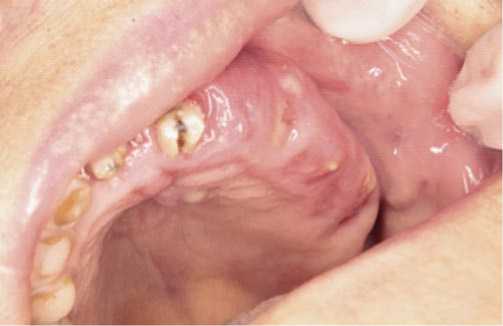
Рис. 1. Свищевые ходы на слизистой оболочке альвеолярного отростка верхней челюсти.
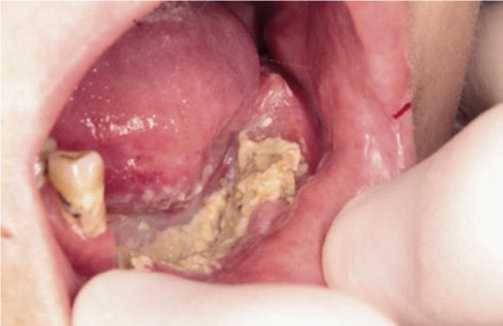

Рис. 2. Дефект слизистой оболочки альвеолярного отростка нижней челюсти, в дефекте кость серого цвета.
Табл. 2. Распределение пациентов группы сравнения по локализации первичного очага
|
Первичный очаг ЗНО |
Количество пациентов |
|
|
абс. |
% |
|
|
Предстательная железа |
9 |
26,5 |
|
Молочная железа |
12 |
35,3 |
|
Яичники |
3 |
8,8 |
|
Кишечник |
4 |
11,8 |
|
Легкое |
4 |
11,8 |
|
Желудок |
1 |
2,9 |
|
Поджелудочная железа |
1 |
2,9 |
|
Итого |
34 |
100 |
В 73,68% случаев (n = 28) наблюдался остеонекроз нижней челюсти, 26,32% (n = 10) — верхней челюсти.
В группу сравнения были включены пациенты, получающие химиотерапию в том числе и ОМА по поводу ЗНО различной локализации в дневном стационаре ГАУЗ СО «ЦГКБ №23 г. Екатеринбурга» без клинических проявлений МОНЧ. Среди обследованных было 20 женщин (58,8%) и 14 мужчин (41,2%), средний возраст составлял 65,7±9,4 лет. Распределение пациентов по локализации первичного очага представлено в таблице 2.
Состояние по шкале оценки общего состояния онкологического пациента (ECOG) у 9 (26,5%) пациентов было 0 баллов, у 16 (47%) — 1 балл, у 9 (26,5%) — 2 балла.
На момент обследования ЗНО у всех пациентов находилось либо в стадии стабилизации, либо в стадии регресса, данных за прогресс опухоли по заключению онколога и дополнительным методом исследования (ПЭТ-КТ) на момент осмотра не было выявлено.
Критерием исключения являлось общее состояние пациента 3 и более баллов по шкале ECOG, а также наличие в анамнезе острого нарушения мозгового кровообращения, ишемической болезни сердца, прием антикоагулянтов и дезагрегантов по любому поводу.
Методы исследования
В настоящее время для диагностики тромбоза используются продукты расщепления фибриногена. Фибриноген при действии тромбина образует мономеры фибрина путем расщепления двух небольших фрагментов (фибринопептидов А и В). Во время этого процесса отрицательный заряд Е фибриногена преобразуется в положительный заряд, что позволяет спонтанно полимеризоваться мономерам фибрина в полимер, который стабилизируется водородными связями. Тромбин также активирует фактор XIII (фермент трансглутаминаза), который стабилизирует исходный полимер фибрина путем каталитического образования сшитых ковалентных связей между соседними D-доменами. Под действием тканевого активатора плазминогена (t-PA), являющегося сериновой протеазой, из неактивного плазминогена образуется активный плазмин, который расщепляет фибрин на множество мелких фрагментов, называемых продуктами деградации фибрина (ПДФ). D-димер, образованный из двух смежных сшитых мономеров, является одним из основных ПДФ. В отличие от конечных продуктов расщепления фибриногена, которые представлены в виде отдельных фрагментов D и Е, при расщеплении попереч-носшитых фактором ХIIIа волокон фибрина, образуются более крупные фрагменты — D-димеры, тримеры D-E-D, поскольку плазмин не способен расщеплять ковалентную связь между D-доменами. Таким образом, действие фибринолитической системы направлено на лизис фибрина, а при чрезмерной активации и фибриногена. В результате образуется смесь продуктов деградации фибрина/фибри-ногена. Продукты деградации фибрина — это крупные фрагменты D-димеры и тримеры, а продукты деградации фибриногена — отдельные олигопептиды с небольшой молекулярной массой. Только продукты деградации поперечно-сшитого фибрина содержат D-димеры. D-димер относится как к маркерам активации свертывания и фибринообразования, так и к маркерам активации фибринолиза. Период полужизни D-димера составляет примерно 8 часов, клиренс осуществляется через почки и ретикуло-эндотелиальную систему. Определение D-димера является наиболее распространенным лабораторным маркером активации свертывания и фибринолиза [13].
Концентрацию D-димера в плазме крови определяли методом трехфазного иммуноферментного анализа реактивами «Вектор-Бест», производство г. Новосибирск, Россия.
Метод определения основан на одностадийном «сендвич» варианте твердофазного иммуноферментно-го анализа. В лунки планшета с иммобилизованными моноклональными антителами вносят калибровочные и контрольные образцы с известными концентрациями D-димера, исследуемые образцы плазмы и пероксидазный конъюгат антител к D-димеру. Образовавшиеся иммунные комплексы «моноклональные антитела — D-димер — конъюгат» после отмывки избытка конъюгата, выявляют ферментативной реакцией пероксидазы с перекисью
водорода в присутствии тетраметилбензидина. После остановки пероксидазной реакции стоп-реагентом измеряют оптическую плотность раствора в лунках. Степень окрашивания пропорциональна концентрации D-димера в образце. Концентрация D-димера в анализируемых образцах рассчитывается на основании калибровочного графика.
Общесоматический статус оценивали с применением шкалы общего состояния онкологического пациента (ECOG), а также по лабораторным общеклиническим показателям.
Расчеты для статистического анализа проводили с помощью пакета анализа MS Excel 10. Определяли среднее значение (М), медиану (Ме) и стандартное отклонение ( σ ). Нормальность распределения оценивали показателями асимметрии и эксцесса. Для выявления зависимости между факторами рассчитывали коэффициент корреляции Пирсона. Для оценки статистической разницы между группами использовали t-критерий Стьюдента и критерий согласия Пирсона χ 2. Уровень надежности 95% (р≤0,5).
Наше исследование проводилось в соответствии с этическими стандартами, изложенными в Хельсинской декларации. Все пациенты, включенные в исследование, подписывали соответствующее информированное согласие. Исследование одобрено на заседании локального этического комитета Уральского государственного медицинского университета 20.05.2022 (протокол №5).
Результаты
При обработке статистических данных пациентов было выявлено, что основная группа и группа сравнения сопоставимы по возрастут и срокам приема ОМА ( χ 2 — 0,99 в каждой группе).
Средний срок лечения ОМА составлял 29,4±25,6 месяцев в основной группе — 11 (29%) пациентов получали ОМА до 12 месяцев, 14 пациентов (36,8 %) — от 13 до 24 месяцев, 13 человек (34,2%) — свыше 24 месяцев. У 3 пациентов (7,9%) был зафиксирован МОНЧ 1 стадии, у 24 (63,1%) — 2 стадии, у 11 (29%) — 3 стадии.
Распределение пациентов по стадиям в зависимости от сроков приема ОМА представлено в таблице 3.
При корреляционном анализе выявлена прямая положительная связь между стадией заболевания и длительностью приема препарата (коэффициент корреляции Пирсона = 0,17).
При анализе общеклинических лабораторных показателей мы выявили незначительное снижение уровня гемоглобина как в основной группе, так и в группе сравнения, остальные показатели не выходили за пределы референсных значений (табл. 4).
Анализируя полученные показатели D-димера, были применены критерии асимметрии и эксцесса, надежность 95%. Значения D-димера у пациентов, получающих бисфосфонаты были сопоставимы со значениями у пациентов, получающих деносумаб в основной группе и
Табл. 3. Распределение пациентов основной группы по стадиям в зависимости от стадии заболевания
|
Срок приема ОМА (мес.) |
Стадия МОНЧ (количество пациентов) |
|||||
|
1 |
2 |
3 |
||||
|
абс. |
% |
абс. |
% |
абс. |
% |
|
|
До 12 мес. |
1 |
9,1 |
9 |
81,8 |
1 |
9,1 |
|
13–24 мес. |
2 |
14,3 |
7 |
50 |
5 |
35,7 |
|
Свыше 24 мес. |
0 |
0 |
8 |
61,5 |
5 |
38,5 |
Табл. 4. Основные общеклинические лабораторные показатели у пациентов основной группы и группы сравнения
|
Показатель (ед.измерения) |
Основная группа |
Группа сравнения |
|
|
Эритроциты (1012) |
м |
4,14 ±0,54 (3,86; 4,44) |
4,24±0,61 (3,73; 4,76) |
|
ж |
4,2±0,6 (3,92; 4,47) |
4,04±0,72 (3,64; 4,44) |
|
|
Гемоглобин (г/л) |
м |
122,62±16,25 (113,96; 131,28) |
123±21,01 (105,42; 140,57) |
|
ж |
113,69±27,26 (101,28; 126,1) |
118,8±16,82(109,48; 128,11) |
|
|
Тромбоциты (109) |
282,26±108,57 (246,57; 317,95) |
327±195,6 (242,89; 412,06) |
|
|
Общий белок (г/л) |
70,82±6,65 (68,42; 73,22) |
73,56±7,17 (70,46; 76,66) |
|
|
АСТ (Е/л) |
18,31±5,11 (16,5; 20,13) |
29,3±18,46 (21,32; 37,28) |
|
|
АЛТ (Е/л) |
15,43±12,34 (11,05; 19,8) |
26,39±5,7 (14,56; 38,21) |
|
|
Креатинин (мкмоль/л) |
91,9±28,69 (82,04; 101,75) |
84,66±21,03 (75,09; 34,24) |
|
|
ПТИ (%) |
92,31±20,11 (85,17; 99,44) |
94,93±10,25 (89,47; 100,4) |
|
|
МНО |
1,08±0,34 (0,96; 1,2) |
1,06±0,1 (0,99; 1012) |
|
|
АЧТВ (сек.) |
29,76±8,29 (26,82; 32,7) |
31,93±4,59 (29,48; 34,38) |
|
^ 4 000, Е х, 3 000,
I 2 000,
? 1 000,
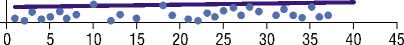
Рис. 3. Разброс результатов исследования у пациентов основной группы.
группе сравнения. Средний уровень D-димера в основной группе составлял 677,82±845,4 (394,78;960,86) нг/мл, был выявлен большой разброс данных с островершинным распределением (Рис. 3).
Высокие значения стандартного отклонения в нашей выборке свидетельствуют об очаговых всплесках у 3 обследуемых (4122,3 нг/мл; 2684 нг/мл; 2336,5 нг/мл).
В проведенном обследовании в основной группе у 14 пациентов (36,8%) уровень D-димера не выходил за пределы референсных значений (<250 нг/мл), у 11 (29%) пациентов показатель был в пределах от 250 до 500 нг/мл, у 5 (13,2%) пациентов показатель был в коридоре от
500 до 1000 мг/мл, у 8 (21%) обследуемых он превышал 1000 мг/мл.
При корреляционном анализе была выявлена средняя положительная связь между уровнем D-димера и сроком приема ОМА (коэффициент Пирсона = 0,3).
В группе сравнения средний срок лечения ОМА составлял 25,8±14,6 месяцев. Средний уровень D-димера составлял 267,93±177,56 (204,98;330,9). В проведенном обследовании у 20 пациентов (60,6%) уровень D-димера не превышал референсных значений (<250 нг/мл), у 9 (27,3%) пациентов показатель был в пределах от 250 до 500 нг/мл, у 4 (12,1%) пациентов показатель был в коридоре от 500 до 1000 мг/мл. При сравнительном анализе средний уровень D-димера в основной группе превышал показатель в группе сравнения в 2,5 раза (t-критерий расчетный (2,68)>t-критерий табличный (1,99), что свидетельствует о значительных статистических различиях в группах).
Обсуждение
МОНЧ является сложным мультифакторным заболеванием и было бы неверным рассматривать его только с точки зрения локального воспаления. Факт наличия ЗНО объясняет развитие в том числе и эндотелиальной дисфункции, обусловленной как влиянием непосредственно опухоли на организм, так и проводимой химиотерапией. При онкологической патологии спектр эндотелиальных нарушений проявляется вазомоторным, адгезионными, ангиогенными и гемостатическими изменениями. Нарушение гемореологической функции характеризуется повышением образования фибрина и снижением уровня фибринолиза, что ведет к адгезии тромбоцитов и фибриновых депозитов на стенках сосудов микроциркулятор-ного русла. Адгезионные молекулы, осуществляющие прямое взаимодействие опухолевых клеток с эндотелием, тромбоцитами и лейкоцитами, могут вызвать формирование тромбоцитарных микротромбов [14; 15]. При вовлечении в процессы микрососудов и мигрирующих лейкоцитов возникают условия для формирования канонического очага воспаления или развития системных микроциркуляторных нарушений — как признаков системного воспаления, высокая вероятность программированного некроза в варианте пироптоза, некробиоза. Повышение уровня D-димера в плазме свидетельствует о тромбозе, в том числе и в микроциркулятороном русле [16; 17]. В нашем исследовании повышение уровня D-димера в основной группе в 63,2%, случаев (в том числе в 34,2% более чем в 2 раза) свидетельствует о системных микроциркуляторных нарушениях.
Выводы
Таким образом проведенное нами исследование на данном этапе является лабораторным подтверждением, предыдущего этапа, где при лазерной доплеровкой фло-уметрии слизистой оболочки альвеолярных отростков челюстей как в очаге поражения, так и на клинически здоровых участках было выявлено системное поражение микроциркуляторного русла [18].
На основании полученных нами результатов, можно расценивать, что уровень D-димера, может являться прогностическим признаком вероятности развития и рецидива МОНЧ, а также необходимо учитывать этот показатель при медикаментозной терапии заболевания.
Дополнительная информация.
Список литературы D-димер, как лабораторный предиктор развития медикаментозно ассоциированного остеонекроза челюсти
- Limones A, Saez-Alcaide LM, Diaz-Parreno SA, Helm A, Bornstein MM, Molinero-MoureNe P. Medication-related osteonecrosis of the jaws (MR-ONJ) in cancer patients treated with denosumab VS. zoledronic acid: A systematic review and meta-analysis. Med Oral Patol Oral Cir Bucal. 2020; 25(3): e326-e336. doi: 10.4317/medoral.23324.
- Srivastava A, Nogueras Gonzalez GM, Geng Y, Won AM, Myers J, Li Y, Chambers MS. Medication-Related Osteonecrosis of the Jaw in Patients Treated Concurrently with Antiresorptive and Antiangiogenic Agents: Systematic Review and Meta-Analysis. J Immunother Precis Oncol. 2021; 4(4): 196-207. doi: 10.36401/JIPO-21-14.
- Lombard T, Neirinckx V, Rogister B, Gilon Y, Wislet S. Medication-Related Osteonecrosis of the Jaw: New Insights into Molecular Mechanisms and Cellular Therapeutic Approaches. Stem Cells Int. 2016; 2016: 8768162. doi: 10.1155/2016/8768162.
- Anesi A, Generali L, Sandoni L, Pozzi S, Grande A. From Osteoclast Differentiation to Osteonecrosis of the Jaw: Molecular and Clinical Insights. Int J Mol Sci. 2019; 20(19): 4925. doi: 10.3390/ijms20194925.
- de Sousa Ferreira VC, Lopes AP, Alves NM, Sousa FRN, Pereira KMA, Gon-dim DV, Girao VCC, Leitao RFC, Goes P. Bisphosphonate-related osteonec-rosis induced change in alveolar bone architecture in rats with participation of Wnt signaling. Clin Oral Investig. 2021; 25(2): 673-682. doi: 10.1007/s0-0784-020-03551-7.
- Hayano H, Kuroshima S, Sasaki M, Tamaki S, Inoue M, Ishisaki A, Sawase T. Distinct immunopathology in the early stages between different antires-orptives-related osteonecrosis of the jaw-like lesions in mice. Bone. 2020; 135: 115308. doi: 10.1016/j.bone.2020.115308.
- Loyson T, Van Cann T, Schoffski P, Clement PM, et al. Incidence of osteonecrosis of the jaw in patients with bone metastases treated sequentially with bisphosphonates and denosumab. Acta Clin Belg. 2018; 73(2): 100-109. doi: 10.1080/17843286.2017.1348001.
- Shibahara T. Antiresorptive Agent-Related Osteonecrosis of the Jaw (ARO-NJ): A Twist of Fate in the Bone. Tohoku J Exp Med. 2019; 247(2): 75-86. doi: 10.1620/tjem.247.75.
- Hasegawa S, Ikesue H, Satake R, Inoue M, et al. Osteonecrosis of the Jaw Caused by Denosumab in Treatment-Naive and Pre-Treatment with Zoledronic Acid Groups: A Time-to-Onset Study Using the Japanese Adverse Drug Event Report (JADER) Database. Drugs Real World Outcomes. 2022; 9(4): 659-665. doi: 10.1007/s40801-022-00324-4.
- Власов Т.Д., Нестерович И.И., Шиманьски Д.А. Эндотелиальная дисфункция: от частного к общему. Возврат к «старой парадигме»?// Регионарное кровообращение и микроциркуляция. — 2019. — №1-8(2). — С.19-27. [Vlasov TD, Nesterovich II, Shimansky DA. Endothelial dysfunction: from the particular to the general. Return to the «Old Paradigm»? Regional blood circulation and microcirculation. 2019; 18(2): 19-27. (In Russ.)] doi: 10.24884/1682-6655-2019-18-2-19-27.
- Клинические рекомендации по применению остеомодифицирующих агентов у пациентов с метастазами в кости злокачественных опухолей. Ассоциация онкологов России. М., 2014. — 6 с. [Clinical guidelines for the use of bone-modifying agents in patients with bone metastases from malignant tumors. Association of Oncologists of Russia. М., 2014. — 6 р. (In Russ.)]
- Ruggiero SL; Dodson TB; Fantasia J, et al. American Association of Oral and Maxillofacial Surgeons position paper on medication-related osteonecrosis of the jaw. 2014 update. J. Oral Maxillofac. Surg. 2014; 72: 1938-1956. doi: 10.1016/j.joms.2014.04.031.
- Мельник А.А. Д-димер как маркер тромбообразования и его применение в клинической практике // Медицинская газета Здоровье Украины 21 века. — 2017. — №24(421). — С.23-24. [Mel'nik A.A. D-dimer as a marker of thrombosis and its application in clinical practice. Medicinckaja gazeta Zdorov'eUkraini 21 veka. 2017; 24(421): 23-24. (In Russ.)]
- Андреева О.В., Семенов Н.Н., Щекочихин Д.Ю. и др. Частота эндотелиальной дисфункции и повышения жесткости сосудов у больных солидными злокачественными новообразованиями // Альманах клинической медицины. — 2022. — №50(2). — С.103-110. [Andreeva OV, Semenov NN, Shchekochikhin DYu, et al. Prevalence of endothelial dysfunction and increased vascular stiffness in patients with solid malignancies. Almanac of Clinical Medicine. 2022; 50(2): 103-110. (In Russ.)] doi: 10.18786/2072-0505-2022-50-022.
- Пизов Н.А., Пизов А.В., Скачкова О.А., Пизова Н.В. Эндотелиальная функция в норме и при патологии // Медицинский совет. — 2019. — №6. — С.154-159. [Pizov AA, Pizov AV, Skachkova OA, Pizova NV. Endothelial function in normal and pathological conditions. Meditsinsky Sovet. 2019; 6: 154-159. (In Russ.)] doi: 10.21518/2079-701X-2019-6-154-159.
- Zotova N, Zhuravleva Y, Chereshnev V, Gusev E. Acute and Chronic Systemic Inflammation: Features and Differences in the Pathogenesis, and Integral Criteria for Verification and Differentiation. International Journal of Molecular Sciences. 2023; 24(2): 1144. doi: 10.3390/ijms24021144.
- Gusev E, Zhuravleva Yu. Inflammation: A New Look at an Old Problem. Int. J. Mol. Sci. 2022, 23(9), 4596. doi: 10.3390/ijms23094596 (In Russ.)]
- Виноградова Н.Г., Харитонова М.П., Львов К.В. Микроциркуляторные нарушения слизистой оболочки альвеолярных отростков у пациентов с медикаментозноассоциированным остеонекрозом челюсти // Проблемы стоматологии. — 2022. — №.1. — С.92-98. [Vinogradova NG, Haritonova MP, Lvov KV. Microcirculatory disorders of alveolar process mucosa in patients with drug-associated osteonecrosis of the jaw. Actual problems in dentistry. 2022; 1: 92-98. (In Russ.)] doi: 10.18481/ 2077-7566-22-18-1 -92-98.


