Действие электрического поля на клеточные суспензии по данным потенциометрических измерений
Автор: Варехов А.Г.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Приборостроение для биологии и медицины
Статья в выпуске: 2 т.29, 2019 года.
Бесплатный доступ
В статье представлены результаты измерений, показывающие, что прямая потенциометрия с использованием липофильных индикаторных ионов (тетрафенилфосфоний) может быть использована как чувствительный инструмент для исследования энергетического состояния клеток. Показано, что воздействие микросекундных электрических импульсов высокой напряженности на аэробные клетки B.subtilis изменяет потенциальный профиль клеточной периферии, т.е. прежде всего трансмембранный и поверхностный потенциалы клеток. С физической точки зрения анализ воздействия основан на механизме поляризации клеток как индуцированном дрейфе свободного ионного заряда, который соответствует экстремально большим значениям - диэлектрической проницаемости и поглощенной энергии. Определены значения напряженности поля и времени воздействия, обеспечивающие инактивацию клеток.
Высоковольтные импульсы, бактериальные клетки, поляризация, тетрафенилфосфоний, потенциометрия
Короткий адрес: https://sciup.org/142218218
IDR: 142218218 | УДК: 577;576.3;537.364 | DOI: 10.18358/np-29-2-i1221
Текст научной статьи Действие электрического поля на клеточные суспензии по данным потенциометрических измерений
Действие электрического поля на клетки, взвешенные в водных средах, широко используется теоретически при изучении клеточной периферии мембранных структур, но также и практически для инактивации клеточных составляющих водных сред [1]. Акцепторами электрических воздействий чаще всего являются мембранные структуры, т.е. сложные многофункциональные агрегаты сопрягающих мембран, выполняющие функции окислительного фосфорилирования. Хорошо известны методы и приемы изучения влияния химических агентов, действие которых сводится как к ингибированию дыхания и фосфорилирования, так и к разобщению обоих этих процессов. Например, типичными разобщителями являются слабая липофильная кислота 2,4-динитрофенол, а также некоторые ионофорные антибиотики (грамицидин и валиномицин), которые угнетают фосфорилирование, но не подавляют дыхание. Другие антибиотики (олигомицин, флорицин, рутамицин) подавляют и перенос электронов, и фосфорилирование. Более жестко действуют дыхательные яды (цианиды, ротенон, азиды и окись углерода). Напротив, глюкоза и продукты ее биологического окисления (сукцинат и др.) способствуют энергизации клеток, увеличивая трансмембранный потенциал. Использование индикаторных липофильных ионов (например, катионов тетрафенилфосфония ТФФ+), несущих делокализованный электрический заряд и обладающих сродством к липидному содержимому клеточной периферии, хорошо отражает энергетическое состояние клетки. Таким образом, потенциометрические измерения с использованием таких индикаторных ионов на водных суспензиях бактериальных клеток и в особенности дышащих клеток, дающие экспериментальные результаты непосредственно в величинах электрической разности потенциалов, являются наилучшим способом наблюдения над жизненными процессами в клеточных популяциях.
В последнее время появилось огромное количество экспериментальных работ по электропорации (electroporation) клеточных мембран. Взрывное образование мембранных пор при действии коротких импульсов высокой напряженности и электротаксис рассматриваются как способы инъекции генов и антираковых лекарственных средств, удаления (абляции) раковых клеток и тканей при необратимой электропорации, внутрикожной доставки плазмидов, инициации апоптоза даже в присутствии апоптических ингибиторов [2, 3]. При действии коротких импульсов длительностью до 1 мкс и при напряженности электрического поля не более 10–20 кВ·см–1 сохраняется жизнеспособность клеток, но при более высоких значениях напряженности начинается их гибель. Для относительно длинных импульсов (более 1 мс) характерно выживание (survival), т.е. ограничение жизненных функций клеток при напряженности поля 0.1– 1 кВ·см–1 и далее — некроз при напряженности выше 3–4 кВ·см–1. Диапазон длительности импульса поля от 1 до 100 мкс при напряженности поля от 0.1 до 100 кВ·см–1 считается относительно неисследованным (relatively unexplored) [2].
КЛЕТКИ В ЭЛЕКТРИЧЕСКОМ ПОЛЕ
Рассмотрим концентрирующее действие клеток, взвешенных в водной среде, на силовые линии электрического поля. Такое действие связано, во-первых, с тем, что частицы концентрируют противоионы из раствора, так что в двойном электрическом слое у поверхности их концентрация становится значительно выше макроскопической. Это, во-вторых, связано с концентрацией на поверхности ионов H + ; например, для границы раздела "жирная кислота—вода", какой в первом приближении можно считать клеточную поверхность, величина градиента pH составляет pH b - pH s = 2 (pHb,pHs— объемное (bulk) и поверхностное (surface) значения) [ 4 ] . Кроме того, дыхание клеток приводит к обогащению приповерхностного слоя ионами H + . Для очень концентрированных клеточных суспензий (например, препаратов тканей), а также для суспензий микроорганизмов уже давно получены [ 5 ] очень высокие значения диэлектрической проницаемости ε = = 2·103–104, измеренные на частотах с периодом колебаний 3–30 мкс, т.е. в области времени, характерного для импульсного электрического воздействия. Эти результаты объяснялись способностью частиц концентрировать ионы H + , причем тем сильнее, чем ниже значение рН. Еще раньше аналогичные результаты, т.е. очень высокие значения диэлектрической проницаемости, были получены на неорганических суспензиях каолина [ 6 ] . Поляризационные процессы на поверхности частиц определяются не только диполями компонентов клеточной периферии и растворителя (воды), но и смещением или, точнее, индуцированным дрейфом адсорбированных ионов в электрическом поле. Такие ионы делят [ 7 ] на специфически адсорбированные при наличии химического сродства их к поверхности и неспецифически адсорбированные, взаимодействующие с поверхностью посредством электростатических сил. Оба типа определяют плотную и относительно рыхлую части штерновского двойного слоя.
Напротив, диэлектрическая проницаемость сильно структурированной воды на поверхности частиц может быть гораздо меньшей по сравнению со свободной водой. Известно, например [ 8 ] , что слои воды толщиной 0.1 мкм, заключенные между пластинками слюды, т.е. высокоомного диэлектрика, имели при температуре 8 ºС на частоте
20 кГц диэлектрическую проницаемость, равную 8. При уменьшении толщины до 0.07 мкм диэлектрическая проницаемость уменьшалась до 4–5, т.е. до значения, соответствующего льду при температуре –5 °С. Структурирование воды на поверхности слюды определяется сильным адсорбционным электрическим полем (1010 B·м–1), тогда как электрическое поле у поверхности клетки значительно слабее (106–107 В·м–1).
Максимальная плотность отрицательного поверхностного заряда для модельного липидного бислоя на основе фосфатидилсерина оценивалась [ 9 ] величиной о max = 0.23 Кл ■ м - 2. В других измерениях [ 10 ] для бактериальных клеток B.subtilis было получено значение о = 0.07 Кл ■ м - 2. Определена также площадь на один центр связывания, равная 15×15 å. Это соответствует числу мест связывания одновалентных катионов на пептидогликане наружной поверхности клетки B.subtilis , примерно равному 107–108. Используем далее эти значения для расчета энергии, поглощенной частицей (клеткой) при действии электрического поля.
Отметим также, что на диэлектрическую жидкость, не содержащую свободных зарядов, в электрическом поле действует сила Гельмгольца с объемной плотностью
F = - ( 1/2 ) s 0 E 2 grad s +
+ ( 1/2 ) s 0 grad [ E 2 p ( d S d p ) T ]
( ρ — плотность диэлектрика). Эта сила действует и на границе "клетка—среда", где первое слагаемое определяет силу натяжения клеточной мембраны, а второе слагаемое отражает появление электрострикционной силы [ 11 ] . Детальное исследование пондеромоторных сил, действующих на границах биологического материала и определяющих деструктивные процессы и в том числе образование мембранных пор в этом материале, представляет большие трудности. Ограничимся здесь только расчетом напряженности поля у поверхности клетки, которая определяет величину электростатической энергии, затрачиваемой на поляризацию. Для расчета запишем сначала выражение для радиальной составляющей напряженности поля около сферической частицы радиуса a [ 12 ] :
Er(r,9) = -E0 cos9 -2E0 a-cos9, r3
так что при r = a и 9 = 0 получаем Er = -3E0. Обозначим теперь W0 — энергию поля E0 в объеме, занятом частицей, и W1 — ту же энергию плюс некоторую энергию, затрачиваемую на деформа- цию поля около частицы. Разницу W - W0 можно выразить в форме эквивалентного увеличения объема области действия поля, т.е. путем введения эквивалентного радиуса req > a. Эквивалентную энергию поля в таком сферическом объеме запишем, исходя из фундаментального соотношения [12] для плотности энергии w = = (12) D - E = (12) 80εE2 , т.е. в виде формулы W =(12)808E0 (4/3)ПГ^, в которой радиус /'q определяется интегрированием:
r eq
^ П 2 3 ^
= а 1 +---[ [ ^3-cos 6drd6
( a к 0 0 r )
,2 I
= а I 1 +— I .
I к /
Коэффициент kE = W/W 0, учитывающий концентрирующее действие поляризующихся частиц, получается равным kE = ( 1 + 2/ к ) 3 = 4.38 .
Для палочкообразных бактериальных клеток B.subtilis , используемых в настоящей работе и аппроксимируемых эллипсоидами вращения, энергия W 1 записывается выражением:
W = 808E 0 2 kEV
1 0 0 E 1
cos 6 Sin 6
-+—
I X 1 X 2
где коэффициенты формы χ 1 и χ 2 являются функциями отношения β большой и малой полуосей эллипсоида, V 1 — геометрический объем одной клетки. Для B.subtilis имеем [ 13 ] при в = 3.33 значения Х 1 = 0.1, X 2 = 0.45 • Отметим, во-первых, что ориентирующее действие электрического поля незначительно ввиду кратковременности его действия, и, во-вторых, что время нахождения клетки в экспериментальной кювете достаточно велико. Более строгий расчет показывает, что предельная ориентация частиц благодаря броуновскому вращению устанавливается уже через 1–2 с. В кювете с перемешиванием целесообразно принять равновероятное распределение ориентации . Тог да средние значения оказываются равными sin2 6 = 2/3 и cos2 6 = 1/3, а выражение для поляризационной энергии принимает вид W = 10.5 808E 0 2 V , откуда следует, что эффективное значение напряженности поля у поверхности частицы составляет примерно 2.3 Е 0 .
Если использовать, как было отмечено выше, очень высокое значение измеренной экспериментально диэлектрической проницаемости, например 8 = 2 -103, то расчет поляризационной энергии частицы (клетки) радиуса а = 2мкм в поле мак- роскопической напряженности 4 кВ·см–1 дает значение 2 -10-13 Дж. Это значение достаточно близко соответствует, например, энергии инактивации клетки E.coli в электромагнитном поле, оцениваемой [5, 14] в 1.4-10-12Дж. С другой стороны, если рассматривать клетку B.subtilis, несущую свободный поверхностный заряд плотности с = 0.07Кл - м-2, как эквивалентный диполь, то энергия такого диполя в электрическом поле напряженности 10кВ - см-1 составит приблизительно 2 -10-12 Дж. Сопоставимость полученных значений позволяет считать обоснованным рассмотренный механизм поляризации как результат индуцированного дрейфа и перераспределения свободного заряда на поверхности частицы.
МАТЕРИАЛЫ И МЕТОДЫ
Для измерений потенциалов клеток использовался стабильный потенциометрический электрод, селективный по отношению к ионообменному комплексу тетрафенилфосфоний—тетрафенил-борат ( ТФФ+—ТФБ ) [ 10 ] . Зависимость электродного потенциала от концентрации ТФФ + в инкубационной среде показана на рис. 1, из которого следует, что крутизна измерительной характеристики на ее линейном участке составляла около 56 мВ/1 ед. при десятикратном изменении концентрации катионов тетрафенилфосфония в инкубационной среде.
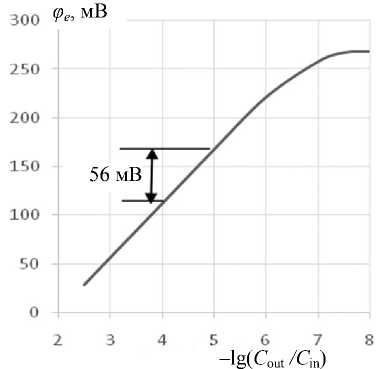
Рис. 1. Электродный потенциал в функции концентрации ТФФ +( С out ) в инкубационной среде.
Концентрация ТФФ +( С in ) во внутреннем растворе электрода 10 - 2М
Отметим, что идеальному (нернстовскому) электроду при температуре Т = 298 К соответствует крутизна 59.2 мВ/1 ед. Таким образом, электрод являлся почти нернстовским. Отмечалось старение электродов и незначительное уменьшение крутизны концентрационной характеристики.
Дифференциальное внутреннее сопротивление электрода определялось графоаналитически на основе вольт-амперной характеристики электрода, полученной при изменении концентрации ТФФ + в инкубационной среде в пределах от 4 • 10 - 7 до 2 * 10 - 3М. При этом электродный потенциал изменялся в пределах от –90 до +50 мВ, а ток электрода — в пределах от –0.25·10–8 до +0.15·10–8 А. Внутреннее сопротивление электрода было равно приблизительно 30 МОм и почти не зависело от концентрации ТФФ + , что являлось существенным метрологическим преимуществом.
Изменения электродного потенциала в зависимости от значений pH инкубационной среды, содержащей интактные клетки B.subtilis , показаны на рис. 2. Эти изменения в пределах pH5 ^ 8 не превосходили 2 мВ и могли быть технически скомпенсированы. Отмечалось [ 15 ] также, что зависимость электродного потенциала от значения pH объясняется не чувствительностью электрода к концентрации протонов, а влиянием pH на константу диссоциации используемой соли ( TPPBr ).
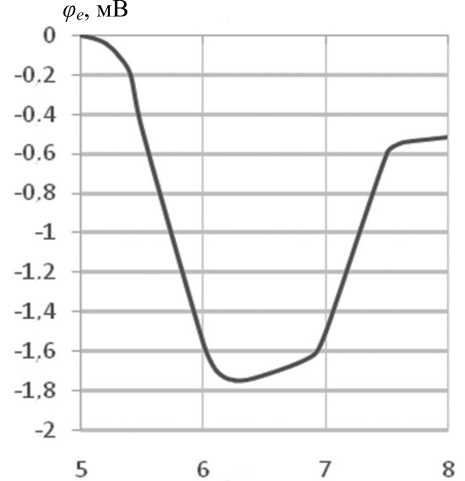
pH
Рис. 2. Изменения электродного потенциала в зависимости от pH инкубационной среды
Экспериментально там же показано, что в относительно кислой среде pH 5 трансмембранный потенциал клеток и связывание ТФФ + с поверхностью клеток минимальны. Связывание максимально в инкубационной среде с pH 6 ^ 7 , но быстро уменьшается при небольших щелочных зна-ченияхpH7.5 ^ 8.0. Максимум трансмембранного потенциала, а также и максимум трансмембранного градиента A pH достигались [ 15 ] при pH 8 ^ 9, что хорошо согласуется с хемиосмотическими параметрами, т.е. с разностью A pH 3.5. Если для инкубационной среды принять значение pH 8.5 , то цитоплазматическое значение должно быть равным pH 5.0, что как раз соответствует [ 15 ] максимуму трансмембранного потенциала, т.е. активному дыханию. Таким образом, в целом максимум связывания не соответствует максимуму дыхательной активности клетки. Возможно, это объясняется особенностями дыхательной цепи B.subtilis , например ингибированием клеточного дыхания от сукцината при разобщении и наличием нескольких молекулярных центров деэнергизации менахиноноксидоредуктазы [ 16 ] . Известно и то, что при высоких щелочных значениях pH угнетается жизнедеятельность дышащих клеток, например дрожжевых, и понижается трансмембранный потенциал. По-видимому, остается считать, что способность клеток связывать липофильные катионы ТФФ + , максимальная для нейтральных значений pH, не определяется однозначно величиной трансмембранного потенциала.
Для экспериментов использовалась двухкамерная термостатированная измерительная ячейка с перемешиванием, содержащая камеру для экспонирования клеточной суспензии в импульсном электрическом поле и измерительную камеру. Обе камеры соединялись отрезком эластичной трубки с встроенным гидравлическим затвором, управляемым электромагнитом. При соединении в измерительную камеру под действием разности гидростатических давлений перетекало 0.5 мл обработанной в электрическом поле суспензии клеток. Камера для экспонирования объемом около 0.5 мл была выполнена в двух вариантах. В первом — в виде двух платиновых проволок диаметром 0.8 мм, впаянных в стекло, с полусферическими окончаниями, располагающимися друг против друга на расстоянии 1 мм. Во втором — в виде плоского конденсатора, т.е. двух платиновых пластин диаметром 22 мм с расстоянием между ними 1 мм.
В измерительной камере объемом 4.5 мл располагался ТФФ+-селективный мембранный электрод, заполненный раствором ТФФ+ в кон- центрации 10–2 М с погруженным в него хлорсеребряным электродом сравнения. Второй электрод сравнения соединялся с инкубационной средой с помощью электролитического ключа на основе насыщенного раствора KCl. Электрометрический вольтметр включался между обоими электродами сравнения. Вся ячейка была заключена в стальной экран для устранения помех различного происхождения.
Методика культивирования клеток [15]
Объектом исследований были бактериальные клетки B.subtilis штамм T2 ( trp ) , эффективно связывающие синтетические жирорастворимые катионы ТФФ + .
Клетки выращивали на агаризованном бульоне Хотингера в течение 12–14 ч после высевания в термостате при 37 °C. Затем клетки смывали обогащенной триптофаном средой Шпицайзена и выращивали на качалке в течение 4 ч. Затем бактериальную суспензию разводили в 10 раз минимальной (по содержанию триптофана) средой Шпицайзена и инкубировали в тех же условиях дополнительно 1.5 ч. Далее клетки осаждали центрифугированием и 2 раза промывали охлажденным буфером Tris H2SO4 pH 7.0 , после чего ресуспендировали в объеме 3 мл того же буфера. Для расчетов концентрации клеток использовалась градуировочная почти линейная зависимость оптической плотности суспензии от концентрации клеток, пересчитанной в сухой вес. Измеренное содержание внутриклеточной воды для B.subtilis составляло 2 мкл в расчете на 1 мг сухого веса клеток [ 15 ] .
Генерация высоковольтных импульсов
Исследовалось воздействие на клетки быстрозатухающего почти гармонического импульсного сигнала (всплеск, или wavelet) длительности около 5 мкс. Высоковольтный импульс формировался на вторичной обмотке высококачественного импульсного трансформатора. Источником электрической энергии была накопительная емкость величиной 0.25 мкФ. Ключевой тиристор с временем переключения < 0.4 мкс замыкался фронтом импульса задающего генератора, после чего накопительная емкость разряжалась через 4 витка первичной обмотки трансформатора с индуктивностью 2.1·10–6 Гн. Расчетная энергия разрядного контура составляла 2.25·10–2 Дж. Максимальная частота импульсов напряжения не превышала 50 Гц, что соответствовало паузе между воздействующими импульсами, равной 20 мс. Время воздействия могло изменяться в пределах от 1 до 100 с шагом в 1 с. Таким образом, максимальное число импульсов было равным 5·103.
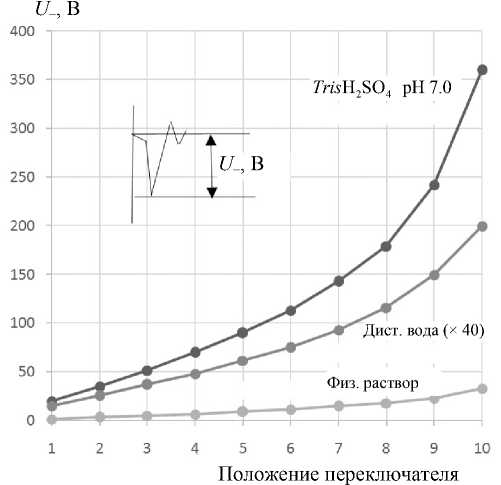
Рис. 3. Амплитуда электрического импульса в ячейке с буферным раствором Tris H2SO4 pH 7.0 , дистиллированной водой и физиологическим раствором.
Для дистиллированной воды значения U - необходимо умножить на 40
На рис. 3 показан характер ступенчатого возрастания десятью дискретными ступенями напряжения на электродах жидкостной ячейки с плоскими платиновыми электродами и расстоянием 1 мм между ними, заполненной буферным раствором Tris H 2 SO 4 pH 7.0 концентрации 0.0016 М, дистиллированной водой и физиологическим раствором 0.154 М NaCl.
Для физиологического раствора максимальное напряжение не превосходило 30 B, а напряженность поля — 300 В см–1. Для среды на основе буфера Tris H 2 SO 4 максимум напряженности поля был равен примерно 3.6 кВ см–1, а эффективная напряженность поля — примерно 2.3 х 3.6 = = 8.3кВ ■ см - 1. Для сравнения: максимальная напряженность поля для дистиллированной воды составляла 80 кВ см–1. Электрический пробой разрядного промежутка был исключен во всех случаях, включая дистиллированную воду с импульсной проводимостью 5.5·10–3 Ом–1м–1.
Калибровка измерительного электрода
Для калибровки электрода в исходном состоянии в инкубационную среду вносилось небольшое избыточное количество ТФФ + (1-я добавка); затем в среду вносились интактные, т.е. несущие транс-
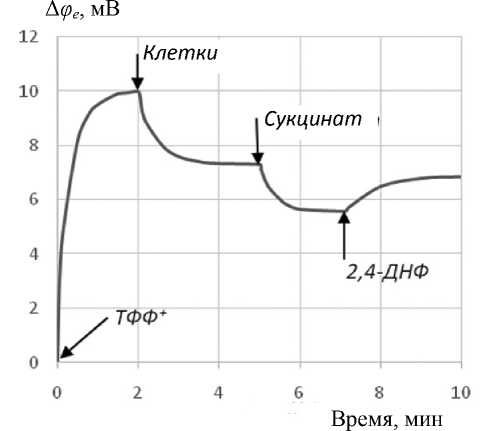
Рис. 4. Изменения электродного потенциала в ходе операций калибровки: добавления ТФФ + , внесения клеток, энергизующей добавки (сукцинат) и разобщителя (динитрофенол)
Калибровка измерительного электрода
|
Добавки |
Добавляемый агент |
Концентрация |
Объем, мл |
|
1 |
ТФФ + (калибровка) |
10–5 М |
0.05 |
|
2 |
Интактные клетки B.subtilis |
0.061 мг мл–1 по сухому весу |
0.3 |
|
3 |
Сукцинат |
7.76·10–3 М |
0.4 |
|
4 |
2,4-динитрофенол |
10–5 М |
0.5 |
мембранный потенциал Афт = -175 мВ [ 15 ] , клетки B.subtilis (2-я добавка); после относительно короткого переходного процесса связывания клетками индикаторных ионов добавлялся (3-я добавка) сукцинат (аммониевая соль янтарной кислоты), что приводило к связыванию дополнительного количества ТФФ + ; наконец, добавлялся (4-я добавка) разобщитель окислительного фосфорилирования 2,4-динитрофенол, что приводило к частичной потере клетками поглощенного ТФФ + . Для наглядности эти экспериментальные процедуры представлены в виде таблицы.
Рис. 4 показывает изменения электродного потенциала в результате выполнения последовательных шагов калибровки. Низкая концентрация ин-
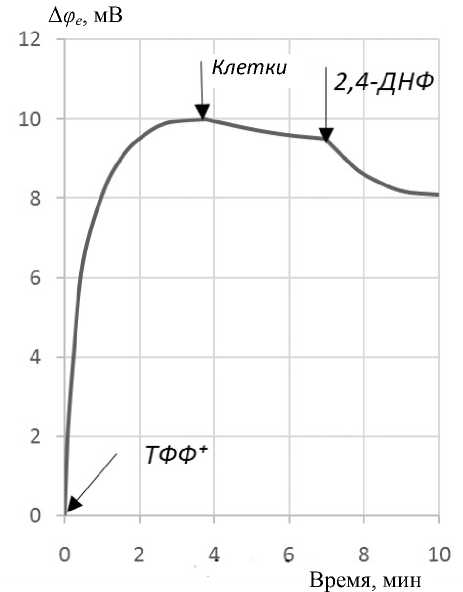
Рис. 5. Изменения электродного потенциала, показывающие кинетику связывания индикаторных катионов клетками, обработанными в электрическом поле умеренной напряженности, и действие на клетки разобщителя ДНФ дикаторных ионов (10–5 М) необходима с принципиальной точки зрения и связана с тем, что результат связывания индикаторных ионов с поверхностью клеток определяется концентрацией мест связывания. Таким образом, избыток ионов у поверхности клеток и, следовательно, избыточный положительный объемный заряд приводил бы к блокированию мест связывания и к искажению результатов. Активация дыхания сукцинатом увеличивала связывание, а действие разобщителя приводило, по крайней мере частично, к ингибированию дыхания.
РЕЗУЛЬТАТЫ ИЗМЕРЕНИЙ
На рис. 5 показан характер изменения электродного потенциала при добавлении после градуировки в инкубационную среду на основе Tris H2SO4 pH 7.0 клеток, экспонированных в той же среде в электрическом поле напряженностей 170, 270, 420, 550, 720 В·см–1, а затем 2,4-динитрофенола. С точностью до небольшого разброса все пять зависимостей хорошо укладываются на кривой, показанной на рис. 5, откуда следует, во-первых, что способность связывать индикаторные катионы ТФФ+ клетками, экспонированными в электрическом поле относительно низкой напряженности, резко уменьшается по сравнению с неэкспонированными клетками. Во-вторых, действие на экспонированные в электрическим поле клетки разобщителя (2,4-ДНФ) проявляется противоположно по сравнению с его действием на интактные клетки (рис. 4). Оба эффекта могут объясняться следующим образом. Уменьшение связывания следует понимать как следствие де-энергизации клетки и уменьшения отрицательного заряда поверхности. Действие разобщителя, обратное тому, какое он оказывает на физиологически активные клетки, объясняется, вероятно, изменением свойств измерительного ТФФ+ -се-лективного электрода. Действительно, процесс измерения связан с протеканием в стекловолокнистой матрице электрода слабого (1–3 нА) тока катионов ТФФ+ .
Уменьшение отрицательного заряда клеточной поверхности способствует сорбции клеток на наружной поверхности измерительного электрода, обращенной в инкубационную среду. Это эквивалентно уменьшению концентрации ТФФ+ вблизи поверхности электрода и увеличению его отрицательного потенциала, т.е. потенциала внутреннего электрода сравнения по отношению к нулевому потенциалу среды. Динитрофенол действует в том же направлении, т.е. еще более уменьшает заряд поверхности. Уменьшение отрицательного заряда поверхности клеток и увеличение адсорбции клеток на поверхности электрода, вероятно, блокирует анионные комплексы в каналах электродного мембранного матрикса, что делает их недоступными для катионов ТФФ+ инкубационной среды.
На рис. 6 показан характер изменения элек-
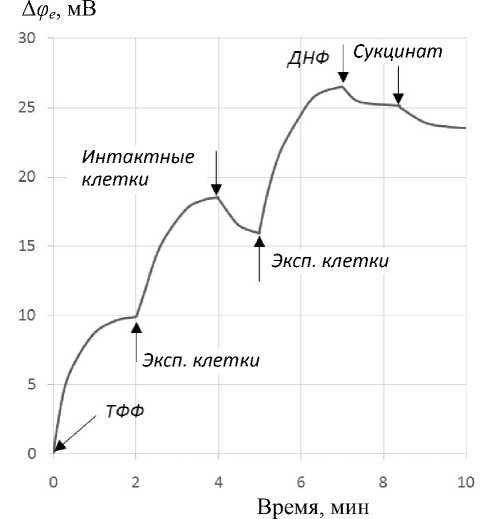
Рис. 6. Изменения электродного потенциала, показывающие действие поля высокой напряженности (8.3 кВ·см –1 )
тродного потенциала при добавлении клеток, подвергнутых действию наибольшего по напряженности 3.6 кВ см–1 однородного электрического поля. Как уже отмечалось во вводной части, эффективное значение напряженности поля на поверхности клетки составляет приблизительно 2.3 х 3.6 = = 8.3 кВ • см - 1 . По сравнению с рис. 5 наблюдаются существенные изменения. Добавление 1 мл экспонированных клеток не уменьшает (по сравнению с калибровкой на рис. 4), а увеличивает электродный потенциал, что говорит об отсутствии связывания индикаторных катионов, но не объясняет большого (8 мВ) положительного приращения электродного потенциала. По всей вероятности, уменьшение отрицательного потенциала поверхности клеток, большее по сравнению с действием поля меньшей напряженности, приводит к значительной адсорбции клеток на поверхности измерительного электрода и образованию на этой поверхности двойного электронного слоя. При этом наружная поверхность клеток, контактирующих с водой, по-прежнему отрицательна. Если считать для среды на основе Tris H2SO4 pH 7.0 , что заря-добразующими ионами электродной поверхности будут анионыSO 4 - , то такая адсорбция эквивалентна генерации на наружной поверхности электрода разности потенциалов, вычитающейся из
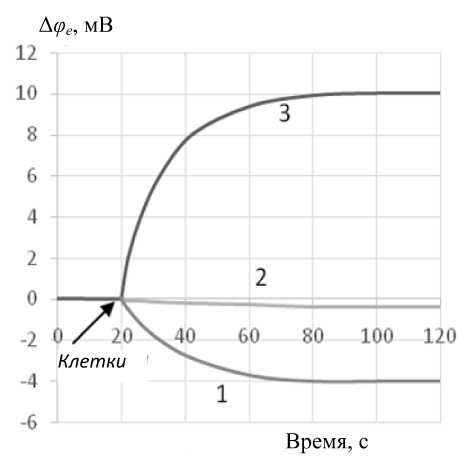
Рис. 7. Изменения электродного потенциала при связывании индикаторных катионов интактными клетками (1); клетками, обработанными в поле умеренной (200÷700В×см - 1 ) напряженности (2) и высокой (8.3кВ×см - 1) напряженности (3)
электродного потенциала, что и уменьшает отрицательный электродный потенциал. Добавление небольшого объема (0.2 мл) интактных клеток и изменение электродного потенциала указывает на связывание индикаторных катионов на отрицательно заряженной клеточной поверхности. Еще одно добавление экспонированных клеток в объеме 0.08 мл той же концентрации продолжает процесс пассивной адсорбции клеток на поверхности электрода.
На рис. 7 показаны для наглядности установившиеся значения изменений электродного потенциала, полученные в экспериментах с интактными клетками (1), а также в экспериментах с клетками, подвергнyтыми действию умеренных (2) по напряженности электрических полей и максимальному (3) для данной серии опытов полю. Эти различия отчетливо выражены.
Напряженность поля, равная примерно 500 В·см–1, может рассматриваться как пороговое значение, а длительность переходного процесса можно оценить значением 60 с.
ВЫВОДЫ
Произведена оценка напряженности электрического поля, соответствующей развитию про- цессов подавления жизнеспособности клеток B.subtilis. Показано, что потенциометрические измерения достаточно ясно и однозначно отражают физиологические параметры бактериальных клеток с дыхательном типом энергетики, прямо или косвенно связанные с трансмембранным и поверхностным потенциалами клеток. Определены важные с практической точки зрения значения напряженности поля и временные параметры электрополевых воздействий, обеспечивающие инактивацию клеток.
Список литературы Действие электрического поля на клеточные суспензии по данным потенциометрических измерений
- Vanegas-Acosta J.C. Electric fields and biological cells: numerical insight into possible interaction mechanisms. Techn. Univ. Eindhoven, 2015. 336 p. URL: https://pure.tue.nl/ws/files/10243383/20151217_CO_Vanegas.pdf
- Weaver J.C., Smith K.C., Esser A.T., Son R.S., Gowrishankar T.R. A brief overview of electroporation pulse strength-duration space: a region where additional intracellular effects are expected//Bioelectrochemistry. 2012. Vol. 87. P. 236-243 DOI: 10.1016/j.bioelechem.2012.02.007
- Hofmann F., Ohnimus H., Scheller C., Strupp W., Zimmermann U., Jassoy C. Electric field pulses can induce apoptosis//J. Membrane Biol. 1999. Vol. 169, is. 2. P. 103-109 DOI: 10.1007/s002329900
- Weiss L. The cell periphery//Int. Rev. Cytol. 1970. Vol. 26. P. 63-105.
- Schwan H.P. Electrical properties of tissue and cell suspensions//Biol. and Med. Phys. 1957. Vol. 5. P. 147-209 DOI: 10.1016/B978-1-4832-3111-2.50008-0
- Fricke H., Curtis H.J. The dielectric constant and resistance of colloidal solutions//Physical review journals archive. 1935. Vol. 47, is. 12. P. 974-975.
- Казарян М.А., Ломов И.В., Шаманин И.В. Электрофизика структурированных растворов солей в жидких полярных диэлектриках. М.: Физматлит, 2011. 192 c.
- Мецик М.С. Свойства водных плеток между пластинками слюды//Поверхностные силы в тонких пленках и дисперсных системах. Сб. докладов IV конференции по поверхностным силам. М.: Наука, 1972. С.189-193.
- Ермаков Ю.А. Биоэлектрохимия бислойных липидных мембран//Российский химический журнал. 2005. Т. 49, № 5. C. 114-120.
- Варехов А.Г. Потенциометрические измерения трансмембранного потенциала клеток с использованием проникающих ионов//Научное приборостроение. 2015. T. 25, № 1. C. 27-35. URL: http://iairas.ru/mag/2015/abst1.php#abst3
- Куперштох А.Л., Медведев Д.А. Электрострикционные механизмы зарождения электрического пробоя жидких диэлектриков в сильных электрических полях//Научный вестник НГТУ СО РАН. 2014. T. 54, № 1. C. 103-113.
- Тамм И.Е. Основы теории электричества. М.: Физматлит, 2003. 616 с.
- Краткий определитель бактерий Берги/Под ред. Дж. Хоулта. М.: Мир, 1980. 495 с.
- Стейси Р., Уильямс Д., Уорден Р., МакМоррис Р. Основы биологической и медицинской физики. М.: Изд-во иностр. лит., 1959. 608 с.
- Гринюс Л.Л., Даугелавичюс Р.Ю., Алькимавичюс Г.А. Исследование мембранного потенциала клеток Bacillussubtilis и Escherichia Coli методом проникающих ионов//Биохимия. 1980. T. 45, № 9. C. 1609-1618.
- Ацаркина Н.В. Особенности функционирования дыхательной цепи Bacillussubtilis. Автореф. дис. … канд. биол. наук. М.: МГУ им. М.В. Ломоносова, 2010. 200 с.


