Действие наночастиц Al2O3 на почвенный микробиоценоз, состояние антиоксидантной системы и микрофлору кишечника красного калифорнийского червя (Eisenia fоetida)
Автор: Яушева Е.В., Сизова Е.А., Гавриш И.А., Лебедев С.В., Каюмов Ф.Г.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Биоэффекты металлов и их форм
Статья в выпуске: 1 т.52, 2017 года.
Бесплатный доступ
Обсуждение возможности применения наноматериалов в агротехнологиях ограничивается тем, что число работ по комплексной оценке биологических рисков при использовании наногербецидов и наноудобрений и изучению воздействия наноматериалов, в частности наночастиц (НЧ) металлов, на почвобионтов невелико. Мы сравнили влияние наночастиц Al2O3 на микрофлору почвы и кишечника красного калифорнийского червя ( Eisenia fоetida ), адаптационные способности этого почвобионта и особенности вермикомпостирования. Предварительный анализ биологической активности НЧ Al2O3 in vitro проводили в тесте ингибирования бактериальной биолюминесценции. Из особей используемого биоиндикаторного вида, имеющих одинаковую массу, сформировали пять групп (в каждой n = 10). При культивировании в I, II, III и IV группах в субстрат добавляли НЧ Al2O3 в дозах соответственно 50, 100, 300, 3000 мг/кг; V группа служила контролем (НЧ в почву не вносили). На 14-е сут определяли антиоксидантную активность каталазы (КТ), супероксиддисмутазы (СОД) и оценивали численность микрофлоры кишечника червей, а также численность микробов в почве. Для определения общей численности микроорганизмов проводили посев на мясо-пептонный агар. Микроорганизмы, использующие минеральные формы азота, выделяли на крахмал-аммиачном агаре (КАА), микроскопические грибы - на среде Чапека, азотфиксаторы - на среде Эшби, целлюлозолитические микроорганизмы - на среде Гетчинсона. При максимальной дозировке вносимых в почву наночастиц оксида алюминия отмечалось увеличение смертности червей (до 20 %). В результате воздействия исследуемых наночастиц происходил рост активности СОД и КТ. При повышении содержания НЧ Al2O3 с 50 до 3000 мг/кг наблюдалось снижение общего числа микроорганизмов в почве: без вермикомпостирования - на 61,7-67,6 %, с вермикомпостированием - на 55,6-61,3 %. Количество грибов в почве в I, II, III и IV группах снизилось соответственно на 42,8; 52,4; 61,9 и 76,2 % относительно контроля; численность азотфиксирующих бактерий - на 64,3; 77,9; 78,6 и 85,7 %, число бактерий, культивируемых на КАА, - на 22,7; 38,6; 84,1 и 86,4 %. В I группе число целлюлозолитических бактерий в почве увеличилось на 6,9 %. Во II, III и IV группах, напротив, отмечали снижение их количества (на 16,7; 12,5 и 25,0 %). В кишечнике E. foetida с ростом содержания НЧ Al2O3 в грунте с 50 до 3000 г/кг также происходило снижение общего числа микроорганизмов - на 9,7-43,2 %. Численность грибов уменьшилась в I, II, III и IV группах соответственно на 18,0; 20,0; 39,0 и 40,0 % относительно контроля, количество азотфиксирующих бактерий - на 16,0; 60,0; 78,8 и 80,0 %. Число целлюлозолитических бактерий в кишечнике E. foetida увеличивалось под действием минимальных дозировок наночастиц (на 16,0 %), тогда как во II, III и IV группах оно снижалось (на 8,0; 32,0 и 40,0 %). Численность бактерий, культивируемых на КАА, уменьшалась в кишечнике особей из I, II, III и IV групп - соответственно на 13,3; 46,7; 60,0 и 73,3 %. Таким образом, имело место дозозависимое действие наночастиц и постепенное развитие бактерицидного эффекта в отношении почвенной и кишечной микрофлоры при возрастании количества НЧ Al2O3 в почве. Обнаруженное негативное влияние НЧ Al2O3 на почвенный биоценоз проявилось в его обеднении, что ведет к деградации почв и снижению их плодородия. Полученные данные подтверждают необходимость комплексной оценки биотоксичности НЧ в разных средах обитания. По показателям антиоксидантной системы установлены адаптационные способности E. fоetida на фоне внесения в почву НЧ Al2O3.
Наночастицы, eisenia fоetida, каталаза, супероксиддисмутаза, микроорганизмы
Короткий адрес: https://sciup.org/142214010
IDR: 142214010 | УДК: 631.46:574.24:546.30-022.532 | DOI: 10.15389/agrobiology.2017.1.191rus
Текст научной статьи Действие наночастиц Al2O3 на почвенный микробиоценоз, состояние антиоксидантной системы и микрофлору кишечника красного калифорнийского червя (Eisenia fоetida)
В последние годы накоплено достаточное количество работ, обосновывающих перспективы применения наноматериалов в микроэлектронике (1), энергетике (2), химической (3), пищевой (4), фармацевтической (5), медицинской промышленности (6-8). Наночастицы (НЧ) металлов имеют важное прикладное значение в сельском хозяйстве (в частности, в растениеводстве и для повышения плодородия почв), где их можно использовать
Исследования выполнены при финансовой поддержке Российского научного фонда (грант ¹ 14-36-00023).
как наногербициды (9), нанопестициды (10), в качестве стимуляторов роста растений (11) и наноудобрений (12).
Среди разнообразных наноматериалов обращают на себя внимание наночастицы алюминия и его оксидов. Известно около 250 минералов, содержащих алюминий и используемых в различных областях, в том числе в агросекторе, возможность применения которых в наноформе активно изучается в настоящее время (13, 14). Однако существует лишь ограниченное число работ по комплексной оценке биологических рисков, связанных с наночастицами алюминия (15-19).
Один из биоиндикаторных видов при определении потенциальной токсичности химических веществ в почвах (20, 21) — красный калифорнийский червь ( Eisenia fоetida ). Черви играют важную роль в круговороте веществ и формировании структуры почвы, улучшая деградацию органических субстратов, перемешивая слои почвы и усиливая аэрацию (22, 23).
В представленном исследовании, использовав красного калифорнийского червя в качестве тест-объекта, мы впервые продемонстрировали дозозависимое действие наночастиц оксида алюминия, развитие бактерицидного эффекта в отношении почвенной микрофлоры и микробиоценоза кишечника E. fоetida по мере возрастания содержания наночастиц Al2O3 в почве, а также проявление адаптационных реакций у E. fоetida .
Целью нашей работы было изучение влияния наночастиц Al2O3 на почвенный микробиоценоз, вермикомпостирование и состояние антиоксидантной системы и микрофлоры кишечника у красного калифорнийского червя.
Методика. В исследовании использовали препарат наночастиц оксида алюминия (НЧ Al2O3, ООО «Передовые порошковые технологии», Россия), полученных методом электрического взрыва проводника в атмосфере аргона. Размер наночастиц — 54 нм, Z-потенциал — 30±0,1 мВ. В состав порошка наночастиц входили: Al2O3 (95 %), сорбированные азот, углеводороды (3 %), вода (2 %). Материаловедческая аттестация препаратов включала электронную сканирующую и просвечивающую микроскопию на приборах JSM 7401F и JEM-2000FX («JEOL», Япония). Рентгенофазовый анализ выполняли на дифрактометре ДРОН-7 (НПО «Буревестник», Россия). Дзет-потенциал частиц определяли на анализаторе Photocor Compact-Z («Фотокор», Россия).
Предварительную оценку биологической активности НЧ Al2O3 in vitro проводили в тесте ингибирования бактериальной биолюминесценции. Пробы суспензий наночастиц готовили в диапазоне концентраций 0,006254,0 М, обрабатывали ультразвуком в течение 30 мин. Использовали генноинженерный люминесцирующий штамм Echerichia coli K12 TG1, конститутивно экспрессирующий гены luxCDABE морского микроорганизма Photobacterium leiongnathi 54D10 (лиофилизированный препарат Эколюм, НВО «Иммунотех», Россия). Непосредственно перед началом опытов E. coli K12 TG1 восстанавливали охлажденной дистиллированной водой, выдерживали при 2-4 °С в течение 30 мин, после чего доводили температуру бактериальной суспензии до 15-25 °С. Тест ингибирования бактериальной люминесценции проводили при помощи микропланшетного анализатора Infinite PROF200 («Tecan Group, Ltd», Швейцария), динамически регистрирующего интенсивность свечения полученных смесей в течение 180 мин с интервалом 5 мин. Результаты влияния наноматериалов на интенсивность бактериальной биолюминесценции (I) оценивали по формуле:
I = Ik 0 мин ½ Io n мин ,
Ikn мин ½ Io0 мин где Ik и Io — интенсивность свечения контрольных и опытных проб на 0-й и n-й мин измерения.
Токсичность исследовали по OECD Guidelines for the Testing of Сhemicals (ОЭСD, 1984, 2004) на лабораторных культурах дождевых червей (красный калифорнийский гибрид) Eisenia foetida Andrei Bouche. Все отобранные особи были половозрелыми. В качестве субстрата использовали искусственную почву (70 % кварцевого песка, 20 % глины, 10 % торфа). Из особей одинаковой массы сформировали группы (по n = 10). При культивировании в I, II, III и IV группах в почву добавляли НЧ Al2O3 в дозах соответственно 50, 100, 300, 3000 мг/кг; V группа служила контролем (без НЧ). НЧ вносили в субстрат перед тем, как поместить в него червей, перемешивали с помощью бытового миксера и доводили до влажности около 85 %. Одновременно инкубировали почвогрунт с НЧ Al2O3 в тех же дозировках без вермикомпостирования. Эксперимент проводился в 3 повторностях.
Антиоксидантную активность каталазы (КТ, КФ 1.11.1.6) и супе-роксиддисмутазы (СОД, КФ 1.15.1.1) у червей определяли на 14-е сут эксперимента на автоматическом биохимическом анализаторе СS-T240 («Dirui Industrial Co., Ltd», Китай) с использованием коммерческих биохимических наборов Randox («Randox», США).
Влияние НЧ на микрофлору кишечника червей и почвенную микрофлору оценивали на 14-е сут культивирования с наночастицами. Для очищение кишечника червей выдерживали в пластиковом контейнере на влажной фильтровальной бумаге в течение 1 сут, затем вскрывали сте- рильным скальпелем, отделяли кишечник и помещали в стерильную пробирку. Пробы почвы отбирали в стерильные пробирки. Микробиологические исследования образцов осуществляли в 1-е сут после отбора. Для определения общей численности микроорганизмов проводили посев на мясо-пептонный агар (МПА). Микроорганизмы, использующие минеральные формы азота, выделяли на крахмал-аммиачном агаре (КАА), микроскопические грибы — на среде Чапека, азотфиксаторы — на среде Эшби, целлюлозолитические микроорганизмы — на среде Гетчинсона (24, 25). В среду с КАА добавляли нистатин (40 мкг/мл) для предотвращения роста грибов, в среду Чапека — пенициллин (50 мкг/мл) для предотвращения бактериального роста. Повторность высева 3-кратная.
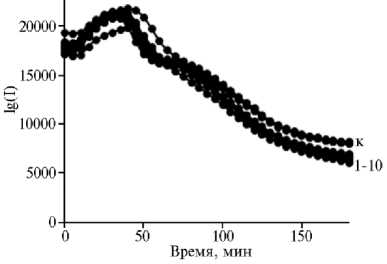
Рис. 1. Динамика свечения (I) Echerichia coli K12 TG1 с клонированными генами luxCDABE Photobacterium leiongnathi 54D10 при контакте с наночастицами Al 2 O 3 в разных концентрациях: 1 — 4,0 М, 2 — 2,0 М, 3 — 1,0 М, 4 — 0,5 М, 5 — 0,25 М, 6 — 0,1 М, 7 — 0,05 М, 8 — 0,025 М, 9 — 0,0125 М, 10 — 0,00625 М, к — контроль.
Статистический анализ данных проводили c использованием программного пакета Statistica 10.0 («StatSoft Inc.», США). Представлены средние арифметические ( M ) со стандартной ошибкой среднего ( m ).
Результаты. Контакт E. coli K12 TG1 с возрастающими концентрациями (0,00625-4,0 М) НЧ Al2O3 не вызывал подавления свечения бактерий в течение 60 мин, что позволило охарактеризовать НЧ Al2O3 как нетоксичные (рис. 1). Через 180 мин биолюминесценция снижалась на 2030 % относительно контрольных значений, что характеризовало исследуемые НЧ как слаботоксичные в отношении живых клеток. Ранее сообщалось об отсутствии цитотоксиче- ского и генотоксического влияния наночастиц соединений алюминия на живую клетку в экспериментах in vitro (26, 27). Снижение свечения бактерий при пролонгировании контакта до 180 мин предполагает наличие хронического токсического эффекта НЧ, требующего времени для развития. Подобную хроническую биотоксичность демонстрируют наночастицы других металлов (28-30).
Для оценки биотоксичности НЧ Al2O3 в отношении E. fоetida исследовали активность ферментов антиоксидантной защиты. Низкие и средние дозы (50-300 мг/кг) наночастиц вызывали манифестную индукцию активности каталазы с максимальными показателями при 300 мг/кг. Дальнейший рост нагрузки наночастицами на почвогрунт (до 3000 мг/кг) приводил к ингибированию КТ. Аналогичный результат получили H.Y. Liang с соавт. (31). В то же время только при внесении НЧ Al2O3 в количестве 3000 мг/кг величина, на которую активность КТ увеличивалась по сравне- нию с контролем, существенно отличалась от того же показателя в осталь- ных группах. Для СОД приращение активности в опыте по сравнению с контролем было примерно одинаковым при разном содержании НЧ Al2O3, то есть дозозависимого эффекта мы практически не наблюдали (рис. 2).
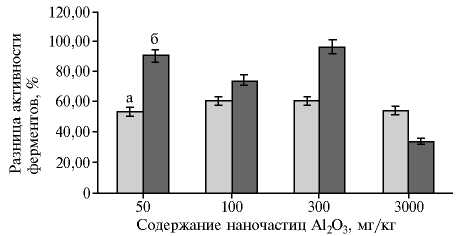
Рис. 2. Разница между активностью супероксиддисмута-зы (а) и каталазы (б) у Eisenia fоetida в контроле и опыте после 14 сут культивирования в искусственной почве с разным содержанием наночастиц Аl 2 O 3 .
Известно, что соединения алюминия способны активировать экспрессию генов СОД и КТ и, как следствие, сами ферменты (32). Неконтролируемое повышение концентрации активных форм окислителей под действием токсического агента в клетках способствовало усилению функций защитных механизмов, что служит важным элементом реакции организма на присутствие токсических дозировок вещества в окружающей среде (33).
В исследованиях W. Sun с соавт. (34) активность СОД у дождевых червей увеличивалась при умеренном экологическом стрессе и уменьшалась при тяжелой экологической напряженности. То есть НЧ алюминия обладают пролонгированным эффектом, и процесс релаксации системы (возврат к нормальному состоянию) может занять определенное время после исключения токсиканта. Действуя как первичная система антиоксидантной защиты, КТ и СОД катализируют преобразование активных форм кислорода в менее активные или инертные (35, 36). В наших опытах, как и в случае с КТ, влияние НЧ Аl2O 3 на СОД у E. foetida сопровождалось увеличением активности при повышении содержания Аl 2 O 3 с 0 до 3000 мг/кг.
На фоне снижения активности ферментов (доза 3000 мг/кг) увеличение смертности тест-объекта достигало 20 % по сравнению со 100 % вы- живаемостью в других группах.
Способность компонентов почвы вступать во взаимодействие с НЧ металлов, связывать их и уменьшать биодоступность нивелирует токсический эффект НЧ в отношении E. foetida . Растворенные или твердые частицы некоторых органических веществ могут агломерировать и сорбировать на поверхности НЧ в составе почвенной матрицы и тем самым снижать их биоактивность (37, 38).
Результаты количественного учета микроорганизмов почвы и ки- шечника червей показали, что через 14 сут инкубации при возрастающих количествах НЧ Аl2O3 численность микроорганизмов изменялась как в самой почве, так и в кишечнике.
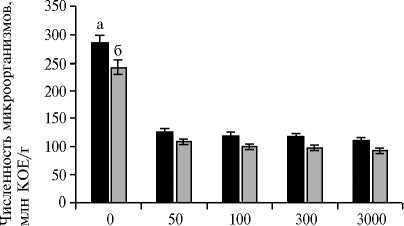
Содержание наночастиц А12О3, мг/кг почвы
Рис. 3. Общая численность микроорганизмов в почвогрунте после 14 сут инкубации с наночастицами Аl 2 O 3 в разных дозировках без вермикомпостирова-ния (а) и при его наличии (б) .
При увеличении дозы НЧ Аl2O3 с 50 до 3000 мг/кг отмечалось последовательное снижение общей численность микроорганизмов в почве без вермикомпо-стирования на 61,7-67,6 %, с вер-микомпостированием — на 55,661,3 %, в кишечнике E. foetida — на 9,7-43,2 % (рис. 3, 4). При этом минимальная дозировка (50 мг/кг) НЧ Аl2O3 снижала общую чис- ленность почвенных микроорганизмов, но не влияла на численность микробиоценоза кишечника E. foetida, что было обусловлено действием барьерных и адаптационно-приспособительных механизмов у этого почвобионта. Дозозависимое снижение количества почвенной мик- рофлоры, обусловленное изменением метаболических процессов в клетке, характерно и для других видов наночастиц
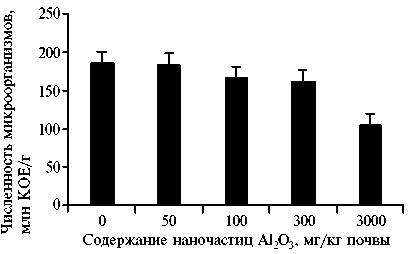
Рис. 4. Общая численность микроорганизмов в кишечнике Eisenia fоetida после 14 сут культивирования с наночастицами Аl 2 O 3 в разных дозировках.
Наблюдались различия в токсическом эффекте НЧ Al2O3 в отношении микроорганизмов in vitro и in vivo: при сопоставимых дозах бактерицидные свойства in vivo проявлялись, in vitro — отсутствовали. Развитие токсического эффекта определялось фактором времени и особенностями среды культивирования.
В контрольных образцах почвы с вермикомпостированием и в кишечнике E. foetida количественный анализ выявил домини- рование бактерий, тогда как численность микроскопических грибов была на несколько порядков ниже.
При инкубации с НЧ Al2O3 численность всех групп микроорганизмов изменялась. Количество грибов в почве в I, II, III и IV группах снизилось соответственно на 42,8; 52,4; 61,9 и 76,2 % относительно контроля, в кишечнике E. foetida — на 18,0 и 20,0 % в I и II группах, на 39,0 и 40,0 % в III и IV группах (табл. 2). То есть с возрастанием содержания НЧ Al2O3 численность микроорганизмов неуклонно уменьшалась, что указывает на бактерицидный эффект в отношении почвенной и кишечной микрофлоры. Наблюдалось снижение резистентности грибов к действию НЧ, в особенности при исследовании микробиоценоза кишечника E. foeti-da . Аналогичные результаты по воздействию на микроскопические грибы известны для наночастиц железа (40). Почвенные грибы, как правило, более устойчивы к тяжелым металлам, чем бактерии (41).
Численность азотфиксирующих бактерий была незначительной в контрольных образцах и под действием НЧ Al2O3 снижалась в почве в I, II, III и IV группах соответственно на 64,3; 77,9; 78,6 и 85,7%, в кишечни- ке E. foetida — на 16,0; 60,0; 78,8 и 80,0 %. Количество целлюлозолитических бактерий увеличивалось в почве и кишечнике E. foetida при минимальных дозировках наночастиц соответственно на 6,9 и 16,0 %. В то же время происходило снижение числа этих бактерий во II группе на 16,7 и 8,0 %, в III — на 12,5 и 32,0 %, в IV — на 25,0 и 40,0 %.
2. Численность разных микроорганизмов в почве и кишечнике Eisenia fоetida при вермикомпостировании через 14 сут после внесения наночастиц Al2O3
|
Микроскопические грибы, тыс. КОЕ/г |
Бактерии |
|||
|
Группа |
целюллозоразруша-ющие, млн КОЕ/г |
утилизирующие мине ральный азот, млн КОЕ/г |
азотфиксаторы, млн КОЕ/г |
|
|
Почва |
||||
|
Контроль |
21,0±3,20 |
72,0±9,70 |
44,0±6,50 |
14,0±4,20 |
|
I |
12,0±2,60 |
77,0±4,30 |
34,0±2,10 |
5,0±0,70 |
|
II |
10,0±2,10 |
60,0±6,40 |
27,0±3,10 |
3,1±0,20 |
|
III |
8,0±0,65 |
63,0±8,20 |
7,0±0,80 |
3,0±0,13 |
|
IV |
5,0±0,40 |
54,0±2,50 |
6,0±0,60 |
2,0±0,10 |
|
Кишечник |
||||
|
Контроль |
5,0±1,60 |
25,0±1,60 |
15,0±0,30 |
4,1±0,80 |
|
I |
4,1±1,20 |
29,0±2,40 |
13,0±1,20 |
2,4±0,40 |
|
II |
4,0±0,45 |
23,0±1,02 |
8,0±0,50 |
2,0±0,20 |
|
III |
3,1±0,10 |
17,0±2,20 |
6,0±0,20 |
1,1±0,30 |
|
IV |
3,0±0,20 |
15,0±1,50 |
4,0±0,90 |
0,8±0,04 |
Согласно данным литературы, НЧ металлов в малых дозах способны стимулировать размножение отдельных групп бактерий, тогда как в высоких — оказывают бактерицидный и бактериостатический эффект, вызывая нарушение целостности клеточной мембраны и изменения в работе внутриклеточных систем (42). Также известно, что степень влияния некоторых НЧ на жизнеспособность азотфиксирующих бактерий и колонизацию ими субстратов определяется зарядом НЧ (43). Численность микроорганизмов, использующих минеральные формы азота, в особенности актиномице-тов, служит важным показателем, поскольку некоторые актиномицеты — это типичные симбионты беспозвоночных, в том числе дождевых червей, участвующих в преобразовании питательных компонентов почвы (44).
Анализ микрофлоры почвы и кишечника E. foetida через 14 сут инкубации показал снижение числа бактерий, культивируемых на КАА, под действием НЧ Al2O3: в почве в I, II, III и IV группах — соответственно на 22,7; 38,6; 84,1 и 86,4 %, в кишечнике червей — на 13,3; 46,7; 60,0 и 73,3 %. В результате наблюдалась общая тенденция к снижению численности микроорганизмов в почве и кишечнике под действием НЧ Аl2O3 по мере увеличения дозировки наночастиц. Исключение составили минимальные вносимые дозы препаратов НЧ: в этом случае происходило увеличение численности целлюлозоразрушающих бактерий.
Таким образом, в модельном эксперименте подтверждено негативное влияние нанопрепаратов Al2O3 на почвенный биоценоз, проявляющееся в его обеднении, что сопровождается деградацией и снижением плодородия. Установлены адаптационные способности красного калифорнийского червя ( Eisenia fоetida ) по показателям антиоксидантной системы на фоне внесения в почву наночастиц Al2O3. Показан положительный эффект применения вермикомпостирования в целях снижения токсического действия наночастиц на почву. В целом полученные результаты подтверждают необходимость комплексной оценки биотоксичности наночастиц в разных средах обитания.
Список литературы Действие наночастиц Al2O3 на почвенный микробиоценоз, состояние антиоксидантной системы и микрофлору кишечника красного калифорнийского червя (Eisenia fоetida)
- Yeo J., Kim G., Hong S., Kim M.S., Kim D., Lee J., Ko S.H. Flexible supercapacitor fabrication by room temperature rapid laser processing of roll-to-roll printed metal nanoparticle ink for wearable electronics application. Journal of Power Sources, 2014, 246: 562-568 ( ) DOI: 10.1016/j.jpowsour.2013.08.012
- Shahravan A., Desai T., Matsoukas T. Passivation of aluminum nanoparticles by plasma-enhanced chemical vapor deposition for energetic nanomaterials. ACS Applied Materials & Interfaces, 2014, 10(6): 7942-7947 ( ) DOI: 10.1021/am5012707
- Luska K.L., Julis J., Stavitski E., Zakharov D.N., Adams A., Leitner W. Bifunctional nanoparticle-SILP catalysts (NPs@SILP) for the selective deoxygenation of biomass substrates. Chemical Science, 2014, 12(5): 4895-4905 ( ) DOI: 10.1039/C4SC02033B
- Machado S., Grosso J.P., Nouws H.P.A., Albergaria J.T., Delerue-Matos C. Utilization of food industry wastes for the production of zero-valent iron nanoparticles. Science of the Total Environment, 2014, 496: 233-240 ( ) DOI: 10.1016/j.scitotenv.2014.07.058
- Ju C., Mo R., Xue J., Zhang L., Zhao Z., Xue L., Zhang C. Sequential intra-intercellular nanoparticle delivery system for deep tumor penetration. Angew. Chem. Int. Ed., 2014, 53: 6253-6258 ( ) DOI: 10.1002/anie.201311227
- Ansari M.A., Khan H.M., Khan A.A., Sultan A., Azam A. Characterization of clinical strains of MSSA, MRSA and MRSE isolated from skin and soft tissue infections and the antibacterial activity of ZnO nanoparticles. World J. Microbiol. Biotechnol., 2012, 28(4): 1605-1613 ( ) DOI: 10.1007/s11274-011-0966-1
- Pramanik A., Laha D., Bhattacharya D., Pramanik P., Karmakar P. A novel study of antibacterial activity of copper iodide nanoparticle mediated by DNA and membrane damage. Colloids and Surfaces B: Biointerfaces, 2012, 96: 50-55 ( ) DOI: 10.1016/j.colsurfb.2012.03.021
- Rai M., Ingle A.P., Birla S., Yadav A., Santos C.A.D. Strategic role of selected noble metal nanoparticles in medicine. Critical Reviews in Microbiology, 2016, 42(5): 696-719 ( ) DOI: 10.3109/1040841x.2015.1018131
- Manimaran M. A review on nanotechnology and its implications in agriculture and food industry. Asian Journal of Plant Science and Research, 2015, 5(7): 13-15.
- Mishra S., Singh H.B. Biosynthesized silver nanoparticles as a nanoweapon against phytopathogens: exploring their scope and potential in agriculture. Appl. Microbiol. Biotechnol., 2015, 99(3): 1097-1107 ( ) DOI: 10.1007/s00253-014-6296-0
- Li X., Yang Y., Gao B., Zhang M. Stimulation of peanut seedling development and growth by zero-valent iron nanoparticles at low concentrations. PLoS ONE, 2015, 10(4): 1-12 ( ) DOI: 10.1371/journal.pone.0122884
- Новицкая Н.В., Джемесюк А.В. Урожайность сои в зависимости от элементов технологии на черноземах типичных лесостепи Украины. Вестник Алтайского государственного аграрного университета, 2015, 127(5): 127.
- Зинченко В.А. Химическая защита растений: средства, технология и экологическая безопасность. М., 2005.
- Шугалей И.В., Гарабаджиу А.В., Илюшин М.А., Судариков А.М. Некоторые аспекты влияния алюминия и его соединений на живые организмы. Экологическая химия, 2012, 21(3): 172-186.
- Лущаева И.В., Моргалев С.Н. Изучение воздействия наночастиц TiO2 и Al2O3 на бактерии Pseudomonas fluorescens и Bacillus mucilaginosus. Вестник Томского государственного университета. Биология, 2009, 8(4): 97-103.
- Heckmann L.-H., Besenbacher F., Janeck J., Hovgaard M.B., Sutherland D.S., Autrup H. Limit-test toxicity screening of selected inorganic nanoparticles to the earthworm Eisenia fetida. Ecotoxicology, 2011, 20: 226-233 ( ) DOI: 10.1007/s10646-010-0574-0
- Sadiq I.M., Pakrashi S., Chandrasekaran N., Mukherjee A. Studies on toxicity of aluminum oxide (Al2O3) nanoparticles to microalgae species: Scenedesmus sp. and Chlorella sp. J. Nanopart. Res., 2011, 13: 3287-3299 ( ) DOI: 10.1007/s11051-011-0243-0
- Azmat H., Javed M., Jabeen G. Acute toxicity of aluminium to the fish (Catla catla, Labeo rohita and Cirrhina mrigala). Pak. Vet. J., 2012, 32(1): 85-87.
- Silva S. Aluminium toxicity targets in plants. Journal of Botany, 2012, 2012: Article ID 219462 ( ) DOI: 10.1155/2012/219462
- Dovic M., Lestan D. Eisenia fetida avoidance behavior as a tool for assessing the efficiency of remediation of Pb, Zn and Cd polluted soil. Environ. Pollut., 2010, 158(8): 2766-2772 ( ) DOI: 10.1016/j.envpol.2010.04.015
- Saez G., Aye M., Meo M., Aimé A., Bestel I., Barthélémy P., Giorgio C. Genotoxic and oxidative responses in coelomocytes of Eisenia fetida and Hediste diversicolor exposed to lipid-coated CdSe/ZnS quantum dots and CdCl2. Environ. Toxicol., 2015, 30(8): 918-926 ( ) DOI: 10.1002/tox.21966
- Edwards C.A., Bohlen P.J. Biology and ecology of earthworms. V. 3. Springer Science & Business Media, 1996.
- Vlčková K., Hofman J. A comparison of POPs bioaccumulation in Eisenia fetida in natural and artificial soils and the effects of aging. Environ. Pollut., 2012, 160: 49-56 ( ) DOI: 10.1016/j.envpol.2011.08.049
- Методы почвенной микробиологии и биохимии/Под ред. Д.Г. Звягинцева. М., 1991.
- Захарова Н.Г., Алимова Ф.К., Егоров С.Ю. Микробиологический мониторинг почв. Казань, 2005.
- Fajardo C., Saccà M.L., Costa G., Nande M., Martin M. Impact of Ag and Al2O3 nanoparticles on soil organisms: in vitro and soil experiments. Science of The Total Environment, 2014, 473-474: 254-261 ( ) DOI: 10.1016/j.scitotenv.2013.12.043
- Sadiq R., Khan Q.M., Mobeen A., Hashmat A.J. In vitro toxicological assessment of iron oxide, aluminium oxide and copper nanoparticles in prokaryotic and eukaryotic cell types. Drug. Chem. Toxicol., 2015, 38(2): 152-161 ( ) DOI: 10.3109/01480545.2014.919584
- Tilston E.L., Collins C.D., Mitchell G.R., Princivalle J., Shaw L.J. Nanoscale zerovalent iron alters soil bacterial community structure and inhibits chloroaromatic biodegradation potential in Aroclor 1242-contaminated soil. Environ. Pollut., 2013, 173: 38-46 ( ) DOI: 10.1016/j.envpol.2012.09.018
- Ko K.S., Kong I.C. Toxic effects of nanoparticles on bioluminescence activity, seed germination, and gene mutation. Appl. Microbiol. Biotechnol., 2014, 98(7): 3295-3303 ( ) DOI: 10.1007/s00253-013-5404-x
- Ismail R.A., Sulaiman G.M., Abdulrahman S.A., Marzoog T.R. Antibacterial activity of magnetic iron oxide nanoparticles synthesized by laser ablation in liquid. Mater. Sci. Eng. C Mater. Biol. Appl., 2015, 53: 286-297 ( ) DOI: 10.1016/j.msec.2015.04.047
- Liang H.Y., Li Y.S., Sun J. Effect of aluminum ion on activities of important antioxidant enzymes from earthworms, Eisenia andrei. Journal of Shanghai Jiaotong University (Agricultural Science), 2007, 25: 551-555.
- Richards K.D., Schott E.J., Sharma Y.K., Davis K.R., Gardner R.C. Aluminum induces oxidative stress genes in Arabidopsis thaliana. Plant Physiol., 2016, 116: 409-418 ( ) DOI: 10.1104/pp.116.1.409
- Yoon C., Koppula S., Yoo S., Yum M., Kim J., Lee J., Song M. Rhus javanica Linn protects against hydrogen peroxide-induced toxicity in human Chang liver cells via attenuation of oxidative stress and apoptosis signaling. Mol. Med. Rep., 2016, 13(1): 1019-1025 ( ) DOI: 10.3892/mmr.2015.4603
- Sun W., Tai T.Y., Lin Y.S. Effect of monosultap on protein content. SOD and AChE activity of Eisenia foetida under two different temperatures. J. Agro-Environ. Sci., 2007, 26: 1816-1821.
- Kunwar A., Priyadarsini K.I. Free radicals, oxidative stress and importance of antioxidants in human health. Journal of Medical and Allied Sciences, 2011, 1(2): 53-60.
- Shinde A., Ganu J., Naik P. Effect of free radicals & antioxidants on oxidative stress: a review. Journal of Dental and Allied Sciences, 2012, 1(2): 63-66.
- Ghosh S., Mashayekhi H., Pan B., Bhowmik P., Xing B. Colloidal behavior of aluminum oxide nanoparticles as affected by pH and natural organic matter. Langmuir, 2008, 24(21): 12385-12391 ( ) DOI: 10.1021/la802015f
- Tourinho P.S., van Gestel C.A., Lofts S., Svendsen C., Soares A.M., Loureiro S. Metal-based nanoparticles in soil: fate, behavior, and effects on soil invertebrates. Environ. Toxicol. Chem., 2012, 31(8): 1679-1692 ( ) DOI: 10.1002/etc.1880
- Fang T., Watson J., Goodman J., Dimkpa C.O., Martineau N., Das S., McLean J.E., Britt D.W., Anderson A.J. Does doping with aluminum alter the effects of ZnO nanoparticles on the metabolism of soil pseudomonads? Microbiol. Res., 2013, 168(2): 91-98 ( ) DOI: 10.1016/j.micres.2012.09.001
- Pawlett M., Ritz K., Dorey R.A., Rocks S., Ramsden J., Harris J.A. The impact of zero-valent iron nanoparticles upon soil microbial communities is context dependent. Environ. Sci. Pollut. Res., 2013, 2: 1041-1049 ( ) DOI: 10.1007/s11356-012-1196-2
- Мынбаева Б.Н. Популяционная структура микрофлоры почв г. Алматы при загрязнении их тяжелыми металлами. Вестник Башкирского университета, 2012, 3: 1282-1284.
- Li H., Chen Q., Zhao J., Urmila K. Enhancing the antimicrobial activity of natural extraction using the synthetic ultrasmall metal nanoparticles. Scientific Reports, 2015, 5: Article number 11033 ( ) DOI: 10.1038/srep11033
- Burke D.J., Pietrasiak N., Situ S.F., Abenojar E.C., Porche M., Kraj P., Lakliang Y., Samia A.C. Iron oxide and titanium dioxide nanoparticle effects on plant performance and root associated microbes. Int. J. Mol. Sci., 2015, 16(10): 23630-23650 ( ) DOI: 10.3390/ijms161023630
- Бызов Б.А., Нечитайло Т.Ю., Бумажкин Б.К., Кураков А.В., Голышин П.Н., Звягинцев Д.Г. Культивируемые микроорганизмы из пищеварительного тракта дождевых червей. Микробиология, 2009, 78(3): 404-413.


