Действие светодиодного облучения разного спектрального состава на фотосинтетический аппарат растений картофеля (Solanum tuberosum L.) в культуре in vitro
Автор: Мартиросян Ю.Ц., Диловарова Т.А., Мартиросян В.В., Креславский В.Д., Кособрюхов А.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Фотосинтез и продуктивность
Статья в выпуске: 5 т.51, 2016 года.
Бесплатный доступ
Размножение в культуре in vitro - важный этап при получении оздоровленного посадочного материала картофеля. Различный спектр облучения может быть использован для регулирования роста и морфогенеза у проростков картофеля ( Solanum tuberosum L.) in vitro. Мы исследовали влияние светодиодных источников света (СД), различающихся по спектральному составу излучения, на ростовые процессы растений картофеля сорта Агрия в культуре in vitro и функциональные параметры фотосинтетического аппарата. Источниками освещения служили светодиодные облучатели («ООО Фокус», Россия) (СД) красного (КС, λ = 635 нм при полуширине полосы излучения ППИ 45 нм), синего (СС, λ = 463 нм, ППИ 23 нм), зеленого (ЗС, λ = 521 нм, ППИ 38 нм) и белого света (БС, λ = 400-730 нм) с интенсивностью облучения на уровне растений 60-65 мкмоль квантовŸм-2Ÿс-1. Часть растений помещали под белые люминесцентные лампы («OSRAM AG», Германия) при той же интенсивности света. Через 28 сут измеряли площадь листьев, высоту растений, учитывали сухую биомассу, определяли скорость СО2-газообмена, а также измеряли параметры переменной флуоресценции хлорофилла. Наибольшее накопление биомассы отмечали при облучении растений люминесцентными лампами, несколько меньшее - при использовании светодиодов белого света. По сравнению с СД белого света действие СС, ЗС и КС приводило к снижению накопления биомассы растениями соответственно на 49,5, 75,6 и 67,5 %. Наблюдаемые изменения были связаны с более высокой активностью фотосинтетического аппарата растений, выращиваемых при облучении светодиодами БС и СС. Скорость фотосинтеза единицы листовой поверхности у этих растений была выше по сравнению с выращиваемыми под СД ЗС и КС. Эффективный квантовый выход ФС II у исследованных растений менялся незначительно (от 0,47 до 0,53), при этом более высокие значения отмечали при использовании люминесцентных ламп и СД белого и зеленого света. Скорость электронного транспорта (ЕТР) и коэффициент нефотохимического тушения (NPQ) менялись подобным образом в зависимости от условий выращивания растений. В условиях, когда скорость фотосинтеза не была лимитирована по СО2, поглощение углекислоты листьями снижалось в ряду люминесцентные лампы > белые СД > красные СД > синие СД > зеленые СД. Максимальная скорость карбоксилирования и большая эффективность реакции наблюдались при облучении растений люминесцентным светом и СД белого света. При облучении СД СС, КС и, особенно, ЗС скорость карбоксилирования снижалась до 77,9; 67,9 и 11,1 % от максимальных значений. Эффективность карбоксилирования резко снижалась при СД КС и ЗС до 37,5 % и 6,7% от максимума. Скорость электронного транспорта в вариантах люминесцентные лампы, БС, КС, СС, ЗС составила соответственно 100; 97,3; 75,1; 68,0; 20,8 %. Одновременно наблюдалось снижение скорости утилизации триозофосфатов до 88,9; 48,7; 28,2; 9,4 % от величины, наблюдаемой при люминесцентном освещении (100 %). Таким образом, в условиях низкой интенсивности света, независимо от его спектрального состава и типа облучателя, активность световых реакций фотосинтеза существенно не изменяется, а наблюдаемые различия в накоплении сухого вещества растениями обусловлены процессами, связанными с активностью реакций темновой фазы фотосинтеза, а также со снижением устьичной проводимости. Полученные результаты позволяют подойти к выяснению влияния разных монохроматических спектров светодиодных облучателей на функционирование фотосинтетического аппарата для обоснования их применения при выращивании растений.
Картофель, рост, фотосинтез, светодиодные облучатели, фоторецепторы
Короткий адрес: https://sciup.org/142213971
IDR: 142213971 | УДК: 633.491:576.3/.7.086.83:631.588.5:581.132 | DOI: 10.15389/agrobiology.2016.5.680rus
Текст научной статьи Действие светодиодного облучения разного спектрального состава на фотосинтетический аппарат растений картофеля (Solanum tuberosum L.) в культуре in vitro
Важный этап при получении оздоровленного посадочного материала картофеля — размножение в культуре in vitro. Имеющиеся данные свидетельствуют, что различный спектр облучения может быть использован для регулирования роста и морфогенеза у проростков картофеля ( Solanum tuberosum L.) in vitro (1-4). Так, при облучении люминесцентными лампа-
∗ Работа выполнена при частичной поддержке гранта РФФИ 15-04-01199а.
ми (красный свет, максимум при X = 660 нм) листья проростков были маленькие, а ростки слабые (2). При освещении синим светом люминесцентных ламп (максимум при X = 480 нм) растения имели хорошо развитые листья. Обогащение спектра красной областью приводило к увеличению площади листовой поверхности (5). Сочетание красных и синих светодиодов способствовало росту и развитию проростков картофеля в лабораторном эксперименте (6).
Следует отметить, что в основном известные работы, посвященные этому вопросу, касались изучения совместного действия красного и синего спектра излучения ламп на ростовые и метаболические процессы в листьях (7-9). Небольшое добавление других спектральных диапазонов, в частности в зеленой (ЗС) области, приводит к повышению эффективности используемых облучателей (7, 10). Положительный эффект на фотосинтетический аппарат и продукционный процесс показан и при использовании дополнительного облучения растений светом с максимумом около X = 630 нм (11, 12). В этом случае изменяется доля активной формы фитохрома В в общем пуле фитохромов, что может приводить к повышению фотосинтетической активности растений (13, 14).
Несмотря на выявленные закономерности при действии светодиодного облучения на ростовые процессы и фотосинтетический аппарат (15-17), вопросы, касающиеся влияния определенных участков спектра на активность световых и темновых реакций фотосинтеза в интактном листе, остаются мало исследованными.
В настоящей работе нами впервые изучена связь активности световой и темновой фаз фотосинтеза и роста у проростков картофеля in vitro при моно- и полихроматическом освещении.
Цель работы заключалась в изучении влияния спектрального состава света на развитие растений и функциональные характеристики фотосинтетического аппарата при размножении растений картофеля в культуре in vitro .
Методика. При получении культуры in vitro в условиях ламинар-бокса верхнюю часть растений картофеля сорта Агрия срезали и высаживали в стерильные пробирки, содержащие питательную среду Мурасиге-Скуга (Murashige T., Skoog F., 1962) для укоренения. Далее пробирки помещали в фитотрон, где они находились в строго контролируемых условиях (температура 18-20 °С, 16-часовой фотопериод).
Источниками освещения служили светодиодные облучатели («ООО Фокус», Россия) (СД) красного (КС, X = 635 нм при полуширине полосы излучения ППИ 45 нм), синего (СС, X = 463 нм, ППИ 23 нм), зеленого (ЗС, X = 521 нм, ППИ 38 нм) и белого света (БС, X = 400-730 нм) с интенсивностью облучения на уровне растений 60-65 мкмоль квантов•м-2•с-1. Часть растений помещали под белые люминесцентные лампы («OSRAM AG», Германия) при той же интенсивности света.
Через 28 сут измеряли площадь листьев, высоту растений. Для учета сухой биомассы в каждом варианте отбирали 6-8 растений, разделяли надземную и подземную части, фиксировали при 105 °С, высушивали при 70 °С и взвешивали.
Скорость СО2-газообмена определяли с помощью переносного инфракрасного газового анализатора LCPro+ («ADC BioScientific Ltd», Великобритания). Кривые зависимости СО2-газообмена листьев от интенсивности света и концентрации углекислого газа в воздухе получали и анализировали согласно описанию (15).
Флуоресценцию хлорофилла измеряли на листьях 2-3-го верхних ярусов, используя флуориметр с импульсно модулированным освещением
(JUNIOR-PAM, «Heinz Walz GmbH», Германия). Параметры флуоресценции регистрировали после 20-минутной темновой адаптации. Определяли эффективный квантовый выход ФС II (фотосистема II), относительную скорость транспорта электронов (ETR), нефотохимическое (NPQ) тушение (18).
Статистическую обработку результатов проводили с помощью программы Statistica 10 («Statsoft Inc.», США). Во всех случаях Р рассчитывали для уровня значимости 0,05. В таблицах и на рисунках приведены средние арифметические значения со стандартной ошибкой ( X ± x ).
Результаты. В задачу нашего исследования входило наблюдение за ростовыми процессами и скоростью фотосинтеза, а также анализ активности световых и темновых реакций фотосинтетического аппарата при укоренении черенков картофеля в зависимости от спектрального состава освещения светодиодными (СД) облучателями.
1. Сухая масса (г) органов растений у картофеля ( Solanum tuberosum L.) сорта Агрия при выращивании in vitro под лампами с разным спектральным составом света ( X ± x )
|
Тип лампы, спектральный состав света |
Лист |
Стебель |
Корень |
Растение |
|
Белые люминесцентные лампы (контроль) |
0,55±0,10 |
0,25±0,02 |
0,15±0,05 |
0,94±0,16 |
|
Светодиодные лампы: |
||||
|
белый ( λ = 400-730 нм) |
0,52±0,03 |
0,28±0,03 |
0,06±0,02* |
0,86±0,06 |
|
синий ( λ = 463 нм) |
0,29±0,09* |
0,21±0,03 |
0,02±0,01* |
0,52±0,13* |
|
зеленый ( λ = 521 нм) |
0,16±0,06* |
0,10±0,04* |
0,04±0,02* |
0,21±0,07* |
|
красный ( λ = 635 нм) |
0,13±0,02* |
0,14±0,01* |
0,02±0,00* |
0,28±0,04* |
Прим еч ани е. Приведены средние значения для 6-8 растений со стандартной ошибкой. * Различия с контролем достоверны (Р < 0,05).
Спектральный состав света значительно влиял на процессы роста и развития растений (табл. 1). Так, при люминесцентном освещении скорость роста, оцениваемая по накоплению надземной биомассы, оказалась наибольшей. Несколько меньшее накопление биомассы наблюдали при облучении СД белого света. Действие синего света проявлялось в снижении накопления биомассы растениями на 49,5 % по сравнению с вариантом, в котором использовали светодиоды белого света, а при облучении светодиодами ЗС и КС накопление биомассы снижалось соответственно на 75,6 и 67,5 %.
2. Ростовые показатели у растений картофеля ( Solanum tuberosum L.) сорта Агрия при выращивании in vitro под лампами с разным спектральным составом света ( X ± x )
|
Тип лампы, спектральный состав света |
Высота стебля, см |
Соотношение биомассы (корни + стебли)/листья |
Число междоузлий |
|
Белые люминесцентные лампы (контроль) |
16,30±1,83 |
0,72 |
8,20±0,55 |
|
Светодиодные лампы: |
|||
|
белый ( λ = 400-730 нм) |
13,78±0,99 |
0,65 |
9,00±0,37 |
|
синий ( λ = 463 нм) |
19,46±1,18 |
0,79 |
9,00±0,30 |
|
зеленый ( λ = 521 нм) |
24,77±1,53* |
0,88 |
9,30±0,33 |
|
красный ( λ = 635 нм) |
32,79±1,52* |
1,23 |
10,10±0,31 |
Прим еч ани е. Приведены средние значения для 6-8 растений со стандартной ошибкой. * Различия с контролем достоверны (Р < 0,05).
Следует также отметить неодинаковый характер распределения сухой биомассы по органам растений в зависимости от типа облучателя и спектрального состава света (табл. 2). Анализ отношения массы стеблей и корней к массе листьев показал, что ее высокое накопление у растений под люминесцентными лампами и СД белого света связано с большим накоплением сухого вещества в листьях по сравнению с корнями и стеблем. При облучении СД КС больше сухой биомассы накапливалось в аттрагирую-щих органах — стебле и корнях.
Выявленные изменения в накоплении сухого вещества при различ- ных спектральных режимах облучения растений связаны с более высокой активностью фотосинтетического аппарата при выращивании под СД БС и СД СС (табл. 3). Скорость фотосинтеза в расчете на единицу площади листовой поверхности в этих вариантах была выше по сравнению с аналогичным показателем при использовании СД ЗС или КС. Для растений в условиях люминесцентного облучения и СД белого света отмечали также высокие значения проводимости устьиц и скорости транспирации.
3. Показатели функционального состояния фотосинтетического аппарата и транспирации у растений картофеля (Solanum tuberosum L.) сорта Агрия при выращивании in vitro под лампами с разным спектральным составом света (X±x)
|
Спектральный режим |
|||
|
ЛС |
СД БС СД СС СД КС |
СД ЗС |
|
ЗС — зеленый свет, λ = 521 нм); Y (II) — эффективный квантовый выход фотосистемы II, отн. ед.; NPQ — нефотохимическое тушение, отн. ед.; ETR — относительная скорость электронного транспорта. Приведены средние значения для 6-8 растений со стандартной ошибкой.
* Различия с контролем достоверны (Р < 0,05).
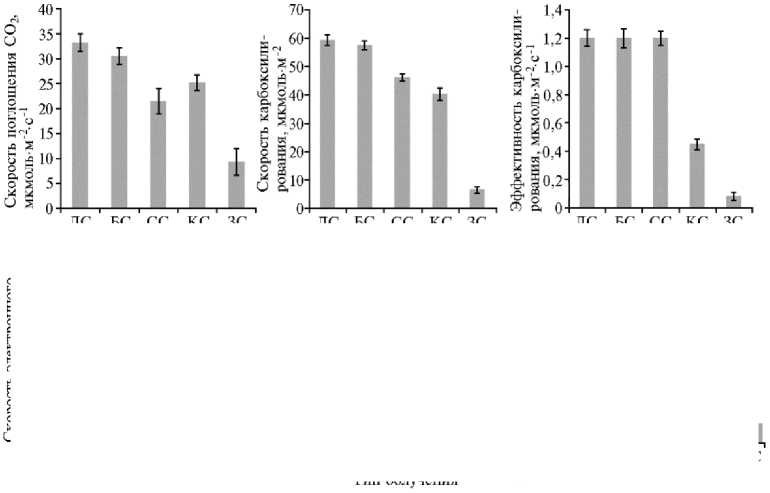
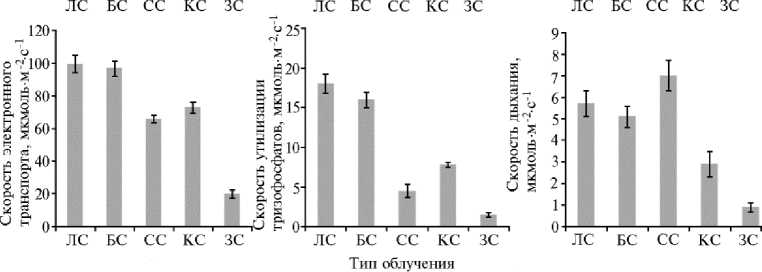
Показатели, характеризующие скорость световых и темновых реакций фотоситнеза у растений картофеля ( Solanum tuberosum L.) сорта Агрия при выращивании in vitro под лампами с разным спектральным составом света. ЛС — люминесцентные лампы, БС — белые светодиоды ( λ = 400730 нм), СС — синие светодиоды ( λ = 463 нм), КС — красные светодиоды ( λ = 635 нм), ЗС — зеленые светодиоды ( λ = 521 нм). Аппроксимация углекислотных кривых СО 2 газообмена с использованием модели G.D. Farquhar с соавт. (1980).
Оценка функционального состояния фотосинтетического аппарата показала, что у исследованных растений эффективный квантовый выход ФС II варьировался незначительно (в пределах от 0,47 до 0,53), при этом бóльшие значения отмечались в вариантах с освещением люминесцентным лампами, а также СД с белым и зеленым светом. Скорость электронного транспорта (ЕТР) и нефотохимическое тушение (NPQ) менялись подобным образом в зависимости от условий выращивания растений. В результате в культуре in vitro при малой интенсивности света наблюдаемая низкая скорость фотосинтеза в случае СД КС и СД ЗС связана прежде всего с активностью темновых реакций фотосинтеза и низкой проводимостью устьиц.
Для определения потенциальной активности световых и темновых реакций фотосинтеза были построены углекислотные кривые. Их анализ с использованием биохимической модели (19) показал, что в условиях, когда скорость фотосинтеза не лимитирована по СО2, поглощение углекислоты листьями снижалось в ряду люминесцентные лампы > белые СД > красные СД > синие СД > зеленые СД (рис.).
Максимальная скорость карбоксилирования и большая эффективность реакции наблюдались при облучении растений люминесцентным светом и СД белого света. В вариантах с СД СС, СД КС и особенно СД ЗС скорость карбоксилирования снижалась до величин, составляющих 77,9; 67,9 и 11,1 % от значений под люминесцентными лампами. Эффективность карбоксилирования резко уменьшалась при облучении СД КС и СД ЗС — соответственно до 37,5 % и 6,7 % от максимума. Скорость электронного транспорта при облучении люминесцентными лампами была наибольшей, и в вариантах СД БС, СД КС, СД СС и СД ЗС составила соответственно 97,3; 75,1; 68,0 и 20,8 % относительно этого показателя. Одновременно имело место снижение скорости утилизации триозофосфатов — соответственно до 88,9; 48,7; 28,2 и 9,4 % от величины, наблюдаемой при люминесцентном освещении (100 %).
Полученные результаты показывают, что разный спектральный состав света неодинаково влияет на активность реакций световой и темновой стадии фотосинтеза. В условиях естественной концентрации СО2 при облучении светодиодами, излучающими в разных участках спектра, скорость первичных процессов фотосинтеза изменялась незначительно, но при этом растения формировали фотосинтетический аппарат с модифицированным потенциалом функциональной активности. При повышенной концентрации СО2, когда ограничение скорости фотосинтеза за счет активности темновых процессов снижается, максимальная скорость карбоксилирования и эффективность карбоксилирования мало изменялись при облучении люминесцентными лампами, СД белого и синего света, но значительно снижались в вариантах с СД КС и СД ЗС. В результате данные, полученные нами с использованием модели, подтверждают заключение о влиянии снижения проводимости устьиц на уменьшение скорости фотосинтеза при облучении растений СД КС и особенно СД ЗС за счет торможения потока СО2 к центрам карбоксилирования (см. табл. 3). Наряду со скоростью световых и темновых реакций фотосинтеза дыхательный газообмен также был подвержен влиянию спектрального состава излучения. При освещении растений СД СС отмечалась наибольшая скорость дыхания по сравнению с таковой в других вариантах. Облучение растений СД КС приводило к снижению интенсивности дыхательного газообмена.
Представленные нами данные о действии разных источников облучения на растения при их размножении в культуре in vitro показывают, что в условиях низкой интенсивности света, независимо от его спектрального состава и типа облучателя (люминесцентны лампы или светодиоды), активность световых реакций фотосинтеза существенно не изменяется, а наблюдаемые различия в накоплении сухого вещества растениями обусловлены процессами, связанными с активностью реакций темновой фазы фотосинтеза (скоростью и эффективностью реакции карбоксилирования, 684
скоростью утилизации триозофосфатов), а также со снижением устьичной проводимости. При этом отмечались значительные различия в дыхательном газообмене, в результате чего изменялось соотношение между активностью дыхания и фотосинтеза.
Наблюдаемые изменения в активности фотосинтетического аппарата — не единственная ответная реакция растений на действие света различного спектрального состава (20-22). Данные литературы свидетельствуют о важной роли фоторецепторов в регуляции роста и морфогенеза растений, активности фотосинтетического аппарата (23-25). Большую роль в проявлении действия света играют регуляторные фоторецепторы в разных световых диапазонах (26-28). Так, спектральный состав света не оказывал значительного влияния на первичные ростовые процессы, однако красный свет способствовал интенсивному формированию осевых органов, вероятно, вследствие стимуляции фоторецептора красного света — фитохрома. Напротив, в условиях облучения растений синим светом происходило ингибирование роста, что могло быть обусловлено действием криптохома. Влияние света проявляется также в изменении гормонального статуса растений (содержание и соотношение гиберелинов и ауксинов) и регуляции активности физиологических процессов (22).
Таким образом, исследование функциональных характеристик фотосинтетического аппарата и ростовых процессов у картофеля в культуре in vitro показало сложный характер изменения активности отдельных процессов световой и темновой стадии фотосинтеза в зависимости от типа облучателя и спектрального состава света. При низкой интенсивности светового потока разного спектрального состава изменения в накоплении сухого вещества растениями обусловлены процессами, связанными с разной активностью реакций темновой фазы фотосинтеза. Полученные результаты позволяют подойти к выяснению роли отдельных монохроматических светодиодных облучателей на функционирование фотосинтетического аппарата и направленно использовать светодиодные облучатели при выращивании растений.
Список литературы Действие светодиодного облучения разного спектрального состава на фотосинтетический аппарат растений картофеля (Solanum tuberosum L.) в культуре in vitro
- Aksenova N.P., Konstantinova T.N., Chailakhyan M.Kh. Morphogenetic effects of blue and red light during exposure of overground and underground organs of potato in culture in vitro. Doklady Botanical Sciences, 1989, 305: 508-512.
- Aksenova N.P., Konstantinova T.N., Sergeeva L.I., Machackova I., Golyanovskayua S.A. Morphogenesis of potato plants in vitro. I. Effect of light quality and hormones. J. Plant Growth Reg., 1994, 13: 143-146 ( ) DOI: 10.1007/BF00196378
- Seabrook J.E.A., Douglass L.K. Prevention of stem growth inhibition and alleviation of intumescence formation in potato plantlets in vitro by yellow filters. Am. J. Potato Res., 1998, 75: 219-224 ( ) DOI: 10.1007/BF02854216
- Seabrook J.E.A. Light effects on the growth and morphogenesis of potato (Solanum tuberosum L.) in vitro: a review. Am. J. Potato Res., 2005, 82: 353-367 ( ) DOI: 10.1007/BF02871966
- Charles G., Rossignol L., Rossignol M. Environmental effects on potato plants in vitro. J. Plant Physiol., 1992, 139: 708-713 ( ) DOI: 0.1016/S0176-1617(11)81715-3
- Jao R.C., Fang W. Growth of potato plantlets in vitro is different when provided concurrent versus alternating blue and red light photoperiods. Hort. Sci., 2004, 39: 380-382.
- Kim S.J., Hahn E.J., Heo J.W., Paek K.Y. Effects of LEDs on net photosynthetic rate, growth and leaf stomata of chrysanthemum plantlets in vitro. Hort. Sci., 2004, 101: 143-151.
- Ohashi-Kaneko K., Takase M., Kon N., Fujiwara K., Kurata K. Effect of light quality on growth and vegetable quality in leaf lettuce, spinach and komatsuna. Environ. Control Biol., 2007, 45: 189-198 ( ) DOI: 10.2525/ecb.45.189
- Yorio N.C., Goins G.D., Kagie H.R., Wheeler R.M., Sager J.C. Improving spinach, radish, and lettuce growth under red light-emitting diodes (LEDs) with blue light supplementation. Hort. Sci., 2001, 36: 380-383.
- Kim H.H., Goins G.D., Wheeler R.M., Sager J.C. Green-light supplementation for enhanced lettuce growth under red-and blue-light-emitting diodes. Hort. Sci., 2004, 39: 1617-1622.
- Kosobryukhov A.A., Kreslavski V.D., Khramov R.N., Bratkova L.R., Shchelokov R.N. Influence of additional low intensity luminescent radiation on growth and photosynthesis of plants. Biotronics, 2000, 29: 23-31.
- Тараканов И.Г., Яковлева О.С. Влияние качества света на физиологические особенности и продукционный процесс базилика эвгенольного (Ocimum gratissimum. L.). В сб.: Физиолого-биохимические основы продукционного процесса у культивируемых растений. Саратов, 2010: 95-97.
- Kreslavski V.D., Lyubimov V.Y., Shirshikova G.N., Shmarev A.N., Kosobryukhov A.A., Schmitt F.J., Friedrich T., Allakhverdiev S.I. Preillumination of lettuce seedlings with red light enhances the resistance of photosynthetic apparatus to UV-A. J. Photochem. Photobiol. B Biol., 2013, 122: 1-6 ( ) DOI: 10.1016/j.jphotobiol.2013.02.016
- Креславский В.Д., Любимов В.Ю., Шабнова Н.И., Ширшикова Г.Н., Шмарев А.Н., Кособрюхов А.А. Активация фитохрома В повышает устойчивость фотосинтетического аппарата проростков салата к УФ-А. Доклады РАСХН, 2014, 1: 20-23.
- Мартиросян Ю.Ц., Полякова М.Н., Диловарова Т.А., Кособрюхов А.А. Фотосинтез и продуктивность растений картофеля в условиях различного спектрального облучения. Сельскохозяйственная биология, 2013, 1: 107-112.
- Аверчева О.В., Беркович Ю.А., Ерохин А.Н., Жигалова Т.В., Погосян С.И., Смолянина С.О. Особенности роста и фотосинтеза растений китайской капусты при выращивании под светодиодными светильниками. Физиология растений, 2009, 56: 17-26.
- Johkan M., Shoji K., Goto F., Hashida S., Yoshihara T. Blue light-emitting diode light irradiation of seedlings improves seedling quality and growth after transplanting in red leaf lettuce. Hort. Sci., 2010, 45: 1809-1814.
- Гольцев В.Н., Каладжи Х.М., Кузманова М.А., Аллахвердиев С.И. Переменная и замедленная флуоресценция хлорофилла а -теоретические основы и практическое приложение в исследовании растений. Ижевск-М., 2014.
- Farquhar G.D., von Caemmerer S., Berry J.A. A biochemical model of photosynthetic CO2 assimilation in leaves of C3 plants. Planta, 1980, 149(1): 78-90 ( ) DOI: 10.1007/BF00386231
- Bukhov N.G., Drozdova I.S., Bondar V.V., Mokronosov A.T. Blue, red and blue plas red light control of chlorophyll content and CO2 Gas exchange in barley leaves: quantitative description of the effects of light quality and fluence rate. Physiologia Plantarum, 1992, 85: 632-638 ( ) DOI: 10.1111/j.1399-3054.1992.tb04765.x
- Матевосян Г.Л., Бурень В.М., Баранова Р.К., Волкова Р.И., Сергеева Л.С. Фиторегуляторные проблемы роста и развития картофеля при быстром размножении промышленно важных сортов. В сб.: Регуляция роста и развития картофеля. М., 1990: 83-87.
- Воскресенская Н.П., Дроздова И.С., Аксенова Н.П., Константинова Т.И., Бондар В.В., Перфильева С.Д., Чайлахян М.Х. Влияние света и фитогормонов на фотосинтез, рост и развитие картофеля сорта Миранда. В сб.: Регуляция роста и развития картофеля. М., 1990: 20-29.
- Креславский В.Д., Кособрюхов А.А., Шмарев А.Н., Аксенова Н.П., Константинова Т.Н., Голяновская С.А., Романов Г.А. Введение гена phyb арабидопсиса повышает устойчивость фотосинтетического аппарата трансгенных растений Solanum tuberosum к УФ-В облучению. Физиология растений, 2015, 62(2): 222-229.
- Shin K.S., Mrthy H.N., Heo J.W., Hahn E.J., Paek K.Y. The effect of light quality on the growth and development of in vitro cultured Doritaenopsis plants. Acta Physiol. Plant., 2008, 30: 339-343 ( ) DOI: 10.1007/s11738-007-0128-0
- Kreslavski V.D., Schmitt F.-J., Keuer C., Fridrich T., Shirshikova G.N., Zharmukhamedov S.K., Kosobryukhov A.A., Allakhverdiev S.I. Response of the photosynthetic apparatus to UV-A and red light in the phytochrome B-deficient Arabidopsis thaliana L. hy3 mutant. Photosynthetica, 2016, 54(3): 321-330 ( ) DOI: 10.1007/s11099-016-0212-z
- Terashima I., Fujita T., Inoue T., Chow W.S., Oguchi R. Green light drives leaf photosynthesis more efficiently than red light in strong white light: revisiting the enigmatic question of why leaves are green. Plant Cell Physiol., 2009, 50: 684-697 ( ) DOI: 10.1093/pcp/pcp034
- Kosobryukhov A.A., Lyubimov V.Yu., Kreslavski V.D. Adaptive mechanisms of photosynthetic apparatus to UV radiation. In: Stress response in plants/B.N. Tripathi, M. Müller (eds.). Springer International Publishing Switzerland, 2015, chapter 3: 59-78 ( ) DOI: 10.1007/978-3-319-13368-3_3
- Hogewoning S.W., Trouwborst G., Maljaars H., Poorter H., van Ieperen W., Harbinson J. Blue light dose-responses of leaf photosynthesis, morphology, and chemical composition of Cucumis sativus grown under different combinations of red and blue light. J. Exp. Bot., 2010, 6: 3107-3117 ( ) DOI: 10.1093/jxb/erq132


