Демонстрация возможности определения низкомолекулярных веществ (урацила и хромат-ионов) на приборе для электрофореза на микрочипах Shimadzu MCE-2010
Автор: Проскурнин М.А., Нечаев М.А., Пирогов А.В., Шпигун О.А.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Материалы научного семинара "Микрочиповые технологии в аналитической химии"
Статья в выпуске: 2 т.15, 2005 года.
Бесплатный доступ
В результате испытаний прибора для электрофореза на микрочипах Microchip Electrophoresis System MCE-2010 фирмы Shimadzu найдены условия получения воспроизводимых пиков урацила и хромата как модель-ных низкомолекулярных соединений. Показано, что прибор MCE-2010 характеризуется экспрессностью электрофоретического разделения и высокой воспроизводимостью времени выхода и площади пиков. Дос-тигнуто 7-10-кратное повышение экспрессности определения по сравнению с традиционным капиллярным зонным электрофорезом. Пределы обнаружения урацила и хромата составляют 2 и 1 мкг/мл соответственно.
Короткий адрес: https://sciup.org/14264383
IDR: 14264383 | УДК: 543.422.5;
Текст статьи Демонстрация возможности определения низкомолекулярных веществ (урацила и хромат-ионов) на приборе для электрофореза на микрочипах Shimadzu MCE-2010
В настоящее время появляются первые коммерческие приборы, в которых в аналитическом цикле для пробоподготовки, разделения и определения используют микрофлюидные чипы. Для многих из них все еще отсутствует методологическое и метрологическое обеспечение, что препятствует их внедрению в широкую практику химического анализа. Прибор для электрофореза на микрочипах Microchip Electrophoresis System MCE-2010 фирмы Shimadzu, появившийся в продаже в 2004 году, реализует высокоскоростной электрофоретический анализ в микроформате [1]. Хотя эта система использует те же принципы, что и капиллярный электрофорез, она обеспечивает высокоскоростное разделение с чрезвычайно малым расходом рабочего буфера и пробы [2]. Кроме того, разделительный канал короче и обеспечивает лучшее рассеивание тепла в сравнении с обычным капиллярным электрофорезом. Однако для данного прибора в настоящее время существуют только методики разделения и определения ДНК и подобных биологических объектов [2–4].
В данной работе исследована возможность электрофоретического определения низкомолекулярных веществ на микрочипах. Отсутствие методик для этих веществ существенно ограничивает применение MCE-2010. В качестве модельных соединений выбраны урацил и хромат калия. Урацил часто используют в хроматографии в качестве маркера мертвого времени удерживания. Пик его имеет симметричную форму, что позволяет оценивать размывание. Хромат часто используют в качестве буферного электролита в капиллярном электрофорезе. Кроме того, эти вещества хорошо поглощают УФ-излучение и для них существуют надежные методики определения методом капиллярного электрофореза [5, 6].
АППАРАТУРА, РЕАГЕНТЫ И ТЕХНИКА ЭКСПЕРИМЕНТА
Характеристики прибора
Shimadzu MCE-2010 способен автоматически проводить электрофоретическое разделение и детектирование в микроканалах, изготовленных в микрочипах на кварцевой подложке методом фотолитографии. В качестве источника излучения используется дейтериевая лампа, монохроматором служит дифракционная решетка. Рабочий диапазон длин волн 190–370 нм. Детектором служит фотодиодная матрица, состоящая из 1024 элементов (минимально определяемая оптическая плотность 1 х 10-5) [1, 2]. В работе использована длина волны 254 нм как наиболее часто использующаяся в капиллярном электрофорезе.
Порт 1 (порт ввода пробы) Канал №2 (разделительный канал), 25 мм
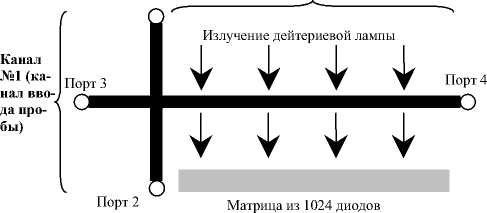
Рис. 1. Схема микрочипа прибора для электрофореза на микрочипах Shimadzu MCE-2010
На рис. 1 представлена схема микрочипа для электрофоретического разделения. Вследствие того что фотодиодная матрица проводит одновременное измерение по всей длине разделительного канала в течение всего процесса разделения, вместо традиционной временной шкалы в электрофореграммах, получаемых на Shimadzu MCE-2010, ось абсцисс имеет размерность длины и ее масштаб неизменен (25 мм — длина разделительного канала, рис. 1).
В работе использован микрочип для общего анализа Shimadzu Type U[50-20] (ширина каналов — 50 мкм, глубина — 20 мкм). Паспортное число теоретических тарелок 100 000 тт/м.
Программное обеспечение MCE-2010
Управление прибором (в том числе извлечение и установка чипа) полностью контролируется программным обеспечением компьютера, подключенным к MCE-2010. Общий цикл измерений представлен на рис. 2. Он состоит из позиционирования микрочипа относительно фотодетектора вдоль и поперек канала, измерения фонового поглощения пустого микрочипа и проверки работоспособности проточной системы (т. н. блок "пере-калибровки детектора") [2]. Далее выполняются системные программы и управление передается программам аналитического цикла: общей программы действий и цикла измерений (рис. 2).
Общая программа действий:
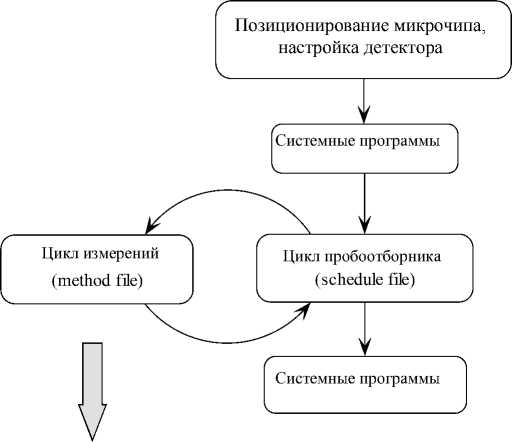
Цикл измерений:

Рис. 2. Принципиальная схема цикла аналитических измерений на приборе для электрофореза на микрочипах Shimadzu MCE-2010
Файлы общей программы действий (schedule file) содержат информацию о числе анализируемых проб и последовательности их измерений и о соответствующих файлах цикла измерений и отчета. Последовательность операций анализа одной пробы задается файлами цикла измерений (method file, рис. 2). В них содержится информация о дополнительных (опционных) системных операциях: промывка системы водой, буферным раствором, параметры системы при детектировании (тип чипа, рабочая длина волны, полярность, объем пробы и буферного раствора, напряжение на капиллярах на каждой стадии анализа, продолжительность каждой стадии и т. д.), параметры обработки полученной информации (необходимо ли вычитание фона и т. п.).
Реагенты
В работе использована деионизованная вода с удельным сопротивлением 18 МOм ⋅ см (рН 5.8, установка очистки воды Milli-Q, Millipore, Франция). Все использованные реагенты имели квалификацию не ниже ч.д.а. В качестве рабочего буферного электролита использованы трис-боратные буферные растворы (50 мМ тетрабората натрия и 50 мМ трис(гидроксиметил)аминометана). Водные растворы урацила (0.8 мг/мл) и хромата калия (1.0 мг/мл) в соответствующем буферном растворе служили в качестве исходных.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Существующие управляющие файлы (управления потоками и управления напряжениями на портах) оптимизированы в Shimadzu MCE-2010 для разделения и определения ДНК и микрочипов со специальным покрытием [3, 4]. Первые эксперименты показали, что параметры файлов цикла измерений, предлагаемые в руководстве к прибору [1] или имеющиеся в открытой печати для биологических методик [2–4], не пригодны для электрофоретического разделения низкомолекулярных веществ. В результате задачей работы был подбор параметров системы, которые позволили бы получать воспроизводимые пики выбранных модельных соединений. Кратко остановимся на основных моментах.
На чипе имеются перекрещивающиеся каналы: канал № 1 для ввода пробы, в канале № 2 происходит разделение компонентов. На чипе сделаны специальные углубления для ввода и вывода растворов, называемые "портами". При анализе пробы можно выделить три стадии. В стадии 1 на порт 1 прикладывается большое напряжение, а на порт 2 — нулевое. Напряжение на порты 3 и 4 подается равным и так, чтобы через них поток практически не шел. В результате электроосмотический поток движется только по первому каналу в направлении порта 2 (электрофоретический ввод пробы). В стадии 2 высокое напряжение прикладывается к порту 3, и электроосмотический поток движется по (разделительному) каналу № 2 в направлении порта 4. На стадии 3 напряжение на всех портах устанавливается нулевым и происходит фотометрическое детектирование вдоль всего канала в течение некоторого заданного времени (для улучшения соотношения сигнал-шум).
Основными изменяемыми параметрами были напряжения на капиллярах. В отличие от разделения биомолекул ввод в микрочип пробы объемом свыше 10 мкл приводит к возникновению большого пика или плато, окруженного отрицательными пиками. Причиной этого является, по-видимому, попадание пробы в разделительный канал на стадии ввода пробы и/или затягивание пробы в стадии 2 из канала ввода пробы в течение всего процесса разделения. Для минимизации этих процессов напряжения в стадии 2 на портах 3 и 4 увеличены по сравнению с определением биомолекул [2–4] для дополнительного сжатия зоны пробы (см. таблицу). Аналогично напряжения на портах 1 и 2 уменьшены для увеличения оттока пробы из канала 1. Оптимальный объем пробы для обоих модельных соединений составил 5 мкл.
Следует отметить, что работа прибора становится нестабильной при повышении напряжений на канале выше 1.4 кВ, а при токах порядка 800– 1000 мкА прибор автоматически отключается. Таким образом, при электрофоретическом разделении низкомолекулярных веществ приходится исходить из компромисса между высокими напряжениями на портах (узкая зона пробы) и нестабильной работой системы разделения или увеличением размывания пробы.
Оптимальный объем буферного раствора для разделения и определения одной пробы, составил 100 мкл, что полностью соответствует имеющимся данным [2–4]. Однако рекомендация промывания системы между анализами рабочим буферным раствором [2] приводила к снижению воспроизводимости результатов из-за различных значений токов в системе. Существенно лучшие результаты (форма пика и воспроизводимость) получали при двукратной промывке системы водой после каждого анализа (системная программа "water purge" [1], длительность 3 мин, 500 мкл воды). Поэтому в файле общей программы действий добавлена команда системе производить системную промывку "water purge" перед и после каждого анализа. Общее время анализа одной пробы составило, таким образом, 7 мин.
Параметры полученного файла цикла измерений для урацила представлены в таблице, типичная электрофореграмма представлена на рис. 3, а. Экспериментальное значение эффективности разделения составило 40 000 тт/м. По сравнению
Условия электрофоретического определения урацила и хромат-ионов на MCE-2010 и некоторые метрологические характеристики определения ( P = 0.95, n = 3). Объем пробы 5 мкл, объем буферного раствора, расходуемого на одну пробу, — 100 мкл
ЗАКЛЮЧЕНИЕ
В результате проведенных испытаний системы Shimadzu MCE-2010 найдены условия получения воспроизводимых пиков урацила и хромата в качестве модельных соединений. Показано, что прибор характеризуется экспрессностью электрофоретического разделения и высокой воспроизводимостью времени выхода и площади пиков. Достигнуто 7–10-кратное повышение экспрессности определения по сравнению с традиционным КЗЭ. Однако разработка полных методик определения этих веществ методом капиллярного электрофореза на микрочипе требует дальнейших экспериментов.
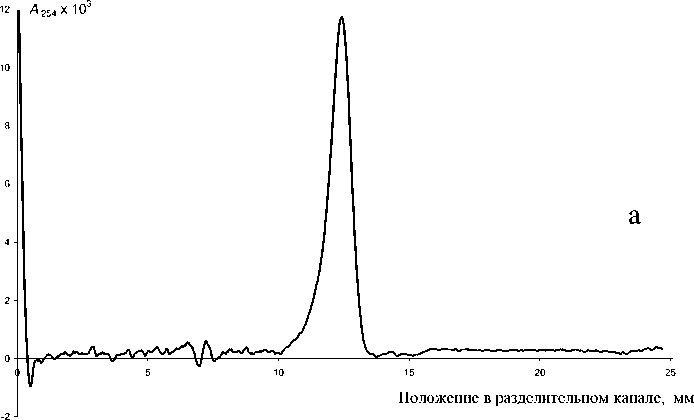
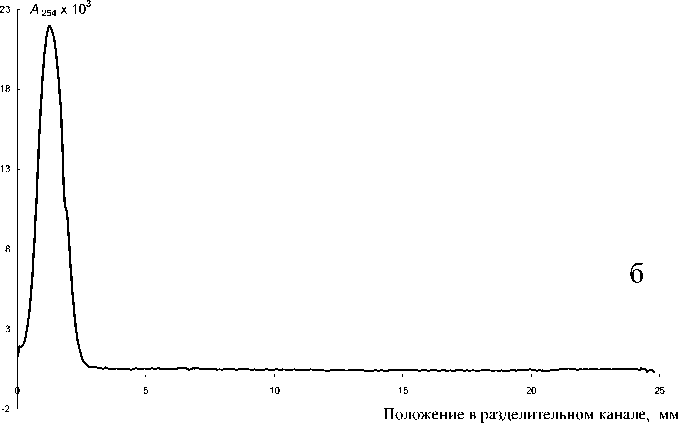
Рис. 3. Определение урацила (0.8 мг/мл) (а) и хромата (0.78 мг/мл) (б) в буферном растворе (50 мМ тетрабората натрия и 50 мМ трис). Объем пробы — 5 мкл, объем буферного раствора — 100 мкл. Длина волны — 254 нм. Другие параметры разделения представлены в таблице


