Десятилетние результаты органосохраняющего лечения рака молочной железы с применением интраоперационной лучевой терапии
Автор: Дорошенко Артем Васильевич, Слонимская Елена Михайловна, Старцева Жанна Александровна, Лисин Валерий Андреевич, Гарбуков Евгений Юрьевич, Тарабановская Наталья Анатольевна, Кокорина Юлия Леонидовна, Литвяков Николай Васильевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 6 т.16, 2017 года.
Бесплатный доступ
Целью исследования является анализ десятилетних результатов органосохраняющего лечения с применением электронной интраоперационной лучевой терапии (ИОЛТ) и дистанционной гамма-терапии (ДГТ) у больных раком молочной железы (РМЖ). Материал и методы. В исследование включено 905 больных РМЖ T1-2N0-1M0 после комбинированного лечения с органосохраняющими операциями. В I группе (n=746) проводилась ИОЛТ в однократной дозе 10 Гр (24,8 Гр по изоэффекту) с последующей адъювантной ДГТ на молочную железу в стандартном режиме, средняя величина - СОД 46 ± 8,1 Гр, курсовая доза на область ложа удаленной опухоли - 60 изоГр (100 усл. ед. ВДФ). Во II (контрольной) группе (n=159) проводилась ДГТ на оставшуюся молочную железу в СОД 40-44 Гр и электронная терапия на область послеоперационного рубца: РОД 3,0-4,0 Гр, 3 фракции в нед, СОД 15-18 изоГр, курсовая доза - 58 изоГр. Результаты. Лучевые реакции I степени по шкале RTOG/EORTC в I группе отмечались у 413 (55,3 %), во II группе - у 71 (44,6 %) больной (р=0,2); II степени - в 76 (10,1%) и 43 (27 %) случаях (p=0,0002); III степени - у 18 (2,4 %) и 9 (5,7 %) больных соответственно (р=0,1). Поздние лучевые повреждения I и II степени наблюдались преимущественно в группе контроля в виде пигментации кожи и лёгкой индурации подкожной клетчатки. Местные рецидивы диагностированы в I группе у 11 (1,47 %), во II (контроль) группе - у 14 (8,8 %) больных. Десятилетняя безрецидивная выживаемость составила в I группе 97,3 ± 1,08 %, в группе контроля - в 88,96 ± 2,8 % (р function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Рак молочной железы, комбинированное лечение, лучевая терапия, органосохраняющие операции
Короткий адрес: https://sciup.org/140254147
IDR: 140254147 | УДК: 618.19-006.6-059-089:615.849.1 | DOI: 10.21294/1814-4861-2017-16-6-11-17
Текст научной статьи Десятилетние результаты органосохраняющего лечения рака молочной железы с применением интраоперационной лучевой терапии
Рак молочной железы (РМЖ) устойчиво занимает лидирующие позиции в структуре онкологической заболеваемости и смертности женского населения как в мире, так и в России. В России отмечается ежегодный прирост больных, у которых злокачественные новообразования в молочной железе выявляются на ранних стадиях заболевания. В 1993 г. удельный вес пациенток с I–II стадиями РМЖ составлял 57,6 %, в 2013 г. –
66,7 % [1], что позволяет увеличить количество органосохраняющих операций, обеспечивая при этом высокое качество жизни [2]. Изначально главной проблемой органосохраняющего лечения был более высокий риск развития местных рецидивов (8–39 %) по сравнению с радикальной мастэктомией (1–12 %). Известно, что проведение адъювантной лучевой терапии (АЛТ) позволяет существенно снизить частоту рецидивирования
после органосохраняющих операций, что подтверждено данными большого числа публикаций. По данным B. Fisher et al. [3], послеоперационная дистанционная лучевая терапия (ДЛТ) позволяет в 3 раза уменьшить риск местных рецидивов при органосохраняющих операциях. Результаты оказались сопоставимы с выполнением радикальной мастэктомии. Метаанализ 17 рандомизированных исследований, который включал более 10 тыс. больных РМЖ после органосохраняющих операций за 10-летний период наблюдения, показал, что в группе пациенток, которым не проводилась дистанционная лучевая терапия на область молочной железы, местные рецидивы возникли в 25 %, в то время как при ДЛТ – в 8 % случаев [4].
Рецидивы рака молочной железы преимущественно выявляются в области послеоперационного рубца – в 44–86 % наблюдений и значительно реже в других квадрантах [5]. Это обусловлено тем, что самая высокая плотность опухолевых клеток (до 90 %) определяется на расстоянии до 4 см вокруг макроскопически определяемого узла [6], что определяет необходимость усиления локального воздействия на ложе удалённой опухоли. В исследовании EORTC 22881–10882 было показано значимое снижение частоты местных рецидивов при применении буста 16 Гр на область послеоперационного рубца дополнительно к ДЛТ всей молочной железы в дозе 50 Гр – 6,2 % против 10,2 % соответственно [7].
Несмотря на доказанную эффективность АЛТ при органосохраняющем лечении больных раком молочной железы, её проведение в ряде случаев может сопровождаться развитием осложнений со стороны здоровых органов и тканей. Наблюдается гиперпигментация и атрофия кожи, нередко в зоне облучения развивается фиброз, что позднее вызывает деформацию органа и ухудшение эстетических результатов лечения [8]. Со стороны легких возникают пульмониты, фиброз, приводящие к нарушению функции дыхания [9]. Было отмечено увеличение частоты рака легких после проведения дистанционной лучевой терапии на область оставшейся молочной железы [10]. Имеются сообщения о влиянии облучения на сердце, что приводит к повышению смертности от сердечно-сосудистых заболеваний [11]. Именно эти обстоятельства определяют целесообразность поиска новых, более эффективных и безопасных методов локального воздействия, одним из которых является интраоперационная лучевая терапия (ИОЛТ).
Очевидным преимуществом ИОЛТ является то, что во время хирургического вмешательства источник излучения можно подвести непосредственно к ложу опухоли, вследствие чего удаётся избежать воздействия облучения на кожу, подкожную клетчатку и, соответственно, уменьшить риск развития фиброза, а также сохранить косметический результат [12]. Кроме этого, ИОЛТ позволяет несколько сократить сроки проведения АЛТ.
Цель исследования – анализ десятилетних результатов органосохраняющего лечения с интраоперационной электронной лучевой терапией и дистанционной гамма-терапией у больных раком молочной железы T1–2N0–1M0.
Материал и методы
В исследование было включено 905 больных раком молочной железы со стадией процесса T1–2N0–1M0, получавших лечение в отделении общей онкологии НИИ онкологии Томского НИМЦ с 2000 по 2015 г. Возраст пациенток варьировал от 20 до 70 лет, в среднем – 48 ± 5,8 года. Во всех случаях диагноз РМЖ был верифицирован морфологически. На хирургическом этапе комбинированного лечения всем пациенткам были выполнены органосохраняющие операции. Системное лечение в неоадъювантном режиме проведено 44,1 % больным, в адъювантном режиме – 45,6 %, гормонотерапию получили 77 % пациенток. Всем больным, включенным в исследование, проводилось облучение. В зависимости от применяемой методики лучевой терапии были сформированы 2 группы пациенток (рис. 1):
В I группу (основную) включено 746 пациенток, которым проводилась интраоперационная лучевая
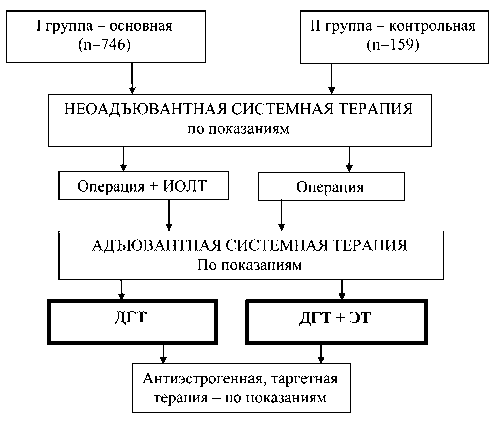
Рис. 1. Дизайн исследования терапия на малогабаритном бетатроне МИБ–6Э, установленном непосредственно в операционной. Однократная доза ИОЛТ на ложе удаленной опухоли составила во всех случаях 10 Гр (24,8 Гр по изоэффекту). Для облучения использовались специально разработанные коллиматоры (патент РФ на полезную модель № 71074), которые подбирались в зависимости от размеров операционной раны. В послеоперационном периоде осуществлялась дистанционная гамма-терапия на оставшуюся молочную железу. Режим фракционирования был стандартным: разовая очаговая доза 2 Гр, 5 фракций в нед. Расчет необходимого числа сеансов и курсовой дозы смешанного облучения проводили по специально разработанной формуле в зависимости от интервала между ИОЛТ и началом ДЛТ. Средняя величина суммарной очаговой дозы гамма-терапии на оставшуюся молочную железу составляла 46 ± 8,1 Гр, курсовая доза смешанного облучения в области ложа удаленной опухоли после проведения ИОЛТ и ДГТ – 60 изоГр (100 усл. ед. ВДФ).
Во II (контрольной) группе, включавшей 159 больных, дистанционная гамма-терапия на оставшуюся молочную железу проводилась после органосохраняющей операции в СОД 40–44 Гр. Дополнительно на область послеоперационного рубца выполняли электронную терапию, средней энергией 7–8 МэВ на малогабаритном бетатроне в режиме: РОД 3,0–4,0 Гр, 3 фракции в нед, СОД 15–18 изоГр. Курсовая доза облучения в области ложа удаленной опухоли составляла 58 изоГр.
По основным клинико-морфологическим параметрам, а также по объему выполненного лечения сформированные группы были репрезентативны (таблица).
Анализ данных осуществляли при помощи прикладного пакета STATISTICA 8.0 for Windows (StatSoft Inc., USA). Продолжительность жизни больных высчитывалась моментным методом по Kaplan – Meier с применением log-rank-теста. Сроки наблюдения составили от 2 до 10 лет. Лучевые повреждения оценивались по шкале RTOG/ EORTC.
Результаты и обсуждение
На первом этапе исследования был разработан и клинически апробирован метод органосохраняющего лечения с применением ИОЛТ у боль-
Таблица
Характеристика групп больных по основным клинико-морфологическим критериям и проведенному объему лечения
|
Характеристика |
I (основная) группа |
II (контрольная) группа |
|
|
групп больных |
(n=746) |
(n=159) |
|
|
Возраст |
< 40 лет |
204 (27,3%) |
39 (24,5%) |
|
> 40 лет |
541 (72,5%) |
120 (75,5%) |
|
|
Стадия опухолевого процесса |
T1N0M0 |
183 (24,5%) |
32 (20,1%) |
|
T2N0M0 |
293 (39,2%) |
65 (40,9%) |
|
|
T1-2N1M0 |
269 (36%) |
62 (39%) |
|
|
Гистологический вариант опухоли |
Инфильтрирующий протоковый |
675 (90,4%) |
146 (91,8%) |
|
Инфильтрирующий дольковый Другие формы |
41 (5,4%) 29 (3,8%) |
7 (4,4%) 6 (3,8%) |
|
|
Радикальная резекция |
395 (52,9%) |
104(65,4%) |
|
|
Вид операции |
Секторальная резекция, лимфаденэктомия |
317 (42,4%) |
55 (34,6%) |
|
Неоадъювантная химиотерапия |
331 (44,3%) |
71 (44,6%) |
|
|
Системная терапия |
Адъювантная хмиотерапия |
337 (45,1%) |
74 (46,5%) |
|
Гормонотерапия |
529 (70,9%) |
133 (83,6%) |
ных РМЖ. Суть метода состоит в том, что после удаления опухоли молочной железы формируется поле облучения: нижние края раны стягиваются лигатурами, что позволяет вывести из зоны лучевой терапии большую грудную мышцу, создать достаточно равномерную поверхность раны. Затем в рану устанавливается коллиматор, соответствующий размерам операционного поля, по нижнему краю которого просверлены отверстия, позволяющие фиксировать нижние края раны нитками к устройству, что исключает попадание в область облучения кожи и подлежащей жировой клетчатки и придает «жесткость» конструкции. Далее проводится сеанс ИОЛТ в дозе 10 Гр (24,8 Гр по изоэффекту). Процедура по установке коллиматора в рану и проведение облучения занимали не более 15 мин.
Какого-либо влияния ИОЛТ на ход операции и течение послеоперационного периода отмечено не было. Лучевых реакций, связанных непосредственно с ИОЛТ, в послеоперационном периоде не возникало. Наиболее часто встречающимися ранними лучевыми реакциями на фоне проведения ДЛТ у больных обеих групп были проявления слабо выраженной эритемы и сухого эпидермита – повреждения I степени. Они проявились у 413 (55,3%) пациенток, получавших ИОЛТ и ДГТ, и у 71 (44,6%) больной, получавших гамма-электронную терапию, различия не имеют статистической значимости (р=0,2). Более существенные изменения, относящиеся к II степени повреждений и проявляющиеся развитием умеренного отёка, островкового влажного эпидермита, значимо чаще отмечались в контрольной группе – в 43 (27 %) случаях, тогда как в основной группе они наблюдались у 76 (10,1 %) больных (p=0,0002). Развитие влажного эпидермита на фоне выраженного отёка ткани молочной железы (III степень по шкале RTOG) было отмечено у 18 (2,4 %) больных, получивших сочетанную ИОЛТ и ДЛТ, и у 9 (5,7 %) пациенток, которым в послеоперационном периоде проводили гамма-электронную лучевую терапию. Различия оказались статистически не значимыми (р=0,1).
Поздние лучевые повреждения I степени достоверно чаще наблюдались во II (контрольной) группе как со стороны кожи в виде пигментации – у 53 (7,1 %) и 23 (14,5 %) пациенток, так и со стороны подкожной клетчатки в виде лёгкой индурации – у 244 (32,7 %) и 78 (49 %) соответственно (р=0,03). Развитие умеренного фиброза, относящегося ко II степени поздних лучевых повреждений, значимо чаще проявлялось у больных РМЖ при послеоперационной гамма-электронной терапии – в 21,3 % наблюдений. В группе пациенток, получивших ИОЛТ и ДГТ, подобные изменения отмечены лишь в 12,4 % случаев (р=0,04). Лучевые реакции III степени наблюдались крайне редко. Выраженный фиброз в области послеоперационного рубца развился у 3 (0,4 %) пациенток в группе с ИОЛТ и у 3 (1,8 %) больных контрольной группы (р=0,1).
Местные рецидивы были диагностированы у 11 (1,5 %) пациенток I группы, тогда как в группе контроля число рецидивов составило 14 (8,8 %) случаев. Важно отметить, что в зоне проведения ИОЛТ (в области послеоперационного рубца) рецидивы опухоли возникли у 4 (0,5 %) больных, у остальных пациенток рост новообразований наблюдался в других квадрантах молочной железы. В контрольной группе рецидивы РМЖ в области послеоперационного рубца наблюдались значимо чаще – у 8 (5,0 %) больных (р<0,05). Десятилетняя безрецидивная выживаемость в основной группе составила 97,3 ± 1,1 %, в группе контроля – 88,9 ± 2,8 %. Различия статистически значимы (р<0,05). Наибольшая частота местных рецидивов в обеих группах отмечена у больных с размером опухоли T2: в основной группе – 81,8 %, в контрольной – 78,5 % (р>0,05). При метастатическом поражении регионарных лимфоузлов рецидивы возникли у 72,7 % пациенток I группы и у 71,4 % больных II группы (р>0,05). Частота рецидивов в зависимости от молекулярных подтипов опухоли в основной группе составила при люминальном РМЖ – 54,5 %, при трижды негативном – 27,3 %, Her2Neu-положительном статусе – 18,2 % наблюдений. В контрольной группе – в 50, 35,7 и 14,2 % случаев соответственно (р>0,05).
За 10 лет наблюдения в основной группе больных метастазы опухоли были выявлены в 19 (3,9 %), в группе контроля – в 16 (10,1 %) случаях. Показатели безметастатической выживаемости в I и II группах составили 94,4 ± 2,7 и 90,5 ±1,4 % соответственно (р<0,05). Метастазирование чаще возникало при размерах опухоли, соответствующей T2: в I группе – у 63,5 %, во II группе – 62,5 % больных. При метастатическом поражении регионарных лимфоузлов отдаленные метастазы возникли у 74 % больных, получавших ИОЛТ, и у 75 % – дистанционную гамма-электронную терапию. Значимых различий отдаленных результатов в сравниваемых группах в зависимости от молекулярного подтипа опухоли не отмечено.
Таким образом, анализ полученных результатов свидетельствует о том, что у больных РМЖ, получавших смешанную лучевую терапию (ИОЛТ и ДГТ) в сочетании с органосохраняющими операциями, наблюдались значимо лучшие 10-летние показатели безрецидивной и безметастатической выживаемости по сравнению с пациентками контрольной группы. Кроме того, при применении ИОЛТ отмечается меньшая частота ранних и поздних лучевых реакций.
Работа выполнена при поддержке гранта РНФ № 17-15-01203.
Список литературы Десятилетние результаты органосохраняющего лечения рака молочной железы с применением интраоперационной лучевой терапии
- Петрова Г.В., Каприн А.Д., Грецова О.П., Старинский В.В. Злокачественные новообразования в России (обзор статистической информации за 1993-2013 гг.). М., 2015. 511.
- Kim M.K., Kim T., Moon H.G., Jin U.S., Kim K., Kim J., Lee J.W., Kim J., Lee E., Yoo T.K., Noh D.Y., Minn K.W., Han W. Effect of cosmetic outcome on quality of life after breast cancer surgery. Eur J Surg Oncol. 2015 Mar; 41 (3): 426-32. DOI: 10.1016/j.ejso.2014.12.002
- Fisher B., Anderson S., Bryant J., Margolese R.G., Deutsch M., Fisher E.R., Jeong J.H., Wolmark N. Twenty-year follow-up of a randomized trial comparing total mastectomy, lumpectomy, and lumpectomy plus irradiation for the treatment of invasive breast cancer. N Engl J Med. 2002 Oct 17; 347 (16): 1233-41.
- Early Breast Cancer Trialists’ Collaborative Group (EBCTCG), Darby S., McGale P., Correa C., Taylor C., Arriagada R., Clarke M.,Cutter D., Davies C., Ewertz M., Godwin J., Gray R., Pierce L., Whelan T., Wang Y., Peto R. Effect of radiotherapy after breast-conserving surgery on 10-year recurrence and 15-year breast cancer death: meta-analysis of individual patient data for 10,801 women in 17 randomised trials. Lancet. 2011 Nov 12; 378 (9804): 1707-16. DOI: 10.1016/S0140-6736(11)61629-2
- Sanders M.E., Scroggins T., Ampil F.L., Li B.D. Accelerated partial breast irradiation in early-stage breast cancer. J Clin Oncol. 2007 Mar 10; 25 (8): 996-1002.


