Деструкция биопленок коагулазонегативных стафилококков под действием бактериальных катионных пептидов
Автор: Коробов В.П., Лемкина Л.М., Полюдова Т.В.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 3, 2015 года.
Бесплатный доступ
В результате проведенных исследований установлено, что бактерии разных штаммов коагулазоне-гативных стафилококков обладают выраженной способностью к образованию биопленок. Динамика роста биопленок бактерий разных штаммов существенно различается. Биопленки, образованные антибиотикочувствительными бактериями, достигают своего максимума через сутки. Пленкофор-мирующий процесс бактерий полирезистентного штамма развивается более медленно, характеризуется перманентным ростом и достигает максимума лишь на 4 сутки. Предупреждение развития биопленок стафилококков возможно при внесении в среду роста низкомолекулярных антибактериальных катионных пептидов - варнерина и хоминина. Как показали эксперименты, данные пептиды способны не только предупреждать развитие биопленок, но и активно разрушать уже сформированные зрелые биопленки коагулазонегативных стафилококков.
Антибиотикорезистентность, биопленки, катионные антибактериальные пептиды, коагулазо-негативные стафилококки
Короткий адрес: https://sciup.org/147204728
IDR: 147204728 | УДК: 579.22
Текст научной статьи Деструкция биопленок коагулазонегативных стафилококков под действием бактериальных катионных пептидов
Уникальные биологические особенности бактерий, такие как наличие разнообразных механизмов адаптации к постоянно меняющимся параметрам сре-ды: позволяют их подавляющем}7 большинству' сохранять жизнеспособность и поддерживать опреде-пенную численность тюпуляции даже в самых экстремальных и агрессивных условиях. Одними из самых значимых адаптивных свойств бактерий является их способность формировать биопленки на грани цах раздела фаз, а также быстрое формирование устойчивости к токсичным соединениям и, в частности, к антибиотикам. В настоящее время считается, что эти два чрезвычайно важных проищи взаимосвязаны, поскольку развитие а нгибиотикорезистентности бактерий в составе биопленки происходит значительно быстрее [Лямин и др. 2012].
Широкое применение б медицинской практике биоматхриалов и искусственных устройств (дре-
电 Коробов В. П., Лемкина Л. М., Полюдова Т. В., 2015
нажи* катетеры, сетки, протезы) способстБует формированию на их поверхностях бактериальных биопленок и повышает риск распространения инфекции в организме [Псрспанова, 2013]. Заболевания, обусловленные биоматсриал-ассоциированны-ми инфекциями, требуют более тщательного подбора доз антибактериальных препаратов, поскольку минимальные ингибирующие концентрации антибиотиков для бактерий в составе биопленок значительно превышают таковые для планктонных клеток [Frank et al.. 2007]. Учитывая высокую приспособляемость бактерий к антибиотическим соединениям, наиболее остро стоит вопрос о поиске средств, эффективно препятствующих образованию биопленок и способствлтощих разрушению зрелых бактериальных пленок. К группе таких соединений, по-видимом>; мопгт быть отнесены антибактериальные катионные пептиды, выделяемые всеми живыми организмами, в том числе, и самими бактериями [Коробов, 2011; Jorge et al, 2012]. Для катионных пептидов варнерина и хоминина, выделенных из коагуглазонегэтивных стафилококков, показана высокая эффективность предотвращения адгезии к полистирол бактерий Staphylococcus epidermidis [Eroshenko. Korobow 2015] и Propion / b acien if tn acnes [Полюдова и др. 2015]t
Целью настоящей работы явилось изучение динамики формирования биопленок на поверхности полистирола чувствительными и антибиотикорезистентными бактериями разных штаммов коаг ) ла- 而 негативных стафилококков (КНС)* а также экспериментальное обоснование возможности применения а нтиба ктериа льных пептидов варнерина и хомнннна для предупреждения пленкообразования и разрушения зрелых биопленок КНС.
Материалы и методы исследования
В качестве объекта исследования использовали ба ктерии коа г^лазонегативных стафилококков (КНС): Staphylococcus epidermidis ГИСК 33 (「 осу-дарственная коллекции патогенных микроорганизмов Государственного на^но-исследователь-ского ннстнтута стандартизации и контроля медицинских и биологических препаратов, Москва), полученный селекционным путем штамм, устойчивый к ципрофлоксацину' 5 : epidemidis ЗЗ-Cf1 [Коробов и др., 2015]. Кроме того, при скрининге более 1000 клинических штаммов КНС, обладающих резистентностью к антибиотикам, был выделен штамм стафилококков, обладающий устойчивостью к 10 антибиотикам. Штамм получил лабораторный порядковый номер 831. Проведенная процедура идентификации с использованием диагностического набора StaphVest 24 (Lachema, Чехия), позволила отнести эти бактерии к вш^у У xyhsus.
Культивирование микроорганизмов проводили на модифицирова иной жидкой богатой питательной среде Luria-Bertani (LB), содержащей (г/л):
триптон (Sigma) - 10.0, дрожжевой экстракт (Sigma)-5 Д КС1-64
Планктонные культуры стафилококков выращивали при 37℃ на ротационном шейкере CERTOMAT IS (Sanorius, Германия) при 150 об/мин. Интенсивность роста в жидких к>гльтуграх оценивали по оптической плотности при длине волны проходящего света 600 нм (口 D^J на спек-тро 巾 отометре PD-3O3 (Япония).
Культуры бактерий, выращенные на среде LB до середины лог-фазы, разводили свежей питательной средой до оптической плотности OD^oo 0.015 (107^КОЕ/мл) и вносили по 100 мкл в лунки плоскодонных полистироловых планшетов (Мед-полимер* Россия). Культивирование проводили в течение 15 сут при 37℃ в термостате. Далее планктонные клетки аккуратно удаляли, лунки дважды промывали 200 мкл 10 мМ фосфатного буфера (pH 7.2).
Для оценки влияния антибактериальных пептидов на формирование биопленок; в лунки планшетов одновременно вносили по 90 мкл среды LB с растворенными в ней препаратами варнерина или хоминина в количестве 8-128 мг/мл. После чего добавляли 10 мкл индикаторных бактериальных культур, содержащих 106> : КОЕ/мл.
Для изучения влияния пептидов на уже образовавшиеся биопленки растворы варнерина и хоми-нтна в LB вносили в ^гнки с Отмыты\ги ^иопден-ками и культивировали в течение 24 ч. В контрольном варианте биопленки инкубировали с0.14 М раствором NaCl. Затем из jij hok планшетов удаляли жидкую часть, лунки промывали фосфатным буфером и подсушивали. Далее для определения биомассы пленок б каждую лунқу планшета вносили по 100 мкл 0.1%-ного раствора генцианвио-лета в 0.14 М растворе NaCl? выдерживали 20 мин.. 箍 тем краситель удаляли, лунки дважды промывали фосфатным буфером, высушивали, и производили экстракцию связавшегося с биопленками красителя 96%-ным этанолом (100 мкл на лунку) в течение 20 мин. Количественную оценк5г этанольных экстрактов осуществляли на микропла ншетнойі спектрофотометре Benchma rk Plus , (Bio-Rad, США) при длине волны 570 нм.
Для определения жизнеспособности клеточных элементов окрашивание биопленок проводили тег-разолием с использовиниейі системы Cell Proliferation Assay в соответствии с инструкцией фирмы (Prainega, США). В каждую лунку на отмытые от срепы биопленки бактерий вносили по 100 мкл во ды, добавляли 20 мкл реакционной смеси и инкубировали 4 ч. при 37℃. Интенсивность окраски измеряли на м икропланшетном спектрофотометре Benchmark Plus (Bio-Rad? США) при длине волны 490 нм.
Поста новк5г антибактериального теста проводи- ли методом серийных разведении в стерильных иммунологических планшетах (Медполимер. Россия). В лунки планшетов вносили по 100 мкл среды LB, не содержащей КС1. В первою лунку ряда вносили 100 мкл исследуемого раствора антибактериальных пептидов и готовили серию двукратных разведений. Затем в каждою лунку вносили по 10 мкл суспенмнм бактерий, содержащей 10б>^КОЕ/мл (в качестве инокулятов использовали клетки лог-фа^ы роста).
При подсчете минимальных подавляющих концентраций (МПК) пептидов для разных бактерийһ учитывали их известное значение МПК для бактерий S. epidermidis ГИСК 33* составляющее 0.25 мкг/мл (как для варнерина. так и для хоминина). При расчете количеств пептидов необходимых для подавления роста антибиотикорезистентных бак-т€рий, учитывали максимальное разведение, при котором наблюдалось отсутствие роста через 16-18 4. инкубации и сраЕннЕалп с разведеним, ингибирующим рост S. epidenftidis ГИСК 33.
Определение антибиотикорезистентности проводили ДИСКОДиффу зионным методом согласно Методическим указаниям [МУК, 2004]. Для постановки тестов использовали бактерии лог-фазы роста и диски, пропитанные стандартными растворами антибиотиков (НИЦФ, Россия). Чувствительность к антибиотикам определяли по диаметру зон подавления роста колоний исслед>гемых бактерий.
Повторность всех экспериментов трехкратная. Статистическою обработку экспериментальных данных проводили с помощью компьютерной программы Microsoft Excel 2000 (Microsoft Inc+, 1999). рассчитывая среднее арифметическое значение и стандартное отклонение.
Результаты и обсуждения
Диско-диффузионный метод определения анти-биотикочувствительности исследуедіых штаммов показал, что бактерии штамма S epideruudis ГИСК 33 обладают ВЫСОКОЙ чувствительностью ко всем щученным антибиотикам, кроме клиндамицина (табл, 1).
Бактерии S epidmnidis 33 Cf проявляли устой-чивось к ципрофлоксацин), и новобиоцину, а бактерии полирезистентного клинического штамма S xylosus S31 были устойчивы к 10 антибиотикам, но обладали низкой чувствительностью к амикацину, оксациллину и ципрофлоксацину (табл, 1).
Таблица 1
Антибиотикочувствите<чьность бактерий исследуемых штаммов КНС (диаметр $ин подавления роста, мм)
Изучение чу ветвите льности планктонных культур исследуемых стафилококков к катионным пептидам варнерину и хоминину [Коробов и др+ 2010“ 2014] показало, что минимальная подавляющая концентрация (МПК) пептидов значительно различается для разных штаммов. Из представленных данных ВИДНО. ЧТО наибольшей Ч) БСТБИТеЛЬНОСТЬЮ к катионным антибактериальным пептидам обладали бактерии вида S. epiden?iidis, а с приобретением устойчивости к ципрофлоксацину незначительно снижалась чувствительность ЛИШЬ К катионному пептиду хоминину. При действии на поли- резистентный штамм S xytcsus 831 варнерин и сниженной ч^ъствительности этих бактерий к дан-хоминин проявляли активность при значительно ным соединениям (табл. 2).
больших конце игра циях^ св идете льств >ю щих о
Таблица 2
Минимальная подавляющая концентрация анпгбактернальны\ катионные пептидов лл 篇 исслелонанных штаммов КНС (мкг/мл)
|
Пептид |
S.epidefmidis ГИСК 33 |
S.epidermidis ГИСК 33 Cf |
S. xy^osus 831 |
|
Варнерин |
0.25 |
0.25 |
1000 |
|
Ходіинин |
0.25 |
S5 |
1000 |
При изучении способности бактерий формировать биопленки на поверхности полистирола было показано, что динамика роста биомассы пленок и количества живых клеток в них различаются у разных штаммов.
Биомасса пленок бактерий S. epidevmidis ГИСК 33 г и численность живых клеток в них достигали максимума уже 'іерез 24 ч+ При дальнейшем к ) тль-тиБировании наблюдалось снижение обоих показателей. Важно отметить, что на фоне постепенного падения биомассы пленок происходило резкое снижение содержания в них жизнеспособных кле-
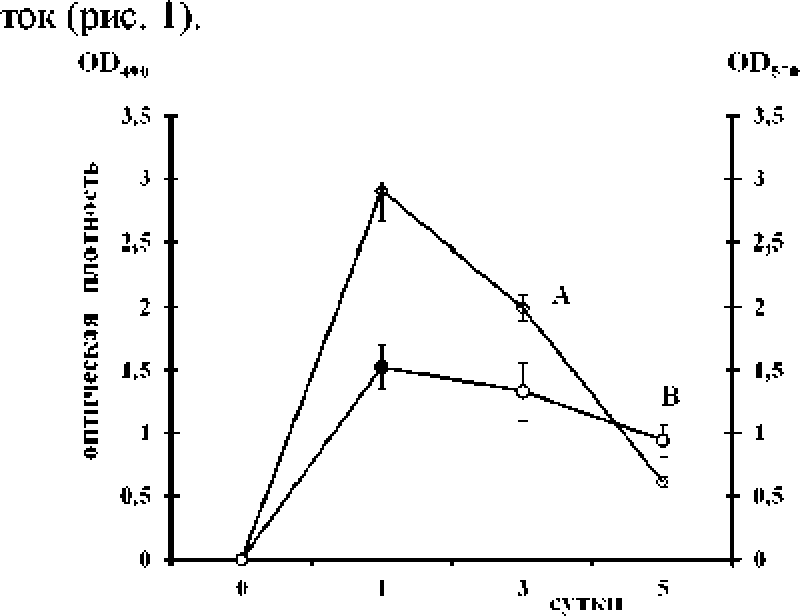
Рис. 1. Динамика роста биопленок
5 : epidemidis ГИСК 33:
А - число живых клеток в биоплснке; В -биомасса плеіпси
Несколько иная картина динамики развития биопленок была характерна для бактерий £ epidermidis ГИСК 33 С 产, устойчивых к ципрофлоксацину, В это^< случае максимумы биомассы пленок и количества живых клеток в них также достигались уже через сутки. При дальнейшем ку л ьтив ирова нии наблюдалось резкое снижение биомассы пленок? однако, количество живых клеток в них продолжало возрастать (рис. 2).
Снижение биомассы пленок бактерий S epi-dermidis ГИСК 33. вшможно. было связано с истощением питательных веществ в среде и разрушением по лисахар идного матрикса собственными литическими ферментами, которые присутствуют в клеточных стенках данного штамма стафилококков [Коробов и др., 2010].
Формирование биопленок бактериями полире-зистентного штамма S xylosus 831 происходило более длительное время (рис. 3)+ Максимальны* значений биомасса пленок достигала лишь на ЗТ-е сут+ культивирования* Следует отметить* что перманентный рост биопленок S xy^osus 831* ха-рактери^овалея двумя фазами увеличения их биомассы и содержания жизнеспособных клеток - фазой быстрого роста (1 сут) и фазой стабилизации этих показателей (2-4 сут.)+
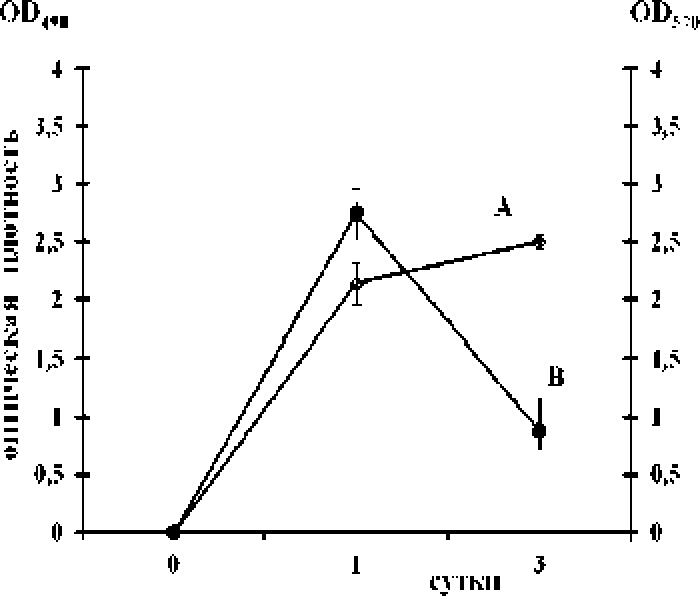
Рис. 2* Динамика роста биопленки S epidermidis ГИСК 33 Cf:
А - число живых клеток в биоплеіЕке. В -биомасса пленки
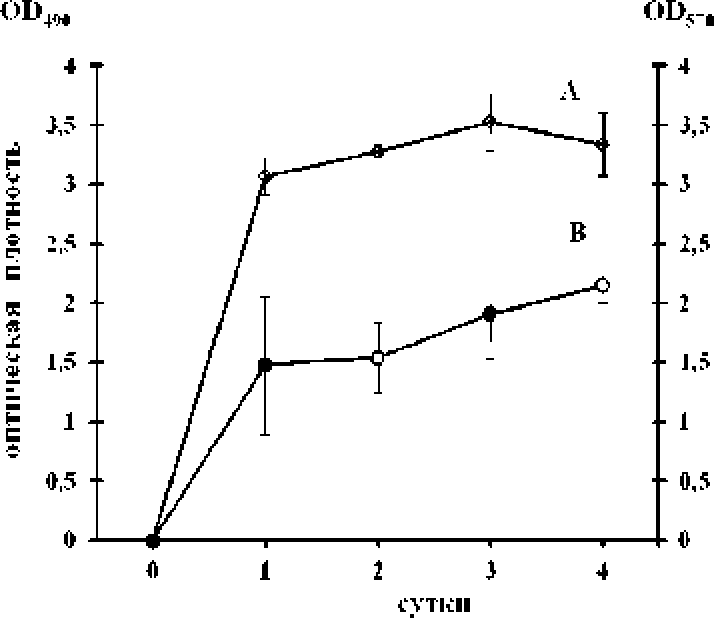
Рис. 3* Динамика роста биопленки Sxylostis 831:
А - число живых клеток в биоппенке, В -биомасса пленки
Для определения влияния варнерина и хомини-на на способность бактерий к образованию биопленок. одновременно с инок\тлумом в питательную среду добавляли эти антибактериальные пептиды. Согласно полученным данным, наличие в среде роста стафилококков варнерина или хоми-нина. приводило к значительному уменьшению биомассы пленок (рис. 4) и количества жизнеспособных бактериальных клеток в сформированных в течение 1 сут. биопленках (рис. 5).
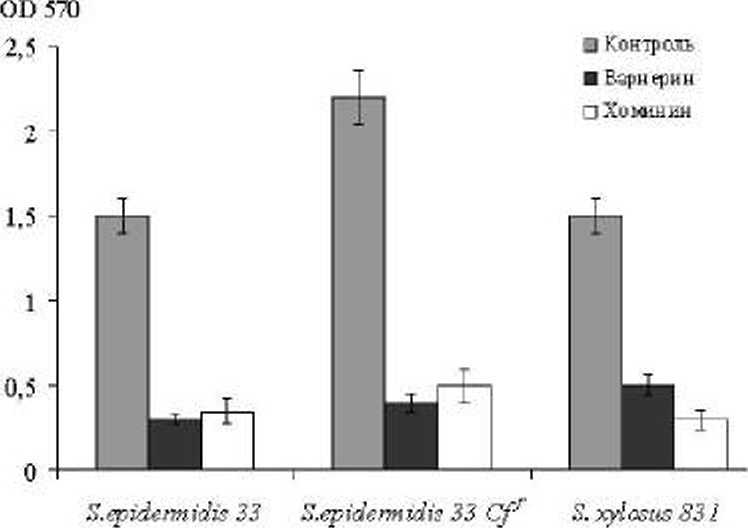
Рис. 4. Формирование биомассы пленок стафилококков в течение суток в
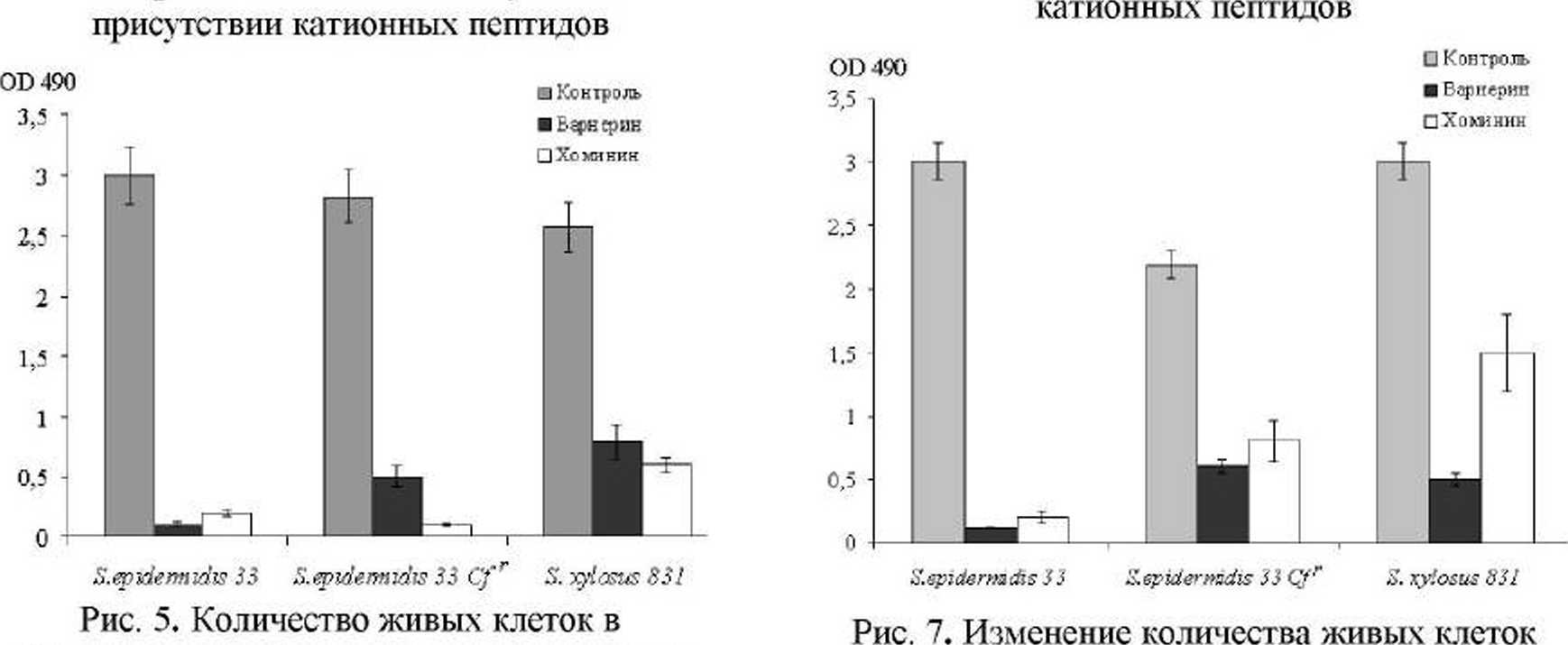
биопленках стафилококков, выращенных в течение суток в присутствии катионных
пептидов
Важным практическим аспектом поллненных результатов является факт ингибирокшия процесса пленкообразования полирезистентных бактерий клинического изолята S xylosus 831.
Однако известно, что бактерии в составе биопленок имеют повышенную выживаемость в при-сутствми антибактериальных веществ, позтому важно было исследовать влияние низкомолекулярных катионных пептидов на сформировавшиеся в течение суток биопленки использованных в работе штаммов стафилококков. Влияние низкомолекулярных катионных пептидов на зрелые биопленки было обнаружено после их инкубации с пептидами в течение суток.
Из представленных на рис. 6 и 7 данных видно, что при наличии в среде пептидов как биомасса суточных пленок исследованных штаммов КНС. так и жизнеспособность их клеточных элементов значительно снижаются.
Таким образом, результаты экспериментов свидетельствуют о том. что использованные в работе катионные пептиды проявляют свое действие и на с ( {юрмированных бактериальных пленках, снижая их
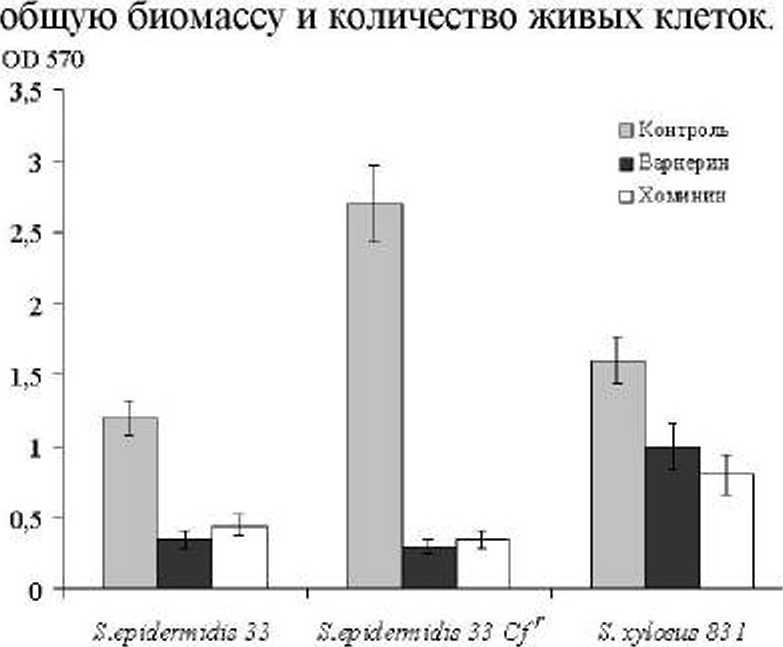
Рис. 6. Разрушение биомассы суточных биопленок стафилококков при действии
при действии катионных пептидов на сутохіные биопленки стафилококков
Результаты проведенного исследования позволяют сделать следующие выводы:
-
1. Изученные штаммы коагулазонегативных стафилококков S. epidermidis ГИСК 33, S. epider-midis ГИСК 33 Cf и 5. xylosus 831 обладают выраженной способностью к образованию биопленок. Динамика формирования клеточных и неклеточных компонентов биопленок бактерий исследуе-
- ммх штаммов существенно различается.
-
2. Присутствие в среде роста низкомолекулярных катионных пептидов варнерина и хоминина подавляет развитие биопленок бактерий всех исследованных штаммов стафилококков.
-
3. Бактериальные катионные пептидоы вызывают деструкцию зрелых биопленок КНС. в том числе и полирезистентного клинического штамма S. xylosus 831.
Работа выполнена при поддержке грантов: РФФИ № 14-04-0068 7. Программ фундаментальных исследований УрО РАН и Министерства образования и науки Пермского края -«Межлугнародные исследовательские группы», № С-26/632.
Список литературы Деструкция биопленок коагулазонегативных стафилококков под действием бактериальных катионных пептидов
- Коробов В.П., Лемкина Л.М., Полюдова Т.В., Акименко В.К. Выделение и характеристика нового низкомолекулярного антибактериального пептида семейства лантибиотиков//Микробиология. 2010. T. 79, № 2. С. 228-238
- Коробов В.П., Лемкина Л.М., Полюдова Т.В., Филатова Л.Б., Панькова Н.В. Активация аутолитической активности Staphylococcus epidermidis 33 низкомолекулярным катионным пептидом варнерином//Микробиология. 2010. T. 79, № 1. С. 133-135
- Коробов В.П. Лантибиотики -природные антибиотики широкого спектра действия//Вестник уральской медицинской академической науки. 2011. № 4/1. С. 10-11
- Коробов В.П., Полюдова Т.В., Лемкина Л.М. Изучение биологических свойств антибиотикорезистентных бактерий Staphylococcus epidermidis 33 и их чувствительности к варнерину//Вестник Пермского университета. Серия Биология. 2015. № 1. С. 5-14
- Коробов В.П., Полюдова Т.В., Лемкина Л.М. Антибактериальный пептид хоминин KLP-1 широкого спектра действия//Патент РФ № 2528055. 2014
- Лямин А.В., Боткин Е.А., Жестков А.В. Проблемы в медицине, связанные с бактериальными пленками//Клин. микробиол. антимикроб. химиотер. 2012. Т. 14, № 4. С. 268-275
- Методические указания. МУК. 4.2.1890-04. Определение чувствительности микроорганизмов к антибактериальным препаратам (утв. Главным государственным санитарным врачом РФ 04.03.2004)
- Перепанова Т.С. Значение инфекций, обусловленных образованием биопленок, в урологической практике//Эффективн. Фармакотер. 2013, № 4. С. 18-27
- Полюдова Т.В., Коробов В.П., Зидина Н.М. Сравнительный анализ формирования биопленок бактериями Propionibacterium acnes Ac-1450 на нативных и обработанных катионными пептидами поверхностях полистирола//Рос. имму-нол. журнал. 2015. Т. 9, № 2. С. 661-663
- Eroshenko D.V., Korobov V.P. New AMPs from Staphylococcus spp., warnerin and hominin, reduce Staphylocococcus epidermidis adhesion and biofilm formation//Multidisciplinary approach for studying and combating microbial pathogens/by ed. A. Mendez-Vilas. -BrownWalker Press. 2015. P. 98-101.
- Frank K.L., Reichert E.J., Piper K.E., Patel R. In vitro effects of antimicrobial agents on planktonic and biofilm forms of Staphylococcus lugdunensis clinical isolates//Antimicrob Agents Chemother 2007. № 51. P. 888-895
- Jorge P., Lourengo A., Pereira M.O. New trends in peptide-based anti-biofilm strategies: a review of recent achievements and bioinformatic approaches//Biofouling. 2012. Vol. 28, № 10. P. 1033-1061


