Деструкция фталевых кислот штаммом Paenarthrobacter sp. SA101, выделенным из сточных вод химического предприятия
Автор: Ястребова О.В., Прохорова А.П., Плотникова Е.Г.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 2, 2023 года.
Бесплатный доступ
Фталевая и терефталевая кислоты (ОФК и ТФК) имеют широкое применение в химической промышленности в качестве пластификаторов для получения полимерных материалов, в связи с чем являются распространенными экополлютантами. Изучена способность штамма Paenarthrobacter sp. SA101, выделенного из образца сточных вод химического предприятия (г. Пермь), к росту в присутствии ОФК и ТФК в высоких концентрациях. Показано, что штамм SA101 способен расти на данных субстратах в концентрациях до 20 г/л, что для представителей рода Paenarthrobacter показано впервые. В средах с ОФК зафиксированы более высокие параметры роста штамма, чем в средах с ТФК: максимальное значение ОП600 (1.64), наиболее высокая удельная скорость роста (0.073±0.003 ч-1) и наименьшая продолжительность лаг-фазы наблюдались в среде с 10 г/л ОФК. При использовании 20 г/л ТФК зафиксирована более высокая удельная скорость роста (0.04±0.002 ч-1) и максимальное значение ОП600 (1.6), однако подготовительная фаза роста была более продолжительной, чем в среде с 10 г/л ТФК. Штамм SA101 способен к утилизации 76% ОФК за 39 ч. и 74.2% ТФК за 71 ч. культивирования при использовании данных субстратов в концентрации 10 г/л. Клетки штамма SA101 содержат плазмиду молекулярной массой ~100 т.п.н. Штамм SA101 является перспективным для разработки биотехнологических методов очистки загрязненных фталатами почв и промышленных стоков.
Орто-фталевая кислота, терефталевая кислота, рост, утилизация
Короткий адрес: https://sciup.org/147241919
IDR: 147241919 | УДК: 579:873:579.222.2 | DOI: 10.17072/1994-9952-2023-2-172-178
Текст научной статьи Деструкция фталевых кислот штаммом Paenarthrobacter sp. SA101, выделенным из сточных вод химического предприятия
Фталевые кислоты – двухосновные ароматические карбоновые кислоты, существующие, в зависимости от положения карбоновых групп, в трех изомерных формах: фталевой ( орто -фталевой, ОФК), изофталевой и терефталевой (ТФК) кислот. Фталаты и сложные эфиры фталевых кислот имеют повсеместное применение в промышленности, используются в качестве пластификаторов для получения полимерных материалов. Эфиры фталевой кислоты (дибутилфталат, диметилфталат, диэтилфталат) используются для пластификации поливинилхлорида (ПВХ), при синтезе полиэфирных волокон, полиэтилена, а также в производстве строительных и смазочных материалов, лаков, косметики [Liang et al., 2008; Gao et al., 2018]. Терефталевая кислота (с пара- расположением карбоксильных групп) применяется в производстве насыщенных полиэфиров, химических волокон, пластмасс, красителей. ТФК является основным исходным соединением для получения полиэтилентерефталата (ПЭТФ), который составляет 90% от общего производимого количества насыщенных полиэфиров [Zhang et al., 2005; Karthik et al., 2008]. Фталаты и их эфиры не связаны ковалентно с пластиковым полимером и выщелачиваются в окружающую среду, представляя угрозу для здоровья человека и животных. Хотя фталаты подвергаются абиотическому фотолизу с периодом полураспада от месяцев до нескольких лет, микробная деградация является основным и экологически безопасным методом утилизации фталатов [Benjamin et al., 2015; Wang et al., 2023].
К настоящему времени биодеградация ОФК, ТФК и их сложных эфиров описана для ряда бактерий различных филогенетических групп, в том числе для штаммов рода Arthrobacter и для принадлежащих ранее к данному роду бактерий, реклассифицированных как представители родов Pseudoarthrobacter, Glutamicibacter, Paenarthrobacter [Eaton 2001; Stanislauskienė et al., 2011; Chen et al., 2021; Shariati et al., 2022; Ren et al., 2023]. Однако среди бактерий рода Paenarthrobacter способность к утилизации фталатов описана лишь для штамма Paenarthrobacter sp. Shss., растущего на ОФК, а также дибутилфталате (1 г/л) и других эфирах фталевой кислоты [Shariati et al., 2022]. Утилизация ОФК и ТФК аэробными бактериями проходит с образованием протокатеховой кислоты как ключевого промежуточного метаболита. При этом разложение ОФК до протокатехата проходит в три этапа: диоксигенирование, дегидрирование и декарбоксилирование; а деградация ТФК до протокатехата включает только две стадии, поскольку декарбоксилирование осуществляется цис -дигидродиолдегидрогеназой. Протокатехат в дальнейшем расщепляется диоксигеназами по орто- , либо мета- пути [Dagley et al., 1971; Liang et al., 2008; Boll et al., 2020].
Материалы и методы исследований
Объект исследования и условия культивирования. Из рабочей коллекции Лаборатории микробиологии техногенных экосистем «Института экологии и генетики микроорганизмов УрО РАН» ПФИЦ УрО РАН для исследований отобран штамм SA101, способный к росту на фталатах.
Культивирование бактерий проводили в минеральной среде К1 [Зайцев, Карасевич, 1981] с добавлением ОФК или ТФК в концентрациях 1, 10, 20, 30, 40 г/л. В качестве инокулята использовали бактериальные клетки в экспоненциальной фазе роста, выращенные в среде К1 с ОФК или ТФК (1 г/л) в качестве субстрата. Бактериальные культуры выращивали в колбах Эрленмейера объемом 250 мл (объем среды – 100 мл) при 28°С, на термокачалке при 100 об/мин.
Определение оптической плотности (ОП) культуральной жидкости проводили на спектрофотометре UV-Visible BioSpec-mini (“Shimadzu”, Япония) при длине волны 600 нм в кювете с длиной оптического пути 1 см. Расчет удельной скорости роста (μ, ч-1) проводили по стандартной формуле
μ = (ln B 2 – ln B 1 )/( t 2 - t 1 ), где В 1 и В 2 – оптические плотности культуры в моменты времени t 1 и t 2 , соответственно [Нетрусов, 2005].
Убыль ОФК и ТФК из среды культивирования определяли методом высокоэффективной жидкостной хроматографии (ВЭЖХ) с использованием хроматографа LC-20AD Prominance (“Shimadzu”, Япония) с колонкой (С-18 150 × 4.6 мм; “Shima-Aldrich”, США) и УФ-детектором SPD-20A (при 205 нм) в системе ацетонитрил – 0.1%-ная H 3 PO 4 (70 : 30). В качестве подвижной фазы использовали 80%-ный раствор ацетонитрила при скорости потока 1.0 мл/мин и температуре 40ºС. Идентификацию соединений проводили при сравнении времени выхода пиков экстрактов со стандартными растворами ОФК и ТФК в концентрациях 50 и 100 мг/л. Количественное содержание рассчитывали с помощью пакета программ “LCsolution” (“Shimadzu”, Япония). Расчет удельной скорости ( μ , ч-1) утилизации ОФК и ТФК проводили по стандартной формуле
μ = (ln С 1 – ln C 2 )/( t 2 - t 1 ), где С 1 , С 2 – концентрация субстрата в начальный и конечный момент времени t 1 и t 2 соответственно [Не-трусов, 2005].
Наличие плазмидной ДНК выявляли модифицированным методом щелочного лизиса [Marko et al., 1982].
Результаты и их обсуждение
Штамм SA101 выделен ранее из образца сточных вод химического предприятия (г. Пермь) и идентифицирован как представитель рода Paenarthrobacter, близкородственный виду Paenarthrobacter ureafa-ciens NCТ (NR 029281) (уровень сходства по гену 16S рРНК составил 99.3%) [Малышева, Ястребова, Плотникова, 2021].
Установлено, что штамм Paenarthrobacter sp. SA101 способен к деструкции ряда ароматических углеводородов и фталатов, в том числе ОФК, ТФК, дибутилфталата, бензоата [Малышева и др., 2021]. На основании способности штамма SA101 к росту на протокатеховой кислоте можно предположить, что штамм осуществляет утилизацию ОФК и ТФК через образование протокатехата – ключевого метаболита фталатов, с расщеплением последнего до основных клеточных метаболитов [Liang et al., 2008; Boll, 2020].
Исследована способность штамма использовать в качестве единственного источника углерода и энергии ОФК и ТФК (в концентрациях 1, 10, 20, 30 г/л) при росте в минеральной среде К1. Установлено, что штамм SA101 растет на данных субстратах в концентрациях до 20 г/л. Увеличение концентрации обоих субстратов приводило к накоплению биомассы, при этом в средах с ОФК были зафиксированы более высокие параметры роста штамма, чем в средах с ТФК (рис. 1). Максимальное значение ОП 600 (1.64), наиболее высокая удельная скорость роста (0.073±0.003 ч-1) и наименьшая продолжительность лаг-фазы роста штамма наблюдались в среде с 10 г/л ОФК. При выращивании штамма в среде с 20 г/л ТФК фиксировали наиболее высокую удельную скорость роста (0.04±0.002 ч-1) и максимальное значение ОП 600 штамма (1.6), однако подготовительная фаза роста была более продолжительней, чем в среде с 10 г/л ТФК (рис. 1, таблица).
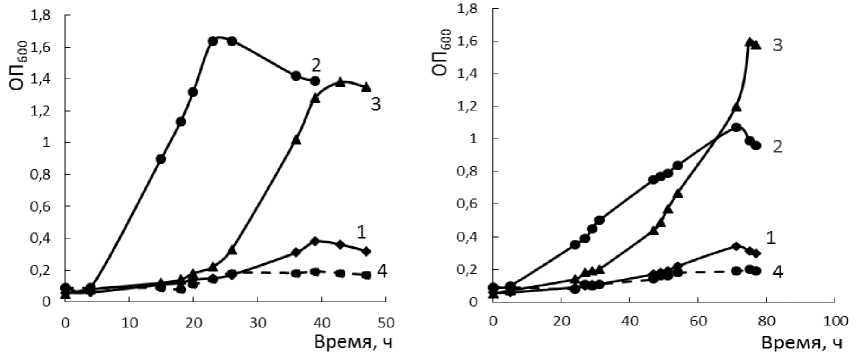
А B
Рис. 1. Рост клеток штамма SA101 в среде с ОФК ( А ) и ТФК ( B ) (г/л): 1 – 1; 2 – 10; 3 – 20; 4 – 30 [Growth of strain SA101 on PA ( A ) and TPA ( B ) (g/l): 1 - 1; 2 - 10; 3 - 20; 4 – 30]
Наиболее высокий уровень утилизации фталатов был зарегистрирован при выращивании в среде с 10 г/л ОФК и ТФК (76% за 39 ч. и 74.2% за 71 ч. соответственно). Максимальная удельная скорость потреб- ления данных субстратов также наблюдалась при их концентрации 10 г/л: 0.052±0.006 ч-1 при культивировании на ОФК и 0.034±0.004 – на ТФК (рис. 2, таблица).
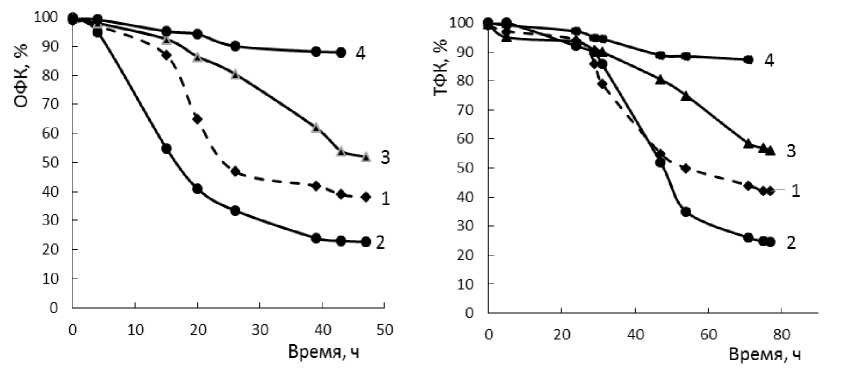
А
B
Рис. 2. Утилизация с использованием клеток штамма SA101 ОФК ( А ) и ТФК ( B ) в концентрации (г/л): 1 – 1; 2 – 10; 3 – 20; 4 – 30
[Utilization of PA ( A ) and TPA ( B ) by strain SA101 (g/L): 1 – 1; 2 – 10; 3 – 20; 4 – 30]
Параметры роста штамма SA101 и утилизация ОФК и ТФК [SA101 strain growth parameters and PA utilization and TPA]
|
Параметры |
Ростовой субстрат, г/л |
|||||
|
ОФК |
ТФК |
|||||
|
1 |
10 |
20 |
1 |
10 |
20 |
|
|
Удельная скорость роста, ч-1 |
0.038 ±0.003 |
0.073 ±0.003 |
0.070 ±0.004 |
0.028 ±0.001 |
0.03 ±0.002 |
0.04 ±0.002 |
|
Максимальное значение ОП 600 |
0.37 |
1.64 |
1.38 |
0.32 |
1.07 |
1.6 |
|
Лаг-фаза роста, ч |
25 |
3 |
18 |
51 |
24 |
31 |
|
Утилизация, % |
60.6 ± 0.4 |
76.0 ± 0.3 |
46.2 ± 0.4 |
55.5 ± 0.4 |
74.2 ± 0.4 |
57.2 ± 0.4 |
|
Удельная скорость утилизации, ч-1 |
0.040 ±0.003 |
0.052 ±0.006 |
.,020 ±0.001 |
0.027 ±0.003 |
0.034 ±0.004 |
0.010 ±0.002 |
Подавление роста бактерий высокими концентрациями фталевых кислот ранее показано для ряда штаммов разных родов, в том числе для Arthrobacter sp. 0574, способность которого к разложению ТФК подавлялась уже при концентрации 10 г/л и выше [Zhang et al., 2013]. Описан штамм Rhodococcus sp. N2, утилизирующий 10 г/л ТФК за 5 сут., а также штамм R. wratislaviensis КТ112-7, растущий в среде с ОФК в концентрации 8 г/л [Егорова и др. 2013; Suwanawat et al., 2019]. Ранее нами описаны бактерии рода Glutamicibacter , способные к росту и утилизации ТФК в концентрации до 30 г/л [Ястребова, Малышева, Плотникова, 2022]. Исследуемый штамм Paenarthrobacter sp. SA101 способен к эффективному разложению ОФК и ТФК за 23 и 71 ч. соответственно в концентрации до 20 г/л, что для представителей рода Paenar-throbacter показано впервые.

Исследование на наличие экстрахромосомной
ДНК модифицированным методом щелочного лизиса [Marko et al., 1982] показало присутствие в клетках Paenarthrobacter sp. SA101 плазмиды молекулярной массой ~100 т.п.н. (рис. 3). Плазмидная локализация генов деградации ОФК описана для штаммов Arthrobacter keyseri 12B и Arthrobacter phenanthrenivorans Sphe3 [Eaton, 2001; Kallimanis et al., 2011]. Для ряда штаммов рода Paenarthrobacter показано наличие плазмид биодеградации аромати-
М 1 2
Рис. 3. Электрофореграмма плазмидной ДНК штамма Paenarthrobacter sp. SA101 (1). M – маркер O'GeneRuler™ 100 bp Plus DNA Ladder (“Fermentas”, Литва); 2 – штамм-деструктор ТФК Rhodococcus sp.
S6 (плазмида ~100 т.п.н.)
[Electropherogram of plasmid DNA of Paenarthrobac-ter sp. SA101 (1). M - O'GeneRuler™ 100 bp Plus DNA Ladder marker (“Fermentas”, Lithuania); 2 – TPA destructor strain Rhodococcus sp. S6 (plasmid ~100 kb)]
ческих соединений. Так, у штаммов Paenarthrobacter nicotinovorans pAO1 и Paenarthrobacter sp. YJN-5 обнаружены плазмиды, включающие гены катаболизма никотина и ипродиона соответственно [Mihăşan et al., 2021; Zhang et al., 2021]. Можно предположить, что гены, контролирующие деструкцию ОФК и ТФК, у штамма SА101 также расположены на плазмиде.
Заключение
Таким образом, исследованный нами штамм Paenarthrobacter sp. SA101 способен к эффективному росту и утилизации до 20 г/л ОФК и ТФК, при этом в средах с ОФК зафиксированы более высокие параметры роста бактериальных клеток, чем в средах с ТФК: при использовании 20 г/л ТФК наблюдались наиболее высокие ростовые характеристики штамма, чем в среде с 10 г/л ТФК, однако подготовительная фаза роста была более продолжительней. Штамм SA101 способен к утилизации 76% ОФК в течение 39 ч. и 74.2% ТФК за 71 ч. культивирования при использовании данных фталевых кислот в концентрации 10 г/л. Штамм Paenarthrobacter sp. SA101 является перспективным для разработки биотехнологических методов очистки загрязненных фталатами почв и промышленных стоков.
Список литературы Деструкция фталевых кислот штаммом Paenarthrobacter sp. SA101, выделенным из сточных вод химического предприятия
- Зайцев Г.М., Карасевич Ю.Н. Утилизация 4-хлорбензойной кислоты штаммом Arthrobacter globi-formis // Микробиология. 1981. Т. 50. С. 35-40.
- Егорова Д.О. и др. Деструкция ароматических углеводородов штаммом Rhodococcus wratislaviensis КТ112-7, выделенным из отходов соледобывающего предприятия // Прикладная биохимия и микробиология. 2013. Т. 49, № 3. С. 267-278.
- Малышева А.А., Ястребова О.В., Плотникова Е.Г. Выделение и характеристика штамма-деструктора сложных эфиров фталевой кислоты Paenarthrobacter sp. SA101 // Фундаментальные и прикладные аспекты биоинформатики, биотехнологии и недропользования: сб. статей всерос. науч. конф. с междунар. участием. Пермь, 2021. С. 69-71.
- Нетрусов А.И. Практикум по микробиологии. М.: Академия, 2005. 608 с.
- Ястребова О.В., Малышева А.А., Плотникова Е.Г. Галотолерантные бактерии рода Glutamicibacter - деструкторы терефталевой кислоты // Прикладная биохимия и микробиология. 2022. Т. 58, № 5. С. 476483.
- Benjamin S. et al. A monograph on the remediation of hazardous phthalates // J. Hazard. Mater. 2015. Vol. 298. P. 58-72.
- Boll M. et al. Minireview. Microbial degradation of phthalates: biochemistry and environmental implications // Environ. Microbiol. Reports. 2020. Vol. 12(1). P. 3-15.
- Chen F. et al. High-efficiency degradation of phthalic acid esters (PAEs) by Pseudarthrobacter defluvii E5: Performance, degradative pathway, and key genes // Sci. Total Environ. 2021. Vol. 794 : 10. doi: 10.1016/j.scitotenv.2021.148719. 48719.
- Dagley S. Catabolism of aromatic compounds by microorganisms // Adv. Microb. Physiol. 1971. Vol. 6. P. 1 -46.
- Eaton R.W. Plasmid-encoded phthalate catabolic pathway in Arthrobacter keyseri 12B // J. Bacteriol. 2001. Vol. 183. P. 3689-3703.
- Gao D. et al. An overview of phthalate acid ester pollution in China over the last decade: Environmental occurrence and human exposure // Sci. Total Environ. 2018. Vol. 645. P. 1400-1409.
- Kallimanis A. et al. Complete genome sequence of Arthrobacter phenanthrenivorans type strain (Sphe3) // Stand. Genomic Sci. 2011. Vol. 4. P. 123-30.
- Karthik M. et al. Biodegradability enhancement of purified terephthalic acid wastewater by coagulation-flocculation process as pretreatment // J. Hazard. Mater. 2008. Vol. 154. P. 721-730.
- Liang D.W., Zhang T., Fang H. Phthalates biodegradation in the environment // Appl. Microbiol. Bio-technol. 2008. Vol. 80. P. 183-198.
- Marko M.A., Chipperfield R., Birnboim H.C. A procedure for the large-scale isolation of highly purified plasmid DNA using alkaline extraction and binding to glass powder // Analit. Biochem. 1982. Vol. 121. P. 382-387.
- Mihä§an M. et al. Time-dependent analysis of Paenarthrobacter nicotinovorans pAO1 nicotine-related proteome // ACS Omega. 2021. Vol. 6. P. 14242-14251.
- Ren C. et al. Complete degradation of di-n-butyl phthalate by Glutamicibacter sp. strain 0426 with a novel pathway // Research Square. 2023. doi.org/10.21203/rs.3.rs-2696404/v1.
- Shariati S. et al. Degradation of dibutyl phthalate by Paenarthrobacter sp. Shss isolated from Saravan landfill, Hyrcanian Forests, Iran // Biodegradation. 2022. Vol. 33. P. 59-70.
- Stanislauskiene R., Rudenkov M., Karvelis L. Analysis of phthalate degradation operon from Arthrobacter sp. 68b // Biologija. 2011. Vol. 57. P. 45-54.
- Suwanawat N. et al. Biodegradation of terephthalic acid by Rhodococcus biphenylivorans isolated from soil // Int. J. Environ. Sci. Dev. 2019. Vol. 10. P. 30-33.
- Wang Z. et al. Environmental health risks induced by interaction between Phthalic Acid Esters (PAEs) and biological macromolecule: A review // Chemosphere. 2023. Vol. 4. 138578. doi: 10.1016/j..138578.
- Zhang M. et al. Comparative genomic analysis of iprodione-degrading Paenarthrobacter strains reveals the iprodione catabolic molecular mechanism in Paenarthrobacter sp. strain YJN-5 // Environ. Microbiol. 2021. Vol. 23. P. 1079-1095.
- Zhang X. et al. Purified terephthalic acid wastewater biodegradation and toxicity // J. Environ. Sci. (China). 2005. Vol. 17(5). P. 876-880.
- Zhang Y.M. et al. Degradation of terephthalic acid by a newly isolated strain of Arthrobacter sp. 0574 // South African J. of Science. 2013. Vol. 109. doi.org/10.1590/ sajs.2013/20120019.


