Деструкция некоторых красителей на композитных фотокатализаторах на основе оксидов SiO2/TiO2
Автор: Авдин Вячеслав Викторович, Буланова Александра Владимировна, Асильбекова Айзада Айтугановна, Илькаева Марина Викторовна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Физическая химия
Статья в выпуске: 3 т.12, 2020 года.
Бесплатный доступ
В работе изучены композитные оксиды SiO2/TiO2, полученные при различном мольном соотношении кремния и титана в исходном растворе. Образцы получены в две стадии. Первая стадия основана на золь-гель технологии с применением пероксида водорода в качестве комплексообразователя. Оксигидроксид титана конвенционально осаждается, промывается бидистиллированной водой и перерастворяется в перекиси водорода с образованием пероксотитановой кислоты. Образуется неопалесцирующий прозрачный раствор. К этому раствору добавляется силикат натрия и формируется единый молекулярный прекурсор, гидролизом которого получается композитный образец, в котором зёрна TiO2 заключены в матрицу SiO2. На второй стадии полученный материал обрабатывается в гидротермальных условиях в автоклавах при саморегулирующемся давлении. TiO2 кристаллизуется в виде зёрен размером около 10 нм. Контроль кристаллизации и роста кристаллов обеспечивается наличием аморфной силикатной матрицы. Небольшой размер зёрен TiO2 приводит к высокой фотокаталитической активности материала. Образцы изучены методами рентгенофазового анализа и сканирующей электронной микроскопии. Фотокаталитическая активность определена для всех полученных образцов в реакции деструкции метиленового голубого под ультрафиолетовым излучением. Наибольшую степень деструкции субстрата обеспечивает образец, полученный при соотношении SiO2/TiO2, равном 1:2. Для этого образца определена возможность фотокаталического разложения метилового оранжевого и метиленового фиолетового. Метиловый оранжевый данным фотокатализатором разлагается довольно медленно, в отличие от метиленового фиолетового и метиленового голубого. Полученные фотокатализаторы можно использовать для очистки воды от красителей.
Золь-гель технология, диоксид титана, силикагель, композитные фотокатализаторы sio2/tio2, фотокаталитическая деструкция красителей
Короткий адрес: https://sciup.org/147234236
IDR: 147234236 | УДК: 544.032.72+544.478-03 | DOI: 10.14529/chem200305
Текст научной статьи Деструкция некоторых красителей на композитных фотокатализаторах на основе оксидов SiO2/TiO2
Диоксид титана обладает рядом преимуществ по сравнению с другими полупроводниками: химической стабильностью, низкой ценой, высокой фотокаталитической активностью и неток-сичностью [1]. Фотокаталитическая активность TiO2 в первую очередь зависит от таких параметров, как фазовый состав, размер кристаллов, удельная поверхность. Рутил при нормальных условиях является термодинамически стабильной фазой диоксида титана, анатаз и брукит термодинамически метастабильны и могут легко переходить в стабильную фазу рутила при термической обработке. Анатаз известен как самая фотокаталитически активная фаза TiO2. Высокая температура термической обработки позволяет увеличить размер кристаллов, тем самым снижая количество поверхностных дефектов материала, что благоприятствует понижению скорости рекомбинации электронных пар и способствует высокой фотокаталитической активности, однако в ходе данной обработки анатаз может быстро переходить в рутил, поэтому очень важным аспектом в получении фотокатализаторов является повышение термической стабильности фазы анатаза. Одним из возможных способов контроля фазового состава является внедрение TiO2 в матрицу SiO2. Внедрение оксидов переходных металлов в силикатную матрицу позволяет повысить удельную поверхность материала, уменьшить размер частиц оксида переходного металла; повышает стабильность каталитически активных фаз и формирует кислотные центры различной силы [2]. На базе теоретических вычислений Сериани и др. [3] предположили, что формирование слоя диок- сида кремния на частицах диоксида титана приводит к формированию электрон-дырочных пар на границе SiO2/TiO2, что может способствовать улучшению фотокаталитической активности. Связи Ti–O–Si известны как активные каталитические центры композитных оксидов в реакциях окисления органических соединений [4], таким образом, вполне обосновано предположить их влияние на процесс фоторазложения.
Традиционные способы реализации золь-гель технологии при синтезе материалов на основе диоксида кремния и оксидов переходных металлов основаны на использовании соответствующих алкоксидов или неорганических солей. Применение алкоксидов позволяет успешно контролировать формирование полиядерных комплексов металлов и впоследствии получать материалы высокой чистоты, обладающие развитой удельной поверхностью, упорядоченной пористой структурой, заданным фазовым составом и морфологией [2]. Однако алкоксиды являются токсичными, нестабильными и дорогими прекурсорами, а данная технология требует использования большого количества органических растворителей и специальных условий хранения, исключающих контакт алкоксида с парами воды. Использование неорганических солей переходных металлов, в свою очередь, затрудняет контроль гидролиза, полимеризации и конденсации аквакомплексов металла, что приводит к формированию слабоактивных каталитических материалов с низкой степенью чистоты, неразвитой поверхностью и непредсказуемым фазовым составом.
Комплексные и порообразующие агенты с большим количеством ОН–групп успешно применяются для увеличения удельной площади поверхности и улучшения геометрии пор [5, 6]. Применяя метод, основанный на использовании порообразующих агентов с аминогруппами, Оки и др. показали возможность варьирования пористости, удельной поверхности и равномерного распределения диоксида титана в матрице диоксида кремния путём использования различных n-алкил аминов [7–10]. Также структурнонаправляющими и порообразующими агентами могут быть блок-сополимеры [11, 12]. Контроль пористости может осуществляться и более сложным методом, включающим использование мицеллярных процессов [13].
Среди наиболее перспективных методов получения оксидных материалов из неорганических прекурсоров можно выделить: золь-гель и гидротермальный синтез, с использованием неорганических солей без модифицирующих добавок, метод Печини, заключающийся в термическом разложении водорастворимого комплекса металла. Пероксидные комплексы переходных металлов водорастворимы, следовательно, в случае их синтеза и использования образуется меньшее количество отходов, наносящих вред окружающей среде, в отличие от комплексов, где необходимо применение дорогих, токсичных растворителей. В данной работе предлагается использование методики, разработанной в работе [14], которая основана на получении единого прекурсора, содержащего водорастворимые пероксотитановую и кремниевую кислоты. В упомянутой работе показано, что зёрна TiO 2 инкапсулируются в фазе SiO 2 , что способствует их небольшому размеру (около 10 нм), высокой кристалличности, близости фотоактивных зёрен к сорбционным центрам (поверхностным ОН-группам SiO2), что приводит к значительному росту по сравнению с чистым TiO 2 фотокаталитических свойств.
Образцы фотокатализаторов на основе SiO 2 /TiO 2 получены при условиях, частично перекрывающихся с таковыми, применёнными в работе [14]. Изучена морфология образцов, рентгенофазовый состав, определена фотокаталитическая активность в реакциях разложения метиленового голубого, метилового оранжевого и метилового фиолетового.
Экспериментальная часть
Для исследований применяли реактивы, имеющие квалификацию не ниже «ХЧ». Дополнительной очистке реактивы не подвергали. Водный раствор оксисульфата титана 0,1 М готовили из концентрированного раствора производства Aldrich (TiOSO4·nH2O), содержащего не более 17 % серной кислоты H2SO4. Водный раствор силиката натрия 0,05 М получали разбавлением концентрированного водного раствора метасиликата натрия (Na2Si3O7), 27 % масс., производства Aldrich. Водный раствор гидроксида натрия 1,5 М готовили из сухих гранул, которые растворяли в бидистиллированной воде. Перекись водорода, стабилизированную серной кислотой, использовали в продажном виде с концентрацией 30 % об. Водный аммиак и азотную кислоту (оба 3 М) готовили путём разбавления концентрированных растворов. Водные растворы метиленового голубого, метилового оранжевого и метилового фиолетового с концентрацией 25 мг/л приготовили из сухих порошков. Концентрацию растворов азотной кислоты, аммиака и гидроксида натрия определяли титриметрически. Концентрацию оксисульфата титана определяли гравиметрически. Концентрации красителей контролировали спектрофотометрически при помощи заранее построенного градуировочного графика.
Для исследований синтезировали серию образцов с различным мольным соотношением SiO 2 /TiO 2 : 1/4, 1/2, 1/1,3, 1/1. Образцы получали в две стадии. Первая стадия – пероксометод, разработанный в работе [15]. Метод основан на золь-гель технологии с применением перекиси водорода в качестве комплексообразователя, позволяющего получить единый молекулярный прекурсор, который представляет собой неопалесцирующий водный раствор пероксотитановой и кремниевой кислот. К 50 мл 0,1 М раствора оксисульфата титана приливали 25, 50, 75 и 100 мл 0,05 М раствора силиката натрия. Затем смесь растворов гидролизовали с помощью 1,5 М раствора гидроксида натрия; введение NaOH прекращали при достижении рН значения 3,2. Полученные в результате гелеобразные осадки центрифугировали (3000 об/мин) и отмывали бидистиллированной водой до отрицательной реакции на противоионы исходных солей. На второй стадии к гидрогелю приливали 4 мл H2O2 (30 % об.), объём доводили до 50 мл дистиллированной водой. С помощью 3М водного аммиака рН реакционной смеси доводили до значения 7,0. Вскоре образовывался прозрачный оранжевый раствор, содержащий пероксокомлекс титана и кремниевую кислоту. После установления рН 7, в реакционную смесь по каплям вводили 3 М раствор азотной кислоты до достижения рН 2. Затем объём раствора доводили бидистиллированной водой до 80 мл. Раствор переносили в автоклав объёмом 140 мл для гидротермальной обработки. Гидротермальную обработку проводили при саморегулирующемся давлении при 180 °С в течение 48 часов. После гидротермальной обработки осадок отделяли центрифугированием при 3000 об/мин, отмывали бидистил-лированной водой и сушили при 60 °С в течение 24 часов под вакуумом 8 мБар.
Так как при конвенциональном осаждении диоксида титана из раствора оксисульфата происходит захват значительного количества противоионов – до 10 % масс. [15], от которых не удаётся избавиться отмывкой осадка, описанная выше процедура «осаждение – растворение – осаждение» позволяет дополнительно уменьшить количество захваченных солей. По данным работ [14, 15] количество сульфатов в диоксиде титана и в композитных материалах SiO2/TiO2 находится на уровне порога обнаружения C,H,N,S-анализатора (<0,1 % масс.).
Навески реагентов брали на весах Sartorius серии СРА, 5 знак точности (0,01 мг). рН контролировали при помощи рН-метра Sartorius РР-25. Синтез проводили при помощи магнитной мешалки с нагревом BIOSAN MSH-300, вакуумного сушильного шкафа Binder VD 115 и центрифуги Hermle LaborTechnic Z383. Исследования морфологии и определение элементного состава выполняли на сканирующем электронном микроскопе Jeol JSM-7001F с приставкой EDS Oxford INCA X-max 80. Рентгенофазовый анализ (РФА) проведён при помощи порошкового рентгеновского дифрактометра Rigaku Ultima IV с использованием излучения CuKa (1,5405929 А) в диапазоне 20 5...90° с дискретностью 0,02°. Измерения концентрации красителей проводили на спектрофотометре ультрафиолетового и видимого диапазона Shimadzu UV-2700.
Фотокаталитическую активность синтезированных оксидов SiO2/TiO2 тестировали в реакции разложения органических красителей в водной среде под ультрафиолетовым излучением. Для эксперимента брали навеску образца SiO 2 /TiO 2 25 мг и помещали её в кварцевый реактор с 50 мл водного раствора красителя с концентрацией 25 мг/л. Суспензию перемешивали на магнитной мешалке в темноте в течение 30 мин до достижения адсорбционного равновесия. Время адсорбции установили в предварительных экспериментах. Адсорбцию определяли фотометрически по пику 664 нм с использованием спектрофотометра Shimadzu UV–2700. После измерения адсорбции суспензию облучали ультрафиолетом до 120 мин. Источник ультрафиолета – 3 кварцевые ртутные лампы ДБК 30, расположенные в закрытом цилиндрическом боксе из алюминиевых листов. Методом актинометрии [16, 17] определили, что мощность светового потока в спектральном диапазоне длин волн менее 410 нм имеет значение 45 Вт/м2. Каждые 30 мин из реактора отбирали аликвоту 5 мл, раствор отделяли от катализатора центрифугированием при 8000 об/мин и измеряли оптическую плотность при 664 нм. После измерения катализатор и раствор возвращали обратно в реактор и продолжали облучение. Фотолиз красителей проводили в тех же экспериментальных условиях, но в отсутствии катализатора. Изменение концентраций красителей при УФ-облучении без катализатора находится в пределах ошибки определения, которая составляет менее 3 %.
Физико-химические исследования проведены на оборудовании научно-образовательного центра «Нанотехнологии» Южно-Уральского государственного университета.
Обсуждение результатов
В литературе представлено большое количество исследований, посвящённых синтезу пероксотитановой кислоты с участием органических лигандов [18–31]. Работ, посвященных использованию пероксотитановой кислоты без органических лигандов в качестве прекурсора TiO2, значительно меньше. Становится очевидным, что контроль свойств материала при использовании пероксотитановой кислоты в качестве прекурсора затруднен. Работа с таким прекурсором будет осложняться нестабильностью пероксотитановой кислоты в отсутствии избытка перекиси водорода и склонностью моно- и олигомерных фрагментов гидроксо-пероксокомплексов титана к полимеризации. Однако из пероксотитановой кислоты, контролируя рН, щелочные, кислотные агенты и условия термической обработки, удавалось получать одномерные материалы, плёнки и порошки с необходимым фазовым составом, обладающие высокой фотокаталитической активностью или термической стабильностью. В работах [32–46] показано, что используя в качестве прекурсора пероксотитановую кислоту, даже в отсутствии органических лигандов, возможно контролировать морфологию, фазовый состав TiO2; также данный метод способствует увеличению термической стабильности фазы анатаза, повышению фотокаталитической активности в сравнении с коммерческими образцами. Стоит отметить, что в литературе не было найдено работ, в которых пероксо-метод применялся для получения материалов на основе SiO2/TiO2, где присутствие диоксида кремния увеличивало бы фотокаталитическую активность смешанного оксида, поэтому это представляет интерес для дальнейших исследований.
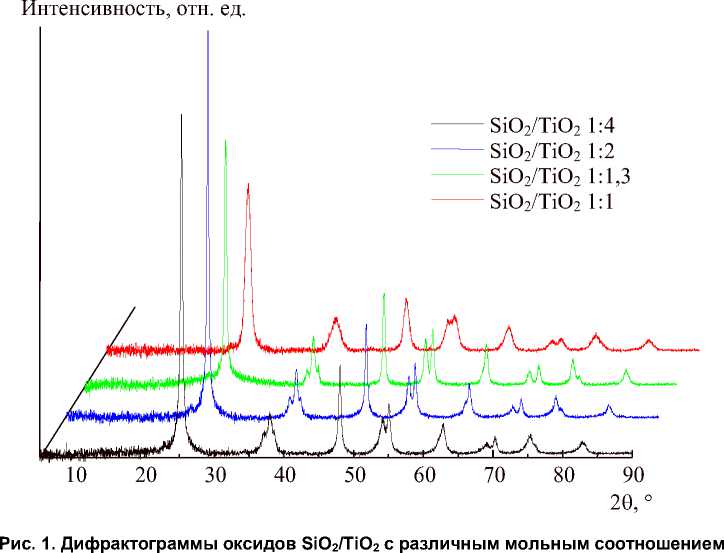
На рис. 1 представлены дифрактограммы полученных образцов. Видно, что образцы на 100 % состоят из фазы анатаза; пиков рутила и брукита не обнаружено. С повышением доли кремнезёма в составе материала кристалличность сначала увеличивается, а затем снижается. В работе [14] это объясняется взаимодействием между частицами диоксида кремния и титана при гидролизе единого молекулярного прекурсора. При малом количестве кремниевой кислоты частицы TiO 2 взаимодействуют с SiO 2 , образуя смешанный полимер. При возрастании доли SiO 2 происходит сегрегация TiO 2 и SiO 2 и зёрна последнего адсорбируются на частицах TiO 2 , контролируя их рост. При соотношении 1:2 степень кристалличности максимальная, затем при большем количестве SiO2 кремнезём мешает формированию крупных крислаллов TiO2 и относительная кристалличность падает.
На рис. 2 представлены СЭМ-изображения образцов. При соотношении 1:4 и 1:2 образцы представлены хорошо различимыми овальными частицами размером около 100 нм, причём при соотношении 1:2 размер зёрен больше и, согласно данным РФА, кристалличность выше. С дальнейшим увеличением доли кремния морфология резко меняется, частицы становятся более мелкими и малокристалличными.

б)
а)

в)
г)
Рис. 2. СЭМ-изображения образцов с соотношением SiO 2 /TiO 2 : а – 1:4; б – 1:2; в – 1:1,3; г– 1:1
Анализ фотокаталитических свойств в реакции деструкции метиленового голубого показывает, что степень кристалличности не связана напрямую с фотокаталитической активностью. На рис. 3а представлены кинетические кривые деструкции метиленового голубого образцами, полученными при разном соотношении SiO2/TiO2. Кривые нормированы на концентрацию после установления сорбционного равновесия. В этой реакции максимальной фотокаталитической активностью отличаются образцы с максимальной и невысокой степенью кристалличности (SiO 2 /TiO 2 соответственно равны 1:2 и 1:1,3). Данный вывод согласуется с результатами, полученными в работе [14]. По-видимому, в образцах, полученных при соотношении SiO2/TiO2 1:4, высока степень внедрения титана в матрицу аморфного силикагеля, что уменьшает способность TiO 2 образовывать под действием УФ излучения пары «электрон – дырка», ответственные за формирование окислителей и деструкцию органического субстрата.
На рис. 3б представлены кинетические кривые деструкции различных красителей на образце, полученном при соотношении SiO2/TiO2 1:2. Как видно из представленных данных, метиловый оранжевый весьма плохо разлагается данными фотокатализаторами, что, возможно, связано с химическим строением данного красителя. Однако два других субстрата претерпевают деструкцию весьма полно, что позволяет говорить о перспективности полученных материалов как фотокатализаторов для очистки воды от некоторых стойких органических загрязнений.
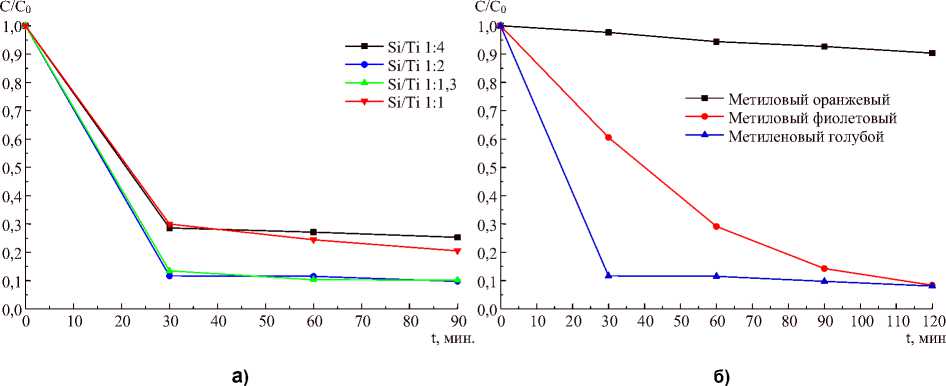
Рис. 3. Кинетика фотодеструкции красителей: а – на образцах, полученных при различном соотношении SiO 2 /TiO 2 , б – различных красителей на образце, полученном при соотношении SiO 2 /TiO 2 , равном 1:2
Заключение
Относительная кристалличность, морфология и фотокаталитическая активность композитных оксидов на основе SiO 2 /TiO 2 определяется мольным соотношением кремния и титана в исходном растворе. Наибольшую активность проявляют образцы, полученные при соотношении SiO 2 /TiO 2 , равном 1:2. Данные образцы состоят из зёрен овальной формы размером около 150 нм и имеют максимальную относительную кристалличность в сравнении с другими образцами. Оксид титана представлен только анатазом, диоксид кремния – аморфной фазой.
Композитные оксиды на основе SiO2/TiO2 являются эффективными фотокатализаторами в реакции деструкции красителей. Из трёх изученных красителей – метиленового голубого, метиленового фиолетового и метилового оранжевого в наибольшей степени подвержены фоторазложению под действием ультрафиолета (45 Вт/м2) метиловый фиолетовый и метиленовый голубой. Композитные оксиды на основе SiO 2 /TiO 2 можно рекомендовать для фотокаталитической очистки воды от некоторых стойких органических загрязнений.
Финансирование
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (грант № 20-03-00904).
Список литературы Деструкция некоторых красителей на композитных фотокатализаторах на основе оксидов SiO2/TiO2
- Jing L., Zhou W., Tian G., Fu H. Surface Tuning for Oxide-based Nanomaterials as Efficient Photocatalysts. Chem. Soc. Rev., 2013, vol. 42, pp. 9509-9549. DOI: 10.1039/c3cs60176e
- Kibombo H.S., Peng R., Rasalingam S., Koodali R.T. Versatility of Heterogeneous Photocatalysis: Synthetic Methodologies Epitomizing the Role of Silica Support in TiO2 Based Mixed Oxides. Catal. Sci. Technol., 2012, vol. 2, pp. 1737-1766. DOI: 10.1039/c2cy20247f
- Seriani N., Pinilla C., Cereda S., De Vita A. et al. Titania-Silica Interfaces. J. Phys. Chem. C, 2012, vol. 116, pp. 11062-11067. DOI: 10.1021/jp301584h
- Coles M.P., Lugmair C.G., Terry K.W., Tilley T.D. Titania-Silica Materials from the Molecular Precursor Ti[OSi(OtBu)3]4: Selective Epoxidation Catalysts. Chem. Mater., 2000, vol. 12, pp. 122131. DOI: 10.1021/cm990444y
- Xu W., Wei L., Luo M. Nanoporous SiO2/TiO2 Composite Prepared by a Combined Sol-Gel and Hybrid Method. Key Eng. Mater., 2008, vol. 368-372, pp. 1497-1499.
- Pab E., Retuert J., Quijada R., Zarate A. TiO2-SiO2 Mixed Oxides Prepared by a combined Sol-Gel and Polymer Inclusion Method. Microporous Mesoporous Mater., 2004, vol. 67, pp. 195203. DOI: 10.1016/j.micromeso.2003.10.017
- Oki A.R., Xu Q., Shpeizer B., Clearfield A. et al. Synthesis, Characterization and Activity in Cyclohexene Epoxidation of Mesoporous TiO2-SiO2 Mixed Oxides. Catal. Commun., 2007, vol. 8, pp. 950-956. DOI: 10.1016/j.catcom.2006.09.022
- Garbassi F., Balducci L. Preparation and Characterization of Spherical TiO2-SiO2 Particles. Microporous Mesoporous Mater., 2001, vol. 47, pp. 51-59. DOI: 10.1016/S1387-1811(01)00302-X
- Kosuge K., Singh P.S. Titanium-Containing Porous Silica Prepared by a Modified Sol-Gel Method. J. Phys. Chem. B, 1999, vol. 103, pp. 3563-3569.
- Pabon E., Retuert J., Quijada R. Synthesis of Mixed Silica Titania by the Sol -Gel Method Using Polyethylenimine: Porosity and Catalytics Properties. J. Porous Mater., 2007, vol. 14, pp. 151158. DOI: 10.1007/s10934-006-9019-9
- Zhu H., Pan Z., Chen B., Lee B. et al. Synthesis of Ordered Mixed Titania and Silica Meso-structured Monoliths for Gold Catalysts. J. Phys. Chem. B, 2004, vol. 108, pp. 20038-20044. DOI: 10.1021/jp047525o
- Zelenâk V., Hornebecq V., Mornet S., Schâf O., Llewellyn P. Mesoporous Silica Modified With Titania: Structure and Thermal Stability. Chem. Mater., 2006, vol. 18, pp. 3184-3191. DOI: 10.1021/cm051608f
- Cojocaru B., Parvulescu V.I., Preda E., Iepure G. et al. Sensitizers on Inorganic Carriers for Decomposition of the Chemical Warfare Agent Yperite. Environ. Sci. Technol., 2008, vol. 42, pp. 4908-4913. DOI: 10.1021/es800170a
- Krivtsov I., Ilkaeva M., Avdin V., Khainakov S. et al. A Hydrothermal Peroxo Method for Preparation of Highly Crystalline Silica-Titania Photocatalysts. J. Colloid Interface Sci., 2015, vol. 444, pp. 87-96. DOI: http://dx.doi.org/10.1016/jjcis.2014.12.044.
- Ilkaeva M., Krivtsov I., Avdin V., Khainakov S.A. et al. Comparative Study of Structural and Thermal Behavior of Mixed Silics-Titania Xerogels Prepared via the Peroxo Method and the Conventional Co-Precipitation Technique. Colloids Surf., A, 2014, vol. 456, pp. 120-128. DOI: 10.1016/j.colsurfa.2014.05.018.
- Galbavy E.S., Ram K., Anastasio C. 2-Nitrobenzaldehyde as a Chemical Actinometer for Solution and ice Photochemistry. J. Photochem. Photobiol., A, 2010, vol. 209, pp. 186-192. DOI: 10.1016/j.jphotochem.2009.11.013.
- Willett K.L., Hites R.A. Chemical Actinometry: Using o-Nitrobenzaldehyde to Measure Light Intensity in Photochemical Experiments. J. Chem. Educ., 2000, vol. 77, pp. 900-902.
- Kakihana M., Kobayashi M., Tomita K., Petrykin V. Application of Water-Soluble Titanium Complexes as Precursors for Synthesis of Titanium-Containing Oxides via Aqueous Solution Processes. Bull. Chem. Soc. Jpn., 2010, vol. 83, pp. 1285-1308. DOI: 10.1246/bcsj.20100103
- Piquemal J.-Y., Briot E., Bregeault J.-M. Preparation of Materials in the Presence of Hydrogen Peroxide: From Discrete or "Zero-Dimensional" Objects to Bulk Materials. Dalton Trans., 2013, vol. 42, pp. 29-45. DOI: 10.1039/c2dt31660a
- Murakami N., Kurihara Y., Tsubota T., Ohno T. Shape-Controlled Anatase Titanium (IV) Oxide Particles Prepared by Hydrothermal Treatment of Peroxo Titanic Acid in the Presence of Polyvinyl Alcohol. J. Phys. Chem. C, 2009, vol. 113, pp. 3062-3069. DOI: 10.1021/jp809104t
- Kefalas E.T., Panagiotidis P., Raptopoulou C.P., Terzis A. et al. Mononuclear Titanium(IV)-Citrate Complexes from Aqueous Solutions: pH-specific Synthesis and Structural and Spectroscopic Studies in Relevance to Aqueous Titanium(IV)-citrate Speciation. Inorg. Chem., 2005, vol. 44, pp. 2596-2605. DOI: 10.1021/ic049276o
- Zhou Z.-H., Deng Y.-F., Jiang Y.-Q., Wan H.-L. et al. The First Structural Examples of Tricitra-totitanate [Ti(H2cit) 3]2- dianions. Dalton Trans, 2003, vol. 13, pp. 2636-2638.
- Deng Y.-F., Jiang Y.-Q., Hong Q.-M., Zhou Z.-H. Speciation of Water-Soluble Titanium Citrate: Synthesis, Structural, Spectroscopic Properties and Biological Relevance. Polyhedron, 2007, vol. 26, pp. 1561-1569. DOI: 10.1016/j.poly.2006.08.017
- Collins J.M., Uppal R., Incarvito C.D., Valentine A.M. Titanium(IV) Citrate Speciation and Structure Under Environmentally and Biologically Relevant Conditions. Inorg. Chem., 2005, vol. 44, pp. 3431-3440. DOI: 10.1021/ic048158y
- Kakihana M., Tada M., Shiro M., Petrykin V. et al. Structure and Stability of Water Soluble (NH4)8[Ti4(C6H4O7)4(O2)4]-8H2O. Inorg. Chem., 2001, vol. 40, pp. 891-894. DOI: 10.1039/C2RA20388J
- Dakanali M., Kelfas E.T., Raptopoulou C.P., Terzis A. et al. A New Dinuclear Ti (IV)-peroxo-citrate Complex from Aqueous Solutions. Synthetic, Structural, and Spectroscopic Studies in Relevance to Aqueous Titanium (IV)-peroxo-citrate Speciation Inorg. Chem., 2003, vol. 42, pp. 4632-4639.
- Tada M., Tomita K., Petrykin V., Kakihana M. Preparation and Characterization of Citratope-roxotitanate Barium Compound for BaTiO3 Synthesis. Solid State Ionics, 2002, vol. 151, pp. 293-297. DOI: 10.1016/S0167-2738(02)00726-9
- Chen Z., Liu J., Qiu S., Dawson G. et al. The Shape-specific Photocatalytic Efficiency of Quantum Size TiO2 Nanoparticles. Catal. Commun., 2012, vol. 21, pp. 1-4. DOI: 10.1016/j.catcom.2012.01.021
- Wu J.-M., Qi B. Low-temperature Growth of Monolayer Rutile TiO2 Nanorod Films. J. Am. Ce-ram. Soc., 2007, vol. 90, pp. 657-660. DOI: 10.1111/j.1551-2916.2006.01453.x
- Tomita K., Petrykin V., Kobayashi M., Shiro M. et al. A Water-soluble Titanium Complex for the Selective Synthesis of Nanocrystalline Brookite, Rutile, and Anatase by a Hydrothermal Method. Angew. Chem., Int. Ed. 2006. V. 45. P. 2378-2381. DOI: 10.1002/anie.200503565
- Tada M., Yamashita Y., Petrykin V., Osada M. et al. A New Water-soluble Ammonium Citra-toperoxotitanate as an Environmentally Beneficial Precursor for TiO2 Thin Films and RuO2/BaTi4O9 Photocatalysts. Chem. Mater., 2002, vol. 14, pp. 2845-2846. DOI: 10.1021/cm011542y
- Wu J.-M. Low-temperature Preparation of Titania Nanorods Through Direct Oxidation of Titanium with Hydrogen Peroxide. J. Cryst. Growth, 2004, vol. 269, no. 2-4, pp. 347-355. DOI: 10.1016/j.jcrysgro.2004.05.023
- Wu J.-M., Zhang T.-W., Zeng Y.-W., Hayakawa S. et al. Large-Scale Preparation of Ordered Titania Nanorods with Enhanced Photocatalytic Activity. Langmuir, 2005, vol. 21, no. 15, pp. 69957002. DOI: 10.1021/la0500272
- Ribeiro C., Vila C., Stroppa D.B., Mastelaro V.R. et al. Anisotropic Growth of Oxide Nanocrys-tals: Insights into the Rutile TiO2 Phase. J. Phys. Chem. C, 2007, vol. 111, no. 16, pp. 5871-5875. DOI: 10.1021/jp070051j
- Mao Y., Kanungo M., Hemraj-Benny T., Wong S. S. Synthesis and Growth Mechanism of Tita-nate and Titania One-dimensional Nanostructures Self-assembled into Hollow Micrometer-scale Spherical Aggregates. J. Phys. Chem. B, 2006, vol. 110, no. 2, pp. 702-710. DOI: 10.1021/jp0544538
- Ichinose H., Terasaki M., Katsuki H. Synthesis of Peroxo-modified Anatase Sol from Peroxo Titanic Acid Solution. J. Ceram. Soc. Jpn., 1996, vol. 104, pp. 715-718.
- Ichinose H., Terasaki M., Katsuki H. Properties of Anatase Films for Photocatalyst from Perox-otitanic Acid-solution and Peroxo-modified Anatase Sol. J. Ceram. Soc. Jpn., 1996, vol. 104, pp. 914917.
- Ichinose H., Terasaki M., Katsuki H. Properties of Peroxotitanium Acid Solution and Peroxo-Modified Anatase Sol Derived from Peroxotitanium Hydrate. J. Sol-Gel Sci. Technol., 2001, vol. 22, pp. 33-40. DOI: 10.1023/A:1011256118320
- Gao Y., Luo H., Mizusugi S., Nagai M. Surfactant-free Synthesis of Anatase TiO2 Nanorods in an Aqueous Peroxotitanate Solution. Cryst. Growth Des., 2008, vol. 8, no. 6, pp. 1804-1807. DOI: 10.1021/cg701157j
- Bao X.-W., Yan S.-S., Chen F., Zhang J.-L. Preparation of TiO2 Photocatalyst by Hydrothermal Method from Aqueous Peroxotitanium Acid Gel. Mater. Lett., 2005, vol. 59, pp. 412-415. DOI: 10.1016/j.matlet.2004.09.035
- Shankar M.V., Kako T., Wang D., Ye J. One-pot Synthesis of Peroxo-titania Nanopowder and Dual Photochemical Oxidation in Aqueous Methanol Solution. J. Colloid Interface Sci., 2009, vol. 331, pp. 132-137. DOI: 10.1016/j.jcis.2008.11.019
- Liu Y.-J., Aizawa M., Wang Z.-M., Hatori H. et al. Comparative Examination of Titania Nano-crystals Synthesized by Peroxo Titanic Acid Approach from Different Precursors. J. Colloid Interface Sci., 2008, vol. 322, pp. 497-504. DOI: 10.1016/j.jcis.2008.03.034
- Etacheri V., Seery M.K., Hinder S.J., Pillai S.C. Oxygen Rich Titania: a Dopant Free, High Temperature Stable, and Visible-light Active Anatase Photocatalyst. Adv. Funct. Mater., 2011, vol. 21, pp. 3744-3752. DOI: 10.1002/adfm.201100301
- Yang H.G., Sun C.H., Qiao S.Z., Zou J. Anatase TiO2 Single Crystals with a Large Percentage of Reactive Facets. Nature, 2008, vol. 453, pp. 638-641. DOI: 10.1038/nature06964
- Liao J., Shi L., Yuan S., Zhao Y., Fang J. Solvothermal Synthesis of TiO2 Nanocrystal Colloids from Peroxotitanate Complex Solution and Their Photocatalytic Activities. J. Phys. Chem. C, 2009, vol. 113, pp. 18778-18783. DOI: 10.1021/jp905720g
- Ennaoui A., Sankapal B.R., Skryshevsky V., Lux-Steiner M.Ch. TiO2 and TiO2-SiO2 thin films and powders by one-step soft-solution method: Synthesis and characterizations. Sol. Energy Mater. Sol. Cells, 2006, vol. 90, no. 10, pp. 1533-1541. DOI: 10.1016/j.solmat.2005.10.019


