Деструкционная активность углеводородокисляющих микромицетов, выделенных из субстратов прибрежных территорий Баренцева и Белого морей
Автор: Исакова Е. А, Корнейкова М. В.
Журнал: Вестник Мурманского государственного технического университета @vestnik-mstu
Статья в выпуске: 2 т.24, 2021 года.
Бесплатный доступ
Проанализирована углеводородокисляющая активность 33 штаммов микромицетов, выделенных из воды и грунтов прибрежных территорий Белого и Баренцева морей и относящихся к родам: Acremonium, Aspergillus, Meyerozyma, Oidiodendron, Paradendryphiella, Penicillium, Pseudoqymnoascus, Tolypocladium, Trichoderma, Sarocladium, Talaromyces, Umbelopsis. Исследования по углеводородокисляющей активности грибов проводили в лабораторном эксперименте в течение двух временных периодов: 14 и 28 суток. Остаточную концентрацию углеводородов нефти в среде определяли методом инфракрасной спектрометрии. Установлено, что микромицеты обладали разной нефтедеструкционной способностью. Снижение содержания нефтепродуктов для тестируемых штаммов за 14 суток составило от 11 до 83 %. Наибольшей нефтедеструктивной активностью обладали штаммы Tolypocladium inflatum st.1, T. inflatum st.2, Penicillium thomii, Meyerozyma guilliermondii, Penicillium simplicissimum, P. camemberti, P. solitum и Trichoderma minutisporum, снижающие концентрацию в среде на 57–83 %. Данные микромицеты выделены из прибрежных субстратов, содержание нефтепродуктов в которых не превышало ПДК. Отмечено, что некоторые отдельные штаммы микроскопических грибов обладают высокой нефтедеструкционной активностью более длительный период времени: Tolypocladium cylindrosporum снижал содержание нефтяных углеводородов за 28 суток на 95 %. Не выявлено четкой связи между грибной биомассой и степенью разложения нефтепродуктов, однако отдельные толерантные виды микромицетов способны активно разлагать углеводороды нефти, существенно не увеличивая своей биомассы. Выявленные активные штаммы нефтеокисляющих микромицетов могут быть использованы для создания биопрепаратов с перспективой их дальнейшего применения для биоремедиации при нефтяных разливах в северных морских экосистемах.
Микроскопические грибы, углеводород-окисляющая активность, морские экосистемы, биоремедиация, нефтезагрязнение, microscopic fungi, hydrocarbon-oxidizing activity, marine ecosystems, bioremediation, oil pollution
Короткий адрес: https://sciup.org/142226885
IDR: 142226885 | УДК: 579.64 : 631.46(470.21) | DOI: 10.21443/1560-9278-2021-24-2-178-189
Текст статьи Деструкционная активность углеводородокисляющих микромицетов, выделенных из субстратов прибрежных территорий Баренцева и Белого морей
*Лаборатория медицинских и биологических технологий КНЦ РАН; Институт проблем промышленной экологии Севера КНЦ РАН, г. Апатиты, Мурманская обл., Россия; e-mail: , ORCID:
Исакова Е. А. и др. Деструкционная активность углеводородокисляющих микромицетов, выделенных из субстратов прибрежных территорий Баренцева и Белого морей. Вестник МГТУ. 2021. Т. 24, № 2. С. 178–189. DOI:
*Laboratory of Medical and Biological Technologies KSC RAS; Institute of ^orth Industrial Ecology Problems KSC RAS, Apatity, Murmansk region, Russia; e-mail: , ORCID:
Isakova, E. A. et al. 2021. Destructive activity of hydrocarbon-oxidizing micromycetes extracted from the substrates of the coastal areas, the Barents and White Seas. Vestnik of MSTU, 24(2), pp. 178–189. (In Russ.) DOI:
В настоящее время нефть и нефтепродукты (НП) являются одними из самых распространенных веществ, загрязняющих воды Мирового океана (Немировская, 2013). Нефтяное загрязнение опасно в связи с высокой токсичностью и миграционной способностью отдельных компонентов нефти (Тетельмин и др., 2013). В результате загрязнения нарушаются естественные биоценозы, изменяется их видовое разнообразие, снижается продуктивная способность; в наземных экосистемах изменяется ферментативная активность почв (Кузнецов и др., 2017). Одним из наиболее эффективных методов ликвидации разливов нефти и НП на этапе доочистки загрязненных участков считается биоремедиация, основанная на способности микроорганизмов разрушать органические загрязнители, выступающие для микробиоты субстратом или источником питания (Finley et al., 2010; Kumar et al., 2018).
В морских экосистемах микромицеты встречаются в значительно меньшем количестве, чем бактерии, поэтому ранее им не уделялось достаточного внимания в вопросе биоремедиации морских загрязненных сред (Kumar et al., 2018; Maamar et al., 2020). Однако с начала XXI века стала развиваться такая ветвь биоремедиации, как микоремедиация. В ее основе лежит использование грибов для разложения или удаления токсических веществ из окружающей среды (Singh, 2006; Husaini et al., 2008; Kumar et al., 2018).
У микроскопических грибов есть ряд преимуществ перед бактериями. Грибы способны проникать внутрь твердых частиц (Raghukumar, 2017). Грибы обладают мицелиальным строением, поэтому имеют огромную адсорбционную поверхность (Донерьян и др., 2016), благодаря чему способны адсорбировать различного рода соединения, в том числе ксенобиотики, такие как фенол, фенольные соединения, полициклические ароматические углеводороды (ПАУ). В отличие от грибов, бактерии не могут эффективно разлагать ПАУ с более чем четырьмя ароматическими кольцами (Leitão, 2009; Maamar et al., 2020). Эффективность использования микромицетов в качестве утилизаторов нефти обусловлена их мощной ферментативной системой, а также высокой устойчивостью в условиях нефтезагрязнения (Зволинский и др., 2010). Есть сведения, что большинство видов морских грибов могут участвовать в процессах биоразложения нефти путем превращения нефтяных углеводородов в более растворимые в воде и менее токсичные для морской среды формы (Kumar et al., 2018; Maamar et al., 2020).
К наиболее распространенным микромицетам-деструкторам углеводородов нефти (УН) относят не менее сотни видов микроскопических грибов (Шапиро и др., 2018). Подавляющее количество таких грибов принадлежат родам: Alternaria, Aspergillus, Candida, Cephalosporium, Cladosporium, Fusarium, Geotrichum, Gliocladium, Mucor, Paecilomyces, Penicillium, Rhizopus, Rhodotolura, Saccharomyces, Talaromyces, Torulopsis и др. (Al-^asrawi, 2012; Kumar et al., 2018; Чапоргина и др., 2019).
Известно, что количество микроорганизмов, способных использовать органический углерод нефти и НП в качестве единственного источника питания и энергии, сравнительно мало по сравнению с общим количеством микроорганизмов, обитающих в окружающей среде (Lebkowska et al., 1995). В связи с этим важно иметь наиболее полное представление о микроорганизмах-деструкторах НП, обитающих в разных природных средах (Macaulay, 2015) в разных климатических поясах, в том числе в арктических условиях. Природа Крайнего Севера характеризуется относительно низкой самоочищающей способностью в силу замедленности процессов энерго- и массообмена, а потому восстановление природных сред здесь проходит очень медленно (Евдокимова и др., 2007). Таким образом, настоящее исследование подтверждает свою актуальность.
Цель работы – поиск активных штаммов микромицетов-нефтедеструкторов, выделенных из потенциально нефтезагрязненных вод и грунтов прибрежных территорий Баренцева и Белого морей, с перспективой их дальнейшего применения для создания биопрепаратов, планируемых к использованию в северных условиях в мероприятиях по биоремедиации.
Материалы и методы
Характеристика района исследований
Отбор образцов субстратов (прибрежная почва, затапливаемые грунты приливно-отливной зоны, морская вода) проводили в Кандалакшском заливе в районе Беломорской биологической станции (ББС) (66 o 34' с. ш., 33 o 08' в. д.), а также на побережье Кольского залива в районах г. Кола (68°53' с. ш., 33°02' в. д.) и пос. Белокаменка (69°04' с. ш., 33°10' в. д.) (рис. 1).
Микроскопические грибы были выделены как из чистых, так и загрязненных НП субстратов. Согласно литературным данным (Немировская и др., 2017), средние концентрации УН в прибрежных районах Кандалакшского залива не достигали величины ПДК. По другим данным (Климовский, 2017), аналогично, уровень УН в поверхностных и придонных водах (2015 г.) не превышал рыбохозяйственный норматив (0,05 мг/дм 3 ) (табл. 1).
По данным, представленным сотрудником лаборатории ИППЭС КНЦ РАН Мязиным В. А., в субстратах, отобранных в пос. Белокаменка, содержание УН также не превышало значения ПДК. В районе г. Кола, наоборот, количество УН в воде, грунте литорали и прибрежной почве было в 6, 1,1 и 22 раза выше значений ПДК соответственно, т. е. данный участок на момент отбора проб (2017 г.) оказался загрязненным НП.
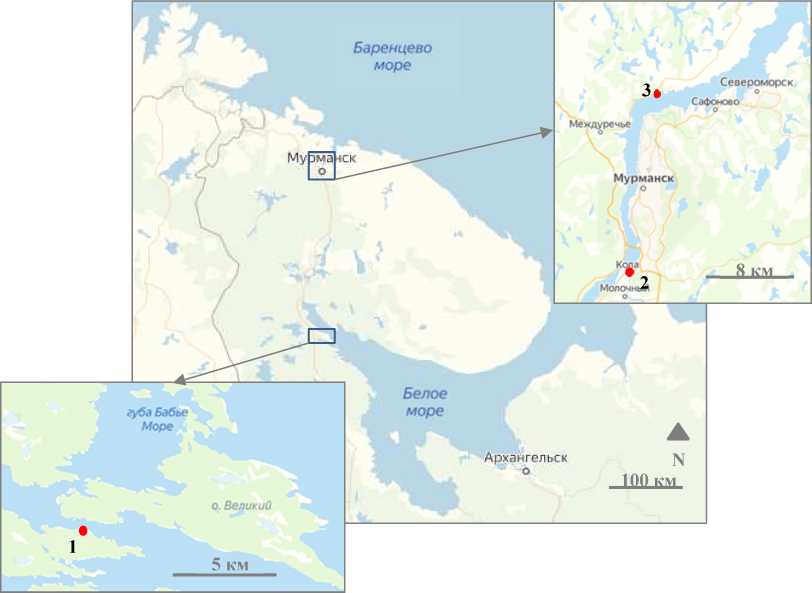
Рис. 1. Районы отбора проб: 1 – ББС; 2 – г. Кола; 3 – пос. Белокаменка. Источник Fig. 1. Sampling areas: 1 – the Belomorsk biological station; 2 – Kola, the town; 3 – Belokamenka, the settlement
Таблица 1. Содержание нефтяных углеводородов в прибрежных субстратах Белого и Баренцева морей Table 1. Content of petroleum hydrocarbons in the coastal substrates of the White and Barents Seas
|
Содержание нефтяных углеводородов |
Субстрат |
Исследуемый участок |
ПДК |
||
|
ББС |
Белокаменка |
Кола |
|||
|
мг/кг |
Прибрежная почва |
– |
839 |
22 730 |
1 000 |
|
Грунт (литораль) |
– |
285 |
1 122 |
||
|
мг/дм 3 |
Вода |
0,03–0,04 |
0,038 |
0,32 |
0,05 |
Культивирование и идентификация микромицетов
Водные и почвенные образцы отбирали стерильно в 3–5-кратной повторностях по стандартным методикам1 (Звягинцев, 1991) для микологического анализа. Выявление и учет численности углеводородокисляющих микромицетов проводили методом предельных разведений почвенной суспензии с последующим глубинным посевом на агаризованную питательную среду Чапека – Докса следующего состава (г/л): NaNO3 – 3,0; KH2PO4 – 1,0; MgSO4 – 0,5; KCl – 0,5; FeSO4 – 0,01, агар-агар – 18,0, дистиллированная вода – 1 л. Для приготовления почвенной суспензии навеску почвы с учетом влажности растворяли в воде, из полученной смеси готовили суспензии до второго 10–2 (песок) и третьего 10–3 (почвогрунты) разведения. Водные пробы анализировали без разведения. В качестве единственного источника углерода добавляли нефть в концентрации 1 % по объему. Каждый исследуемый образец анализировали в трех повторностях. Чашки Петри с высеянным материалом инкубировали в течение 10 дней при температуре 27 °С. По окончании инкубирования выросшие изоляты выделяли в чистую культуру на агаризованную среду Чапека – Докса и сусло-агар. Идентификацию грибов выполняли с использованием светового микроскопа Olympus CX41 (Япония) на основе культурально-морфологических признаков по определителям российских и зарубежных авторов (Егорова, 1986; Klich, 2002; Domsch et al., 2007), названия таксонов унифицировали с использованием базы данных Index Fungorum (.
Для ряда видов идентификацию осуществляли на основании анализа участка рибосомальных генов ITS1–5.8S–ITS2 рДНК. Выделение ДНК проводили по методике (Archaea, 2007). Секвенирование участков ДНК делали с помощью набора реактивов BigDye Terminator V. 3.1 Cycle Sequencing Kit (AppliedBiosystems, USA) с последующим анализом продуктов реакции на секвенаторе Applied Biosystems 3130l Genetic Analyzer в научно-производственном центре "Синтол" (г. Москва).
Характеристика микромицетов
Проанализирована нефтедеструкционная активность 33 штаммов микромицетов (табл. 2). Наибольшее количество исследуемых видов относилось к роду Penicillium – 12 видов. Роды Tolypocladium и Trichoderma представлены тремя видами, Acremonium, Aspergillus, Oidiodendron, Sarocladium, Talaromyces – двумя видами. Грибы родов Meyerozyma, Paradendryphiella, Pseudoqymnoascus, Umbelopsis представлены одним видом. Все исследуемые грибы относились к отделу Ascomycota, за исключением Umbelopsis ramanniana. Данный вид является представителем отдела Mucoromycota.
Таблица 2. Микромицеты, исследуемые на углеводородокисляющую активность Table 2. Micromycetes tested for hydrocarbon-oxidizing activity
|
Вид |
Местообитание |
|
|
Белое море |
Баренцево море |
|
|
Acremonium sp. st.2 |
+* |
|
|
Acremonium tubakii W. Gams |
+ |
|
|
Aspergillus flavus Link |
+** |
|
|
A. sydowii (Bainier & Sartory) Thom & Church |
+ |
|
|
Meyerozyma guilliermondii (Wick.) Kurtzman & M. Suzuki |
+ |
|
|
Oidiodendron periconioides st.1 Morrall |
+ |
|
|
O. periconioides st.2 Morrall |
+ |
|
|
Paradendryphiella salina (G.K. Sutherl.) Woudenb. & Crous |
+ |
|
|
Penicillium camemberti Thom |
+** |
|
|
P. canescens Sopp st.1 |
+** |
|
|
P. canescens Sopp st.2 (=P. raciborskii) |
+* |
|
|
P. chrysogenum Thom |
+* |
|
|
P. corylophilum Dierckx |
+** |
|
|
P. dipodomyus (Frisvad, Filt. & Wicklow) Banke, Frisvad & S. Rosend. |
+ |
|
|
P. roseopurpureum Dierckx |
+ |
|
|
P. simplicissimum (Oudem.) Thom (=P. janthinellum) |
+** |
|
|
P. solitum Westling |
+ |
|
|
Penicillium sp. st.1 |
+ |
|
|
Penicillium sp. st.2 |
+ |
|
|
P. thomii Maire |
+ |
|
|
Pseudogymnoascus pannorum (Link) Minnis & D. L. Lindner |
+ |
|
|
Sarocladium strictum (W. Gams) Summerb. |
+ |
|
|
S. terricola (J. H. Mill., Giddens & A. A. Foster) A. Giraldo, Gené & Guarro |
+* |
|
|
Talaromyces diversus (Raper & Fennell) Samson, N. Yilmaz & Frisvad |
+ |
|
|
T. variabilis (Sopp) Samson, N. Yilmaz, Frisvad & Seifert |
+ |
|
|
Tolypocladium cylindrosporum W. Gams |
+ |
|
|
T. inflatum st.1 W. Gams |
+ |
|
|
T. inflatum st.2 W. Gams |
+ |
|
|
T. tundrense Bissett |
+ |
|
|
Trichoderma aureoviride Rifai |
+ |
|
|
T. minutisporum Bissett |
+ |
|
|
T. polysporum (Link) Rifai |
+ |
|
|
Umbelopsis ramanniana (Möller) W. Gams |
+ |
|
Примечание. * – г. Кола, ** – пос. Белокаменка.
Лабораторный эксперимент
Эксперимент проводили в два этапа. На первом этапе работы продолжительность опыта составляла 14 суток. Изначально проводили смыв чистых культур микромицетов в колбы Эрленмейера с питательной средой Чапека без сахарозы. Для этого добавляли грибную суспензию с титром 10 6 –10 7 КОЕ/мл в 50 мл питательной среды. В качестве источника углерода вносили нефть в концентрации 1 % по объему.
Контролем служила стерильная среда с нефтью без микромицетов. Повторность опыта – трехкратная. Культивирование грибов проводили при температуре 27 °С. Спустя 14 или 28 суток определяли биомассу микроскопических грибов, высушивая ее при 105 °С до абсолютно сухой массы. Остаточную концентрацию НП в среде определяли на анализаторе АН-2 (г. Санкт-Петербург) методом инфракрасной спектрометрии, основанном на выделении эмульгированных и растворенных нефтяных компонентов из жидкой среды экстракцией четыреххлористым углеродом (ССl 4 ), хроматографическом отделении НП от сопутствующих органических соединений других классов на колонке, заполненной оксидом алюминия, и количественном их определении по интенсивности поглощения С–Н связей, метиленовых (–СН 2 –) и метильных (–СН 3 ) групп в инфракрасной области спектра 2 .
На втором этапе работы продолжительность опыта составляла 28 суток. В ходе этого этапа изучали нефтедеструкционный потенциал морских штаммов микромицетов, являющихся редко встречающимися видами в зональных почвах Кольского полуострова.
Результаты и обсуждение
Нефтедеструкционная активность микромицетов в течение 14 суток
Известно, что в первое время после загрязнения существенное снижение содержания НП в среде происходит за счет испарения легких фракций нефти. Например, с водной поверхности углеводороды легкой фракции нефти улетучиваются в течение 10 суток, углеводороды средней фракции удерживаются намного дольше, а компоненты тяжелой фракции нефти практически не испаряются (Немировская, 2013). Так, за счет испарения может деградировать до 10 % тяжелой и до 75 % легкой нефти (Давыдова и др., 2004; Macaulay, 2015). В нашем эксперименте за счет испарения разлагалось от 32 до 43 % углеводородов, что согласуется с литературными данными (Другов и др., 2007).
Установлено, что микромицеты обладают разной нефтедеструкционной способностью. Снижение содержания УН в жидкой среде для 33 тестируемых штаммов спустя 14 суток составило от 11 до 83 % (рис. 2).
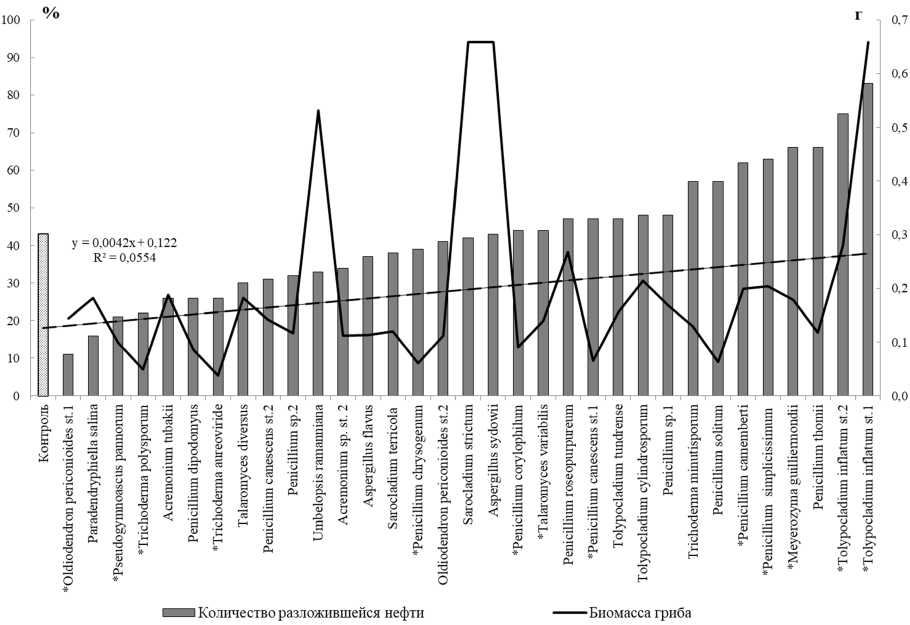
Рис. 2. Убыль нефтепродуктов в питательной среде за 14 суток инкубации.
Звездочкой отмечено статистически достоверное снижение концентрации нефтепродуктов грибами (p = 0,05; df = 4; t = 2,78)
Fig. 2. Decrease of oil products in the nutrient media for 14 days of incubation.
A statistically significant decrease in the concentration of oil products by fungi is marked with an asterisk (p = 0,05; df = 4; t = 2,78)
Ранее коллегами (Чапоргина и др., 2019) разработана шкала деструкционной активности микроскопических грибов к УН за 14 суток, согласно которой микромицеты разделены на три группы: I – виды с высокой активностью, снижающие содержание нефти в среде на 80–98 %; II – виды со средней активностью, снижающие содержание нефти в среде на 50–79 %; III – виды с низкой активностью, снижающие содержание нефти в среде на 49 % и менее.
Согласно данной шкале высокой деструкционной активностью обладал один штамм Tolypocladium inflatum st.1, достоверно снижающий содержание НП в среде на 83 % от исходного содержания НП, из которых на долю биологической деструкции пришлось 40 %.
Средней деструкционной активностью обладали семь штаммов T. inflatum st.2, Penicillium thomii, Meyerozyma guilliermondii, Penicillium simplicissimum, P. camemberti, P. solitum и Trichoderma minutisporum, снижающие содержание НП в среде на 57–75 %. Работы других авторов (Atlas, 1981; Zheng et al., 2003; Husaini et al., 2008; Leitão, 2009; Zhang et al., 2017; Govarthanan et al., 2017; Рark et al., 2019; Serra et al., 2019; Vasconcelos et al., 2019; Zajc et al., 2019; Чапоргина и др., 2019) подтверждают, что вышеуказанные роды микромицетов способны участвовать в биоразложении нефти и НП. Следовательно, эти исследуемые грибы можно считать устойчивыми к нефтяному загрязнению.
Грибы Penicillium simplicissimum и P. camemberti выделены из прибрежных территорий п. Белокаменка Кольского залива Баренцева моря, остальные активные микромицеты-нефтедеструкторы обнаружены в Кандалакшском заливе Белого моря. Важно отметить, что эти грибы выделены из относительно чистых в отношении нефтезагрязнения участков, в которых содержание УН не превышало уровня ПДК. Это указывает на то, что микроорганизмы с высокой углеводородокисляющей способностью могут обитать и в незагрязненных НП природных средах.
Существуют литературные данные, что вышеперечисленные микромицеты наряду с другими компонентами нефти способны разлагать ПАУ. Полициклические ароматические углеводороды считаются повсеместно распространенными, токсичными и мутагенными приоритетными поллютантами окружающей среды (Husaini et al., 2008; Leitão, 2009). Так, грибы морского происхождения Tolypocladium sp. являются подходящим генетическим ресурсом для биоремедиации засоленных сред и способны разлагать пирен и бензапирен. Установлено, что деградация пирена отдельными штаммами Tolypocladium sp. в модельном опыте за 7 дней составляла в соленой среде от 0 до 58 %, т. е. способность утилизировать углеводороды является свойством отдельных штаммов, а не видов. В незасоленной среде убыль пирена этим микромицетом составляла 65 % и бензаперена – 63 % (Vasconcelos et al., 2019).
Эндофитный гриб (^akayan et al., 2013; Chen et al., 2015; Ravuri et al., 2020) Meyerozyma guilliermondii также является типичным морским представителем и часто обнаруживается в дрожжевой форме (по нашим наблюдениям). Способен разлагать как азотсодержащие углеводороды (3-гидрокси-пропионитрил, бензонитрил, циклогексан-карбонитрил) (Zhang et al., 2017; Serra et al., 2019), так и алифатические углеводороды (н-гексадекан) (Zajc et al., 2019).
Некоторые виды Trichoderma также рассматривают в качестве потенциальных агентов биоремедиации в почве (Tripathi et al., 2013), подверженной воздействию ПАУ, что связано со способностью грибов этого рода метаболизировать различные соединения как с высокой, так и с низкой молекулярной массой (нафталин, фенантрен, хризен, пирен и бензапирен) (Zafra et al., 2015).
В мероприятиях по биоремедиации используют и разнообразные виды рода Penicillium (Sinclair et al., 1975; Рark et al., 2019; Чапоргина и др., 2019), которые могут быть потенциально интересны для разработки технологий очистки природных сред от загрязняющих веществ (Leitão, 2009; Ghanbari et al., 2014; Maamar et al., 2020).
По данным нашего эксперимента, остальные 25 видов обладали низкой нефтедеструкционной активностью ниже 48 % (рис. 1). У трети видов остаточная концентрация в среде была на уровне испарения. Ряд штаммов Oidiodendron periconioides st.1, Pseudogymnoascus pannorum, Trichodema polysporum, Acremonium tubakii, Penicillium dipodomyus, Trichoderma aureoviride снижали содержание УН в среде на 11–26 %. Эти грибы являются чувствительными к нефтяному загрязнению, и в процессах активного биоразложения нефти и НП они, скорее всего, не способны участвовать.
Важным показателем в механизмах самоочищения природных сред является не только остаточное содержание УН, но также и рост биомассы грибов в условиях нефтезагрязнения. В нашем исследовании при данной величине выборки (p = 0,05; df = 4; t = 2,78) не было выявлено достоверной корреляционной связи между степенью разложения НП и биомассой микроскопических грибов (r = 0,3). Наибольшая грибная биомасса была отмечена у штаммов Tolypocladium inflatum st.1, T. inflatum st.2, Aspergillus sydowii, Sarocladium strictum, Umbelopsis ramanniana. Однако в отличие от первых двух последние три вида микромицетов не проявили заметной нефтедеструктивной активности (рис. 2).
Как правило, микроорганизмы нуждаются в подходящих условиях роста, в качестве которых могут выступать питательные вещества (субстраты) и биогенные элементы, температура, рН, окислительновосстановительный потенциал, содержание кислорода. Перечисленные показатели сильно влияют на рост и развитие микробиоты (Csutak et al., 2010; Govarthanan et al., 2017) в условиях нефтезагрязнения. Возможно, в нашем случае низкие значения биомассы микромицетов можно объяснить именно недостатком питательных веществ, недостаточной аэрацией среды, а также токсическим эффектом нефти на тестируемые штаммы.
Нефтедеструкционная активность микромицетов в течение 28 суток
Процесс естественного восстановления загрязненных НП природных сред длителен по времени, каждый отдельный микроорганизм (в том числе его штаммы) способен метаболизировать УН с характерной для него скоростью. Поэтому мы проверили степень разложения НП некоторыми морскими микромицетами-нефтедеструкторами в жидкой среде за более длительный период времени.
В результате опыта по изучению нефтедеструктивной способности микромицетов за 28 суток практически у всех видов не было выявлено существенных изменений в содержании УН в среде по сравнению с 14-дневным периодом, за исключением штамма Tolypocladium cylindrosporum (рис. 3). В этом варианте за первые 14 суток инкубирования количество УН снизилось на 48 %, а в последующие 14 суток достигло уровня 95 % разложения от исходного содержания нефтепродуктов, из которых на долю биологической деструкции пришлось 32 %.
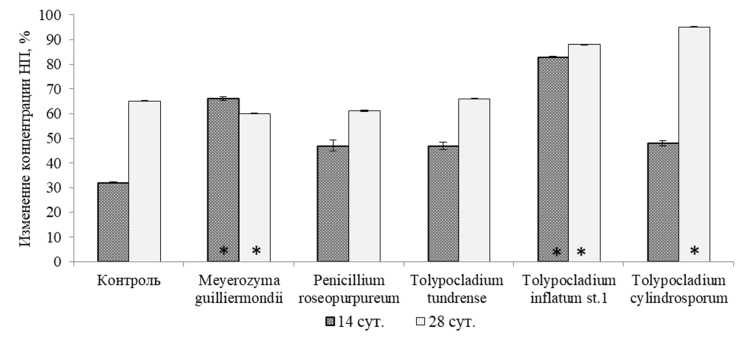
Рис. 3. Убыль нефтепродуктов в среде через 14 и 28 суток инкубации некоторыми штаммами грибов. Звездочкой отмечено статистически достоверное снижение концентрации НП грибами (p = 0,05; df = 4; t = 2,78)
Fig. 3. Decrease of oil products in the medium after 14 and 28 days of incubation with some strains of fungi. A statistically significant decrease in the concentration of oil products by fungi is marked with an asterisk (p = 0,05; df = 4; t = 2,78)
Следует также отметить, что в контрольном варианте за счет испарения в течение 28 суток разложилось в два раза больше НП, чем за 14-дневный период (63 % относительно 32 % НП).
Результаты опыта свидетельствуют о том, что наиболее активно деструкция НП происходит в течение 10–15 суток с момента внесения нефти в жидкую среду с грибной культурой. Это необходимо учитывать при планировании восстановительных мероприятий окружающей среды при аварийных нефтяных разливах. Принимая во внимание факт, что первостепенно процессам испарения и микробиологической деструкции поддаются легкие фракции нефти, можно предположить, что остальные компоненты, относящиеся к средним и тяжелым фракциям, в морской среде в дальнейшем либо осядут на дно, либо мигрируют водными массами, либо уже более медленными темпами будут подвергаться микробиальным метаболическим превращениям (Немировская, 2013; Ossai et al., 2020).
Однако чтобы иметь полное представление о накоплении, детоксикации, трансформации и минерализации УН микроскопическими грибами, необходимы дальнейшие исследования для определения физиологических, биохимических и молекулярных механизмов устойчивости микромицетов в условиях нефтезагрязнения.
Заключение
Таким образом, анализ нефтедеструкционной способности 33 штаммов микроскопических грибов, выделенных из прибрежных территорий Белого и Баренцева морей, показал, что микромицеты обладают разной активностью к деградации нефти. Среди них есть как чувствительные, так и толерантные к нефтезагрязнению виды. Наибольшей нефтедеструктивной активностью обладали штаммы Tolypocladium inflatum st.1, T. inflatum st.2, Penicillium thomii, Meyerozyma guilliermondii, Penicillium simplicissimum, P. camemberti, P. solitum и Trichoderma minutisporum, снижение концентрации НП этими грибами составило 57–83 %. Наиболее активно деструкция УН микромицетами в лабораторном эксперименте проходила в течение 14 суток с момента внесения нефти в жидкую среду с грибной культурой. Некоторые представители микроскопических грибов в окислении УН могут участвовать более длительный период: Tolypocladium cylindrosporum снижал содержание УН за 28 суток на 95 %.
Четкой связи между грибной биомассой и степенью разложения НП не выявлено, однако толерантные виды микромицетов, существенно не увеличивая своей биомассы, способны активно разлагать УН.
Выявленные активные штаммы нефтеокисляющих микромицетов могут быть использованы для создания биопрепаратов с перспективой их дальнейшего применения для биоремедиации при нефтяных разливах в северных морских экосистемах.
Проведение полевых работ выполнено за счет проекта Коларктик КО1001. Постановку лабораторного эксперимента осуществляли в рамках темы НИР по госзаданию АААА-А18-118021490070-5. Обобщение полученных результатов и подготовка рукописи статьи выполнены в рамках темы НИР по госзаданию 0186-2019-0009. Авторы выражают благодарность кандидату биологических наук, заведующему лабораторией экологии микроорганизмов ИППЭС КНЦ РАН Мязину Владимиру Александровичу за помощь в организации и проведении полевых работ, а также за помощь в освоении метода по определению содержания нефтепродуктов.
Конфликт интересов


