Детекция сторожевых лимфатических узлов при начальном раке яичников: первые результаты и перспективы
Автор: Тихоновская М.Н., Шевчук А.С.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 4 т.24, 2025 года.
Бесплатный доступ
Цель исследования – проанализировать результаты применения методики биопсии сторожевых лимфатических узлов (СЛУ) при начальном раке яичников. Материал и методы. В проспективное одноцентровое исследование включено 48 пациенток с диагнозом рак яичников I–IIA стадий, которым проведено хирургическое стадирование в отделении онкогинекологии НМИЦ онкологии им. Н.Н. Блохина с 2022 по 2024 г. Индоцианин зеленый вводили в воронко-тазовую и собственную связки яичников или в их культи, идентифицировали и удаляли сторожевой лимфатический узел. Далее выполняли тазовую и парааортальную лимфаденэктомию. Результаты. Успешно картирован хотя бы один сторожевой лимфатический узел у 40 (83,3 %) пациенток. У 3 (7,5 %) пациенток выявлены метастазы в лимфатических узлах. Из них у 1 (2,5 %) пациентки метастаз выявлен в парааортальном сторожевом лимфатическом узле, у 1 (2,5 %) больной парааортальный сторожевой лимфоузел оказался ложноотрицательным и у 1 (2,5 %) пациентки метастаз выявлен в тазовых лимфоузлах, где сторожевой лимфатический узел не картирован. Таким образом, при биопсии СЛУ метастатически измененные лимфоузлы в парааортальной зоне удалось выявить лишь у 50 % пациенток. В тазовой зоне ни у одной из пациенток с картированными СЛУ не выявлены метастазы. Осложнений, ассоциированных с биопсией СЛУ, не наблюдалось. Заключение. Результаты применения биопсии сторожевых лимфоузлов не позволяют однозначно сделать вывод о достаточной ее эффективности. Необходимы проведение дальнейших исследований и накопление опыта для улучшения результатов применения методики.
Сторожевые лимфатические узлы, ранний рак яичников, индоцианин зеленый, лимфаденэктомия
Короткий адрес: https://sciup.org/140312269
IDR: 140312269 | УДК: 618.11-006.6:612.428 | DOI: 10.21294/1814-4861-2025-24-4-20-28
Текст научной статьи Детекция сторожевых лимфатических узлов при начальном раке яичников: первые результаты и перспективы
Исследование сторожевых лимфатических узлов (СЛУ) – современная методика, направленная на выявление первого лимфатического узла (ЛУ) на пути лимфооттока от опухоли и его морфологическое исследование с целью обнаружения метастатического поражения. Удаление одного ЛУ является менее травматичной процедурой по сравнению с тотальной лимфаденэктомией, что снижает морбидность хирургического вмешательства и улучшает качество жизни пациенток. Эффективность и онкологическая безопасность методики исследования СЛУ доказаны при многих локализациях, таких как рак молочной железы, вульвы, эндометрия, шейки матки и меланома кожи [1–4].
Согласно клиническим рекомендациям МЗ РФ, при раннем раке яичников (РЯ) (кроме муцинозного и эндометриоидного) забрюшинная лимфаденэктомия является обязательным этапом хирургического стадирования [5]. Однако ее целесообразность до сих пор является предметом активных дискуссий. В 2006 г. в единственном рандомизированном исследовании не продемонстрированы значимые различия безрецидивной и общей выживаемости в группах c лимфаденэктомией или без нее, при медиане наблюдения 87,8 мес [6] . В крупном многоцентровом ретроспективном исследовании показано, что лимфаденэктомия значимо повышает риск интра- и послеоперационных осложнений, таких как повреждение нервов и сосудов, увеличивает объем кровопотери, длительность операции, частоту формирования лимфокист и лимфедемы, а также приводит к задержкам проведения адъювантной химиотерапии [7]. Анализ опыта отделения онкогинекологии НМИЦ онкологии им. Н.Н. Блохина показал, что выполнение тазовой и парааортальной лимфаденэктомии у 99 больных ранним РЯ привело к изменению плана адъювантного лечения только у 1 (1 %) пациентки
-
[8]. В связи с этим возможность заменить забрюшинную лимфаденэктомию биопсией сторожевых лимфатических узлов (БСЛУ) при раннем РЯ представляется чрезвычайно перспективной. Немногочисленные зарубежные исследования и первый отечественный опыт демонстрируют возможность исследования СЛУ с использованием индоцианина зеленого (ICG) при РЯ начальных стадий [9–11]. С 2022 г. данная методика активно изучается в отделении онкогинекологии НМИЦ онкологии им. Н.Н. Блохина.
Цель исследования – проанализировать результаты применения методики БСЛУ при раннем РЯ на основании анализа 3-летнего опыта НМИЦ онкологии им. Н.Н. Блохина.
Материал и методы
В проспективное одноцентровое исследование, проведенное в отделении онкогинекологии НМИЦ онкологии им. Н.Н. Блохина в 2022–24 гг., было включено 48 пациенток с морфологически верифицированным диагнозом РЯ, у которых на момент включения в исследование клиническая стадия опухолевого процесса соответствовала IА–IIA. Критериями исключения являлись: дис-семинация опухоли по брюшине таза или за его пределами по данным КТ или интраоперационной ревизии, признаки метастатического поражения забрюшинных ЛУ или наличие отдаленных метастазов, ECOG>2, предшествующая настоящему заболеванию лучевая терапия на область малого таза и брюшной полости, а также хирургическое вмешательство в области забрюшинного пространства (подвздошной и парааортальной зон). Показатели пациенток внесены в базу данных и проанализированы ретроспективно.
В качестве красителя выбран индоцианин зеленый (ICG), учитывая опыт его применения при других локализациях, а также данные мировой литературы о его использовании при раннем раке яичников. Возможности применения радиоизотопного метода ограничены организационными особенностями введения радиофармпрепарата за пределами радиоизотопной лаборатории, в связи с чем мы его не применяли.
Для идентификации СЛУ 0,25 % раствор индоцианина зеленого вводили в периваскулярное пространство воронко-тазовой связки (подбрю-шинно) и собственной связки яичника на стороне поражения. В случае, когда яичник отсутствовал, краситель вводили в культи связок яичника. После идентификации СЛУ удаляли, его направляли на плановое гистологическое исследование. Всем пациенткам после БСЛУ выполняли двустороннюю тазовую и парааортальную лимфаденэктомию до уровня почечных вен, а также все процедуры хирургического стадирования в соответствии с клиническими рекомендациями. В течение 30 дней пациентки прослежены на предмет ранних послеоперационных осложнений.
В исследовании оценивали частоту детекции СЛУ, осложнений процедуры и выявления метастатически измененных ЛУ с применением БСЛУ. Частоту детекции определяли как отношение количества пациенток с хотя бы одним идентифицированным СЛУ к общему количеству пациенток. Частоту осложнений определяли как отношение количества пациенток, у которых развились осложнения, ассоциированные с БСЛУ, к общему количеству пациенток. Частоту выявления метастатически измененных ЛУ с применением БСЛУ оценивали отдельно для тазовой и парааор-
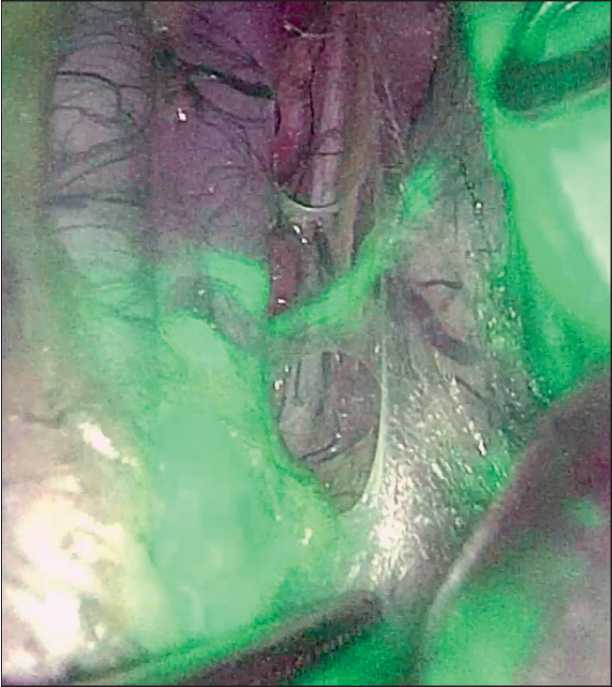
Рис. 1. Детекция СЛУ в тазовых лимфоузлах слева (лапаротомия). Примечание: рисунок выполнен авторами Fig. 1. SLN mapping, left pelvic zone (laparotomy).
Note: created by the authors тальной зон. В оценку включены только пациентки с картированными СЛУ. Данный показатель рассчитывали как отношение количества пациенток с истинноположительными СЛУ к общему количеству пациенток с истинноположительными и ложноотрицательными СЛУ в исследуемой зоне. Также проведен сравнительный анализ различных характеристик пациенток для оценки их влияния на частоту детекции СЛУ.
Статистический анализ проводили с помощью пакета epiR: Tools for the Analysis of Epidemiological Data. R package version 2.0. Для сравнения частот применяли статистический критерий Miettinen and Nurminen.
Результаты
С февраля 2022 по декабрь 2024 г. в отделении онкогинекологии НМИЦ онкологии им. Н.Н. Блохина у 48 пациенток с РЯ (табл. 1), которым выполнено хирургическое стадирование, применена методика БСЛУ. Средний возраст больных составил 46,7 (19–74) года. У 18 (37,5 %) пациенток опухоль представлена серозной high-grade аденокарциномой. Исходная клиническая стадия у всех пациенток соответствовала IA–IIA, распространенные стадии заболевания (IIB и выше) диагностированы только по данным послеоперационного патомор-фологического исследования.
Ни у одной из пациенток не возникли интраоперационные осложнения или осложнения в раннем послеоперационном периоде, ассоциированные с БСЛУ. Тазовая и парааортальная лимфаденэктомия выполнена 47 (97,9 %) пациенткам. Одной (2,1 %) пациентке после БСЛУ лимфаденэктомия не выполнялась в связи с диагнозом доброкачественной опухоли (папиллярная цистаденома), установленным по результатам интраоперационного патомор-фологического исследования.
Введение лимфотропного красителя в связки яичника выполнено 34 (70,8 %) пациенткам с сохраненным яичником. Остальным 14 (29,2 %) больным
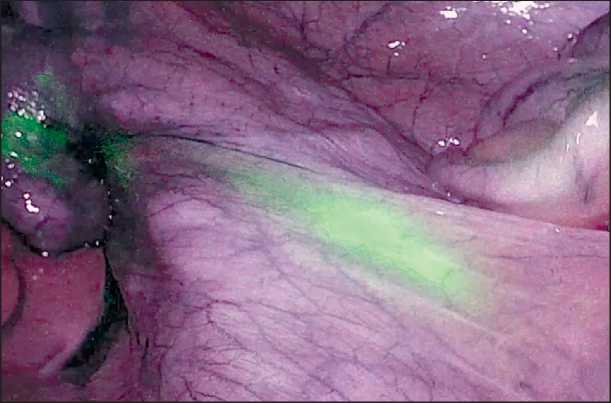
Рис. 2. Детекция СЛУ в парааортальных лимфоузлах (лапароскопия).Примечание: рисунок выполнен авторами Fig. 2. SLN mapping, paraaortic zone (laparoscopy).
Note: created by the authors
Таблица 1/table 1
Примечание: таблица составлена авторами.
Note: created by the authors.
Общая характеристика пациенток
Patients’ characteristics
лимфотропный препарат вводили в культи связок яичника. У 40 (83,3 %) пациенток был картирован хотя бы один СЛУ (рис. 1, 2). Локализация СЛУ представлена на рис. 3. У 27 (67,5 %) пациенток идентифицированы только парааортальные СЛУ, у 12 (30 %) – тазовые и парааортальные, у 1 (2,5 %) пациентки – только тазовый СЛУ.
Наиболее часто СЛУ определялся в зоне нижних аортокавальных ЛУ – у 13 (32,5 %) пациенток. В верхних аортокавальных, нижних паракаваль-ных, нижних парааортальных и верхних парааор- тальных ЛУ частота детекции составила 6 (15 %), 6 (15 %), 8 (20 %) и 7 (17,5 %) соответственно. В верхних паракавальных ЛУ сторожевой узел выявлен у 2 (5 %) пациенток. В подвздошной зоне чаще всего отмечена детекция СЛУ в группе наружных подвздошных ЛУ справа – у 8 (20 %) пациенток, у 2 (5 %) СЛУ локализовался в зоне внутренних подвздошных сосудов. Слева в подвздошной области идентифицировано 2 (5 %) СЛУ – один в области общих подвздошных и один в области наружных подвздошных сосудов. У 1 (2,5 %) па-
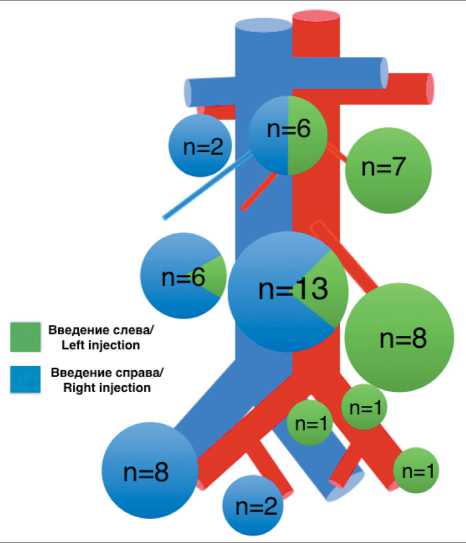
Рис. 3. Локализация СЛУ в зависимости от стороны введения ICG. Примечание: рисунок выполнен авторами
Fig. 3. SLN location by site of ICG injection.
Note: created by the authors циентки СЛУ идентифицирован в пресакральной области. Обращает на себя внимание тот факт, что слева от аорты идентифицированы СЛУ только при левостороннем введении красителя. Справа от нижней полой вены СЛУ идентифицированы при правостороннем введении красителя у всех, кроме одной пациентки – единственное наблюдение контралатеральной детекции. В верхних аортокавальных ЛУ практически равнозначно по частоте идентифицированы СЛУ как при левостороннем, так и при правостороннем введении. А вот в СЛУ нижней аортокавальной группы преобладало правостороннее введение – 10 (77 %) из 13 наблюдений.
Частота успешного картирования была незначимо выше в группе лапаротомных операций по сравнению с лапароскопией: 87,9 vs 73,3 % соответственно (р=0,215). Частота картирования при первичных и рестадирующих операциях составила 82,6 vs 84 % соответственно (р=0,898). Отмечено значимое снижение частоты картирования СЛУ при введении красителя в культи связок в сравнении с введением в анатомически целостную связку: 64,3 vs 91,2 % соответственно (р=0,025).
Метастазы в лимфатических узлах выявлены у 3 (6,25 %) из 48 пациенток. Из них у одной пациентки метастаз выявлен в парааортальном СЛУ, и это был единственный метастаз среди всех удаленных ЛУ у этой больной. У другой пациентки результат картирования оказался ложноотрицательным: СЛУ в парааортальной зоне был идентифицирован, однако метастаз выявлен в другом парааортальном ЛУ. У третьей пациентки метастаз выявлен в тазовом ЛУ, при этом СЛУ в этой зоне идентифицирован не был. У всех пациенток с метастазами в лимфатических узлах морфологический тип опухоли соответствовал серозной high-grade аденокарциноме. Таким образом, частота метастазирования в этой группе составила 16,7 % (3 из 18). Следует отметить, что среди пациенток с серозной high-grade аденокарциномой частота картирования хотя бы одного СЛУ составила 94,4 %. У 39 (97,5 %) из 40 пациенток подтверждено наличие СЛУ в удаленных тканях, у 1 (2,5 %) элементы ЛУ в биоптате не найдены. Таким образом, точность методики
Таблица 2/table 2
Диагностические характеристики методики БСЛУ
Diagnostic characteristics of sln detection
|
Показатель/Indicator |
НМИЦО им. Н.Н. Блохина, 2025/N.N. Blokhin NMRCO, 2025 (n=48) |
SELLY, 2024 [20] (n=169) |
|
Частота картирования/Detection rate |
40 (83,3 %) |
99 (63,6 %) |
|
Выявление метастазов при забрюшинной лимфаденэктомии без БСЛУ/ Positive nodes after retroperitoneal lymphadenectomy without SLN method |
3 (7,5 %) |
8 (8,1 %) |
|
Выявление метастазов в СЛУ без ультрастадирования/ Positive nodes in SLN without ultrastaging |
1 (2,5 %) |
4 (4 %) |
|
Выявление метастазов в СЛУ с ультрастадированием/ Positive nodes in SLN with ultrastaging |
– |
7 (7,1 %) |
|
Выявление метастазов после забрюшинной лимфаденэктомии + БСЛУ с ультрастадированием/ Positive nodes after retroperitoneal lymphadenectomy and SLN detection with ultrastaging |
– |
15 (15,2 %) |
|
Ложноотрицательные СЛУ/False negative SLN |
1 (2,5 %) |
4 (4 %) |
|
Частота выявления метастатически измененных ЛУ/ Level of LN metastasis detecting by SLN Примечание: таблица составлена авторами. |
50 % |
73,3 % |
Notes: SLN – sentinel lymph node; created by the authors.
составила 97,5 %. Методом БСЛУ идентифицированы метастатические ЛУ у 1 из 3 пациенток. Однако в одном наблюдении метастаз выявлен в подвздошной зоне, где не был картирован СЛУ. Таким образом, с применением методики БСЛУ удалось выявить лишь 50 % пациенток с метастатически измененными ЛУ в парааортальной зоне (истинноположительные СЛУ). В тазовой зоне ни у одной из пациенток с картированными СЛУ не были выявлены метастазы. Предварительный статистический анализ показал, что полученных данных недостаточно для оценки чувствительности методики в исследуемой подгруппе (95 % ДИ 0,01–1,00), что диктует необходимость проведения дальнейшего исследования с набором большей популяции пациенток.
Обсуждение
Проведенное исследование является первым в нашей стране проспективным исследованием методики БСЛУ при раннем РЯ. Небольшое количество пациенток, включенных в исследование, обусловлено низкой частотой встречаемости ранних форм РЯ. Трудность применения методики объясняется, прежде всего, техническими особенностями ее реализации. Стандартная техника введения красителя при раннем РЯ не разработана. В мировой литературе описано несколько точек введения: в строму яичника, в основание связок у полюсов яичника, в периваскулярное пространство связок яичника [12–15]. Введение в яичник рядом с опухолью сопряжено с высоким риском разрыва капсулы опухоли и нарушением абластики, поэтому на практике не применяется. Наш опыт показал, что
Таблица 3/table 3
|
Источник/ Study |
N |
Доступ/ Approach |
Место введения/ Point of injection |
Краситель/ Tracer |
Локализация СЛУ/ SLN localion |
Частота детекции/ Detection rate |
Ложноотрицательный результат/ False negative |
|
Kleppe et al., 2014 [9] |
21 |
ЛТ/LT |
Связки яичника/ Ligaments of the ovary |
99mTc + синий/ 99mTc + blue dye |
ПА – 67 %, Т – 9 % ПА + Т – 24 %/ PA – 67 %, Pel – 9 % PA + Pel – 24 % |
100 % |
0 % |
|
Связки яичника – |
ПА – 84 %, Т – 8 % ПА + Т – 8 %/ PA – 84 %, Pel – 8 % PA + Pel – 8 % |
||||||
|
Hassanzadeh |
25, яичник – 10/ |
99mTc + синий/ 99mTc + blue dye |
|||||
|
et al., 2016 [16] |
35 |
ЛТ/LT |
Ligaments of the ovary – 25, ovary – 10 |
90 % |
н/д |
||
|
ЛТ – 7, |
|||||||
|
Nyberg et al., 2017 [17] |
20 |
ЛС – 3/ LT – 7, LS – 3 |
Мезовариум/ Mesovarium |
99mTc + синий/ 99mTc + blue dye |
ПА – 60 %, Т – 10 %/ PA – 60 %, Pel – 10 % |
100 % |
0 % |
|
Lago et al., 2020 [18] |
20 |
ЛТ – 11, ЛС – 9/ LT – 11, LS – 9 |
Связки яичника, культи связок/ Ligaments of the ovary, ligaments’ stumps |
99mTc + ICG |
ПА/PA |
100 % (Tc) 90 % (ICG) |
н/д/n/d |
|
ПА – 67 %, |
|||||||
|
Laven et al., |
11 |
ЛТ/LT |
Культи связок/ |
99mTc + синий/ |
ПА + Т – 33 %/ |
27 % |
н/д/n/d |
|
2021 [19] |
Ligaments’ stumps |
99mTc + blue dye |
PA – 67 %, PA + Pel – 33 % |
||||
|
Связки яичника, |
|||||||
|
Nero et al., |
ЛТ, ЛС/ LT, LC |
культи связок/ |
|||||
|
2024, SELLY |
169 |
Ligaments of the |
ICG |
н/д/n/d |
63,6 % |
4 % |
|
|
[20] |
ovary, ligaments’ |
||||||
|
stumps |
|||||||
|
ЛТ – 33, ЛС – 15/ LT – 33, LS – 15 |
Связки яичника, |
ПА – 67,5 %, ПА + Т – 30 %, Т – 2,5 %/ PA – 67,5 %, PA + Pel – 30 % , Pel – 2,5 % |
|||||
|
НМИЦО им. Н.Н. Блохина, 2025 |
48 |
культи связок/ Ligaments of the ovary, ligaments’ stumps |
ICG |
83,3 % |
2,5 % |
Примечание: таблица составлена авторами.
Note: created by the authors.
Сравнительные характеристики методики БСЛУ
Comparable characteristics of sln detection
введение в периваскулярное пространство связок демонстрирует наибольшую частоту детекции, поэтому оно было принято за основную методику в представленном исследовании.
Частота детекции хотя бы одного СЛУ составила 83,3 %, что соотносится с данными мировой литературы (табл. 3). Следует отметить, что с накоплением опыта наблюдалась тенденция к увеличению частоты детекции. Так, в первый год применения методики частота детекции составила 60 %, в последующие годы она превысила 85 %. По результатам самого крупного многоцентрового проспективного исследования C. Nero et al. (2024), включающего 169 пациенток, частота детекции оказалась ниже и составила 58,6 % [20]. Мы применяли аналогичную технику введения красителя – подбрюшинно в периваскулярное пространство связок. Более высокую частоту детекции в нашем исследовании, вероятно, можно объяснить тем, что оно проводилось в одном центре, в то время как в исследовании SELLY принимали участие 15 хирургов из 10 центров Италии. По данным исследования SELLY, сторожевые лимфоузлы в тазовой зоне идентифицированы у 63 (63,6 %) из 99 пациенток. В нашем же исследовании частота детекции в группе тазовых ЛУ оказалась низкой – лишь у 13 (32,5 %) из 40 пациенток. Чаще всего трудности с картированием тазовых СЛУ обусловлены ретроперитонеальной диффузией красителя, что препятствовало идентификации. Помимо этого, введение красителя в собственную связку яичника часто сопровождалось оттоком по ходу воронко-тазовой связки и отсутствием детекции в подвздошной зоне, а в случае введения в культю собственной связки и вовсе отсутствием прокрашивания лимфатических протоков. Следует отметить, что пациентки с удаленными ранее яичником или маткой представляют особенно сложную для детекции СЛУ клиническую группу. В исследовании P. Laven et al. [18] краситель вводили только в культи связок, СЛУ удалось идентифицировать лишь у 3 из 11 пациенток, таким образом, частота детекции составила 27,3 %. Возможно, такие результаты обусловлены фиброзированием лимфатических протоков после пересечения связок, особенно с применением электрокоагуляции. В нашем исследовании из 14 пациенток с удаленным ранее яичником СЛУ удалось картировать у 9 (64,3 %). В процессе накопления опыта мы несколько модифицировали технику введения препарата в культи связок: инъекция красителя в культю воронко-тазовой связки осуществляется после ее натяжения в периваскулярное пространство на некотором расстоянии (обычно 2 см) от


