Диагностическая значимость ускорения коронарного кровотока, измеренного методом чреспищеводной эхокардиографии при аортокоронарном шунтировании
Автор: Ефремов С.М., Новиков М.А., Трофимов А.А., Шматов Д.В., Каменских М.С., Загатина А.В.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Оригинальные статьи ишемическая болезнь сердца
Статья в выпуске: 3 т.27, 2023 года.
Бесплатный доступ
Актуальность. Чреспищеводная эхокардиография как способ интраоперационной оценки коронарного кровотока недостаточно изучена. Цель. Оценить возможность выявления с помощью чреспищеводной эхокардиографии проксимальных стенозов коронарных артерий; определить взаимосвязь между стенозами по коронарографии и скоростью кровотока в соответствующей области по чреспищеводной эхокардиографии; изучить динамику скорости кровотока до и после аортокоронарного шунтирования и ее связь с послеоперационным повреждением миокарда. Методы. В проспективное когортное исследование включили 186 пациентов, направленных на аортокоронарное шунтирование. Всем больным проводили интраоперационную чреспищеводную эхокардиографию с измерением скорости кровотока в области его ускорения в проксимальных отделах бассейна левой коронарной артерии до и после шунтирования. В первый день послеоперационного периода измеряли концентрацию тропонина I. Результаты. Зоны ускоренного кровотока до шунтирования наблюдались для ствола левой коронарной артерии - в 88 случаях (47,3 %), для передней межжелудочковой артерии - в 146 (78,5 %), для огибающей артерии - в 28 (15,1 %). По результатам ROC-анализа, скорость кровотока, превышающая 73 см/с, в левой коронарной артерии и свыше 91 см/с в огибающей артерии ассоциирована со стенозом 50 и 70 % соответствующих артерий по данным коронарографии. Увеличение скорости кровотока в передней межжелудочковой артерии либо ее снижение менее 4 см/с после шунтирования - предикторы 10-кратного повышения концентрации тропонина I в послеоперационном периоде. Заключение. Оценка коронарного кровотока во время чреспищеводной эхокардиографии может иметь дополнительное диагностическое значение для выявления клинически значимых стенозов коронарных артерий, а его исследование в динамике может служить ранним критерием прогнозирования периоперационного повреждения миокарда.
Аортокоронарное шунтирование, ишемическая болезнь сердца, коронарный кровоток, послеоперационное повреждение миокарда, чреспищеводная эхокардиография
Короткий адрес: https://sciup.org/142239085
IDR: 142239085 | DOI: 10.21688/1681-3472-2023-3-44-52
Текст научной статьи Диагностическая значимость ускорения коронарного кровотока, измеренного методом чреспищеводной эхокардиографии при аортокоронарном шунтировании
Цитировать: Ефремов С.М., Новиков М.А., Трофимов А.А., Шматов Д.В., Каменских М.С., Загатина А.В. Диагностическая значимость ускорения коронарного кровотока, измеренного методом чреспищеводной эхокардиографии при аортокоронарном шунтировании. Патология кровообращения и кардиохирургия. 2023;27(3):44-52.
С.М. Ефремов, М.А. Новиков, А.А. Трофимов, Д.В. Шматов,
Чреспищеводная эхокардиография (ЧПЭхоКГ) является информативным инструментом кардиоанестезиолога и рутинно применяется при отсутствии противопоказаний. Несмотря на то что целесообразность рутинного использования этого исследования при хирургическом лечении неосложненной ишемической болезни сердца спорна, к нему прибегают для гемодинамического мониторинга, оценки результатов и осложнений хирургического вмешательства [1]. В клинической практике нередки случаи, когда новые данные, выявленные в результате ЧПЭхоКГ, вносят коррективы в операционный план, в том числе при выполнении аортокоронарного шунтирования (АКШ) [2; 3].
Коронарография — общепризнанный метод исследования коронарного русла у пациентов с ишемической болезнью сердца. Адекватная оценка стенозов коронарных артерий подразумевает использование нескольких проекций с выбором оптимальной из них, а при выявлении пограничных стенозов рекомендовано прибегать к дополнительным методам диагностики, таким как фракционный резерв кровотока (англ. Fractional Flow Reserve, FFR) или внутрисосудистый ультразвук [1; 4]. Возможности интраоперационной визуализации проксимальных сегментов коронарных артерий с использованием ЧПЭхоКГ недостаточно изучены. Дизайн настоящего проспективного когортного исследования происходит из гипотезы, что функциональная оценка коронарного кровотока во время интраоперационной ЧПЭхоКГ имеет клиническую значимость в диагностике гемодинамически значимых стенозов коронарных артерий.
Цель — изучить клиническую значимость интраоперационной оценки коронарного кровотока при помощи чреспищеводной эхокардиографии.
Для достижения поставленной цели были сформулированы следующие задачи:
-
1. Оценить возможность выявления стенозов проксимальных отделов коронарных артерий во время интраоперационной чреспищеводной эхокардиографии.
-
2. Определить взаимосвязь степени стеноза коронарных артерий по данным коронарографии со скоростью кровотока по чреспищеводной эхокардиографии.
-
3. Изучить динамику скорости коронарного кровотока, оцениваемого по ЧПЭхоКГ, до и после аортокоронарного шунтирования и ее связь с послеоперационной концентрацией тропонина I.
Методы
Этическая экспертиза
Исследование соответствует принципам Хельсинкской декларации и одобрено этическим комитетом Клиники высоких медицинских технологий им. Н.И. Пирогова Санкт-Петербургского государственного университета (протокол № 04-2018 от 05.04.2018 г.). Все пациенты подписали добровольное информированное согласие.
Условия сбора данных
Исследование проведено в Клинике высоких медицинских технологий им. Н.И. Пирогова Санкт-Петербургского государственного университета (Санкт-Петербург, Россия). Критерии включения: возраст 18 и более лет; планируемое аортокоронарное шунтирование, в том числе в составе комбинированного вмешательства. Критерии исключения: экстренное хирургическое вмешательство; противопоказания к периоперационной ЧПЭхоКГ. Данные о пациентах извлекали из электронной медицинской документации.
Эхокардиография коронарных артерий
ЧПЭхоКГ выполняли через 30 мин после индукции общей анестезии у всех пациентов как часть рутинной клинической практики. В каждом случае проводили полную оценку согласно рекомендациям Американского эхокардиографического общества (англ. American Society of Echocardiography, ASE) / Общества анестезиологов сердечно-сосудистой системы (англ. Society of Cardiovascular Anesthesiologists, SCA) [5]. Визуализацию до и после шунтирования осуществляли в условиях
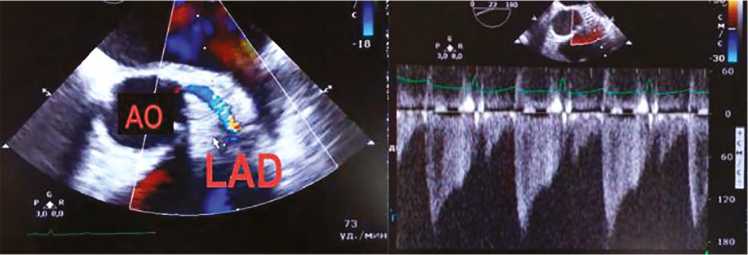
Рис. 1. Визуализация стеноза по зоне ускорения кровотока в передней межжелудочковой артерии
Примечание. АО — аорта; LAD — англ. left anterior descending artery, левая передняя нисходящая артерия.
гемодинамической стабилизации на фоне поддержания среднего артериального давления не менее 65 мм рт. ст. Все эхокардиографические исследования выполнял анестезиолог, специализирующийся на кардиохирургии, имеющий национальный сертификат ультразвуковой диагностики и опыт ЧПЭхоКГ, в том числе коронарных артерий, с использованием диагностической ультразвуковой системы CX50 (Philips, Амстердам, Нидерланды) и транспищеводного датчика X7-2t (Philips, Амстердам, Нидерланды). Повторную визуализацию коронарных артерий проводили после отлучения пациентов от аппарата искусственного кровообращения и стабилизации гемодинамики. Все операции АКШ осуществляла команда из трех кардиохирургов.
Анатомический ход коронарных артерий исследовали с помощью цветовой допплерографии с использованием стандартных и модифицированных положений датчика, прежде всего среднепищеводной позиции для визуализации аортального клапана по короткой и длинной осям. По возможности анализировали ствол левой коронарной артерии (ЛКА) целиком и проксимальные сегменты передней межжелудочковой артерии (ПМЖА), левой огибающей артерии (ОА). Изначально цветное допплеровское сканирование проводили с использованием предела Найквиста 0,2 м/с. В дальнейшем по мере необходимости предел Найквиста увеличивали вплоть до 0,7 м/с для улучшения визуализации. Для оценки скорости кровотока применяли импульсноволновой режим допплерографии. О возможности визуализации стенозов коронарных артерий судили исходя из определения зон увеличения скорости кровотока в соответствующих артериях (рис. 1). Измеряли максимальную диастолическую скорость в одной и той же области артерии до и после шунтирования (рис. 2). Поскольку результаты допплерографии зависят от угла между направлением распространения ультразвуковой волны и током крови, датчик располагали для обеспечения максимально возможной параллельной проекции.
Анестезия
Индукцию анестезии проводили с помощью фентанила (5 мкг/кг) и пропофола (1–2 мг/кг). Миорелаксации достигали рокурония бромидом (0,1 мг/кг). Анестезию поддерживали до, во время и после искусственного кровообращения периодическими инъекциями фентанила (2,5 мкг/кг) с 30-минутным интервалом и 2–3% севофлураном.
Хирургический доступ выполняли посредством полной срединной стернотомии. В случае использования аппарата искусственного кровообращения первичное заполнение контура осуществляли
Рис. 2. Измерение максимальной диастолической скорости в зоне ускорения кровотока до (А) и после (В) шунтирования
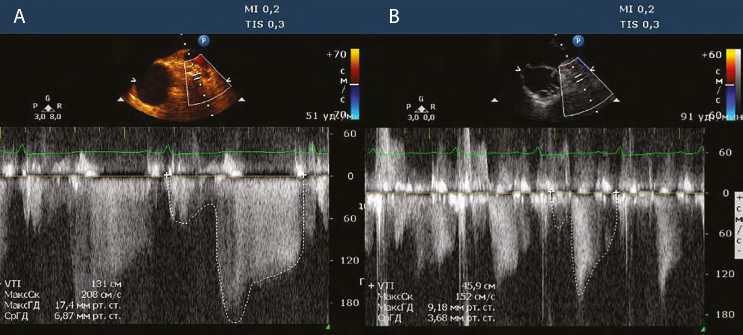
Табл. 1. Общие сведения о пациентах, включенных в исследование
|
Критерий |
Значение |
|
|
Женский пол, n (%) |
49 (26,3) |
|
|
Возраст, лет |
64,2 ± 8,6 |
|
|
Индекс массы тела, кг/м2 |
28,4 ± 4,4 |
|
|
I |
5 (2,7) |
|
|
Функциональный класс стенокардии до операции, n (%) |
II |
86 (46,2) |
|
III |
61 (32,8) |
|
|
IV |
12 (6,45) |
|
|
I |
2 (1,1) |
|
|
Функциональный класс сердечной недостаточности по классификации Нью- |
II |
97 (52,2) |
|
Йоркской ассоциации кардиологов до операции, n (%) |
III |
79 (42,5) |
|
IV |
2 (1,1) |
|
|
Оценка по шкале STS Mortality |
1,1 [0,8; 1,8] |
|
|
Оценка по шкале STS Mortality + Morbidity |
9,8 [6,8; 12,4] |
|
|
Фракция выброса по данным трансторакальной эхокардиографии до операции, % |
60 [49,0; 65,8] |
|
|
Комбинированное вмешательство, n (%) |
28 (15,1) |
|
|
Артериальная гипертензия |
182 (97,8) |
|
|
Диабет |
30 (16,1) |
|
|
Фибрилляция предсердий |
16 (8,6) |
|
|
Диализ-зависимая хроническая болезнь почек |
1 (0,5) |
|
|
Хроническая обструктивная болезнь легких |
8 (4,3) |
|
|
Постинфарктный кардиосклероз |
113 (60,8) |
|
|
Кардиохирургическое вмешательство в анамнезе |
1 (0,5) |
|
|
Чрескожное коронарное вмешательство в анамнезе |
47 (25,3) |
|
|
Однососудистое |
14 (7,5) |
|
|
Характер поражения коронарных артерий согласно коронарографии, n (%) |
Двухсосудистое |
46 (24,7) |
|
Трехсосудистое |
126 (67,7) |
|
|
50–69 |
40 (21,7) |
|
|
Поражение ствола левой коронарной артерии, n (%) |
≥ 70 |
37 (20,1) |
|
Окклюзия |
0 |
|
|
50–69 |
26 (14) |
|
|
Проксимальное поражение передней межжелудочковой артерии, n (%) |
≥ 70 |
129 (69,4) |
|
Окклюзия |
20 (10,8) |
|
|
50–69 |
22 (11,8) |
|
|
Проксимальное поражение огибающей артерии, n (%) |
≥ 70 |
85 (45,7) |
|
Окклюзия |
34 (18,3) |
|
|
Операция в условиях искусственного кровообращения, n (%) |
174 (93,5) |
|
|
Длительность искусственного кровообращения, мин |
70 [56; 84] |
|
|
Продолжительность окклюзии аорты, мин |
42,5 [32; 54] |
|
|
Вазопрессоры после операции, n (%) |
34 (18,2) |
|
|
Периоперационный инфаркт миокарда 5-го типа [6], n (%) |
9 (4,8) |
|
Примечание. STS Mortality — показатель смертности по шкале Общества торакальных хирургов (англ. Society of Thoracic Surgeons); STS Mortality + Morbidity — показатель смертности и заболеваемости. Данные представлены как M ± SD, Me [Q1; Q3] или как n (%).
1 000 мл раствора Рингера, 200 мл 10% маннитола и 200 мл 4,2% гидрокарбоната натрия. Начальную дозу гепарина (300 Ед/кг) вводили для достижения активированного времени свертывания 480 с. Интраоперационную назофарингеальную температуру поддерживали на уровне 36,0–36,7 °C. Защиты миокарда достигали путем антеградной кристалло- идной холодовой кардиоплегии модифицированным раствором St. Thomas с температурой 4 °C непосредственно после пережатия аорты, который повторно вводили с 20–25-минутными интервалами, или кустодиолом в дозе 20 мл/кг при комбинированных вмешательствах (АКШ и коррекция клапанной патологии).
Специфичность, %
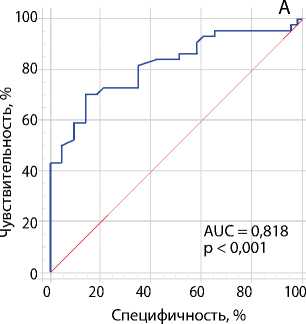
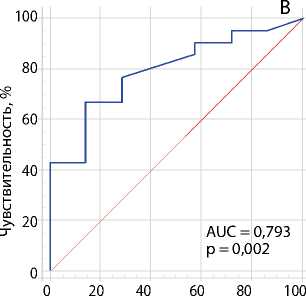
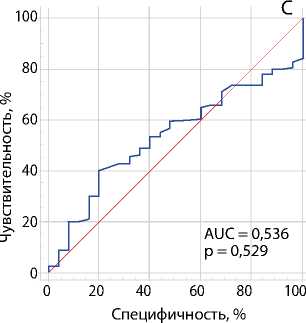
Рис. 3. ROC-кривые оценки взаимосвязи между скоростью кровотока в зоне его ускорения и степенью стеноза коронарных артерий согласно результатам коронарографии: стеноз ствола левой коронарной артерии ≥ 50 % (A); стеноз огибающей артерии ≥ 70 % (B); стеноз передней межжелудочковой артерии ≥ 70 % (C)
Примечание. AUC — англ. area under curve, площадь под кривой.
Лабораторные исследования
Тропонин I определяли в сыворотке крови имму-ноферментным методом c использованием реагентов Access AccuTnI (Beckman Coulter, Бреа, США) на анализаторе Access2 (Beckman Coulter, Бреа, США).
Статистический анализ
Категориальные переменные представлены как числа и доли в процентах, непрерывные переменные — как медианы и 25- и 75% квартили для распределения, отличного от нормального, и как среднее и стандартное отклонение для нормально распределенных данных. Для оценки нормальности переменных использовали критерий Шапиро – Уилка с пороговым значением p < 0,05. Оценку взаимосвязи степени стеноза по данным коронарографии со скоростью ускорения кровотока в соответствующей коронарной артерии осуществляли с помощью ROC-анализа с расчетом площади под ROC-кривой и определения критерия с наилучшим соотношением чувствительности и специфичности. Также ROC-анализ проводили для оценки взаимосвязи между динамикой скорости коронарного кровотока до и после АКШ и степенью повреждения миокарда. Динамику коронарного кровотока рассчитывали как разницу скорости между этапами до и после АКШ, а в качестве переменной классификатора приняли десятикратное увеличение концентрации тропонина I в первые сутки после операции (5 нг/мл).
Все статистические расчеты выполняли в программе MedCalc версии 20.123 (MedCalc Software Ltd., Остенде, Бельгия).
Результаты
С октября 2018 г. по октябрь 2022 г. в исследование включили 186 пациентов. Периоперационная характеристика представлена в табл. 1.
Возможности визуализации коронарного кровотока посредством чреспищеводной эхокардиографии
Общая частота успешной визуализации зон ускоренного коронарного кровотока в бассейне ЛКА на ЧПЭхоКГ составила 175 (94,1 %) и 157 (84,4 %) случаев до и после АКШ соответственно. Визуализация зон ускоренного коронарного кровотока была вариабельна для различных артерий и исходно составляла: для ствола ЛКА — 88 (47,3 %) случаев, ПМЖА — 146 (78,5 %), огибающей артерии — 28 (15,1 %).
Взаимосвязь скорости кровотока по чреспищеводной эхокардиографии и степени стеноза по коронарографии
Для изучения взаимосвязи между скоростью кровотока в зоне его ускорения и степенью стеноза коронарных артерий провели ROC-анализ, в котором в качестве исследуемого параметра взяли скорость коронарного кровотока по ЧПЭхоКГ, а прогнозируемого критерия — степень стеноза ≥ 50 % для ЛКА и ≥ 70 % для ПМЖА и ОА согласно результатам коронарографии. Результаты ROC-анализа представлены на рис. 3 и в табл. 2.
Табл. 2. ROC-анализ диагностической ценности ускорения коронарного кровотока по чреспищеводной эхокардиографии по отношению к стенозам коронарных артерий: ≥ 50 % левой коронарной артерии и ≥ 70 % передней межжелудочковой и огибающей артерий, согласно коронарографии
|
Артерия |
Критерий*, см/с |
AUC |
95% ДИ |
p |
Чувствительность |
Специфичность |
|
ЛКА |
> 73 |
0,818 |
0,721–0,893 |
< 0,0001 |
70,5 |
86 |
|
ОА |
> 91 |
0,793 |
0,598–0,921 |
0,0017 |
67 |
86 |
|
ПМЖА |
≤ 81 |
0,536 |
0,449–0,621 |
0,53 |
40 |
80 |
Примечание. * — скорость кровотока в месте его ускорения, соответствующего проекции стеноза; ЛКА — ствол левой коронарной артерии; ОА — огибающая артерия; ПМЖА — передняя межжелудочковая артерия; AUC — англ. area under curve, площадь под кривой; ДИ — доверительный интервал.
Зависимость концентрации тропонина от изменения скорости коронарного кровотока
Динамика скорости кровотока по данным допплерографии после выполнения коронарного шунтирования была следующей. В большинстве случаев для всех сосудов отмечалось снижение скорости кровотока: n = 30 (65 %) для ствола ЛКА, n = 79 (62 %) для ПМЖА и n = 7 (64 %) для ОА. Повышение скорости кровотока выявляли реже: n = 14 (30 %) для ствола ЛКА, n = 44 (35 %) для ПМЖА, n = 3 (27 %) для ОА. В единичных случаях скорость кровотока оставалась без изменений: n = 2 (4 %) для ствола ЛКА, n = 4 (3 %) для ПМЖА, n = 1 (9 %) для огибающей артерии.
Рутинное измерение тропонина I выполнили у всех пациентов в первые сутки после операции. Во время проведения исследования, в январе 2022 г., лабораторная служба клиники перешла на опреде- ление высокочувствительного тропонина I, а невысокочувствительное измерение стало недоступно. В результате невысокочувствительный тест провели у 155 больных, высокочувствительный — у 31 пациента. С учетом значительных различий этих методов и существенно меньшего количества доступных результатов высокочувствительного анализа решили ограничить анализ повреждения миокарда невысокочувствительным тестом (n = 155). В данной когорте 10-кратное превышение тропонина I после операции выявили у 28 (18 %) пациентов.
Результаты ROC-анализа оценки взаимосвязи между динамикой скорости коронарного кровотока до и после АКШ и степенью повреждения миокарда представлены на рис. 4 и в табл. 3. Учитывая малое количество измерений скорости кровотока по ОА на обоих этапах исследования (n = 12), ROC-анализ для этой артерии не проводили.
Рис. 4. ROC-кривые оценки взаимосвязи между разницей скорости коронарного кровотока до и после шунтирования и 10-кратным превышением концентрации тропонина I после операции: ствол левой коронарной артерии (A); передняя межжелудочковая артерия (B) Примечание. AUC — англ. area under curve, площадь под кривой.
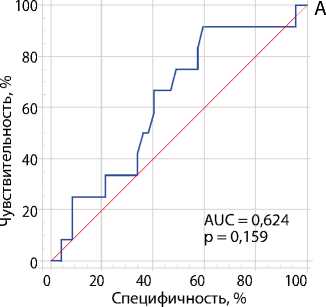
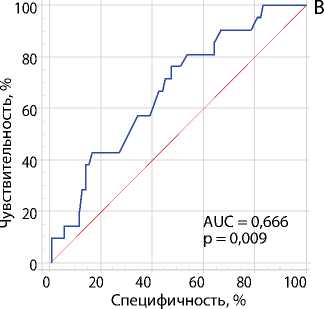
Табл. 3. ROC-анализ прогностической ценности динамики коронарного кровотока до и после аортокоронарного шунтирования по отношению к 10-кратно превышающей верхнюю границу нормы концентрации тропонина I в первые сутки после операции
|
Градиент по артерии* |
Критерий, см/с |
AUC |
95% ДИ |
p |
Чувствительность |
Специфичность |
|
ЛКА |
> 29 |
0,624 |
0,488–0,747 |
0,159 |
91 |
40 |
|
ПМЖА |
≤ 4 |
0,666 |
0,567–0,755 |
0,009 |
76,2 |
52,4 |
Примечание. * — разница скорости коронарного кровотока в месте стеноза между этапами до и после аортокоронарного шунтирования; ЛКА — ствол левой коронарной артерии; ПМЖА — передняя межжелудочковая артерия; AUC — англ. area under curve, площадь под кривой; ДИ — доверительный интервал.
Обсуждение
Основными результатами работы являются следующие находки:
-
1. Продемонстрирована возможность функциональной оценки стенозов проксимальных сегментов ЛКА с использованием ЧПЭхоКГ посредством измерения скорости коронарного кровотока в месте его ускорения.
-
2. В настоящем исследовании скорость коронарного кровотока, превышающая 73 см/с в ЛКА и 91 см/с в ОА, была ассоциирована со стенозами 50 и 70 % соответствующих артерий по данным коронарографии.
-
3. Выявлена возможная прогностическая значимость измерения скорости коронарного кровотока в динамике до и после выполнения АКШ. В частности, увеличение кровотока по ПМЖА по сравнению с исходным после операции может являться предиктором клинически значимого повреждения миокарда.
В настоящем исследовании общая частота визуализации стенозов коронарных артерий составила 94,1 %, что совпадает с результатами исследования T.E. Samdarshi и соавт., сообщивших об успешном определении коронарного кровотока у 93 % пациентов [7]. После АКШ доля успешных визуализаций уменьшалась, вероятно, вследствие значительного снижения коронарного кровотока в проекции проксимального стеноза на фоне адекватно функционирующих коронарных шунтов.
M. Yoshitatsu и соавт. проанализировали эффекты АКШ на коронарный кровоток дистальнее дистальных анастомозов с использованием трансторакальной эхокардиографии у 55 пациентов [8]. Авторы обнаружили увеличение кровотока в исследуемых участках коронарных артерий, вероятно, в результате выполненной реваскуляризации. Частота успешных измерений коронарного кровотока была выше после операции (80 % против 60 % до вмешательства), что соответствует ожидаемым эффектам АКШ. Авторы отметили зависимость между исходно безуспешным измерением коронарного кровотока и тяжелым поражением коронарного русла. При этом именно у таких пациентов улучшение кровотока после операции было более выраженным. Эти данные не противоречат нашим результатам, поскольку мы оценивали кровоток проксимально анастомоза, непосредственно в зоне его ускорения, соответствующей локализации стеноза артерии. Предполагаем, что успешная реваску- ляризация, приводящая к увеличению кровотока дистальнее анастомоза, снижает его проксимально, что соответствует выявленной нами зависимости между изменением скорости коронарного кровотока и концентрацией тропонина I в первые сутки после операции.
Взаимосвязь между увеличением скорости коронарного кровотока, измеренного в ходе рутинной трансторакальной эхокардиографии, и сердечнососудистыми осложнениями была продемонстрирована ранее [9; 10]. Атеросклеротическое поражение — не единственный фактор, приводящий к увеличению скорости коронарного кровотока [11]. Другой причиной может быть усиление потребности в кислороде и повышение перфузии на фоне ишемии миокарда [12]. К сожалению, наше исследование не позволяет оценить взаимосвязь между скоростью кровотока и функцией коронарных шунтов, поскольку флоуметрию пациентам не проводили.
Мы не обнаружили взаимосвязи между ускорением кровотока по ПМЖА и степенью ее стеноза, в то время как для ЛКА и ОА такая зависимость выявлена. Вероятно, это связано с тем, что стеноз ПМЖА ≥ 70 % имели 149 (80 %) пациентов, что ограничивает возможности статистического анализа дескриминативных функций данного критерия. Кроме того, морфологическая гетерогенность поражения коронарного русла имеет множество параметров, учесть которые в рамках одной работы не представляется возможным. В частности, не учтены протяженность стенозов, наличие диффузного поражения коронарного русла, а артерии с окклюзионным поражением также входили в анализ.
Ограничения
-
1. Мы не проводили рутинной оценки функции коронарных шунтов (при помощи коронарошунто-графии или флоуметрии), что не позволяет детально дифференцировать причину послеоперационного повреждения миокарда.
-
2. Измерение скорости кровотока при допплерографии зависит от угла визуализации, который может, с одной стороны, влиять на достоверность результатов, а с другой — изменяться на различных этапах операции.
-
3. Мы ограничились измерением скорости кровотока в бассейне ЛКА исходя из соображений безопасности пациента и недопустимости пролонгирования операции по причине исследования коронарных артерий во время чреспищеводной эхокардиографии.
-
4. С учетом того что исследование одноцентровое, а метод ЧПЭхоКГ является оператор-зависи-мым, необходима как внутренняя, так и внешняя валидация полученных результатов.
-
5. Исследование проводили на выборке небольшого размера.
-
6. Для статистического анализа использовали только однофакторный анализ.
Заключение
Оценка коронарного кровотока во время ЧПЭхоКГ может иметь дополнительное диагностическое значение при анализе клинически значимых стенозов коронарных артерий, а его исследование в динамике может служить ранним критерием прогнозирования периоперационного повреждения миокарда. Валидация полученных результатов и выявление их роли в принятии клинических решений — предмет будущих исследований.
Список литературы Диагностическая значимость ускорения коронарного кровотока, измеренного методом чреспищеводной эхокардиографии при аортокоронарном шунтировании
- 1. Lawton J.S., Tamis-Holland J.E., Bangalore S., Bates E.R., Beckie T.M., Bischoff J.M., Bittl J.A., Co- 8. hen M.G., DiMaio J.M., Don C.W., Fremes S.E., Gaudino M.F., Goldberger Z.D., Grant M.C., Jaswal J.B., Kurlansky P.A., Mehran R., Metkus T.S. Jr, Nnacheta L.C., Rao S.V., Sellke F.W., Sharma G., Yong C.M., Zwischenberger B.A. 2021 ACC/AHA/SCAI Guideline for coronary artery revascularization: a report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. 9. J Am Coll Cardiol. 2022;79(2):e21-e129. PMID: 34895950. https://doi.org/10.1016/j.jacc.2021.09.006
- Guarracino F., Cariello C., Tritapepe L., Doroni L., Baldassarri R., Danella A., Stefani M. Transoesophageal echocardiography during coronary artery bypass procedures: impact on 10. surgical planning. HSR Proc Intensive Care Cardiovasc Anesth. 2010;2(1):43-49. PMID: 23440403; PMCID: PMC3484577.
- Metkus T.S., Thibault D., Grant M.C., Badhwar V., Jacobs J.P., Lawton J., O'Brien S.M., Thourani V., Wegermann Z.K., Zwischenberger B., Higgins R. Transesophageal 11. echocardiography in patients undergoing coronary artery bypass graft surgery. J Am Coll Cardiol. 2021;78(2):112-122. PMID: 33957241; PMCID: PMC8876254. https://doi. org/10.1016/j.jacc.2021.04.064
- Рекомендации ESC/EACTS по реваскуляризации миокарда 2018. Российский кардиологический журнал. 2019;(8):151 -226. https://doi.org/10.15829/1560-4071-2019-8-151-226 2018 ESC/EACTS guidelines on myocardial revascularization. Russian Journal of Cardiology. 2019;(8):151-226. (In Russ.) https://doi.org/10.15829/1560-4071-2019-8-151-226
- Hahn R.T., Abraham T., Adams M.S., Bruce C.J., Glas K.E., Lang R.M., Reeves S.T., Shanewise J.S., Siu S.C., Stewart W., Picard M.H. Guidelines for performing a comprehensive transesophageal echocardiographic examination: recommendations from the American Society of Echocardiography and the Society of Cardiovascular Anesthesiologists. J Am Soc Echocardiogr. 2013;26(9):921-964. PMID: 23998692. https:// doi.org/10.1016/j.echo.2013.07.009
- Thygesen K., Alpert J.S., Jaffe A.S., Chaitman B.R., Bax J.J., Morrow D.A., H.D. White; Executive Group on behalf of the Joint European Society of Cardiology (ESC)/American College of Cardiology (ACC)/American Heart Association (AHA)/World Heart Federation (WHF) Task Force for the Universal Definition of Myocardial Infarction. Fourth universal definition of myocardial infarction (2018). J Am Coll Cardiol. 2018;72(18):2231-2264. PMID: 30153967. https://doi. org/10.1016/_i.jacc.2018.08.1038
- Samdarshi T.E., Nanda N.C., Gatewood R.P. Jr, Ballal R.S., Chang L.K., Singh H.P., Nath H., Kirklin J.K., Pacifico A.D. Usefulness and limitations of transesophageal echocardiography in the assessment of proximal coronary artery stenosis. J Am Coll Cardiol. 1992;19(3):572-580. PMID: 1538012. https://doi.org/10.1016/S0735-1097(10)80275-X
- Yoshitatsu M., Miyamoto Y., Mitsuno M., Toda K., Yoshikawa M., Fukui S., Nomura F., Hirata N., Onishi K. Changes in left anterior descending coronary artery flow profiles after coronary artery bypass grafting examined by means of transthoracic Doppler echocardiography. J Thorac Cardiovasc Surg. 2003;126(5):1531-1536. PMID: 14666029. https://doi. org/10.1016/S0022-5223(03)00972-3
- Morofuji T., Saito M., Inaba S., Morioka H., Sumimoto T. Prognostic value of proximal left coronary artery flow velocity detected by transthoracic Doppler echocardiography. Int J Cardiol Heart Vasc. 2018;19:52-57. PMID: 29946565; PMCID: PMC6016069. https://doi.org/10.1016/_i.ijcha.2018.04.003
- Zagatina A., Zhuravskaya N., Kamenskikh M., Shmatov D., Sayganov S., Rigo F. Role of coronary flow velocity in predicting adverse outcome in clinical practice. Ultrasound Med Biol. 2018;44(7):1402-1410. PMID: 29706411. https://doi. org/10.1016/i.ultrasmedbio.2018.03.021
- Takeuchi M., Nakazono A. Coronary artery imaging with transthoracic doppler echocardiography. Curr Cardiol Rep. 2016;18(7):63. PMID: 27216843. https://doi.org/10.1007/ s11886-016-0740-y
- Dole W.P., Nuno D.W. Myocardial oxygen tension determines the degree and pressure range of coronary autoregulation. Circ Res. 1986;59(2):202-215. PMID: 3742744. https://doi. org/10.1161/01.RES.59.2.202


