Диагностические возможности молекулярно-генетических параметров ВПЧ-инфекции в стратегии выбора радикальных программ лучевой терапии начального рака шейки матки
Автор: Бойко Б.В., Мкртчян Л.С., Киселва В.И., Иванов С.А., Замулаева И.А.
Рубрика: Научные статьи
Статья в выпуске: 2 т.34, 2025 года.
Бесплатный доступ
Рак шейки матки (РШМ) остаётся одной из лидирующих причин женской смертности. Актуальность поиска прогностических факторов, позволяющих на дооперационном этапе оценить неблагоприятный прогноз и избежать необходимости комбинированного подхода, не вызывает сомнений. В литературе широко обсуждается прогностическая значимость параметров ВПЧ высокого канцерогенного риска (ВКР) в отношении течения и результатов лечения РШМ. В то же время работы по изучению взаимосвязи традиционных клинико-морфологических факторов и молекулярно-генетических параметров ВПЧ-инфекции, диагностической возможности этих параметров для выявления неблагоприятных форм заболевания на дооперационном этапе и прогностической роли в клиническом исходе РШМ ранних стадий немногочисленны и зачастую противоречат друг другу, а выборки, на которых проводятся исследования, неоднородны, что и обосновывает актуальность проводимой работы. Цель исследования - изучение взаимосвязи клинико-морфологических характеристик РШМ и молекулярно-генетических параметров ВПЧ-инфекции с оценкой диагностических возможностей этих параметров при определении неблагоприятных форм заболевания и их прогностической значимости в отношении результатов радикального лечения больных РШМ I стадии. В исследование было включено 75 пациенток с гистологически верифицированным ВПЧ-положительным и ВПЧ-отрицательным РШМ I стадии (Ia - 30/75 (40%); Ib - у 45/75 (60%)), которым проводили радикальное специализированное лечение в виде хирургического, комбинированного лечения или сочетанной лучевой/химиолучевой терапии. Средний возраст больных в группе составил 43,64±11,3 лет. По морфологической форме преобладал плоскоклеточный рак - в 73/75 (97,3%) случаев. Молекулярно-генетические параметры ВПЧ определяли методом ПЦР в реальном времени. Количественную нагрузку ДНК ВПЧ выражали в логарифмах геномных эквивалентов E7, нормированных на 100 тыс. клеток. При проведённом однофакторном анализе у больных более старшей возрастной категории наиболее часто встречалась моноинфекция ВПЧ (p=0,024). Вирусная нагрузка (ВН) была ниже при более распространённых формах заболевания (Ib2 стадия по сравнению с Ia1,2) (р=0,004), при размерах опухоли более 2 см (р=0,014) и стромальной опухолевой инвазии более 1/3 (p=0,059). Проведён анализ взаимосвязи ВН до лечения с неблагоприятными факторами, которые были выявлены у части больных при патоморфологическом исследовании операционного материала и явились основанием для изменения стадии заболевания. Показано прогностическое значение ВН в отношении изменения стадии: при относительно низком уровне ВН (lgE7/1055³6,1) (р=0,049). При проведении многофакторного анализа статистически значимых факторов прогноза клинического исхода РШМ I стадии выявлено не было (p>0,05). Молекулярно-генетические параметры ВПЧ ВКР могут быть использованы для оценки риска выявления неблагоприятных клинико-морфологических форм первичного РШМ I стадии и выбора тактики лечения с предпочтением радикальных программ лучевой терапии (сочетанной лучевой/химиолучевой терапии) при низкой ВН, при которой высока вероятность послеоперационной уточнённой диагностики более распространённых форм заболевания и соответственно проведения адъювантной лучевой терапии.
Рак шейки матки, лучевая терапия, вирус папилломы человека, высокий канцерогенный риск, впч-статус, генотип впч, множественная инфекция, вирусная нагрузка, интегрированная форма
Короткий адрес: https://sciup.org/170209568
IDR: 170209568 | УДК: 618.146-006.6-085.849.1:578.827.1]-07 | DOI: 10.21870/0131-3878-2025-34-2-94-108
Текст научной статьи Диагностические возможности молекулярно-генетических параметров ВПЧ-инфекции в стратегии выбора радикальных программ лучевой терапии начального рака шейки матки
Рак шейки матки (РШМ) продолжает занимать лидирующую позицию среди злокачественных новообразований женских половых органов с тенденцией к увеличению впервые выявленных случаев за год: с 604 тыс. в 2020 г. до 662,3 тыс. 2025 г. В Российской Федерации пик заболеваемости приходится на возраст 30-59 лет, а смертности – 30-39 лет [1]. Несмотря на постоянное совершенствование лечебно-диагностических технологий, пятилетняя общая выживаемость больных в течение последних десятилетий остаётся на прежнем уровне, составляя при I стадии 91,2%.
Основным методом лечения РШМ I стадии является хирургический, однако, при выявлении факторов неблагоприятного прогноза (размер опухоли более 4 см, глубокая стромальная инвазия, лимфоваскулярное распространение, метастатическое поражение лимфатических узлов, положительный край резекции опухоли, инвазия опухоли в параметрий) практически у 80% больных проводится адъювантный курс дистанционной (ДЛТ) и/или внутриполостной лучевой терапии (ВЛТ). По данным различных авторов, у больных РШМ I стадии субклиническое поражение лимфатических узлов встречается в 10-26% случаев [2], частота лимфоваскулярной инвазии -38,6% [3], сочетание двух неблагоприятных факторов - 89% [4]. Однако, проведённые на доопе-рационном этапе клинико-морфологическая и радиологическая диагностика не всегда позволяют при ранних формах заболевания адекватно оценить распространённость опухолевого процесса, наличие инвазии патологического процесса в лимфоваскулярное пространство и др. [5].
Известные преимущества хирургического лечения – уточнение распространённости заболевания на основании гистологического исследования операционного материала – нивелируются значимым снижением качества жизни больных вследствие высокой частоты осложнений, возникших при добавлении адъювантных курсов лучевой/химиолучевой терапии [6]. В этих условиях, при выборе тактики лечения больных РШМ, которым, вероятно, потребуется послеоперационное облучение, целесообразно избегать комбинации хирургического и лучевого лечения, отдавая предпочтение сочетанной лучевой/химиолучевой терапии в самостоятельном режиме [7] . Таким образом, актуальность поиска прогностических критериев, позволяющих на дооперацион-ном этапе выявлять неблагоприятные формы заболевания и избегать необходимости комбинированного подхода, выбирая альтернативный метод - лучевую терапию в самостоятельном режиме, не вызывает сомнений.
В литературе широко обсуждается прогностическая значимость параметров вируса папилломы человека (ВПЧ) высокого канцерогенного риска (ВКР), доказанного этиологического фактора РШМ, в отношении течения и результатов лечения заболевания. Так, по результатам одних исследований показатели общей и безрецидивной выживаемости оказались статистически значимо выше при ВПЧ-ассоциированном РШМ по сравнению с ВПЧ-отрицательным [8]. В других работах не было обнаружено связи между выживаемостью больных РШМ и статусом ВПЧ, в том числе и с учётом наиболее распространённых генотипов ВПЧ - 16 и 18 [9]. Значение множественной ВПЧ-инфекции как прогностического фактора также до сих пор остаётся дискутабельным [10]. Сообщается, что исходная низкая вирусная нагрузка (ВН) явилась независимым прогностическим фактором неблагоприятного клинического исхода у больных плоскоклеточным РШМ IB1-IIA стадий и была связана с другими клинико-патологическими факторами (стадия FIGO, поражение лимфоузлов) [11]. При изучении влияния интеграции на результаты лечения РШМ выявлены более низкие показатели безрецидивной выживаемости при лучевой терапии ВПЧ-положительного РШМ с интегрированными формами ВПЧ [12]. В единичных работах проводится корреляционный анализ максимально полного спектра клинико-морфологических факторов РШМ и молекулярно-генетических параметров ВПЧ ВКР. Так, отечественные исследователи, включив в многофакторный анализ клинико-морфологические факторы РШМ II и III стадии и молекулярногенетические параметры ВПЧ-инфекции, выявил три фактора, имеющих прогностическую значимость для безрецидивной выживаемости: биомаркер, связанный с ВПЧ - ВПЧ-негативный статус или интеграция ДНК ВПЧ в геном клетки, стадия заболевания и возраст [13]. Однако, интересным представляется и возможность использования молекулярно-генетических параметров ВПЧ-ин- фекции в качестве критериев идентификации неблагоприятных форм заболевания на доопера-ционном этапе, что не обсуждается в подобных работах, в том числе и в отношении РШМ I, что и обосновывает актуальность проводимого исследования.
Материалы и методы
Клиническая группа исследования
В исследование вошли 75 больных морфологически верифицированным РШМ I стадии (FIGO) с ВПЧ-отрицательными или ВПЧ16/18-позитивными формами заболевания. Пациентки проходили хирургическое (24-32,0%), комбинированное (15-20,0%) лечение или сочетанную лучевую/химиолучевую терапию (СЛТ/ХЛТ – 36 (48,0%)) в отделении лучевых и комбинированных методов лечения гинекологических заболеваний МРНЦ им. А.Ф. Цыба в период с 2007 по 2023 гг. (рис. 1).
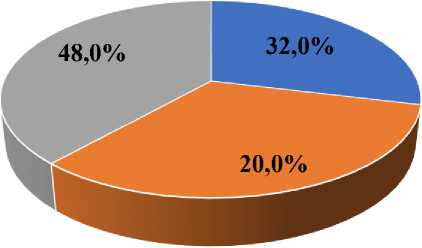
Хирургический Комбинированный СЛТ/ХЛТ
Рис. 1. Распределение больных в зависимости от метода проводимого лечения.
Перед началом лечения проводилось полное клинико-лабораторное обследование (бимануальное ректовагинальное исследование, магнитно-резонансная томография и/или компьютерная томография органов малого таза и брюшной полости, рентгенография лёгких и т.д.). Гистологический тип опухоли определяли в соответствии с классификацией ВОЗ [14]. На основании полученных данных оценивали распространённость опухолевого процесса, выполнялось стадиро-вание заболевания в соответствии с рекомендациями FIGO и классификацией TNM [15, 16]. Пациентки подписывали информированное согласие на участие в исследовании, которое было одобрено Комитетом по этике МРНЦ им. А.Ф. Цыба.
Клинико-морфологическая характеристика больных представлена в табл. 1. Средний возраст больных в группе составил 43,64±11,3 лет с преобладанием пациенток репродуктивного возраста – до 45 лет (62,7%). Распределение по подстадиям (по FIGO) было практически равномерным: Ia стадия была диагностирована у 30/75 (40%) больных, Ib – у 45/75 (60%). По морфологической форме преобладал плоскоклеточный рак – в 73/75 (97,3%) случаях.
По данным проведённого обследования у больных, которым планировалась СЛТ/ХЛТ, оценивали размеры и глубину инвазии опухоли; у больных с хирургическим лечением данные параметры, а также лимфоваскулярную инвазию (ЛВИ) оценивали по результатам гистологического исследования операционного материала (табл. 2).
Таблица 1
Клинико-морфологические параметры пациенток больных РШМ I стадии (n=75)
|
Клинические и морфологические характеристики больных РШМ |
Количество больных (%) |
|
Возраст, лет |
|
|
<30 |
8 (10,7) |
|
30-44 |
39 (52,0) |
|
45-60 |
17 (22,7) |
|
>60 |
11 (14,7) |
|
Стадия заболевания (FIGO) |
|
|
Ia1 |
22 (29,3) |
|
Ia2 |
8 (10,7) |
|
Ib1 |
28 (37,3) |
|
Ib2 |
17 (22,7) |
|
Гистологический тип опухоли |
|
|
Плоскоклеточный рак |
73 (97,3) |
|
Аденокарцинома |
2 (2,7) |
Таблица 2
Параметры опухолевого процесса больных РШМ I стадии (n=75)
|
Параметры распространённости опухолевого процесса |
Количество больных (%) |
|
|
ЛВИ (n=35) |
отсутствие наличие |
29 (82,9) 6 (17,1) |
|
Глубина инвазии (n=75) |
менее 1/3 более 1/3 |
51 (68,0) 24 (32,0) |
|
Размер опухоли (n=75) |
менее 2 см более 2 см |
62 (82,7) 13 (17,3) |
Методика выявления ВПЧ ВКР и определения молекулярно-генетических параметров вируса
Выявление ВПЧ ВКР, типовую принадлежность и количественную нагрузку вирусов проводили методом мультиплексной ПЦР в реальном времени на аппарате «Rotor-Gene» (Corbett Research, Sydney, Австралия) с использованием тест-систем «AmpliSens HPV HCR screen-titer-FL» и «AmpliSens HPV HCR genotype-titer FL» (ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, Россия).
Анализ физического состояния вируса (эписомальная или интегрированная форма) оценивали у ВПЧ16/18-позитивных пациентов методом TagMan-технологии в формате мультиплекс-ПЦР в режиме реального времени с использованием набора реагентов, содержащих праймеры и зонды, предназначенные для специфической амплификации генов E2 и E7 этих вирусов (ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, Россия). Параллельно оценивали количество ДНК β-глобина человека. Все три мишени амплифицировали в одной пробирке. Каждый клинический образец был выполнен в трёх повторах. Одновременно в каждом опыте амплифицировали стандартные образцы с известной концентрацией ДНК ВПЧ 16 и/или 18 типа ДНК β-глобина. Количество геномных эквивалентов E2 и E7 рассчитывали по калибровочным кривым, полученным на этих стандартных образцах. Степень интеграции ДНК ВПЧ16/18 оценивали по соотношению количества Е2 и Е7 геномных эквивалентов вируса с учётом стандартного отклонения и коэффициента вариации данных. (Ген Е7 в процессе интеграции вирусной ДНК в клеточный геном сохраняется интактным, соответственно количество его в обеих формах вируса эписомальной и интегрированной одинаковое. Ген Е2 при этом разрушается и количество его снижается).
Количество ДНК ВПЧ расcчитывали в логарифмах геномных эквивалентов Е7 вируса, нормализованных на 200 тыс. геном-эквивалентов человека или 100 тыс. клеток (1 клетка содержит 2 β-глобина).
Методика лечения и оценка эффективности результатов
Всем больным, включённым в группу исследования, было проведено радикальное лечение в виде хирургического вмешательства с/без адъювантной лучевой терапии или самостоятельных курсов сочетанной лучевой терапии с/без одновременной химиотерапии с целью радиомодификации. Хирургическое лечение проводилось в объёме экстрафасциальной или расширенной экстирпации матки с/без придатков (тип I-III по Piver) в зависимости от распространённости опухолевого процесса. По результатам гистологического исследования операционного материала у 15/75 (20,0%) больных с неблагоприятными факторами прогноза (размер опухоли более 4 см, глубокая стромальная инвазия, лимфоваскулярное распространение) был проведён курс адъювантного лечения в виде ДЛТ и/или ВЛТ не позднее 21-28 дней после хирургического вмешательства.
Сочетанная лучевая терапия включала на первом этапе курс ДЛТ на линейных ускорителях электронов Elekta Synergy S, Varian Halcyon с энергией фотонов 6 МэВ по методике 3D CRT, IMRT или VMAT (Rapid Arc) на область малого таза (первичный очаг) и зоны возможного регионарного метастазирования в разовой очаговой дозе (РОД) на PTV 2,0 Гр, ежедневно 5 дней в неделю до суммарной очаговой дозы (СОД) 46,0 Гр. Второй этап СЛТ включал курс внутриполостной брахитерапии на аппаратах Микроселектрон, GammaMed Plus Ix по методике высокодозной брахитерапии (High Dose Rate) источниками излучения 60Co и 192Ir в РОД 7,0 Гр, 1 раз в 6 дней до СОД 40,0-45,0 Гр. Суммарная поглощённая доза от всего курса СЛТ составляла 85,0-90,0 Гр, общая длительность проведения курса лучевой терапии не превышала 7-8 недель. С целью радиомодификации на фоне ДЛТ выполняли еженедельное введение Цисплатина в разовой дозе 40 мг/м2 (5-6 введений).
Оценка эффективности проведённого лечения больных РШМ оценивали по показателям безрецидивной выживаемости в соответствии с критериями RECIST v. 1.1 (Response Evaluation Criteria in Solid Tumors) [17]. Неблагоприятным клиническим исходом заболевания считали прогрессирование, включая локо-регионарные рецидивы и/или отдалённые метастазы, или смерть в результате прогрессирования заболевания, зафиксированные в течение всего периода наблюдения за больными, независимо от времени выявления. Средний срок наблюдения составил 77,0 (37,0-115,0) мес.
Методика проведения статистического анализа
Статистический анализ выполняли с использованием пакетов программного обеспечения Statistica 10.0 (StatSoft, Inc., Minneapolis, MN, USA), SPSS Statistics 23.0 (International Business Machines Corp., Armonk, NY, USA), MedCalc 13.3.3.0 (MedCalc Software Ltd., Ostend, Belgium), StatTech v. 4.8.2 (разработчик – ООО «Статтех», Россия). Количественные показатели оценивали на предмет соответствия нормальному распределению с помощью критерия Колмогорова-Смирнова. В случае отсутствия нормального распределения количественные данные описывали с помощью медианы (Me) и нижнего и верхнего квартилей (Q1-Q3), в случае нормального распределения – с помощью средних арифметических величин (M) и стандартных отклонений (SD).
Категориальные данные описывали с указанием абсолютных значений и процентных долей. 95% доверительные интервалы для процентных долей рассчитывали по методу Клоппера-Пир-сона. Количественные показатели, выборочное распределение которых соответствовало нормальному, описывали с помощью средних арифметических величин (M) и стандартных отклонений (SD).
Однофакторный анализ проводили путём оценки непараметрической корреляции Спирмена. В последующем, с целью статистической оценки полученных данных и выяснения независимого влияния каждого из изучаемых факторов на клинический исход больных РШМ нами был произведён многофакторный анализ методом логистической регрессии.
Результаты
В исследовании проведён анализ распространённости ВПЧ-инфекции, его молекулярногенетических параметров и взаимосвязи с клинико-морфологическими факторами больных РШМ I стадии с оценкой диагностических возможностей в плане идентификации неблагоприятных клинико-морфологических форм заболевания и прогностического значения в отношении результатов радикального лечения заболевания.
ВПЧ-статус и молекулярно-генетические параметры ВПЧ ВКР у больных РШМ I стадии. По результатам проведённого анализа ДНК ВПЧ ВКР не был выявлен у 13/75 (17%) больных РШМ I стадии. При ВПЧ-положительном РШМ наиболее часто встречался 16 генотип – в 51/62 (82,2) случаях: в виде моноинфекции – в 46/62 (74,2%), в сочетании с 18 генотипом – в 2/62 (3,2%), с другими генотипами (33, 35, 59, 66) – в 3 (4,8%) случаях. ВПЧ 18 выявлен у 6/62 (9,7%) больных в одиночном варианте, другие генотипы (31, 33, 35, 45, 51) составили оставшиеся 8,1% от общего числа, и чаще встречались в виде множественной инфекции.
В табл. 3 представлено распределение молекулярно-генетических параметров у 62/75 (83%) ВПЧ-положительных больных РШМ.
Таблица 3
Молекулярно-генетические параметры ВПЧ-инфекции у больных РШМ I стадии
|
Молекулярно-генетические параметры ВПЧ-инфекции |
Количество больных (%) |
|
Число генотипов |
|
|
Моноинфекция |
56 (90,3) |
|
Полиинфекция |
6 (9,7) |
|
Вирусная нагрузка |
|
|
Низкая lgE7<3 |
1 (1,6) |
|
Средняя 3≤lgE7<5 |
16 (25,8) |
|
Высокая lgE7≥5 |
45 (72,6) |
|
Статус ДНК ВПЧ |
|
|
Эписомальная форма |
34 (54,7) |
|
Интегрированная форма |
28 (45,3) |
В анализируемой группе наиболее часто встречалась моноинфекция – у 56/62 (90,3%) больных, высокая ВН – у 45/62 (72,5%). Интегрированные и эписомальные формы наблюдали с одинаковой частотой – соответственно у 28/62 (45,3%) и 34/62 (54,7%) больных.
Молекулярно-генетические параметры ВПЧ-инфекции и клинико-морфологические факторы РШМ I стадии. ВПЧ-отрицательные формы встречались при 1а и Ib стадиях с одинаковой частотой – соответственно у 7/45 (15,5%) против 5/30 (16,6%) (р>0,05), статистически значимых корреляций в отношении и других клинико-морфологических факторов выявлено не было. Не обнаружено также взаимосвязи между определённым генотипом и клинико-морфологическими параметрами РШМ (р>0,05). Данные результаты могут быть обусловлены маленькой выборкой больных с ВПЧ-отрицательными формами заболевания и гистологической формой аденокарциномы – соответственно 13/75 (17,3%) и 2/75 (2,7%) случаев.
При проведённом корреляционном анализе количества генотипов с клинико-морфологическими факторами заболевания обнаружено наличие статистически значимой взаимосвязи лишь с возрастом: моноинфекция была ассоциирована со старшей возрастной группой (р=0,024) (табл. 4).
Таблица 4
Взаимосвязь количества генотипов ВПЧ ВКР с возрастом больных РШМ I стадии
|
Показатель |
Категории |
Возраст, лет |
P |
|
|
M±SD |
n |
|||
|
Количество генотипов |
Моноинфекция Полиинфекция |
44,14±11,05 33,50±4,72 |
56 6 |
0,024 |
Изучение взаимосвязи ВН с традиционными факторами прогноза (стадия заболевания, размер и глубина инвазии опухоли) выявило более низкую ВН при более распространённом РШМ (р=0,004), при опухоли более 2 см (р=0,014) и стромальной инвазии более 1/3 (p=0,059) (табл. 5).
Таблица 5
Уровень вирусной нагрузки в зависимости от клинико-морфологических факторов
|
Клинический параметр |
Количество больных абс. (%) |
Вирусная нагрузка |
p-value |
||||
|
низкая lgE7<3 |
средняя 3≤lgE7<5 |
высокая lgE7≥5 |
M±SD, lgE7/105 |
||||
|
Ia1 |
18 (100) |
0 |
2 (11,1) |
16 (88,9) |
5,96±1,61 |
||
|
Стадия заболевания |
Ia2 |
7 (100) |
0 (0,0) |
3 (42,9) |
4 (57,1) |
5,65±1,11 |
0,004 |
|
(FIGO) |
Ib1 |
23 (100) |
0 (0,0) |
4 (17,4) |
19 (82,6) |
6,0±2,53 |
|
|
Ib2 |
14 (100) |
1 (7,1) |
7 (50,0) |
6 (42,9) |
4,85±1,31 |
||
|
Размер опухоли |
менее 2 см более 2 см |
50 (100) 12 (100) |
0 (0,0) 1 (8,3) |
9 (18,0) 7 (58,4) |
41 (82,0) 4 (33,3) |
6,01±1,86 4,73±1,34 |
0,014 |
|
Глубина стромаль- |
менее 1/3 |
42 (100) |
0 (0,0) |
8 (50,0) |
34 (75,6) |
5,85±2,01 |
0,059 |
|
ной инвазии |
более 1/3 |
20 (100) |
1 (100,0) |
8 (50,0) |
11 (24,4) |
5,12±1,38 |
|
Учитывая наличие статистически значимой ассоциации уровня ВН с традиционными клинико-морфологическими факторами, влияющими на выбор метода и объёма лечения, выполнена оценка прогностической ценности данного молекулярно-генетического параметра ВПЧ-инфекции в отношении возможности идентификации на дооперационном этапе неблагоприятных форм заболевания. Из 39 больных, прошедших хирургическое лечение, при проведении полноценного морфологического исследования операционного материала у 12 (30,8%) были выявлены неблагоприятные факторы, которые во время проведения клинико-радиологического обследования до начала лечения не были диагностированы. Отмечена тенденция к снижению ВН у больных с выявленными неблагоприятными факторами прогноза. Так, средняя ВН (±SE) составила в этой группе 5,60±0,38, в то время, как у остальных больных – 6,07±0,19 (р=0,20). Далее больные были разделены на группы с относительно высокой (≥6,1, n=19) и низкой (<6,1, n=20) ВН. Было установлено, что в результате патоморфологического исследования традиционные неблагоприятные факторы, повлекшие за собой изменение стадии заболевания после хирургического лечения, выявлены у 9 из 20 (45,0%) больных с низкой ВН и лишь у 3 из 19 (15,8%) больных с высокой ВН (р=0,049 по критерию χ2) (табл. 6). Таким образом, вероятность выявления неблагоприятных факторов была в 2,8 раза выше при относительно низкой ВН до лечения.
Таблица 6
Сопоставление вирусной нагрузки до лечения с изменением стадии после хирургического лечения на основании результатов патоморфологического исследования (в таблице указано количество больных)
|
Вирусная нагрузка, lgE7/105 |
Изменение стадии |
|
|
произошло |
не произошло |
|
|
<6,1 |
9 |
11 |
|
≥6,1 |
3 |
16 |
Чувствительность этого метода прогнозирования изменения стадии заболевания после послеоперационного патоморфологического исследования составила 0,750 (99% ДИ 0,388-0,934), специфичность 0,593 (99% ДИ 0,355-0,793). Величина AUC, характеризующая прогностическую ценность изучаемого показателя, равна 0,672, что позволяет рассматривать ВН как средний по мощности прогностический признак.
При изучении физического статуса ДНК ВПЧ отмечена лишь взаимосвязь на уровне тенденции интегрированных форм с более распространённой формой опухоли – Ib стадией заболевания (p=0,054) (рис. 2).
100,0
80,0
60,0 %
40,0
20,0
0,0
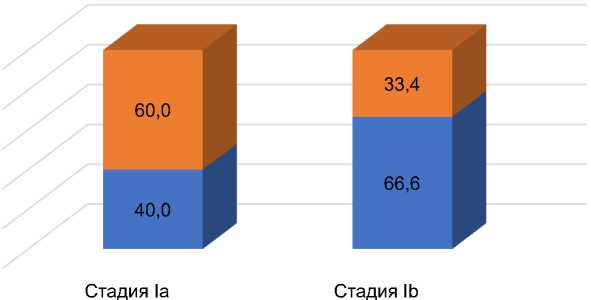
■ Интегрированная форма ■ Эписомальная форма
Рис. 2. Физический статус ДНК ВПЧ в зависимости от стадии заболевания (FIGO).
Однофакторный и многофакторный анализы клинического исхода РШМ в зависимости от молекулярно-генетических параметров ВПЧ-инфекции. Проведённый однофакторный анализ не выявил статистически значимых молекулярно-генетических параметров ВПЧ-инфекции, влияющих на клинический исход заболевания (p>0,05). Результаты проведённого анализа представлены в табл. 7.
Проведённый многофакторный анализ, в который были включены традиционные клиникоморфологические характеристики РШМ I стадии (возраст, стадия по FIGO, гистологический тип опухоли, наличие/отсутствие лимфоваскулярной инвазии, глубина инвазии, размер опухоли) и молекулярно-генетические параметры ВПЧ-инфекции (статус ВПЧ ВКР, физический статус ДНК
ВПЧ, ВН, количество генотипов) не выявил предикторов клинического исхода заболевания при проведённых радикальных методах лечения (р>0,05), что может свидетельствовать об адекватности выбранной тактики при выявленных прогностически неблагоприятных формах заболевания.
Таблица 7
Результаты однофакторного анализа клинического исхода в зависимости от молекулярно-генетических параметров ВПЧ
|
Параметр |
Категории |
Исход заболевания |
Отношение шансов (95% ДИ), p-value |
|
|
благоприятный абс. (%) |
неблагоприятный абс. (%) |
|||
|
Статус ВПЧ ВКР |
ВПЧ-положительный ВПЧ -отрицательный |
54 (81,8) 12 (18,2) |
8 (88,9) 1 (11,1) |
1,78 (0,20-15,58), p=1,00 |
|
Физический статус ДНК ВПЧ |
эписомальная форма интегрированная форма |
24 (44,4) 30 (55,6) |
4 (50,0) 4 (50,0) |
0,80 (0,181-3,536), p=1,00 |
|
Вирусная нагрузка |
низкая lgE7<3 средняя 3≤lgE7<5 высокая lgE7≥5 |
1 (1,9) 15 (27,8) 38 (70,4) |
0 (0,0) 1 (12,5) 7 (87,5) |
0,36 (0,041-3,198), p=0,589 |
|
Количество генотипов |
моноинфекция полиинфекция |
48 (88,9) 6 (11,1) |
8 (100,0) 0 (0,0) |
0,44 (0,02-8,53), p=1,00 |
Обсуждение
По результатам анализа в группе исследования доля ВПЧ-положительных больных составила 82,3%, что соответствует общемировым и отечественным показателям [18]. Выявлена статистически значимая взаимосвязь между уровнем ВН и стадией заболевания (р=0,049), а также размером опухоли (p=0,014): с увеличением распространённости опухолевого процесса и размера опухоли ВН снижается. Данный результат подтверждается исследованием Zuo J. и соавт. (2019), в котором авторы отмечают снижение показателей ВН по мере прогрессирования опухолевого процесса [11]. При анализе взаимосвязи ВН с выявленными при гистологическом исследовании неблагоприятными факторами, которые явились основанием для изменения стадии заболевания после хирургического лечения, была показана возможность прогнозирования послеоперационного изменения стадии заболевания при уровне ВН <6,1 (р=0,049, чувствительность 0,750, специфичность 0,593, AUC 0,672). Эти данные по своей сути могут быть подтверждением гипотезы о том, что высокая ВН увеличивает шанс интеграции ДНК ВПЧ в клеточный геном клетки хозяина, провоцируя тем самым не только развитие онкологического процесса, но и его прогрессирование [19]. В этой связи необходимо отметить исследование отечественных авторов, в котором была показана отрицательная корреляция между уровнем ВН и степенью интеграции [13], а также работы, в которых показана ассоциация высокого уровня ВН с эписомальными формами ДНК ВПЧ, которые, в свою очередь, коррелируют с лучшими показателями выживаемости, в то время как низкая ВН связана с интегрированными формами ДНК ВПЧ и ассоциируется с худшими результатами лечения [20].
Несмотря на вышеописанные данные, по результатам проведённого многофакторного анализа ни один из предполагаемых параметров не коррелировал с клиническим исходом у больных РШМ I стадии (p>0,05), что может свидетельствовать об адекватном стадировании больных, в том числе после проведённого хирургического лечения, и выборе тактики – наблюдение или адъювантная лучевая терапия в соответствии с клиническими рекомендациями.
Заключение
Как показали наши исследования, ВН позволяет оценить риск выявления неблагоприятных клинико-морфологических факторов в случае гистологического исследования операционного материала. Обнаружение относительно низкой ВН (<6,1) свидетельствует о более высокой вероятности послеоперационного выявления распространённых форм заболевания, что может потребовать проведения адъювантной лучевой терапии в соответствии с клиническими рекомендациями. В этих случаях предпочтительным может явиться использование радикальных программ лучевой терапии – сочетанной лучевой/химиолучевой терапии в самостоятельном режиме.


