Диагностическое значение нарушений азотистого обмена при неалкогольной жировой болезни печени у коморбидных больных с метаболическим синдромом и стратификация ее стадий
Автор: Арямкина Ольга Леонидовна, Биек Альфред Юлаевич, Саитов Азиз Русланович
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Обзоры
Статья в выпуске: 3, 2023 года.
Бесплатный доступ
Цель определить значение гипераммониемии для диагностики неалкогольной жировой болезни печени (НАЖБП) у больных с метаболически ассоциированной коморбидной патологией. Материалы и методы. Проведено одномоментное когортное рандомизированное исследование по изучению НАЖБП у больных с метаболически ассоциированной патологией СД 2-го типа, ожирением, артериальной гипертензией, ИБС, дислипидемией. Обследовано 96 больных, подразделенных на 3 подгруппы: пациенты с НАЖБП на стадиях стеатоза (n=33), неалкогольного стеатогепатита (НАСГ) (n=47) и цирроза печени (ЦП) (n=16), установленных впервые. Для диагностики НАЖБП дополнительно применены неинвазивные методы калькуляторы определения фиброза печени APRI, FIB4, NAFLD fibrosis score; для диагностики печеночно-клеточной недостаточности оценка содержания аммиака в капиллярной крови. Статистическая обработка проведена параметрическими и непараметрическими методами, корреляционным и кластерным анализом с помощью пакета Statistica 10.0, рассчитано отношение шансов (ОШ). Результаты. У больных в возрасте 64,2±0,85 года с соотношением женщин и мужчин 64,9 % и 35,1 %, с индексом коморбидности М. Чарлсон 4,57±0,12 балла метаболический синдром (МС) в 100 % случаев представлен СД 2-го типа, у 2/3 инсулинопотребным; АГ, у трети на III стадии; в 87,5 % случаев ожирением; в 90,6 % ИБС и в 100 % НАЖБП на стадии стеатоза (34,4 %), НАСГ (49 %) и ЦП (16,6 %) с малосимптомным течением. По дополнительным критериям (результатам NFS) у 52,1 % пациентов диагностирован фиброз F3-F4стадии, у 47,9 % F2; у 91,7 % гипераммониемия (ГАЕ) до 111,1±4,86 (101,3-120,7) мкмоль/л. ГАЕ нарастала от стадии стеатоза до стадии НАСГ и ЦП, коррелировала со степенью фиброза печени, активностью гепатита и ключевыми критериями МС. Применение калькулятора NFS и диагностика ГАЕ позволили стратифицировать стадии неалкогольной жировой болезни печени.
Неалкогольная жировая болезнь печени, стратификация стадий, гипераммониемия, метаболический синдром, коморбидность
Короткий адрес: https://sciup.org/14128740
IDR: 14128740 | УДК: 616-06[616-07-616-01/-099] | DOI: 10.34014/2227-1848-2023-3-49-66
Текст научной статьи Диагностическое значение нарушений азотистого обмена при неалкогольной жировой болезни печени у коморбидных больных с метаболическим синдромом и стратификация ее стадий
Введение. Сердечно-сосудистая патология (артериальная гипертензия (АГ), ишемическая болезнь сердца (ИБС)), ожирение и сахарный диабет (СД) 2-го типа / инсулинорези-стентность являются первопричинами формирования ведущего квартета метаболического синдрома (МС) [1–3]. Метаболический синдром представляет собой коморбидную патологию, число составляющих которой во всем мире непрерывно увеличивается [4, 5]. В квинтет МС входит неалкогольная жировая болезнь печени (НАЖБП). В мире и в России за- болеваемость НАЖБП среди взрослого населения составляет 24–33 %. Этот показатель прогрессивно растет и в 2023 г. достиг значений 4613 новых случаев на 100 000 населения [5–9]. Стадиями прогрессирования заболевания являются стеатоз, стеатогепатит, цирроз печени и гепатоцеллюлярная карцинома. В настоящее время доказана взаимосвязь между фиброзированием печени и сердечно-сосудистыми событиями [10]. Актуальность проблем сердечно-сосудистой и гастроэнтерологической патологии обусловлена их вхождением в десятку лидирующих причин смерти. В период с 1990 г. по 2019 г. рост смертности от сердечно-сосудистых заболеваний (1-е место) и заболеваний печени (10-е место) достиг 53,77 % и 45,54 % соответственно [11].
Истинную картину заболеваемости и распространенности НАЖБП сегодня определить крайне сложно, так как в МКБ отсутствуют четкие шифры данного заболевания, но по эпидемическому росту основных проявлений МС – ожирения и СД 2-го типа – можно предположить увеличение числа больных НАЖБП. Данная патология печени характеризуется ма-лосимптомным течением, и ее диагностика требует исключения других этиологических форм стеатогепатита – алкогольного, лекарственного и хронического гепатита С. Особенно сложно дифференцировать НАЖБП с лекарственным гепатитом ввиду необходимости лечения в первую очередь метаболически ассоциированной эндокринной и сердечно-сосудистой патологии, атерогенной дислипидемии, нарушений ритма сердца, сердечной недостаточности [12–15]. Накопленные данные, свидетельствующие о системности и многофакторности этиопатогенеза данного хронического заболевания печени, позволили к 2020 г. сформировать экспертное консенсусное понятие – МАЖБП: метаболически ассоциированная жировая болезнь печени (Metabolic (dysfunction) associated fatty liver disease) [9, 16–22].
Среди жителей северных широт ожирение, проблемы СД 2-го типа и артериальной гипертензии приобретают все большее значение, поскольку, например, в Ханты-Мансийском автономном округе – Югре показатели распространенности этих заболеваний превышают общероссийские значения [23, 24].
Определение стадии НАЖБП по наличию и выраженности в ней фиброза, в первую очередь неинвазивными методами, является чрезвычайно важным как для установления собственно диагноза данного заболевания, так и для мониторинга состояния пациентов [7–9, 12–15]. Оценку выраженности синдромов поражения печени, в т.ч. печеночно-клеточной недостаточности, необходимо проводить у больных с метаболически ассоциированной коморбидностью. Анализ параметров цитолиза, холестаза и желтухи при НАЖБП позволяет дифференцировать стадии неалкогольного стеатогепатита (НАСГ) и цирроза печени (ЦП), а изучение маркеров нарушения азотистого обмена, в частности повышенного содержания аммиака, – выявлять этиологию, патогенез и степень гипераммониемии (ГАЕ), что важно для контроля за лечением данных коморбидных больных [25, 26].
Цель исследования. Определить значение гипераммониемии для диагностики неалкогольной жировой болезни печени у больных с метаболически ассоциированной коморбид-ной патологией.
Материалы и методы. Работа проведена в 2019–2021 гг. по плану НИР кафедры внутренних болезней БУ Ханты-Мансийского автономного округа – Югры «Сургутский государственный университет» на клинической базе университета в БУ ХМАО-Югры «Сургутская окружная клиническая больница» с соблюдением требований биомедицинской этики и законодательства РФ. Дизайн исследования: когортное одномоментное рандомизированное исследование, проведенное методом сплошной выборки, посвященное диагностике НАЖБП у пациентов с метаболическим синдромом. Критерий включения – больные с метаболически ассоциированной коморбид-ной патологией; критерий исключения – хронический гепатит иной этиологии (вирусной, аутоиммунной, алкогольной, лекарственной).
Обследованы 96 пациентов с метаболическим синдромом, госпитализированных преимущественно в эндокринологическое отделение с диагнозом СД 2-го типа, у которых, кро- ме оценки коморбидности по числу сопутствующих заболеваний и расчета индекса комор-бидности М. Чарлсон (ИКЧ), проводился поиск НАЖБП (К76.0. Жировая дегенерация печени, не классифицированная в других рубриках). Референтную группу, сформированную для определения аммиака в крови, составил 21 здоровый человек. Диагнозы СД 2-го типа, ожирения, АГ, ИБС, хронической болезни почек (ХБП) и НАЖБП устанавливались по стандартным критериям данной формы хронического заболевания печени и патологий метаболического синдрома в соответствии с актуальными клиническими рекомендациями.
Все 96 пациентов имели НАЖБП и были подразделены на 3 подгруппы: 1-ю группу составили пациенты с НАЖБП на стадии стеатоза (n=33), 2-ю – на стадии НАСГ (n=47), 3-ю – на стадии ЦП (n=16). Возраст больных варьировал от 34 до 82 лет и в среднем составлял 64,2±0,85 (95 % ДИ: 62,5–65,8) года; соотношение женщин и мужчин – 64,9/35,1.
Анализировались гендерно-возрастные параметры в соответствии со стратификацией возраста ВОЗ (2020), показатели трофологического статуса по ИМТ (кг/м2). Метаболический синдром диагностировался в случае сочетания абдоминального ожирения (окружность талии >80 см у женщин и >94 см у мужчин) с двумя и более следующими дополнительными признаками: АГ, триглицериды ≥1,7 ммоль/л, ЛПНП>3,0 ммоль/л, ЛПВП<1,0 ммоль/л у мужчин и <1,2 ммоль/л у женщин, гипергликемия натощак (уровень глюкозы ≥6,1 ммоль/л) и/или нарушение толерантности к глюкозе (глюкоза в плазме крови через два часа после глюкозотолерантного теста в пределах 7,8–11,1 ммоль/л) [1–4, 27, 29].
С учетом повсеместного прогрессивного увеличения числа больных с НАЖБП оценивались клинико-лабораторные маркеры гепатита: цитолиз, мезенхимальное воспаление, холестаз, желтуха, печеночно-клеточная (белково-синтетическая) недостаточность, в т.ч. при МС [28, 29]. Для этого, кроме протромбина и альбуминов, определялся аммиак в капиллярной крови фотометрическим методом на портативном приборе Pocket Chem BA PA-4140 (Arkray, Япония) с использованием тест-полосок с оценкой результата в течение 200 с [25, 26]. Устанавливались активность (параметры цитолитического синдрома – АЛТ, АСТ), тяжесть (фибротическая перестройка по данным неинвазивных калькуляторов) и стадия НАЖБП (стеатоз, НАСГ, ЦП) [4, 7–9, 12–15, 22, 27]. Общеклинические и биохимические исследования проводились на аппаратах экспертного класса: автоматических анализаторах IRIS серии iQ200 (США), AUTION MAX AX-4030 (Япония) с тест полосками, Aution Sticks 10EA Arkray (Япония); гематологическом анализаторе Cell-Dyn Ruby, Abbott (Россия) с лизирующим WBC реагентом UBG-Lyse для анализатора Cell-Dyn Ruby (США), лизирующим CNfreeHGB/NOC реагентом (США); биохимическом анализаторе Beckman Coulter AU 680 (США) с реагентами (Германия).
Инструментальными методами (УЗИ) определялись размеры и структура паренхиматозных абдоминальных органов, в первую очередь печени и селезенки, наличие стеатоза печени. При помощи ультразвуковой эластомет-рии печени на аппарате FibroScan® 530 Compact с ультразвуковым датчиком (М+) (Echo-sens, Франция) по запатентованной технологии VCTE (Vibration-controlled Transient elas-tography) устанавливалось наличие фиброза и его степень по плотности печеночной ткани методом фибросканирования в соответствии с параметрами L. Castera: до 5,8 кПа – фиброза нет – стадия F0; от 5,9 до 7,2 кПа – стадия F1; от 7,3 до 9,5 кПа – стадия F2; от 9,6 до 12,5 кПа – стадия F3; более 12,5 кПа – стадия F4. Эта классификация сопоставима с градацией степени фиброза (F) по системе METAVIR: F0 – отсутствие фиброза; FI – портальный фиброз без формирования септ вокруг триады; FII – портальный фиброз, единичные септы; FIII – портальный массивный фиброз, множественные септы; FIV – массивный фиброз или цирроз печени. Также применялись неинвазивные калькуляторы APRI, FIB4, NAFLD fibrosis score [5–7]. APRI-тест использует соотношение АСТ к числу тромбоцитов; диагностическая значимость теста составляет 68,4–83 %. FIB4 устанавливает стадию фиброза печени на основании возраста, уровней АСТ, АЛТ, тромбоцитов с достовер- ностью 80–90 %; NAFLD fibrosis score – по комплексу параметров, заложенных в онлайн-калькулятор , с диагностической чувствительностью 67 % и специфичностью 97 %. Значения NALD fibrosis score, меньшие -1,455, свидетельствуют об отсутствии фиброза, от -1,455 до 0,675 – о фиброзе на стадии Fi-Fii, >0,675 отражают FIII–FIV стадии фиброза, или выраженный фиброз, или цирроз печени [7–9, 12–16].
Печеночная энцефалопатия (ПЭ) оценивалась по значениям теста Рейтана: ее отсутствие определялось при выполнении теста менее чем за 40 с, латентная стадия – при 41–60 с, ПЭ I–II стадии – при 61–90 с, ПЭ II стадии – при 91–120 с, ПЭ III стадии – при >120 с.
Содержание аммиака в референтной группе составляло 36,7±2,85 (95 % ДИ: 30,8–42,6) мкмоль/л и не превышало 54 мкмоль/л, что соответствует нормоаммониемии. При этом уровень аммиака более 55 мкмоль/л свидетельствует о ГАЕ.
Весь фактический материал обрабатывался в программе Statistica 10.0 c использованием параметрических и непараметрических методов, частотного, корреляционного и кластерного видов анализа. Рассчитывались 95 % доверительный интервал (95 % ДИ) – confidence interval (CI), отношение шансов (ОШ) – odds ratio (OR), 95 % и 99 % значимость различий при р<0,05 и р<0,001 соответственно. При сравнении подгрупп пациентов со cтеато-зом и НАСГ использовался параметр p1, cтеа-тозом и ЦП – p2, НАСГ и ЦП – p3.
Результаты и обсуждение. При оценке гендерно-возрастных параметров, трофологического статуса по наличию ожирения и ИМТ было установлено (табл. 1), что возраст пациентов с 99 % вероятностью возрастал от стадий стеатоза и НАСГ до стадии цирроза печени (р 1 =0,1806; р 2 =0,0000; р 3 =0,0000). Соотношение женщин и мужчин в целом не различалось ( х 2 =2,39; р=0,1223). Однако среди больных НАЖБП на стадии стеатоза преобладали мужчины ( / 2 =9,87; р=0,0017), а на стадии НАСГ - женщины ( х 2=9,57; р=0,0020). Число больных НАЖБП с ожирением было значительно большим, чем с избыточной массой тела (р=0,0000), и возрастало от стадии стеатоза к стадиям НАСГ и цирроза печени (р 1 =0,0000). Степень ожирения также увеличивалась с углублением патологии (р 1 =0,1722; р 2 =0,0000; р 3 =0,0000).
Таблица 1
Table 1
Гендерно-возрастные параметры и нутритивный статус при метаболически ассоциированной неалкогольной жировой болезни печени (n=96)
Gender-Age Parameters and Nutritional Status in Metabolically Associated Non-Alcoholic Fatty Liver Disease (n=96)
|
Группа Group |
Мужчины Males |
Женщины Females |
Возраст, лет Age |
Ожирение, % Obesity |
ИМТ по Кетле, кг/м2 BMI (Quetelet index), kg/m2 |
|
Стеатоз Steatosis (n=33) |
28 |
5 |
61,2±1,13 (95 % CI: 58,6–63,8) |
72,7 |
33,8±0,48 (95 % CI: 32,8–34,8) |
|
Х 2 =9,87 р=0,0017 |
|||||
|
НАСГ Non-alcoholic steatohepatitis (n=47) |
10 |
37 |
63,2±1,08 (95 % CI: 61,0–65,4) |
93,6 |
35,9±0,62 (95 % CI: 34,7–37,2) |
|
Х 2=9,57 р=0,0020 |
р 1 =0,1806 |
р 1 =0,0059 |
р 1 =0,1722 |
||
|
ЦП Liver cirrhosis (n=16) |
- |
16 |
72,9±1,9 (95 % CI: 68,9–76,9) |
100 |
43±1,93 (95 % CI: 38,9–41,1) |
|
р 2 =0,0000; р 3 =0,0000 |
р 2 =0,0000 р 3 =0,0000 |
||||
|
Группа Group |
Мужчины Males |
Женщины Females |
Возраст, лет Age |
Ожирение, % Obesity |
ИМТ по Кетле, кг/м2 BMI (Quetelet index), kg/m2 |
|
Итого Total |
38 (39,6 %) |
58 (60,4 %) |
- |
84 (87,5 %) |
- |
|
χ 2=2,39 р=0,1223 |
р=0,0000 |
||||
В ходе исследования было установлено, что ИКЧ увеличивался с возрастанием степени НАЖБП: при стеатозе – 4,4±0,2 (95 % ДИ: 4,0–4,7) балла, при НАСГ – 4,5±0,2 (95 % ДИ: 4,13–4,8) и при ЦП – 5,25±0,34 (95 % ДИ: 4,5–6,0) (р 1 =0,8080; р 2 =0,0277; р 3 =0,0450), в среднем составляя 4,57±0,12 (95 % ДИ: 4,33–4,8) балла и свидетельствуя о наличии у всех обследованных высокой ко-морбидности.
Составляющей метаболического синдрома являлся увеличенный объемом талии (у мужчин – 118,6±1,71 (95 % ДИ: 115,2–122,1) см, min – 103 см, max – 140 см; у женщин – 119,0±1,44 (95 % ДИ: 116,1–121,9), min – 102 см, max – 145 см), позволивший вместе с ИМТ по Кетле диагностировать ожирение I, II, III степеней соответственно у 31 (32,3 %), 38 (39,6 %), 14 (14,6 %) пациентов и избыточную массу тела у 13 (13,5 %) чел. Межгрупповые различия по критериям Манна – Уитни были установлены между группами пациентов с НАСГ и стеатозом (U 1 =4,5788; р 1 =0,0000) и с ЦП и НАСГ (U 3 =3,7961; р 3 =0,0001). Таким образом, с 95 % вероятностью доказана прогностическая роль ожирения в развитии метаболически ассоциированной НАЖБП (ОШ 2,86±0,31; 95 % ДИ: 1,56–5,25; р<0,05).
Важной этиопатогенетической составляющей МС является СД 2-го типа, который был диагностирован у всех 96 больных, причем 70,8 % из них находились на инсулинотера-пии. Продолжительность течения СД 2-го типа варьировала от 1 до 27 лет и в среднем составляла 12,8±0,6 (95 % ДИ: 11,6–14,0) года. Уровень гликемии у пациентов достигал 17,2±0,38 (95 % ДИ: 16,4–18) ммоль/л (min – 10,2 ммоль/л, max – 29,2 ммоль/л), содержание гликированного Hb – 12,0±0,25 (95 % ДИ: 11,5–12,5) % (min – 6,9 %, max – 18,3 %). При этом анализ межгрупповых различий по критерию Манна – Уитни выявил разницу лишь в длительности течения СД 2-го типа на стадиях НАСГ и стеатоза печени (U1=3,5868; р1=0,0002) и стадии ЦП по сравнению с НАСГ (U3=4,5002; р3=0,0000).
Сердечно-сосудистые заболевания как составляющие метаболически ассоциированной коморбидности у обследуемых были представлены: 1) АГ в 100 % случаев, в т.ч. в каждом третьем случае (32,3 %) – АГ осложненного течения: в анамнезе острые нарушения мозгового кровообращения (14 (14,6 %)), острый коронарный синдром – острый инфаркт миокарда (17 (17,7 %)); родолжительность течения АГ составляла 28–35 лет: 22,4±0,67 (95 % ДИ: 19,2–22,4) года; 2) ИБС – 87 (90,6 %) случаев на момент обследования, включающей, кроме постинфарктного кардиосклероза, стенокардию и сердечную недостаточность; продолжительность течения по анамнезу – до 16 лет: 13,7±0,45 (95 % ДИ: 11,9–15,2) года; 3) атеросклерозом иных локализаций – 18 (18,8 %) случаев, преимущественно бра-хеоцефальных артерий с клиникой цереброваскулярной болезни.
Хроническая почечная недостаточность как осложнение сахарного диабета (микро- и макроангиопатии) и АГ диагностировалась более чем у половины пациентов (55 (57,3 %)) на стадии C3a–C3b–С IV (13 (13,5 %)) c уровнем СКФ 46,9±2,9 (95 % ДИ: 40,5–53,2) мл/мин/1,73 м2 (min – 16,2 мл/мин/1,73 м2, max – 58,0 мл/мин/1,73 м2). В рамках кардиоваскулярного континуума у 14 (14,6 %) пациентов была выявлена анемия с Нb 112,2±2,7 (95 % ДИ: 106,4–118,0) г/л.
Пятый компонент МС – НАЖБП – диагностировался по клинико-лабораторным показателям гепатита, которые характеризовались следующими изменениями, согласующимися с данными литературы [4, 5, 12–16, 22, 27–29]. Маркеры цитолиза – АЛТ и АСТ – превышали референсные значения в 2,73±
±0,53 (95 % ДИ: 1,64–3,8) и 2,5±0,4 (95 % ДИ: 1,63–3,3) раза соответственно, маркер холестаза ГГТП повышался до 151,1±9,2 (95 % ДИ: 105,1–196,8) u/l, тогда как уровень щелочной фосфотазы составлял 111,9±12,2 (95 % ДИ: 95,1–119,9) u/l. У 21 (21,8 %) пациента определена паренхиматозная желтуха с содержанием билирубина от 21,7 до 25,3 мкмоль/л. Более чем в трети случаев (34 (35,4 %)) выявлена гипоальбуминемия сложного генеза со значениями 33,7±0,4 (95 % ДИ 32,9–34,6) г/л, однако ее следовало отнести и к печеночно-клеточной недостаточности, так как были диагностированы и иные параметры данного синдрома, в частности тест связи чисел, или тест Рейтана, составил 79,7±2,64 (95 % ДИ: 74,4–84,9) с. Латентная стадия энцефалопатии была определена у 32 (33,3 %) пациентов, I–II стадия – у 25 (26,1 %), II – у 33 (34,4 %) и III – у 6 (6,2 %) чел. У больных НАЖБП на стадии стеатоза значение теста Рейтана достигло 50,7±1,1 (95 % ДИ: 48,5–53,0) с (латентная стадия), при НАСГ – 89,0±2,28 (95 % ДИ: 84,4–93,6) с (I–II стадия), при ЦП – 112,0±3,4 (95 % ДИ: 104,8–119,2) с (II и III стадии энцефалопатии), что доказывает ведущую роль повреждения печени в развитии синдрома энцефалопатии и печеночно-клеточной недостаточности.
У 47 больных НАСГ и 16 больных ЦП методом фибросканирования были верифицированы стадии F2–F4 фиброза печени по шкале METAVIR, что соответствует стадиям хронического гепатита (F2, F3) и стадии цирроза печени (F4). Использование неинвазивных калькуляторов фиброза печени показало, что 50 (52,1 %) пациентов с НАЖБП со значениями NAFLD Fibrosis Score 0,675 и более имеют фиброз на стадии F3–F4, 46 (47,9 %) больных – на стадии F2. Значение, полученное в тесте FIB4, составило 4,06±0,13 (95 % ДИ: 3,76–4,4), варьируя от 3,6 до 5,01, что соответствует F3–F4 стадии фиброза, лишь у 12 (12,5 %) больных; у остальных 84 пациентов показатель располагался в интервале от 0,1 до 2,96, что отражает малую вероятность значимого фиброза печени. В каждом 10-м (10 (10,4 %)) обследовании APRI TEST превышал значение 1,0, что соответствует наличию фибротиче-ской перестройки в печени. Следует отметить, что данные неинвазивных калькуляторов совпали с данными эластометрии печени.
Также определялись параметры печеночно-клеточной недостаточности. Кроме концентрации альбуминов в сыворотке крови и теста Рейтана, изучалось содержание аммиака, являющегося конечным продуктом обмена азотсодержащих веществ и обладающего нейротоксическим эффектом. Наиболее активным продуцентом аммиака является печень; в норме он удаляется из организма с мочой в виде мочевины [25, 26, 30–38]. Повышение содержания аммиака в крови свидетельствует о нарушении его катаболизма. Гипераммониемия является проявлением энцефалопатии, свидетельствует о нарушении белково-синтетической функции печени – синдроме печеночно-клеточной недостаточности и связана с воспалением в печени и, возможно, с ее фибротической перестройкой [33–38].
В исследовании изучались нарушения белкового обмена при приобретенной патологии печени – НАЖБП – на уровнях печеночной и внепеченочной портальной гипертензии у больных ЦП в соответствии с положением трех клинических рекомендаций «Консенсус «Гипераммониемия у взрослых» [26].
Нарушения белкового и азотистого обмена оценивались по содержанию аммиака, общего белка, мочевины, креатинина и мочевой кислоты в сыворотке крови больных НАЖБП (табл. 2). Средние значения общего белка, альбуминов, мочевины, креатинина и мочевой кислоты у пациентов были в пределах референсных, варьируя соответственно от 62 до 83 г/л, от 32 до 48 г/л, от 3,2 до 20,7 ммоль/л, от 46 до 223 мкмоль/л и от 151 до 790 ммоль/л.
Параметры белкового и азотистого обмена (n=96)
Таблица 2
Table 2
Parameters of Protein and Nitrogen Metabolism (n=96)
|
Показатель |
Значение (M±m, 95 % ДИ) Value (M±m, 95 % CI) |
|
Общий белок, г/л Total protein, g/l |
71,5±0,5 (70,5–72,5) |
|
Альбумины, г/л Albumin, g/l |
39,1±0,3 (38,4–39,7) |
|
Альбумины снижены, г/л (n=13; 13,5 %) Low albumin, g/l (n=13; 13,5 %) |
33,7±0,37 (32,9–34,6)* |
|
Мочевина, ммоль/л Urea, mmol/l |
6,62±0,06 (6,08–7,15) |
|
Мочевина повышена, ммоль/л (n=31; 32,3 %) High urea value, mmol/l (n=31; 32,3 %) |
9,2±0,47 (8,9–10,2)* |
|
Креатинин, мкмоль/л Creatinine, mkmol/l |
97,3±2,2 (92,9–101,7) |
|
Креатинин повышен, мкмоль/л (n=61; 63,5 %) High creatinine level, mkmol/l (n=61; 63,5 %) |
107,6±2,35 (102,9–112,3)* |
|
Мочевая кислота, ммоль/л Uric acid, mmol/l |
355,3±13,4 (328,5–382,0) |
|
Мочевая кислота повышена, ммоль/л (n=35; 36,4 %) High uric acid level, mmol/l (n=35; 36,4 %) |
459,1±22,2 (413,8–504,3)* |
|
Аммиак, мкмоль/л Ammonia, mkmol/l |
103,6±4,7 (94,3–113,0)* |
|
Аммиак повышен, мкмоль/л (n=88; 91,7 %) High ammonia level, mkmol/l (n=88; 91,7 %) |
111,1±4,86 (101,3–120,7)* |
Примечание. * – сравнение с нормой.
Note. * compared with the norm.
Вместе с тем у каждого седьмого больного (13,5 %) наблюдалась гипоальбуминемия, что отражает нарушение белково-синтетической функции печени и потерю белка с мочой в рамках кардиоренального континуума. Содержание альбуминов в сыворотке крови составляло 33,7±0,37 (95 % ДИ 32,9–34,6) г/л. Азот мочевины (мочевина) оказался повышенным более чем в трети случаев (32,3 %), что также свидетельствует о повреждении почек и, возможно, о потере массы тела на фоне прогрессирующего фиброза печени. При этом гиперкреати-нинемия у 63,5 % больных указывает на ХБП, о которой сказано выше. Таким образом, у больных с МС выявлены сложные многокомпонентные нарушения белкового обмена, в т.ч. подтверждающие критерии НАЖБП по синдрому печеночно-клеточной недостаточности.
ГАЕ как еще один маркер печеночноклеточной недостаточности диагностирована у 88 (91,7 %) пациентов с МАЖБП с максимальным значением 226 мкмоль/л и средним значением 111,1±4,86 (95 % ДИ: 101,3– 120,7) мкмоль/л, что с 99 % вероятностью выше референсных значений, составляющих 36,7±13,1 (р=0,0000). Уровень аммиака 77,8±1,62 (95 % ДИ: 74,5–81) мкмоль/л у 46 (52,9 %) пациентов соответствовал легкой степени ГАЕ, 136±5,73 (95 % ДИ: 124,4– 177,7) мкмоль/л у 32 (36,9 %) пациентов – средней тяжести и 206,4±3,52 (95 % ДИ: 201,8–215) мкмоль/л у 9 (10,2 %) чел. – тяжелой гипераммониемии (рис. 1).
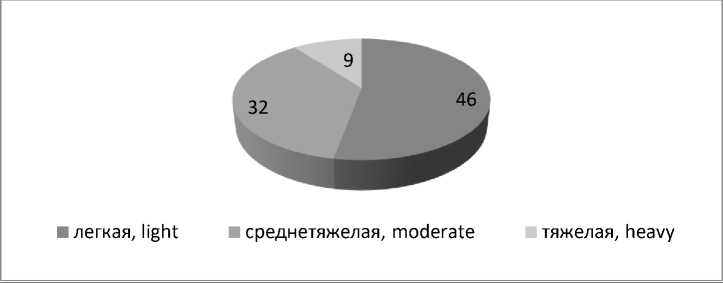
Рис. 1. Степени тяжести гипераммониемии при МАЖБП
Fig. 1. Hyperammonemia severity in metabolic associated fatty liver disease
При стратификации содержания аммиака у больных МАЖБП с ГАЕ по стадиям заболевания (табл. 3) было установлено, что значения ГАЕ возрастают от стадии стеатоза печени до стадий НАСГ у 95,7 % пациентов и до ЦП в 100 % случаев. В настоящее время единого подхода к оценке данного синдрома у гепато- логических больных нет, а исследователи отмечают его значение преимущественно на стадии цирроза печени невирусной и вирусной этиологии [24, 25, 30–38] и связывают чаще всего с ожирением и инсулинорезистентно-стью [34]. Нами же были обследованы больные с МС без установленного диагноза НАЖБП.
Таблица 3
Table3
Содержание аммиака в крови при метаболически ассоциированной жировой болезни печени, мкмоль/л (n=96)
Ammonia level in blood in metabolically associated non-alcoholic fatty liver disease (n=96), (mmol/l)
|
Группа больных Group of patients |
Содержание аммиака Ammonia level |
р |
|
На стадии стеатоза (n=33) Steatosis (n=33) |
75,5±4,04 (67,3–83,8) |
р N =0,0000 |
|
Аммиак повышен (n=27; 81,8 %) Increased ammonia level (n=27; 81,8 %) |
83,6±4,14 (75,1–92,2) |
р N =0,000 |
|
На стадии неалкогольного стеатогепатита (n=47) Non-alcoholic steatohepatitis (n=47) |
102,4±5,8 (90,7–114,1) |
р N =0,000 р 1 =0,0004 |
|
Аммиак повышен (n=45; 95,7 %) Increased ammonia level (n=45; 95,7 %) |
104,7±5,8 (92,9–116,5) |
р N =0,000 |
|
На стадии цирроза печени (n=16) Liver cirrhosis (n=16) |
165,2±10,2 (143,3–187,1) |
р N =0,000 р 2 =0,0000 р 3 =0,0000 |
Примечание. р N – сравнение c нормой.
Note. * compared with the norm.
Выявленные нами данные позволяют заподозрить НАЖБП уже на ее ранних стадиях у лиц с МС без изменений в биохимических пробах печени и требовать исследования пе- чени на наличие фиброза – изначально с применением неинвазивных калькуляторов, а при сочетании ГАЕ с подозрением на фиброз (при положительных тестах) – проведения эласто- метрии. Особенно важно диагностировать ГАЕ в сочетании с фиброзом печени по данным неинвазивных калькуляторов, в первую очередь NAFLD fibrosis score как самого информативного.
Анализ межгрупповых различий методом Манна – Уитни выявил и подтвердил значимость нарастания значений аммиака при МАЖБП от стадии стеатоза к стадии стеатоге-патита и далее к стадии цирроза печени (U 1 =3,3685, р 1 =0,0005; U 2 =5,3658, р 2 =0,0000; U 3 =4,4316, р 3 =0,0000). Установлено, что ГАЕ у больных НАЖБП на стадии НАСГ является прогностически значимым фактором (ОШ 7,2±0,83; 95 % ДИ: 1,38–37,5; р<0,05). Установлены взаимосвязи средней силы между ГАЕ и женским полом (r=0,3725; р=0,0000), ИМТ по Кетле (r=0,4698; р=0,0000), ожирением (r=0,4580; р<0,05), его стадией (r=0,4698; р=0,0000), гиперлипидемией низкой плотности (r=0,4442; р<0,05), маркерами цитолиза – с АЛТ (r=0,3350; р=0,001) с кратностью повышения фермента (r=0,3056; р<0,05), АСТ (r=0,4426; р=0,0000) с кратностью ее повышения (r=0,3358; р<0,05), определяющими обострение воспаления в печении при НАЖБП или его активность (r=0,3967; р=0,0000), выявленной сонологически степенью стеатоза печени (r=0,2216; р<0,05), а также сильные связи с синдромом сердечной недостаточности (r=0,9112; р=0,031) и средние со значениями СКФ (r=0,3114; р=0,002).
Установленные достоверные обратные взаимосвязи средней силы между ГАЕ и содержанием тромбоцитов (r=-0,3184; р=0,0020) могут отражать формирование и/или прогрессирование синдрома портальной гипертензии. Оказалось, что чем выше содержание аммиака в крови больных, тем ниже содержание фибриногена, что подтверждено обратной зависимостью (r=-0,6139; р=0,0028) и свидетельствует об усугублении печеночно-клеточной недостаточности и подтверждается взаимосвязью с энцефалопатией (r=0,5369; р=0,0000) с 99 % вероятностью. Энцефалопатия встречалась по нарастающей чаще при МАЖБП от стадии стеатоза к стадии НАСГ и далее к стадии ЦП (U1=7,5768, р=0,0000; U2=5,6178, р2=0,0000; U3=4,2160, р3=0,0000). Оказались достоверными и взаимоотношения между ГАЕ и фибротической перестройкой печени по параметрам неинвазивных калькуляторов – APRI (r=0,4311; р=0,0010), FIB4 (r=0,3862; р=0,0040), NAFLD Fibrosis Score (r=0,3584; р=0,0070).
Все вышесказанное подтверждается данными кластерного анализа. Совокупность ас-тенизации, гипоальбуминемии, повышения значений в тесте Рейтана с гипераммониемией является дополнительным и важнейшим критерием печеночно-клеточной недостаточности при НАЖБП у больных с МС (абдоминальным ожирением, СД 2-го типа, кардиоваскулярной патологией, кардиоренальными взаимоотношениями на фоне атерогенной дислипидемии), что продемонстрировано в кластерах и субкластерах у 96 больных и подтверждено взаимосвязями печеночно-клеточной недостаточности с содержанием аммиака и составляющих всего диагностического комплекса при МС и НАЖБП.
При проведении настоящего исследования уточнена роль нарушений белкового и азотистого обменов, в первую очередь гипераммониемии, в клинической картине МАЖБП – от ее формирования до прогрессирования через стадии НАСГ и ЦП, что подтверждается активностью воспаления в печени, печеночноклеточной недостаточностью, прогрессирующей до стадии цирроза печени, в т.ч. в виде прямых корреляций с маркерами цитолиза, энцефалопатией, взаимосвязями с фибротиче-ской перестройкой печени.
Заключение. Таким образом, неалкогольная жировая болезнь печени, заболеваемость и распространенность которой в связи с эпидемиями ожирения, СД 2-го типа, метаболического синдрома во всем мире прогрессивно увеличивается, входящая в квинтет метаболически ассоциированных заболеваний, в первую очередь эндокринных (ожирения, СД 2-го типа) и сердечно-сосудистых (АГ и ИБС), является важной междисциплинарной проблемой современного здравоохранения. В диагностике НАЖБП первичного генеза, характеризующейся клинической малосимптомно-стью, но неуклонно прогрессирующим течением до стадий цирроза печени и первичной гепатоцеллюлярной карциномы, формирующейся при метаболически ассоциированной коморбидной патологии в рамках кардиогепа-тологического континуума, множество вопросов остается открытым. Данное заболевание требует проведения дифференциации с гепатитом иной этиологии, в первую очередь со стеатогепатитом алкогольного, лекарственного генеза и гепатитом С. Число больных с метаболическим синдромом в мире прогрессивно растет, а НАЖБП определяет параметры качества и продолжительности жизни больных в связи с ее прогрессированием на фоне кажущегося благополучия. В этой связи поиск дополнительных методов диагностики и мониторирования данного заболевания печени важен и своевременен. Применение неинвазивных калькуляторов, позволяющих ориентировочно оценить наличие и степень фиброза, определение аммиака в крови и собственно гипераммониемии как еще одного важного маркера печеночно-клеточной недостаточности позволяют улучшить диагностику НАЖБП как на уровне амбулаторной, так и на уровне стационарной медицинской помощи.
На платформе «Врачи РФ» 28 июня 2023 г. был размещен проект Министерства здравоохранения РФ «Об утверждении стандарта медицинской помощи взрослым при неалкогольной жировой болезни печени (диагностика, лечение и диспансерное наблюдение)», под- готовленный Минздравом России 14.06.2023 для оказания первичной медико-санитарной помощи, специализированной медицинской помощи в условиях амбулаторного лечения, лечения в дневном стационаре и стационарно, регламентирующий объемы и частоту исследований, в котором прописаны ведение больных терапевтом и гастроэнтерологом, общеклинические и общетерапевтические биохимические анализы крови, анализ результатов УЗИ и эластометрии печени, проведение иммунологических тестов, МРТ и анализа гепатобиоптатов с коэффициентом 0,0033 source=vrch Система ГАРАНТ). Однако полученные нами данные расширяют диагностические возможности при НАЖБП, позволяя ее заподозрить по результатам применения неинвазивных калькуляторов, в первую очередь NAFLD fibrosis score, выявления печеночно-клеточной недостаточности путем внедрения обязательного исследования капиллярной крови на аммиак, а выявленная гипераммониемия в совокупности NAFLD fibrosis score позволяет стратифицировать стадии данного часто встречаемого хронического заболевания печени и проводить дальнейший поиск его клинико-диагностических маркеров, исключив гепатит иной этиологии, а также мониторировать течение на фоне проводимой терапии.
Работа проведена в рамках инициативной темы «Предикторы генеза развития, течения и исходов хронических и коморбидно протекающих соматических заболеваний» № АААА-А19-119062490051-6 БУ Ханты-Мансийского автономного округа – Югры «Сургутский государственный университет», зарегистрированной в ЕГИСУ НИОКТР до 2022 г. и пролонгированной за № 123060100028-5 до 2025 г.
Список литературы Диагностическое значение нарушений азотистого обмена при неалкогольной жировой болезни печени у коморбидных больных с метаболическим синдромом и стратификация ее стадий
- БеленковЮ.Н., Привалова Е.В., Каплунова В.Ю., Зекцер В.Ю., Виноградова Н.Н., Ильгисонис И.С., Шакарьянц Г.А., Кожевникова М.В., Лишута А.С. Метаболический синдром: история развития, основные критерии диагностики. Рациональная фармакотерапия в кардиологии. 2018; 14 (5): 757-764.
- Оганов Р.Г., Денисов И.Н., Симаненков В.И., Бакулин И.Г., Бакулина Н.В., Болдуева С.А., Барба-раш О.Н., Гарганеева Н.П., Дощицин В.Л., Драпкина О.М., Дудинская Е.Н., Котовская Ю.В., Лила А.М., Мамедов М.Н., Марданов Б.У., Миллер О.Н., Петрова М.М., Поздняков Ю.М., Рунихи-на Н.К., Сайганов С.А., Тарасов А.В., Ткачева О.Н., Уринский А.М., Шальнова С.А. Коморбидная патология в клинической практике. Клинические рекомендации. Кардиоваскулярная терапия и профилактика. 2017; 16 (6): 5-56.
- Оганов Р.Г., Симаненков В.И., Бакулин И.Г., Бакулина Н.В., Барбараш О.Л., Бойцов С.А., Болдуева С.А., Гарганеева Н.П., Дощицин В.Л., Каратеев А.Е., Котовская Ю.В., Лила А.М., Лукьянов М.М., Морозова Т.Е., Переверзев А.П., Петрова М.М., Поздняков Ю.М., Сыров А.В., Тарасов А.В., Ткачева О.Н., Шальнова С.А. Коморбидная патология в клинической практике. Алгоритмы диагностики и лечения. Кардиоваскулярная терапия и профилактика. 2019; 18 (1): 5-66.
- Бабенко А.Ю., Лаевская М.Ю. Неалкогольная жировая болезнь печени - взаимосвязи с метаболическим синдромом. Русский медицинский журнал. 2018; 1 (I): 34-40. URL: https://www.rmj.ru/arti-des/endokrinologiya/Nealkogolynaya_ghirovaya_bolezny_pecheni_vzaimosvyazi_s_metabolicheskim_sindromom/#ixzz872Tqf2ro Under Creative Commons License: Attribution (дата обращения: 23.03.2023).
- ЛивзанМ.А., Гаус О.В., Николаев Н.А., Кролевец Т.С. НАЖБП: коморбидность и ассоциированные заболевания. Экспериментальная и клиническая гастроэнтерология. 2019; 1 (10): 57-65.
- Le M.H. Global incidence of non-alcoholic fatty liver disease: a systematic review and meta-analysis of 63 studies and 1,201,807 persons. Journal of Hepatology. 2023; 79 (2): 287-295. DOI: 10.1016/ j.jhep.2023.03.040.
- Лазебник Л.Б., Радченко В.Г., Голованова Е.В., Звенигородская Л.А., Конев Ю.В., Селиверстов П.В., Ситкин С.И., Ткаченко Е.И., Авалуева Е.Б., Айламазян Э.К., Власов Н.Н., Гриневич В.Б., Корниенко Е.А., Новикова В.П., Хорошинина Л.П., Жесткова Н.В., Орешко Л.С., Дуданова О.П., Добри-ца В.П., Турьева Л.В., Тирикова О.В., Козлова Н.М., Елисеев С.М., Гумеров Р.Р., Венцак Е.В., Алешина Е.И., Гурова М.М., Горячева Л.Г. Неалкогольная жировая болезнь печени: клиника, диагностика, лечение (рекомендации для терапевтов, 2-я версия). Экспериментальная и клиническая гастроэнтерология. 2017; 2: 22-37.
- Драпкина О.М., Буеверов А.О. Неалкогольная жировая болезнь печени как мультидисциплинарная патология. Москва: ВИДОКС; 2019. 103.
- Лазебник Л.Б., Голованова Е.В., Туркина С.В., Райхельсон К.Л., Оковитый С.В., Драпкина О.М., Маев И.В., Мартынов А.И., Ройтберг Г.Е., Хлынова О.В., Абдулганиева Д.И., Алексеенко С.А., Ар-датская М.Д., Бакулин И.Г., Бакулина Н.В., Буеверов А.О., Виницкая Е.В., Волынец Г.В., Еремина Е.Ю., Гриневич В.Б., Долгушина А.И., Казюлин А.Н., Кашкина Е.И., Козлова И.В., Конев Ю.В., Корочанская Н.В., Кравчук Ю.А., Ли Е.Д., Лоранская И.Д., Махов В.М., Мехтиев С.Н., Новикова В.П., Остроумова О.Д., Павлов Ч.С., Радченко В.Г., СамсоновА.А., СарсенбаеваА.С., Сайфут-динов Р.Г., Селиверстов П.В., Ситкин С.И., Стефанюк О.В., Тарасова Л.В., Ткаченко Е.И., Успенский Ю.П., Фоминых Ю.А., Хавкин А.И., Цыганова Ю.В., Шархун О.О. Неалкогольная жировая болезнь печени у взрослых: клиника, диагностика, лечение. Рекомендации для терапевтов, третья версия. Экспериментальная и клиническая гастроэнтерология. 2021; 1 (1): 4-52.
- Широкова Е.Н. Неалкогольная жировая болезнь печени, гиперлипидемия и сердечно-сосудистые риски. Consilium Medicum. 2017; 19: 74-76.
- 10 главных причин смерти. URL: https://plus-one.m/society/2022/07/20/10-glavnyh-prichin-smerti (дата обращения: 23.03.2023).
- Маев И.В., Андреев Д.Н., Кучерявый Ю.А., Дичева Д.Т., Кузнецова Е.И. Неалкогольная жировая болезнь печени с позиций современной медицины: пособие для врачей. Москва: Прима Принт; 2020. 68.
- Андреев Д.Н., Маев И.В., Дичева Д.Т., Кузнецова Е.И. Диагностика и лечение неалкогольной жировой болезни печени: обзор европейских рекомендаций 2016 года. Consilium Medicum. 2017; 19 (8): 8-13.
- Маев И.В., Андреев Д.Н., Дичева Д.Т., Кузнецова Е.И. Неалкогольная жировая болезнь печени: пособие для врачей. Москва: Прима Принт; 2017. 64.
- Голованова Е.В. Патология желчевыводящих путей и печени у больных с метаболическим синдромом: пособие для врачей. Москва: Прима Принт; 2020. 64.
- EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease. J Hepatol. 2016; 64: 1388-1402.
- ICD-11 Implementation or Transition Guide. Geneva: World Health Organization; 2019.
- Eslam M., Newsome P.N., Anstee Q.M. A new defi nition for metabolic associated fatty liver disease: an international expert consensus statement. Journal of Hepatology. 2020; 73 (1): 202-209. DOI: 10.1016/ j.jhep.2020.03.039.
- Eslam M., Sanyal A.J., George J. MAFLD: a consensus driven proposed nomenclature for metabolic associated fatty liver disease. Gastroenterology. 2020; 158 (7): 1999-2014. DOI: 10.1053/j.gas-tro.2019.11.312.
- Yasser Fouad. What's in a name? Renaming 'NAFLD' to 'MAFLD'. Liver International. 2020; 00: 1-8.
- Shi Z., Tuomilehto J. The circadian syndrome predicts cardiovascular disease better than metabolic syndrome in Chinese adults. J Intern Med. 2020; 289 (6): 851-860. DOI: 10.1111/joim. 12924. PMID: 31081577. PMCID: PMC6851668.
- Цуканов В.В., Васютин А.В., ТонкихЮ.Л. Новые аспекты неалкогольной жировой болезни печени. Доктор.Ру. 2021; 20 (4): 33-39.
- Биек А.Ю., Сайтов А.Р., Добрынина И.Ю., Арямкина О.Л. Метаболически ассоциированная неалкогольная жировая болезнь печени. Вестник СурГУ. Медицина. 2021; 3 (49): 14-19.
- Верижникова Л.Н., Арямкина О.Л., Терентьева Н.Н. Соматическая патология у жителей Ханты-Мансийского автономного округа - Югры. Бюллетень сибирской медицины. 2020; 19 (2): 13-19.
- Лазебник Л.Б., Голованова Е.В., Алексеенко С.А., Буеверов А.О., Плотникова Е.Ю., Долгушина А.И., Ильченко Л.Ю., Ермолова Т.В., Тарасова Л.В., Ли Е.Д., Цыганова Ю.В., Ахмедов В.А., Агеева Е.А., ЛосевВ.М., КуприяноваИ.Н., Серикова С.Н., КорочанскаяН.В., ВологжанинаЛ.Г., ЦиммерманЯ.С., СасЕ.И., Журавель С.В., Оковитый С.В., ОсипенкоМ.Ф., РадченкоВ.Г., СолдатоваГ.С., Ситкин С.И., Селиверстов П.В., Шавкута Г.В., Бутова Е.Н., Кожевникова С.А. Российский консенсус «Гиперам-мониемии у взрослых». Экспериментальная и клиническая гастроэнтерология. 2019; 12: 4-23.
- Лазебник Л.Б., Голованова Е.В., Алексеенко С.А., Буеверов А.О., Плотникова Е.Ю., Долгушина А.И., Ильченко Л.Ю., Ермолова Т.В., Тарасова Л.В., Ли Е.Д., Цыганова Ю.В., Ахмедов В.А., Агеева Е.А., Лосев В.М., Куприянова И.Н., Серикова С.Н., Корочанская Н.В., Вологжанина Л.Г., Циммерман Я.С., Сас Е.И., Журавель С.В., Оковитый С.В., Осипенко М.Ф., Радченко В.Г., Солдатова Г.С., Ситкин С.И., Селиверстов П.В., Шавкута Г.В., Бутова Е.Н., Кожевникова С.А. Российский консенсус «Гипераммониемии у взрослых» (версия 2021). Экспериментальная и клиническая гастроэнтерология. 2021; 3: 97-118.
- ЛазебникЛ.Б., Туркина С.В. НАЖБП-ассоциированная коморбидность. Экспериментальная и клиническая гастроэнтерология. 2021; 194 (10): 5-13.
- Резник Е.В., Алиева А.М., Модестова А.В., Волынкина В.М., Кисляков В.А., Никитин И.Г., Байко-ва И.Е. Хронические гепатиты: учебное пособие для вузов. 2-е изд. Москва; Юрайт: РНИМУ им. Н.И. Пирогова; 2022. 87.
- Мычка В.Б., Верткин А.Л., Вардаев Л.И., Дружилов МА., Ипаткин Р.В., Калинкин А.Л., Кузнецова И.В., Кузнецова Т.Ю., Мехтиев С.Н., Моргунов Ю.Л., Миллер А.М., Мамедов М.Н., Осипо-ва И.В., Пушкарь Д.Ю., Тапильская Н.И., Титаренко В.Л., Чумакова Г.А., Щекотов В.В., Аганезо-ва Н.В., Аметов А.С., Антропова О.Н., Балан В.Е., Богачев Р.С., Демидова Т.Ю., Драпкина О.М., Луцевич О.Э., Наумов А.В., Оганов Р.Г., Паценко М.Б., Пырикова Н.В., Сигал А.С., Салов И.А., Смет-никВ.П., Теблоев К.И., Толстов С.Н., УльрихЕ.А., Фисун А.Я., Юренева С.В., ЯшковЮ.И. Консенсус экспертов по междисциплинарному подходу к ведению, диагностике и лечению больных с метаболическим синдромом. Кардиоваскулярная терапия и профилактика. 2013; 12 (6): 41-82.
- Плотникова Е.Ю., СиньковаМ.Н., Исаков Л.К. Астения и утомление при гипераммониемии: этио-патогенез и методы коррекции. Медицинский совет. 2021; 21-1: 95-104.
- Петрова Э.М., Черанева В.А., Грачев В.Г. Гепатогенная слабость как клинический маркер гипе-раммониемии и эффективность ее коррекции у пациентов с доцирротическими стадиями неалкогольной жирово... Лечащий врач. 2020; 8: 48-53.
- Гаранина Е.В. Влияние курсового приема L-орнитин-Ь-аспартата на фиброз и стеатоз печени у больных ассоциированной с нарушениями метаболизма жировой болезнью печени (неалкогольной жировой болезнью печени), имеющих гипераммониемию. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2021; 31 (4): 31-36.
- Плотникова Е.Ю., Сухих А.С. Различные варианты гипераммониемии в клинической практике. Медицинский совет. 2018; 14: 34-42.
- Шавкута Г.В., Шнюкова Т.В., Колесникова Е.С., Кручинин В.В., Лютова А.К., Тимченко А.С. Повышение уровня аммиака и его связь с висцеральным ожирением и инсулинорезистентностью. Экспериментальная и клиническая гастроэнтерология. 2019; 9: 75-79.
- Ильченко Л.Ю., Никитин И.Г. Гипераммониемия у пациентов на доцирротической стадии: клиническая реальность? Архивъ внутренней медицины. 2018; 8 (3): 186-193.
- Горбань В.В., Корочанская Н.В., Горбань Е.В., Серикова С.Н. Клинико-лабораторные констелляции неалкогольной жировой болезни печени и гастроэзофагеальной рефлюксной болезни: возможности скрининга стеатогепатоза и стеатогепатита на основании выявления гипераммониемии в амбулаторной практике. Экспериментальная и клиническая гастроэнтерология. 2019; 166 (6): 105-112.
- Алексеенко С.А., Агеева Е.А., Полковникова О.П. Современные подходы к диагностике и лечению гипераммониемии у пациентов с хроническими заболеваниями печени на доцирротической стадии. Медицинский альманах. 2019; 1 (58): 57-59.
- Буеверов А.О., Богомолов П.О., Маев И.В., Мациевич М.В., Уварова О.В. Возможности терапевтической коррекции гипераммониемии и минимальной печеночной энцефалопатии у пациентов с хроническим гепатитом С на доцирротической стадии. Терапевтический архив. 2019; 91 (2): 52-58.


