Диагностика гаплотипа FH4 у крупного рогатого скота симментальской породы с использованием системы ПЦР в реальном времени
Автор: Зимина Анна Александровна, Бардуков Николай Владимирович, Форнара Маргарет Сержевна, Костюнина Ольга Васильевна
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Ветеринария и зоотехния
Статья в выпуске: 11, 2020 года.
Бесплатный доступ
Цель исследования - разработка тест-системы методом ПЦР в реальном времени для диагностики и изучения путей распространения FH4 в популяции крупного рогатого скота симментальской породы. С использованием метода ПЦР в реальном времени изучено распространение мутации в гене SUGT1, ассоциированной со снижением фертильности и эмбриональной смертностью потомства в популяции коров (n = 180) и быков-производителей (n = 239) симментальской породы Воронежской, Орловской, Липецкой, Калужской, Московской областей, республик Татарстан, Хакасия и Алтайского края. Работа тест-системы основана на принципе Taq Man. По результатам генотипирования в исследуемой группе быков симментальской породы оказалось 15 скрытых носителей FH4, происходящих из линий Редада 711620016730, Хонига 803610032, Страйка 979322326, Польцера 803608138 и Целота 929105907; в группе коров - 4 скрытых носительницы, отцами которых были быки-производители Вальтер 644662345 (л. Флориана 374), Мыльный 1405 (л. Фасадника 642), Марс 3659 (л. Неолита 8593). В заявленной выборке животных не был диагностирован гомозиготный вариант GG по причине эмбриональной смертности потомства. Частота генотипа АА составила 93,7 ± 0,016 и 97,7 ± 0,011 % в группах быков и коров соответственно, в среднем по выборке - 95,5 ± 0,010 %. Частота встречаемости аллеля G фиксировалась на уровне 0,032 ± 0,011 у быков и 0,012 ± 0,008 у коров соответственно и в среднем по исследованной выборке составила 0,023 ± 0,007. Проведенные исследования показали эффективность разработанной тест-системы в выявлении полиморфизма (А→G в позиции 11102143 (rs110793536, ARS-UCD1.2) в гене SUGT1, ассоциированного с фертильностью. Системная организация скрининговых мероприятий позволит осуществлять идентификацию летальных генетических дефектов в воспроизводительной части стада до случной компании. Данный подход обеспечит участие в селекционном процессе только тех животных, которые не имеют генетического груза.
Крупный рогатый скот, пцр в реальном времени, симментальский скот, скрининг
Короткий адрес: https://sciup.org/140250546
IDR: 140250546 | УДК: 575.113.2:636.237.23 | DOI: 10.36718/1819-4036-2020-11-138-144
Текст научной статьи Диагностика гаплотипа FH4 у крупного рогатого скота симментальской породы с использованием системы ПЦР в реальном времени
Anna A. Zimina
Federal Research Center of Animal Husbandry – L.K. Ernst Institute of Animal Husbandry, staff scientist of the laboratory of molecular bases of selection, candidate of agricultural sciences, Russia, Moscow Region, Podolsk
Nikolay V. Bardukov
Federal Research Center of Animal Husbandry – L.K. Ernst Institute of Animal Husbandry, junior staff scientist of the laboratory of molecular bases of selection, candidate of agricultural sciences, Russia, Moscow Region, Podolsk
Margaret S. Fornara
Federal Research Center of Animal Husbandry – L.K. Ernst Institute of Animal Husbandry, senior staff scientist of the laboratory of molecular bases of selection, candidate of biological sciences, Russia, Moscow Region, Podolsk
THE DIAGNOSTICS OF FH4 HAPLOTYPE IN THE SIMMENTAL CATTLE BREEDUSING THE SYSTEM OF PCR IN REAL TIME
The aim of the study was to develop real-time PCR test system for diagnosing and studying the distribution of FH4 in the population of Simmental cattle. Using the real-time PCR method, the distribution of the mutation in the SUGT1 gene associated with the decrease in the fertility and embryonic mortality of progene in the population of cows (n = 180) and sire (n = 239) Simmental breed of Voronezh, Oryol, Lipetsk, Kaluga, Moscow Regions, the Republics of Tatarstan, Khakassia and Altai Region was studied. The testing system’s work is based on the Taq Man principle. According to the results of genotyping in the studied group of Simmental bulls, 15 latent carriers of FH4 were identified, originating from the lines Redad 711620016730, Honig 803610032, Strike 979322326, Polzer 803608138 and Celot 929105907; in the group of cows – 4 hidden carriers, whose fathers were bulls-producers Walter 644662345 (l. Florian 374), Myilnyiy 1405 (l. Façadnik 642), Mars 3659 (l. Neolit 8593). The homozygous GG variant was not diagnosed in the claimed sample of animals due to the embryonic mortality of the progene. The frequency of the AA genotype was 93.7±0.016 % and 97.7±0.011 % in the groups of bulls and cows, respectively, with an average of 95.5±0.010 % in the sampling. The frequency of occurrence of the G allele was fixed at the level of 0.032±0.011 in the bulls and 0.012±0.008 in the cows, respectively, and mean value for the studied sample was 0.023±0.007. Thus, our studies have shown the effectiveness of the developed test system in detecting polymorphism (А→G in the position 11102143 (rs110793536, ARS-UCD1.2) in the SUGT1 gene associated with fertility. Systematic organization of screening activities will allow identifying lethal genetic defects in the reproductive part of the herd before the breeding company. This approach ensures that only those animals not having genetic load will participate in the breeding process.
Введение. Популяции крупного рогатого скота подвержены распространению рецессивных заболеваний. Отдельные отцы производят де- сятки тысяч потомков путем искусственного осеменения. Частота вредных аллелей, переносимых такими родителями, может значительно увеличиться в течение нескольких поколений. Вредные аллели часто проявляются отсутствием гомозиготности, обусловленной эмбриональной / фетальной, перинатальной или ювенильной летальностью гомозигот [1, 2].
Существует поэтапный подход выявления летальных генетических дефектов. Первый этап основан на первоначальной регистрации заболевания с последующим картированием хромосомного региона и идентификации соответствующей мутации. При использовании данного подхода были открыты такие значительные генетические дефекты, как BLAD, CVM, DUMPS, у голштинского скота. Следующий этап основан на выявлении (по результатам полногеномного секвенирования или SNP-скрининга с использованием ДНК-чипов высокой и средней плотности) участка хромосом, характеризующихся потерей гомозиготности по одному из аллелей на фоне сегрегации обоих аллелей в используемой популяции, и не требует наличия информации о фенотипических признаках заболевания. Для их обозначения был предложен термин «гаплотипы фертильности» [3].
Как определенные наборы аллелей, наблюдаемые на одной хромосоме или части хромосомы, гаплотипы наследуются вместе с небольшой вероятностью рекомбинации. Многочисленные присущие им достоинства сделали гаплотипы неотъемлемой частью генетических вариантов и стали доступны в виде супераллелей [4]. К ним относятся генетические дефекты, ассоциированные с эмбриональной смертностью, удлинением сервис-периода, возрастанием количества осеменений на одну стельность, абортами, увеличением межотельного периода, удлинением лактации [3].
Причинная мутация p.W317R была обнаружена в гене SUGT1, кодирующем белок SGT1, супрессор G2 аллеля SKP1 (S-Фаза киназа-ассоциированный белок 1), нарушенная функция которого ингибирует митотический клеточный цикл и тем самым приводит к аборту [5]. SGT1 является консервативным эукариотическим белком, который функционирует во многих биологических процессах посредством взаимодействия с различными белковыми комплексами и содержит три различных домена: тетратри- копептидный повторяющийся домен (TPR), мотив CS (присутствует в белках CHP и SGT1) и мотив SGS (специфическая последовательность SGT1). SGT1 контролирует функцию кине-тохора во время метафазы митотического клеточного цикла [6]. Мутации в SUGT1 ингибируют переходы клеточного цикла G1/SиG2/M [7] и, таким образом, могут вызывать раннюю эмбриональную летальность у эукариот [6]. Предполагается, что мутация W317R сильно повреждает функцию белка SGT1. Остаток триптофана в позиции 317 SGT1 консервативен у всех эукариот, что указывает на необходимость его наличия для нормальной функции белка [1, 6–8]. Вероятно, что диплоидные клетки (зиготы), гомозиготные по FH4, вообще не подвергаются делению, в результате чего наблюдается отсутствие стельности и переход коровы в следующий цикл эструса. Таким образом, эффект данной мутации заключается в большей степени в увеличении сервис-периода, чем в возникновении эмбриональной смертности [1].
На сегодняшний день в симментальской породе регистрируется 9 селекционно-значимых гаплотипов фертильности и генетических дефектов: арахномелия (A), тромбопатия (TP), бычья субфертильность (BMS), карликовость (DW), врожденный дефицит цинка (ZDL) и с первого по четвертый симментальские гаплотипы (FH1, FH2, FH3, FH4) с частотой встречаемости 0,3–9 % [9].
Гаплотип FН4 локализован на 12-й бычьей хромосоме (BTA12) в области 10,859,75912,805,107 (UMD3.1 genome assembly). Показано, что нуклеотидная замена А→Gв позиции 11102143 SUGT1 (rs110793536, ARS-UCD1.2) ассоциирована с эмбриональной смертностью и смертью потомства в первые недели жизни, при этом аллель G является нежелательным [1, 10].
Частота встречаемости гаплотипа варьируется от 2,9 до 5 % [1, 11, 12].
Распространению гаплотипов фертильности способствует то, что их носители – выдающиеся быки-производители, наиболее интенсивно используемые в системе искусственного осеменения. Кроме того, передача мутантного гена потомству может быть осуществлена через мать, являющуюся носителем мутации в гетерозиготной форме. Однако генотипирование самок позволит более точно идентифицировать животных-носителей мутации. Последующее предотвращение спаривания носителей будет способствовать снижению потери телят и повышению экономической эффективности отрасли в целом [2].
Одним из ключевых элементов по выявлению наследственных аномалий является организация и проведение системного генетического скрининга, предоставляющего возможность определения статуса племенных животных на наличие наследственных дефектов, контроля за их распространением, разработки программ, направленных на их элиминацию как в стадах, так и в хозяйствах в целом [13].
Цель исследования : разработка тест-системы методом ПЦР в реальном времени для диагностики и изучения путей распространения FH4 в популяции крупного рогатого скота симментальской породы.
Материал и методы исследования. Исследование выполнено на образцах ДНК, выделенных из ткани коров (n = 180) племенного завода Орловской области и спермы быков-производителей (n = 239) симментальской породы племенных организаций Воронежской, Орловской, Липецкой, Калужской, Московской областей, республик Татарстан, Хакасия и Алтайского края.
В выборку вошли быки-производители 1981– 2015 гг. рождения и коровы 2000–2011 гг. рождения в возрасте 2,9 лактации с показателями молочной продуктивности за 305 дн. наивысшей лактации (2,3 лакт.) – 5499 кг молока с МДЖ и МДБ 4,10 и 3,21 % соответственно.
Геномную ДНК выделяли с использованием набора реагентов для выделения «ДНК-Экстран-2» (ООО «Синтол», Россия), согласно рекомендациям производителя.
Для определения полиморфизма в гене SUGT1 изначально была создана референтная выборка животных (n = 50) с известными генотипами с помощью метода полимеразной цепной реакции с последующим анализом полиморфизма длин рестрицированных фрагментов (ПЦР-ПДРФ) [14].
Подбор праймеров осуществляли с использованием программного обеспечения Primer3web, v. 3.0.0 [15]. В качестве эндонуклеазы рестрикции использовалась Msp1. Продукты ПЦР-ПДРФ анализа разделяли посредством электрофореза в 3 % агарозном геле с добавлением димидиума бромида до конечной концентрации 30 нг/мкл и визуализировали в УФ-свете. Для идентификации длин фрагментов использовали молекулярный маркер длины 50 п.н. (ООО «Биосан», Россия).
Для разработки тест-системы в режиме реального времени подбор праймеров и зондов к гену SUGT1 осуществляли через базу данных Генбанк полноразмерные последовательности гена SUGT1 [16] . Видоспецифичность праймеров была проверена in silico с использованием программы BLASTN [17].
Результаты исследования. Работа тест-системы основана на принципе TaqMan [18].
Сравнение скорости накопления продуктов амплификации по кинетическим кривым в исследуемых образцах (специфические фрагменты ДНК) позволяет определить генотип животных по гену SUGT1 . Для определения AA и AG аллелей используются 2 канала – R6G и FAM. Нормальный A аллель дает рост сигнала по каналу FAM , а мутантный аллель G – по каналу R6G [14].
Амплификацию проводили в конечном объеме 15 мкл реакционной смеси, содержащей 1хПЦР буфер (20 мМ (NH4)2SO4, 75 мМ Трис-HCl, pH=8,8, 0,1 % (v/v) Tween 20, 1,67 мМ MgCl2,), 0,25 мМ дНТФ, 10 пкМ каждого из праймеров, 10 пкМ каждого зонда, 1 Ед. Taq-полимеразы и 1 мкл тестируемой ДНК (50–500 нг/мкл).
Данный генетический фактор (FH4) наследуется по аутосомно-рецессивному типу. Это означает, что животное может быть полностью здоровым и иметь в своем генотипе два желательных аллеля АА (рис., А). Животное может быть скрытым носителем, и тогда в генотипе будет содержаться один желательный и один мутантный аллель AG (рис., Б). При использовании такого животного в разведении 50 % потомков получат аллель G. Распространение заболевания связано с тем, что гетерозиготные животные фенотипически не отличаются от здоровых, поэтому селекция по фенотипу не приводит к выбраковке носителей мутации.
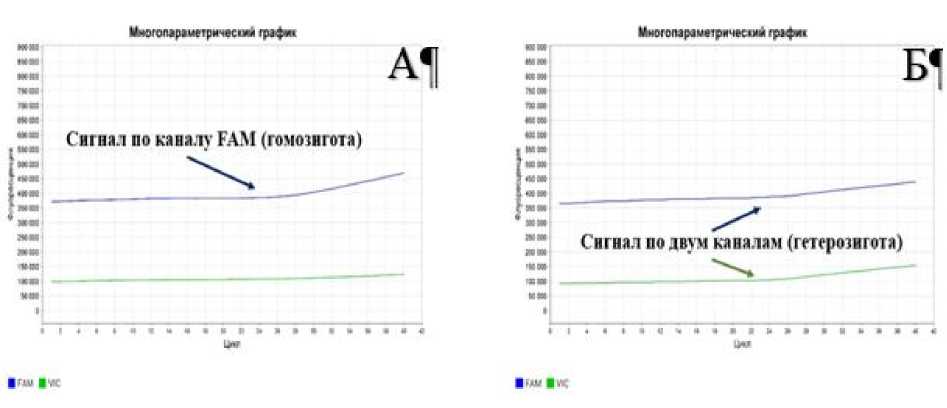
Детекция результатов генотипирования животных в режиме реального времени по характеру кривых флуоресценции: А – генотип АА; Б – генотип AG
Животное, имеющее в своем генотипе два нежелательных аллеля (GG) не жизнеспособно.
По результатам генотипирования в исследуемой группе быков симментальской породы оказалось 15 скрытых носителей FH4, происходящих из линий Редада 711620016730, Хонига 803610032, Страйка 979322326, Польцера 803608138 и Целота 929105907; в группе коров – 4 скрытых носительницы, отцами которых были быки-производители Вальтер 644662345 (л. Флориана 374), Мыльный 1405 (л. Фасадника 642), Марс 3659 (л. Неолита 8593).
В заявленной выборке животных не был диагностирован гомозиготный вариант GG по причине эмбриональной смертности потомства.
Частота генотипа АА составила 93,7 и 97,7 % в группах быков и коров соответственно, в среднем по выборке – 95,5±0,010 %. Частота встречаемости аллеля G фиксировалась на уровне 0,032 у быков и 0,012 у коров соответственно и в среднем по исследованной выборке составила 0,023±0,007 % (табл.).
Распределение частоты встречаемости вариантов гена SUGT1
|
Группа |
Кол-во |
Частота генотипов, % |
Частота аллелей |
||
|
AA |
АG |
G |
A |
||
|
Быки |
239 |
93,7 ±0,016 (n=224) |
6,3 (n=15) |
0,032±0,011 |
0,968 |
|
Коровы |
180 |
97,7 ±0,011 (n=176) |
2,3 (n=4) |
0,012±0,008 |
0,988 |
|
Всего |
419 |
95,5 ±0,010 (n=400) |
4,5 (n=19) |
0,023±0,007 |
0,977 |
Выводы. Таким образом, проведенное исследование показало эффективность разработанной тест-системы в выявлении полиморфизма в гене SUGT1 , ассоциированного с фертильностью, а именно из 419 животных симментальской породы, оказавшихся в выборке, 4,5 % являлись носителями гаплотипа FH4 , а частота встречаемости аллеля G в изучаемой популяции была на уровне 0,023.
Системная организация скрининговых мероприятий позволит осуществлять идентификацию летальных генетических дефектов в воспроизводительной части стада до случной кампании. Данный подход обеспечит участие в селекционном процессе только тех животных, которые не имеют генетического груза.
Список литературы Диагностика гаплотипа FH4 у крупного рогатого скота симментальской породы с использованием системы ПЦР в реальном времени
- Pausch H., Schwarzenbacher H., Burgstaller J., Flisikowski K., Wurmser C., Jansen S., Jung S., Schnieke A., Wittek T., Fries R.: Homozygous haplotype deficiency reveals deleterious mutations compromising reproductive and rearing success in cattle. BMC Genomics. 16: 312. 2015; Pubmed reference: 25927203. DOI: 10.1186/s12864-015-1483-7
- Зиновьева Н.А., Олейник С.А., Злыднев Н.З., Морозов В.Ю. Гаплотипы фертильности голштинского скота // Сельскохозяйственная биология. 2016. Т. 51, № 4. С. 423-435.
- Трухачев В.И. Методические рекомендации по оптимизации селекционно-технологических элементов при производстве молока / Ставропольский гос. аграр. ун-т. Ставрополь, 2017. 71 с.
- Wu Y., Fan H., Wang Y., Zhang L., Gao X., Chen Y., Li J., Ren H.Y., Gao H. Genome-Wide Association Studies Using Haplotypes and Individual SNPs in Simmental Cattle. Published: October 20, 2014. DOI: 10.1371/journal.pone.0109330
- R306 FH4 MUTATION. URL: https://www.vhlgenetics.com/en-gb/DNA-tests/Catalog/Details/Cattle/R306-FH4-mutation (дата обращения: 07.07.2020).
- Bai C., Sen P., Hofmann K., Ma L., Goebl M., Harper J.W. et al. SKP1 connects Cell cycle regulators to the ubiquitin proteolysis machinery through a novel motif, the F-box. Cell. 1996; 86: 263-74. PMID:
- DOI: 10.1016/s0092-8674(00)80098-7 ISBN: 8706131
- Kitagawa K., Skowyra D., Elledge S.J., Harper J.W., Hieter P. SGT1 encodes an essential component of the yeast kinetochore assembly pathway and a novel subunit of the SCF ubiquitin ligase complex. Mol Cell. 1999; 4(1):21-33.
- DOI: 10.1016/s1097-2765(00)80184-7
- Shirasu K., Schulze-Lefert P. Complex formation, promiscuity and multi-functionality: protein interactions in disease-resistance pathways. Trends of Plant Science. 2003; V. 8: 6. P. 252- 258.
- DOI: 10.1016/S1360-1385(03)00104-3
- URL: https://www.mos-bulls.ru/docs/Noginsk_2017_pdf/10_28_07_2017_Zinovyeva_N_A.pdf (дата обращения: 14.04.2020 г.).
- Локализация мутации в гене, SNP-замена. URL: http://www.ensembl.org/Bos_taurus/Varia-tion/Explore?r=12:11101643-11102643;v=rs110793536;vdb=variation;vf=68925259 (дата обращения: 14.04.2020 г.).
- Форнара М.С., Костюнина О.В., Филипченко А.А. и др. Система определения полиморфизма SUGT1, ассоциированного с гаплотипом фертильности симментальского скота FH4 // Ветеринария, зоотехния и биотехнология. 2019. № 3. С. 92-97.
- Трухачев В.И., Злыднев Н.З., Олейник С.А. и др. ДНК-диагностика наследственных заболеваний молочного скота // Фермер. Черноземье. 2018. № 9 (18). С. 52-56.
- Патентная заявка № 2020122247 от 06.07.2020 г. Способ диагностики полиморфизма SUGT1, обуславливающего гаплотип фертильности (FH4) крупного рогатого скота симментальской породы. URL: https://www1.fips.ru (дата обращения: 17.08.2020).
- Подбор праймеров в онлайн-режиме. URL: http://primer3.ut.ee (дата обращения: 27.05.2020).
- Полноразмерная последовательности гена SUGT1. URL: http://www.ncbi.nlm.nih.gov/genbank (дата обращения: 11.05.2020).
- Проверка видоспецифичности праймеров. URL: http://blast.ncbi.nlm.nih.gov/Blast.cg (дата обращения: 17.04.2020).
- Holland P.M., Abramson R.D., Watson R., Gelfand D.H. Detection of specific polymerase chain reaction product by utilizing the 5'-3' exonuclease activity of Thermus aquaticus DNA polymerase // PNAS August 15, 1991 88 (16) 7276-7280;
- DOI: 10.1073/pnas.88.16.7276


