Диагностика и лечение медуллярного рака щитовидной железы
Автор: Исаев П.А., Ильин А.А., Медведев В.С., Семин Д.Ю., Полькин В.В., Дербугов Д.Н., Васильков С.В., Чеботарева И.В.
Рубрика: Научные статьи
Статья в выпуске: 3 т.22, 2013 года.
Бесплатный доступ
В работе проанализированы результаты лечения 85 больных медуллярным раком щитовидной железы в возрасте от 7 до 78 лет. Анализ отдалённой выживаемости выявил отрицательное влияние таких факторов, как наличие экстратиреоидной инвазии первичной опухоли, регионарное и отдалённое метастазирование (р
Медуллярный рак щитовидной железы, диагностика, лечение
Короткий адрес: https://sciup.org/170170114
IDR: 170170114
Текст научной статьи Диагностика и лечение медуллярного рака щитовидной железы
Медуллярный рак щитовидной железы (МРЩЖ) является наиболее агрессивно протекающей опухолью, исходящей из С-клеток и составляющей в структуре злокачественных новообразований щитовидной железы (ЩЖ) 4-10% [4]. Скрытое течение МРЩЖ приводит к тому, что более чем у половины больных к моменту установления диагноза определяются регионарные метастазы [6]. На ранних стадиях МРЩЖ не имеет специфических клинических признаков, поэтому для его выявления приходится проводить дифференциальную диагностику с другими опухолевыми и неопухолевыми заболеваниями ЩЖ [9].
Наиболее эффективным методом лечения является хирургический [1]. Однако данные литературы об объёмах операции на первичном очаге и регионарных лимфатических узлах противоречивы. Так, многие исследователи применяют тиреоидэктомию с центральной лимфо-диссекцией [2, 7]. Другие предлагают органосохраняющие операции, при условии раннего выявления МРЩЖ [1]. Некоторые авторы говорят о высокой склонности МРЩЖ к регионарному распространению и поэтому считают целесообразным выполнение расширенного объёма операции, вплоть до обязательной профилактической двухсторонней модифицированной или радикальной лимфодиссекции [3]. Имеющиеся в литературе сведения об эффективности дистанционной гамма-терапии неоднозначны и противоречивы [5, 8]. Нерешённость этих вопросов определяет необходимость проведения работ по комплексной оценке эффективности методов диагностики и лечения данной патологии.
Исаев П . А . – вед . научн . сотр ., д . м . н .; Ильин А . А . – вед . научн . сотр ., д . м . н .; Медведев В . С . – зав . отделением , д . м . н .; Сёмин Д . Ю . – врач , к . м . н .; Полькин В . В . – ст . научн . сотр ., к . м . н .; Дербугов Д . Н . – врач .; Васильков С . В .* – научн . сотр .; Чеботарева И . В . – врач . ФГБУ МРНЦ Минздрава России .
Материалы и методы
В основу настоящей работы положены наблюдения за 85 больными, которые находились на обследовании и лечении в клинике МРНЦ с сентября 1999 г. до настоящего времени. Распространённость опухоли оценивали согласно Международной классификации (р)ТNM (UICC/AJCC, 2002). Возраст больных колебался от 7 до 78 лет, составляя в среднем 42,1±1,6 лет. Мужчин было 30, женщин – 55. У 81% (69 из 85) пациентов диагностирована спорадическая форма, у 19% (16 из 85) – семейная форма МРЩЖ.
При поступлении в клинику больным проводили комплексное клинико-инструментальное обследование с обязательным ультразвуковым исследованием (УЗИ) шеи, с тонкоигольной аспирационной биопсией (ТИАБ) первичной опухоли и, при подозрении на метастазы, регионарных лимфатических узлов, с последующим цитологическим исследованием.
Для изучения возможности использования значимости тиреокальцитонина (ТКТ) в дифференциальной диагностике МРЩЖ с различными заболеваниями ЩЖ и оценки распространённости опухолевого процесса был определён его уровень в сыворотке крови до и после операции у 178 больных: у 43 пациентов с МРЩЖ, 48 – раком ЩЖ (РЩЖ) из А- и В-клеток, 43 – с фолликулярной аденомой и у 44 – с узловым зобом. Определение концентрации ТКТ в сыворотке крови выполнялось иммуннорадиометрическим методом с использованием наборов ELSA-hCT фирмы CIS-bio International (Франция). Исследование проводилось в дублях, чувствительность метода составляла 0,5 пг/мл, диапазон нормальных значений варьировал от 0 до 10 пг/мл.
Хирургическое лечение было проведено 97% (82 из 85) больным МРЩЖ. Из них 42 пациента первично оперированы в нашей клинике, остальные 40 пациентов – в других лечебных учреждениях. 45% (38 из 85) больных МРЩЖ по плану комбинированного и симптоматического лечения осуществляли дистанционную лучевую терапию (ДЛТ) на гамма-терапевтических установках «Рокус» и «Агат Р». Показаниями к лучевому лечению были обширность местного и регионарного процесса, отдалённого метастазирования.
Описательный анализ был проведён с помощью статистического пакета GraphPad (версия 3). Одномерный статистический анализ выполняли с помощью таблиц сопряжения с использованием теста ранговой корреляции Спирмана и точного теста Фишера (Fisher’s exact test), с вычислением отношения шансов OR (Odds ratio). Все статистические расчёты проводили с оценкой границ 95% доверительных интервалов. Многофакторный анализ влияния переменных на переменную результата производили методом логистической регрессии. Различие признавалось достоверным при условии p<0,05 и не включения значения 1,0 в диапазон 95% доверительных интервалов соотношения рисков HR (Hazard ratio). Для выполнения статистических расчётов использовалась программа SPSS, версия 17 (SPSS Inc., Chicago, IL, USA).
Результаты обследования
У 52% (44 из 85) больных, поступивших в клинику, были установлены III и IV стадии опухолевого процесса. В 60% (51 из 85) наблюдений были обнаружены регионарные, а у 19% (16 из 85) – отдалённые метастазы. Выход опухоли за пределы капсулы ЩЖ и инвазия окружающих анатомических структур выявлена у 31% (26 из 85) больных. Период от проявления первых признаков заболевания до обращения к врачу составил в среднем полтора года.
На дооперационном этапе ведущую роль в диагностике играло ультразвуковое исследование с последующим цитологическим исследованием биопунктата, выполненного тонкой иглой, позволившего в 83% (47 из 57) наблюдений распознать злокачественный характер заболевания. Чётко верифицировать морфологическую форму опухоли удалось только в 37% (21 из 57) случаев.
Использование иммунорадиометрического метода определения уровня ТКТ сыворотки крови резко повышало достоверность дооперационной диагностики. Повышенный уровень ТКТ в сыворотке крови до начала лечения был выявлен у 95% (83) больных МРЩЖ. Концентрация ТКТ у больных МРЩЖ в десятки раз превышала нормальные значения и была достоверно выше по сравнению с аналогичным показателем у 48 больных РЩЖ из А- и В-клеток и у больных контрольных групп (43 – фолликулярной аденомой и 44 – узловым зобом). Оценка уровня ТКТ может являться критерием эффективности лечения. Так, у 38 больных, у которых уровень ТКТ после проведённого лечения нормализовался, в течение последующих 2,8±1,3 лет рецидива опухоли не отмечено. Уровень опухолевого маркера во всех этих наблюдениях возвратился к норме в сроки от семи дней до трёх месяцев после окончания лечения. У 40 из 45 больных с сохраняющимися высокими значениями ТКТ в сроки 3,5±1,4 года после операции был выявлен рецидив заболевания.
В определении распространённости опухолевого процесса огромное значение имело эхографическое исследование. Только ультразвуковое исследование позволило выявить у 33% (15 из 45) больных, первично обследованных в клинике, опухолевое образование ЩЖ, а поражение лимфатических узлов шеи – у 67% (30 из 45) больных.
При эхографическом исследовании в 22 из 33 наблюдений дополнительные очаги опухолевого роста не нашли отображения, в семи из одиннадцати наблюдений не представилось возможным установить прорастание опухолью капсулы щитовидной железы. В то же время в превентивно удалённых лимфатических узлах центральной и паравазальной клетчатки шеи, расценённых при УЗИ как не поражённых опухолью, метастазы были выявлены в 40% (6 из 15) и 60 (3 из 5) случаев, соответственно.
Не менее важным методом в оценке распространённости опухолевого процесса было рентгенологическое исследование, позволившее выявить метастазы МРЩЖ в легкие (11 больных) и кости скелета (7 пациентов), а при КТ органов грудной клетки поражение лимфатических узлов средостения было обнаружено в 10 наблюдениях.
Большую помощь в оценке распространённости МРЩЖ оказали методы радиоизотопной диагностики, информативность которых превышала в ряде случаев информативность рентгенологического метода. Так, при исследовании с MIBI (methoxyisobutylisonitrile) была уточнена локализация метастазов (выявляемых как «горячие» узлы) в 67% (12 из 18) случаев. Исследование с DMSA (dimercaptosuccinic acid) позволило уточнить локализацию метастазов в 30% (4 из 17) наблюдений. Вместе с тем радиоизотопный метод обладает низкой специфичностью в дифференциальной диагностике МРЩЖ и другой опухолевой и не опухолевой патологии щитовидной железы, поскольку накопление радиофармпрепаратов возможно во всех случаях.
Тот факт, что по данным зарубежной литературы до 30% от всех случаев МРЩЖ приходится на семейные формы заболевания, сделал необходимым проведение скрининга, который включал в себя сбор анамнестических данных, клиническое и инструментальное обследование родственников пациентов. Это позволило выявить МРЩЖ у 16 (19%) пациентов в возрасте до 35 лет, членов восьми семей. У 11 из них были выявлены регионарные, у 2 – отдаленные метастазы. У больных с семейной формой МРЩЖ во всех случаях имелось поражение обеих долей ЩЖ с множественными опухолевыми фокусами, располагавшимися в основном в средней части органа и участками С-клеточной гиперплазии. Проведение молекулярно-биологического исследования позволило подтвердить наследственные мутации RET (Rearranged during transfection) – протоонкогена во всех наблюдениях. Дальнейшее проведение исследования в семьях этих больных позволило на этапе доклинических проявлений заболевания выявить аналогичные мутации еще у пяти детей.
Результаты лечения
В нашем исследовании 82 больным МРЩЖ были проведены различные по объёму операции на ЩЖ, которые в 60% (49 из 82) случаев были дополнены вмешательством на регионарных лимфоколлекторах шеи (табл. 1).
Таблица 1 Объём хирургического вмешательства
|
Вмешательство на лимфоколлекторе |
Вмешательство на первичном очаге |
Всего (абс.ч., %) |
|||
|
Энуклеация |
ГТЭ |
СТЭ |
ТЭ |
||
|
Диссекция ЦК шеи |
- |
- |
3 |
10 |
13 (16%) |
|
ФФИ + диссекция ЦК шеи |
- |
3 |
5 |
28 |
36 (44%) |
|
Не выполнялась |
4 |
11 |
8 |
10 |
33 (40%) |
|
Итого (абс. ч., %) |
4 (5%) |
14 (17%) |
16 (20%) |
48 (58%) |
82 (100%) |
Примечание: ГТЭ – гемитиреоидэктомия; СТЭ – субтотальная тиреоидэктомия; ТЭ – тиреоидэктомия; ЦК шеи – центральная клетчатка шеи; ФФИ – фасциально-футлярное иссечение.
После первично проведённого хирургического лечения в сроки от трёх месяцев до пяти лет у 48% (40 из 82) больных МРЩЖ был установлен рецидив опухоли. У 28% (11 из 40) он был выявлен одновременно как в оставшейся ткани ЩЖ, так и в лимфатических узлах шеи, а у 72% (29 из 40) – только в регионарных лимфатических узлах. Наибольшее число местных рецидивов возникло после энуклеации – в 75% (в 3 из 4) наблюдений, после гемитиреоидэктомии – у 43% (6 из 14) и после субтотальной тиреоидэктомии – у 12% (2 из 16) больных. Это объясняется тем, что для МРЩЖ характерна диссеминация процесса по ткани ЩЖ. В нашем исследовании множественные дополнительные очаги были выявлены у 51% (43 из 85) пациентов. При спорадической форме интратиреоидная диссеминация имела место у 39% (27 из 69) больных, а при семейной – в 100% (16) наблюдений. В то же время на дооперационном этапе обследования и при осмотре макропрепарата во время операции дополнительные очаги МРЩЖ удалось выявить только в 33% (11 из 33) случаев. Интратиреоидная диссеминация была выявлена у 41% (17 из 41) больных с начальными стадиями заболевания (рТ1-рТ2) и у 59% (26 из 44) – с распространёнными формами МРЩЖ (рТ3-рТ4). Анализ полученных данных показал, что при всех стадиях МРЩЖ оптимальным объёмом операции на первичном очаге является тиреоидэктомия.
Вместе с тем, наибольшее число рецидивов МРЩЖ (36 случаев) возникло в регионарных лимфатических узлах, что свидетельствует о недостаточной оценке поражения лимфоколлек-тора на дооперационном этапе обследования, и, как следствие этого, выполнение нерадикального объема операций.
Для МРЩЖ характерно раннее и обширное метастазирование. Так, при размерах первичного очага до 1см (рТ1) метастазы в лимфоузлы шеи были выявлены после первого хирургического вмешательства и после реопераций по поводу регионарных рецидивов в восьми из десяти наблюдений.
Поражение лимфатических узлов центральной клетчатки шеи наблюдалось столь же часто, в 65% (32 из 49) случаев, как и поражение паравазальных лимфоузлов шеи, в 67% (33 из 49) наблюдений. Следует отметить, что размеры опухоли более 3 см и выход её за пределы капсулы ЩЖ явились факторами, негативно влияющими на регионарное метастазирование. Так, при размерах первичного очага более 3 см метастазы МРЩЖ в паравазальную клетчатку шеи были выявлены в 76% (28 из 37) случаев, а при экстратиреоидной инвазии – в 100% (26) наблюдений. Рецидив МРЩЖ в паравазальных лимфоузлах, расценённых на первом этапе лечения как не поражённые (при эхографическом исследовании), был выявлен в 15% (3 из 20) случаев при размерах опухоли менее 2 см в диаметре. В 37% (9 из 24) – при размерах первичного очага более 2 см в диаметре (рис. 1).
Размер первичного очага
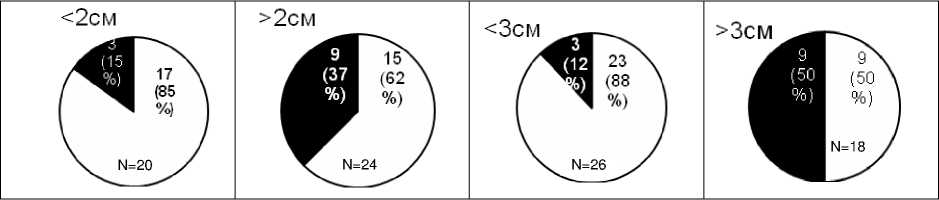
– число больных с рецидивом МРЩЖ; – без рецидива; N – общее число больных.
Рис . 1. Частота регионарного рецидива в паравазальных лимфатических узлах шеи в зависимости от размеров опухоли.
На рис. 1 видно, что наибольшая частота возникновения рецидивов в лимфоузлах пара-вазальной клетчатки шеи (даже при отсутствии клинических признаков их метастатического поражения) отмечена в группе больных с опухолями более 3 см.
Для изучения влияния объёмов хирургического вмешательства на частоту рецидивов МРЩЖ мы условно разделили больных на две сопоставимые группы.
В первую группу, обозначаемую как «органосохраняющие операции», включили пациентов, объём хирургического вмешательства у которых заключался в удалении только части ЩЖ, либо – тиреоидэктомии, но без регионарной лимфодиссекции. Во вторую группу включили пациентов с «условно-радикальными» хирургическими вмешательствами. Они заключались в тиреоидэктомии и различных объёмах регионарной лимфодиссекции: иссечении центральной клетчатки шеи у 26% (10 из 38) больных и фасциально-футлярном иссечении с одновременным удалением центральной клетчатки шеи у 74% (28 из 38) больных (табл. 2).
Таблица 2
|
Показатель |
Объём хирургического вмешательства |
||
|
ОС |
УР |
||
|
Число больных |
44 |
38 |
|
|
Пол |
Мужчины |
13 |
16 |
|
Женщины |
31 |
22 |
|
|
Медиана возраста больных, лет |
44,2±2,2 |
40,2±2,6 |
|
|
Стадия |
I – II, абс. ч., (%) |
18 (41%) |
14 (37%) |
|
III – IV, абс. ч., (%) |
26 (59%) |
24 (63%) |
|
|
Безрецидивное течение |
17 (39%) |
25 (66%) |
|
ОС – органосохраняющие операции, УР – условно-радикальные операции.
Распределение больных в зависимости от объёма операции
В первой группе безрецидивное течение было прослежено у 39% (17 из 44) больных, во второй – у 66% (25 из 38) пациентов, р<0,05.
Частота рецидивов МРЩЖ в регионарных лимфатических узлах в зависимости от стадии опухолевого процесса и объемов хирургического вмешательства представлена в таблице 3.
Рецидив МРЩЖ в регионарных лимфатических узлах
Таблица 3
|
Объём операций |
Стадия МРЩЖ |
n |
Число больных с рецидивами рака в лимфоузлах шеи, абс. ч, (%) |
|
|
ОС |
I–II |
18 |
4 |
24 (55%) |
|
III-IV |
26 |
20 |
||
|
УР |
I–II |
14 |
0 |
12 (31%) |
|
III-IV |
24 |
12 |
||
ОС – органосохраняющие операции, УР – условно-радикальные операции.
У пациентов с начальными стадиями (I-II) МРЩЖ после «органосохраняющих операций» рецидив заболевания был выявлен в 22% (4 из 18) случаев. Среди больных, поступивших на поздних стадиях (III-IV), было установлено прогрессирование метастатического процесса в лимфатических узлах шеи в 77% (20 из 26) наблюдений. У пациентов с начальными стадиями (I-II) после «условно-радикальных операций» рецидив заболевания не выявлен. Вместе с тем, у больных, поступивших на поздних стадиях опухолевого процесса (III-IV), несмотря на выполненную лимфодиссекцию центральной клетчатки шеи, рецидив метастатического процесса в паравазальных лимфатических узлах был выявлен в 50% (12 из 24) случаев. Это свидетельствует о недостаточной оценке распространённости опухолевого процесса на дооперационном этапе обследования и, как следствие этого, выполнение неадекватного объёма хирургического вмешательства.
Дистанционная гамма-терапия была проведена 45% (38 из 85) больных медуллярным раком щитовидной железы. У 71% (27 из 38) больных дистанционная гамма-терапия была выполнена на втором этапе комбинированного лечения, в связи с неуверенностью в радикализме хирургического вмешательства. В зону облучаемых тканей включались область ложа щитовидной железы и боковой лимфоколлектор шеи. Суммарная очаговая доза колебалась от 44 до 60 Гр.
После окончания лечения в сроки от трёх месяцев до пяти лет (2,7±1,1 лет) в 63% (17 из 27) наблюдений в области ложа удалённой щитовидной железы (3) и регионарного лимфоколлек-тора (14) выявлены рецидивы. У всех этих больных после хирургического лечения уровень тиреокальцитонина в сыворотке крови продолжал оставаться на прежних цифрах, и в последующем проведённая дистанционная гамма-терапия не оказала существенного влияния на снижение его уровня. Вместе с тем, у 37% (10 из 27) пациентов с нормальным уровнем тиреокальцитонина в сроки от трёх месяцев до шести лет (3,3±0,9 лет) рецидивов не наблюдалось.
У шести больных с местнораспространёнными формами МРЩЖ (рТ3-рТ4) с целью девитализации опухоли дистанционная гамма-терапия была проведена на первом этапе комбинированного лечения. Облучение проводили в режиме традиционного фракционирования по 2 Гр пять раз в неделю до суммарной очаговой дозы 40 Гр. В течение ближайшего года после окончания комбинированного лечения у пяти больных были выявлены одновременно регионарные и отдалённые метастазы, а у одного – только регионарные метастазы.
У пяти больных с местнораспространёнными опухолями и отдалёнными метастазами МРЩЖ (в лёгкие, кости) курс дистанционной гамма-терапии был проведён c паллиативной целью. В трёх наблюдениях из-за обширного распространения первичного очага и регионарных метастазов дистанционную гамма-терапию проводили на область ложа щитовидной железы и боковой лимфоколлектор шеи в режиме традиционного фракционирования до суммарной очаговой дозы 60 Гр. После окончания лечения у всех троих пациентов был отмечен продолженный рост опухоли.
У двух больных дистанционную гамма-терапию на область отдалённых костных метастазов проводили с симптоматической целью (разовая очаговая доза – 5 Гр, суммарная очаговая доза – 25 Гр). У одного пациента болевой синдром уменьшился, но у другого боли стали более интенсивными. Анализ данных рентгенологического исследования показал, что у этих больных размеры метастазов до и после проведённой дистанционной гамма-терапии не изменились. Высокий уровень тиреокальцитонина крови сохранялся как до курса ДЛТ, так и после него.
Судьба всех 85 наблюдаемых нами больных МРЩЖ прослежена с момента окончания лечения до настоящего времени. В целом, среди пациентов с этой патологией после проведённого лечения общая выживаемость в течение первого года составила 79% (67), 5 лет – 74% (63) и 10 лет – 66% (56).
Анализ результатов отдалённой выживаемости в зависимости от стадии МРЩЖ показал, что все четыре пациента с I стадией живы и продолжают наблюдаться в течение десятилетнего периода. При II и III стадиях МРЩЖ десятилетняя выживаемость составила соответственно 93,1±4,7% и 69,4±7,6%. Все 16 больных с IV стадией умерли от прогрессирования регионарных и отдалённых метастазов (р<0,05).
Сравнительная оценка общей десятилетней выживаемости в зависимости от степени распространённости МРЩЖ показала, что при стадии опухолевого процесса, соответствующего символу рТ1, она составила 90±9,4% (9), при стадии рТ2 – 80,6±7,1% (25) и при стадии рТ3 – 77,7±9,7% (14), р=0,20. Наличие экстратиреоидной инвазии (рТ4) оказалось фактором, существенно ухудшающим выживаемость больных, и общая десятилетняя выживаемость составила 30,7±9,1% (8) (р<0,01).
При динамическом наблюдении установлено, что у 51 больного с выявленными регионарными метастазами общая десятилетняя выживаемость была значительно ниже, чем у 34 пациентов без метастастатического поражения шейных лимфатических узлов, 37±9,2% (10) при pN1b, 62,5±9,8% (15) при pN1a против 91,1±4,8% (31) при pN0 (р<0,01).
Анализ отдалённой выживаемости в зависимости от объёмов хирургического лечения продемонстрировал, что после тиреоидэктомии, дополненной шейной лимфодиссекцией, общая десятилетняя выживаемость составила 79±6,6% (30), а после «органосохраняющих» операций – 59±7,4% (26) соответственно. Различия были значимыми (р<0,05).
Выводы
-
1. Отсутствие специфических признаков МРЩЖ обуславливает значительные трудности в его диагностике. Комплексное использование ультразвукового исследования, тонкоигольной аспирационной биопсии и последующего цитологического исследования биопунктата позволяет в 83% (47 из 57) случаев распознавать злокачественный характер заболевания и в 37% (21 из 57) наблюдений чётко верифицировать морфологическую форму опухоли, а в 33% (11 из 33) и 36% (7 из 11) соответственно определить интра- и экстратиреоидную диссеминацию.
-
2. ТКТ является высокочувствительным маркером МРЩЖ, определение его в сыворотке крови позволяет повысить уровень дооперационной диагностики этой патологии.
-
3. Семейный скрининг больных МРЩЖ с использованием ультразвукового исследования, тонкоигольной аспирационной биопсии и определения онкомаркеров позволил на этапе доклинических проявлений диагностировать дополнительные случаи заболевания у пяти больных. Определение специфических мутаций в RET-протоонкогене позволяет выявить потенциальных больных на доклиническом этапе развития медуллярного рака.
-
4. Основным методом лечения больных МРЩЖ является хирургический, включающий тиреоидэктомию с вмешательством на лимфатическом коллекторе шеи, объем которого зависит от распространенности опухолевого процесса.
-
5. МРЩЖ – клинически агрессивно протекающее заболевание. Общая выживаемость в течение первого года составила 79% (67), 5 лет – 74% (63) и 10 лет – 66% (56). Основными факторами, негативно влияющими на прогноз заболевания, являются возраст пациентов старше 50 лет, наличие экстратиреоидной инвазии опухоли, регионарные метастазы и высокий уровень ТКТ.
Список литературы Диагностика и лечение медуллярного рака щитовидной железы
- Бржезовский В.Ж., Любаев В.Л. Диагностика и лечение медуллярного рака щитовидной железы//Практическая онкология. 2007. Т. 8, № 1. C. 29-35.
- Демидчик Ю.Е., Колбухов А.Э., Демидчик З.Э. и др. Результаты лечения больных медуллярным раком щитовидной железы у детей//Онкологический журнал. 2008. № 3. C. 44-47.
- Ильин А.А., Румянцев П.О. Диагностика и лечение семейных форм медуллярного рака щитовидной железы//Проблемы эндокринологии. 2000. № 4. C. 19-22.
- Blom C.B., Ceolin L., Romitti M. et al. The rare intracellular RET mutation p.Ser891Ala in an apparently sporadic medullary thyroid carcinoma: a case report and review of the literature//Arq. Bras. Endocrinol. Metabol. 2012. V. 56. P. 586-591.
- Brierley J., Sherman E. The role of external beam radiation and targeted therapy in thyroid cancer//Semin. Radiat. Oncol. 2012. V. 22. P. 254-262.
- La Rosa S., Imperatori A., Giovanella L. et al. Thyroid metastases from typical carcinoid of the lung differentiating between medullary thyroid carcinoma and neuroendocrine tumor metastasis to the thyroid//Thyroid. 2009. V. 19. P. 521-526.
- Mazeh H., Sippel R.S. Surgical management of medullary thyroid cancer//Minerva Endocrinol. 2012. V. 37. P. 329-334.
- Oshiro C., Kamigaki S., Arai T. et al. A case of thyroid medullary carcinoma with multiple painful bone metastases successfully treated with strontium-89 chloride//Gan To Kagaku Ryoho. 2012. V. 39. P. 951-953.
- Trimboli P., Nasrollah N., Amendola S. et al. Should we use ultrasound features associated with papillary thyroid cancer in diagnosing medullary thyroid cancer?//Endocr. J. 2012. V. 30. P. 503-508.


