Диагностика и особенности лечения лёгочного кровотечения
Автор: Владимирова Е.С., Черноусов Ф.А., Котаджян В.Г., Гасанов А.М., Бармина Т.Г., Крамаренко А.И.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 5 т.15, 2025 года.
Бесплатный доступ
Актуальность. Лёгочное кровотечение (ЛК) представляет сложную проблему при различных заболеваниях лёгких. Учитывая высокий уровень смертности (70%) до применения эмболизации, ЛК требует быстрой оценки и стабилизации состояния, защиты дыхательных путей с определением источника кровотечения для радикального вмешательства. Цель исследования: выявление причин лёгочных кровотечений с определением источника и оценкой методов лечения. Объект и методы. В исследование включены 132 поступивших пациента и 17 переведённых в институт с лёгочным кровотечением различной этиологии, госпитализированных в реанимацию (11 человек), торакальное отделение (138 человек), потребовавших диагностики и оказания различной неотложной помощи (ангиографии, эмболизации, ФБС, бронхоблокации, стенирования бронхов. Результаты. Показаны проявления ЛК при различной патологии, проведена диагностика и лечение. Для определения степени тяжести ЛК взята классификация Григорьева Е.Г. (1А, 1Б, 1В, 2А, 2Б, 3А, 3Б). Основным методом диагностики ЛК явились компьютерная томография с внутривенным болюсным контрастным усилением, ФБС, эзофагоскопия, на основании которых и данных клинической картины определена тактика лечения. Оказание неотложной помощи было основано на результатах обследования, включая ангиографию и использование для лечения эндоскопических, миниинвазивных методов (ангиографию, эмболизацию бронхиальных и других артерий, стентирования аорты) и консервативного ведения. Показанием к проведению ангиографии и необходимости выполнения эндоваскулярной эмболизации для пациентов с лёгким или умеренным кровохарканьем явилось кровотечение, не поддававшееся консервативному ведению. Прогноз ЛК зависит от ряда факторов, включая быстроту диагностики и ЭБА, при необходимости проведения бронхоблокации с учётом общего состояния пациента и наличия сопутствующих заболеваний. При неэффективности ЭБА необходим ангиографический поиск с целью выявления дополнительных источников, небронхиальных артерий. Выводы. При ЛК малой и средней интенсивности лечение основано на комплексной диагностике и раннем выявлении ЛК путём ангиографии ЭБА. В случаях массивных ЛК целесообразно выполнять бронхоблокацию в комплексном ведении, а при неэффективности ЭБА необходим ангиографический поиск с целью выявления дополнительных источников кровотечения: небронхиальных артерий. Обеспечение временного гемостаза является целесообразным, чтобы избежать экстренной операции. Высокий рецидив ЛК (50%) и рецидив ЛК (10%) после экстренной эмболизации и эмболизации в анамнезе диктуют необходимость выполнения ЭБА во всех случаях, дополнительный ангиографический поиск, а в последующем проведение лечения патологического процесса.
Лёгочное кровотечение [D011650], кровохарканье [D006469], эмболизация бронхиальных артерий [D004621], бронхиальные артерии [D001981], бронхоскопия [D001999], компьютерная томография [D014057], ангиография [D000792], бронхоэктатическая болезнь [D001987], рак лёгкого [D008175], стентирование дыхательных путей [D015607], бронхиальная окклюзия [D001991], интервенционная радиология [D015642]
Короткий адрес: https://sciup.org/143185335
IDR: 143185335 | УДК: 616.24-005.1-07-08 | DOI: 10.20340/vmi-rvz.2025.5.CLIN.12
Текст научной статьи Диагностика и особенности лечения лёгочного кровотечения
Кровохарканье, лёгочное кровотечение (ЛК) – симптом, связанный с широким спектром заболеваний лёгких, сердца, сосудов, системных заболеваний соединительной ткани [1–7]. В 90% случаев источником массивного кровохарканья является бронхиальные артерии [8, 9]. Бронхиальное русло связано с малым кругом кровообращения на капиллярном и прекапиллярном уровне с последующим развитием значительных анастомозов [10]. Другими источниками ЛК могут быть небронхиальные сосуды и сосуды лёгких.
В зависимости от этиологической причины смертность от ЛК составляет 35–85%, кровотечение из системы лёгочных артерий составляет 5%, в 5% случаев источником ЛК являются небронхиальные коллатеральные артерии, а в оставшихся случаях – системные и другие заболевания [10, 11]. Массивное ЛК встречается редко (5–15%) и определяется как кровопотеря, превышающая 600 мл в сутки или 150 мл в час [12].
Тяжесть кровохарканья варьирует от лёгкой до массивной и может привести к гемодинамической нестабильности и смерти от удушья или шока.
До применения эмболизации бронхиальных артерий (ЭБА) летальность составляла более 70% [7, 13]. Уровень смертности с лёгким кровотечением составлял 2,5%, с умеренным – 6%, с высоким – 38%, а у пациентов с раком и геморрагическим синдромом был более высоким [14]. Непосредственной причиной летального исхода в большинстве случаев является асфиксия кровью. Тяжёлые ЛК требуют обеспечить проходимость дыхательных путей, стабильность гемодинамики, одновременное проведение диагностических и лечебных мероприятий.
Диагностические методы исследования включают рентгеновское исследование, бронхоскопию, компьютерную томографию (КТ). Одни авторы считают, что рентгенография грудной клетки позволяет определить место кровотечения в 45–65% случаев, а причину – в 25–35% [1, 5, 15–18]. Поскольку диагностическая точность рентгенографии при обнаружении кровотечения низкая, то по этой при- чине предпочтительнее использовать визуальный метод – бронхоскопию, которая может обнаружить кровотечение более чем в 90% случаев, и при массивном кровотечении осуществить бронхоблока-цию [19]. Другие авторы считают альтернативным методом КТ с болюсным контрастным усилением [20]. Метод позволяет не только обнаружить ЛК и его причину, но и дать детальную характеристику бронхиальным артериям (место отхождения, ход и диаметр), оценить состояние лёгких и средостения. Если состояние пациента стабильно, можно рассмотреть возможность проведения КТ грудной клетки на первом этапе обследования [16, 22, 23].
Локализованные ЛК требуют местного лечения – бронхоскопии, эмболизации бронхиальных артерий; диффузные, альвеолярные необходимо лечить системно, т.е. в зависимости от причины.
Радикальным и эффективным методом неотложного лечения ЛК является эмболизация бронхиальных артерий (ЭБА) даже при массивном кровохарканье, эффективность наблюдается в 90% случаев [25–29]. Согласно метаанализу, проведённому Karlafti E. и соавт., рецидивы ЛК после ЭБА составляют 21,46% [6]. Одной из причин рецидива ЛК являются пороки развития сосудов лёгких (патологические соустья между двумя системами кровообращения), поэтому необходим анализ и другие подходы на этапах в лечении ЛК.
Таким образом, тактика ведения при ЛК требует быстрой оценки состояния пациента, определения источника кровотечения, защиты дыхательных путей, визуализации для проведения эмболизации бронхиальных артерий и при рецидивах кровотечения поиска других источников.
Цель исследования: выявление причин лёгочных кровотечений с определением источника и оценкой методов лечения.
Объект и методы
В исследование включены 132 поступивших пациента и 17 переведённых в институт с лёгочным кровотечением различной этиологии, госпитализированных в реанимацию (11 человек), торакальное отделение (138 человек), потребовавших диагностики и оказания различной неотложной помощи (ангиографии, эмболизации, ФБС, бронхобло-кации, стенирования бронхов). Возраст пострадавших варьировал от 22 до 86 лет, мужчин было 106, женщин – 43. Все пациенты находились на лечении в институте с января 2021 г. по август 2025 г.
Критерии включения:
-
- лёгочные кровотечения различной степени тяжести (классификация по Григорьеву Е.Г. (1А, 1Б, 1В, 2А, 2Б, 3А, 3Б)), различной этиологии (инфек-
- ции, новообразования и заболевания лёгких, пороки сердца, заболевания сосудов);
-
– впервые возникшие ЛК;
-
– рецидивные ЛК, рецидивные ЛК после эмболизации бронхиальных артерий;
-
– возраст старше 20 лет.
В основу тяжести ЛК были взяты существующие критерии ЛК по Григорьеву Е.Г.
-
1 степень – кровохарканье:
-
• 1А – 50 мл/сутки;
-
• 1Б – 50–200 мл/сутки;
-
• 1В – 200–500 мл/сутки;
-
2 степень – массивное лёгочное кровотечение:
-
• 2А – 30–200 мл/ч;
-
• 2Б – 200–500 мл/ч;
-
3 степень – профузное легочное кровотечение:
-
• 3А – 100 мл одномоментно;
-
• 3Б – более 100 мл одномоментно + обструкция трахеобронхиального дерева, асфиксия.
Массивное и молниеносное ЛК
Всем пациентам на фоне интенсивной гемостатической, заместительной, корригирующей терапии выполняли бронхоскопию, общеклинические лабораторные исследования, рентгенографию грудной клетки в двух проекциях, компьютерную томографию средостения и лёгких, УЗИ грудной полости по показаниям. Во время бронхоскопии диагностировали источник кровотечения в бронхах, осуществляли санацию с удалением сгустков и содержимого просвета бронхов. Одновременно оценивали интенсивность и источник кровотечения, также, непосредственно после санации, выполняли инстилляцию гемостатическими и сосудосуживающими холодными растворами. Оценка интенсивности кровотечения проводилась по модифицированной нами классификации Коржевой И.Ю. по аналогии с классификацией Форрест. Наличие признаков кровотечения в виде следов или формирующейся в течение нескольких минут узкой дорожки крови служило показанием к остановке кровотечения, осуществлялась обтурация бронха. В случае обтурации бронха новообразованием проводилась эндоскопическая реканализация бронха с последующим стентированием.
Рентгенодиагностика включала обзорный и боковой снимки груди, рентгенографию рёбер.
КТ исследования грудной клетки были выполнены по стандартной методике с внутривенным болюсным контрастным усилением (КУ). Область сканирования – от уровня верхней аппертуры грудной клетки до задних рёберно-диафрагмальных синусов. Исследование проводили на высоте спокойного вдоха при полностью задержанном дыхании. После нативного сканирования выполнялось внут- ривенное болюсное КУ с проведением артериальной, венозной и отсроченной фаз.
Прямую ангиографию выполнили в 149 случаях. Исследование проводили на ангиографе GEDiscov-ery. Показанием было наличие признаков лёгочного кровотечения по клиническим данным и КТ. Доступ осуществляли через бедренную или лучевую артерию, используя неионный йодсодержащий контрастный препарат (ультравист 370). В 148 случаях, когда были обнаружены косвенные признаки активного кровотечения, такие как гиперваскуляризация исследуемой области, в 143 случаях выполняли эмболизацию микроэмболами 300–1000 микрон, микроспиралями до достижения выраженного замедления кровотока в проксимальном сегменте бронхиальной артерии и наступления эффекта «стоп контраст» в дистальном русле, и в одном случае наблюдали прямые признаки ЛК, когда контраст поступал в левый бронх. В трёх случаях эмболизация не проводилась из из-за анатомических особенностей бронхиальных артерий, их крайне малого диаметра, выраженной извитости проксимальных сегментов, невозможности селективно катетеризировать бронхиальные артерии без рефлюкса контрастного препарата в аорту, в двух других – из-за выраженного болевого синдрома, в третьем случае после трансплантации лёгких и стентирования долевого бронха на фоне стриктуры на высоте ЛК проводили стентирование аорты.
Эзофагогастродуоденоскопию и трахеоброн-хоскопию у пациентов выполняли с использованием видеогастроскопов и видеобронхоскопов фирмы Olympus на видеосистеме Olympus Exera III с применением оптической хромоскопии для лучшей визуализации патологически изменённых участков слизистой оболочки по стандартной методике. Эндоскопические диагностические исследования выполняли под внутривенной седацией или комбинированной эндотрахеальной анестезией. Для местной анестезии голосовых складок применяли орошение их 2% раствором лидокаина. При рецидивирующих кровотечениях из просвета бронха без видимых источников и повреждений на слизистой оболочке бронхов с целью гемостаза использовали клапанный обтуратор «Медланг», диаметр клапанного обтуратора подбирался в соответствии с диаметром блокируемого бронха.
Методика эндоскопической бронхоблокации и стентирования
Эндоскопическая бронхоблокация основана на том, что после установки клапана в кровоточащей части лёгкого прекращается вентиляция воздухом, в соответствии с феноменом Эйлера Лильестранд-та происходит спазм сосудов лёгочной артерии в этой зоне, кровообращение лёгкого редуцируется и кровотечение останавливается (рис. 1). Механизм действия клапанной бронхоблокации состоит в формировании дренированного ателектаза.
Эндоскопическое стентирование трахеобронхиального дерева выполняли с использованием рентгенологического контроля для лучшего позиционирования стента. При возможности эндоскопической визуализации границ опухолевого стеноза органа отмечали границы с применением рентгеноконтрастных меток, которые крепили к коже грудной клетки пациентов. При декомпенсированных опухолевых стенозах без возможности прямой эндоскопической визуализации протяжённости и границ стеноза первым этапом выполняли контрастирование сужения органа водорастворимым контрастом, что позволяло определить размеры стеноза. Следующим этапом выполняли заведение направляющей струны, положение которой контролировали под R-контролем. По струне-проводнику под R-контролем производили заведение в зону сужения доставочного устройства с са-морасширяющимся стентом с последующей его установкой, контролируя положение стента эндоскопически и рентгенологически.
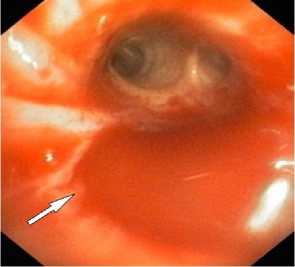
А
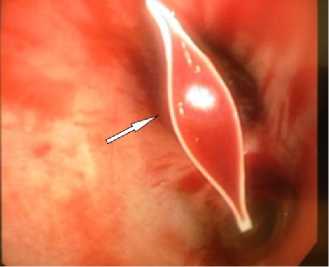
Б
Рисунок 1. Эндо-фото. Признаки лёгочного кровотечения, после эндоскопического гемостаза посредством установки эндобронхиального клапана. А. Кровь в просвете бронха. Б. Просвет бронха с эндобронхиальным клапаном
Figure 1. Endoscopic photograph. Signs of pulmonary hemorrhage after endoscopic hemostasis via endobronchial valve placement. A. Blood in the bronchial lumen. Б. Bronchial lumen with endobronchial valve
Результаты
Первичный осмотр пациента включал оценку общего состояния, дыхательных путей, гемодинамических показателей, исключение любых не лёгочных источников (например кровавой рвоты или носового кровотечения). При сборе анамнеза рецидив ЛК наблюдался в 80 (54%) случаев.
Проведённый анализ 149 пациентов ЛК показал, что инфекционные заболевания лёгких различной этиологии наблюдали в 21 (14,1%) случае: пневмония (6), ТБЦ активная (2) и неактивная формы (6), эхинококкоз (2), аспергиллез (3), абсцесс лёгкого (2).
Согласно литературным данным, причиной ЛК, наблюдаемой при пневмонии, является з олотистый стафилококк (Staphylococcus aureus) , который продуцирует токсин пантона-валентина (ПВЛ) метициллин-чувствительными и резистентными штаммами [30]. Предполагается, что патогенность экзотоксина происходит через мембранный рецептор с последующим связыванием с G-белком, что вызывает адгезию нейтрофилов к эндотелиальным клеткам, расширение капилляров, миграцию лейкоцитов и некроз сосудов.
Таблица1. Причины, тяжесть и оказание помощи при лёгочных кровотечениях Table 1. Causes, severity, and treatment of pulmonary hemorrhages
|
Показатель |
Год |
|||||||
|
2021 |
2022 |
2023 |
2024 |
2025 |
Всего |
|||
|
Количество пациентов, n |
11 |
17 |
44 |
49 |
28 |
149 |
||
|
Пол |
муж. жен. |
8 3 |
11 6 |
29 15 |
37 12 |
21 7 |
106 43 |
|
|
Возраст, лет |
муж. жен. |
55 (33–79) 44 (37–55) |
54,2 (37–73) 67,5 (62–80) |
59,4 (30–86) 58,4 (40–80) |
60 (24–85) 60,3 (42–85) |
61,2 (42–86) 53,6 (33–79) |
57,96 56,76 |
|
|
Инфекции |
Пневмония |
Covid 2 |
1 |
1 |
2 |
6 (4,0%) |
||
|
ТБЦ |
1 |
1 |
2 (1,3%) |
|||||
|
ТБЦ в анамнезе |
1 |
2 |
1 |
2 |
6 (4,0%) |
|||
|
Аспарагиллез лёгкого |
1 |
1 |
1 |
3 (2,0%) |
||||
|
Эхинококкоз лёгких |
1 |
1 |
2 |
|||||
|
Абсцесс лёгкого |
2 |
2 |
||||||
|
Новообразования лёгких |
Рак лёгкого |
2 |
2 |
15 |
18 |
6 |
43 (28,5%) |
|
|
МТС в лёгкие |
1 |
1 |
2 |
|||||
|
Доброкачественное образование бронха |
1 |
1 |
||||||
|
Заболевание лёгких |
Бронхоэктатич. болезнь |
2 |
9 |
7 |
2 |
20 (15,4%) |
||
|
Интерстициальные изменения в лёгких |
1 |
1 |
5 |
4 |
11 (7,4%) |
|||
|
Бронхиолит |
2 |
2 |
||||||
|
Саркоидоз |
2 |
2 |
||||||
|
ХОБЛ |
2 |
2 |
2 |
1 |
7 (4,6%) |
|||
|
Киста лёгкого |
1 |
1 |
2 |
|||||
|
Эрозивный бронхит |
1 |
1 |
2 |
|||||
|
Заболевание сердца |
ХСН, ПИКс, после АКШ |
2 |
1 |
3 |
||||
|
Пороки сердца, сосудов |
1 |
2 |
3 |
|||||
|
Васкулит Рандю-Ослера и Виллебранта |
1 1 |
2 |
||||||
|
AV мальформация |
1 |
2 |
3 |
|||||
|
Другие причины ЛК |
Неясный диагноз после обследования |
1 |
3 |
5 |
6 |
7 |
22(14,7%) |
|
|
Ингаляция щелочью |
1 |
1 |
||||||
|
Аортобронхиальный свищ |
2 |
2 |
||||||
|
Госпитализация |
Поступление в отделение |
8 |
16 |
34 |
38 |
24 |
120 |
|
|
Поступление в реанимацию |
1 |
1 |
2 |
5 |
3 |
12 |
||
|
Переведён из другого стационара в отделение |
1 |
8 |
6 |
1 |
16 |
|||
|
Переведён из другого стационара в реанимацию |
1 |
1 |
||||||
|
Частота ЛК |
Впервые возникшее ЛК |
6 |
5 |
13 |
20 |
10 |
54 (36%) |
|
|
Рецидив ЛК |
6 |
10 |
27 |
25 |
13 |
80 (54%)0 |
||
|
Рецидив ЛК после эмбол. экстр. и в анамнезе |
2 |
3 |
3 |
5 |
2 |
15(10%) |
||
|
Тяжесть ЛК gпо Григорьеву |
ЛК 1 А |
5 |
11 |
39 |
31 |
17 |
103 (69,2%) |
|
|
ЛК 1Б |
1 |
4 |
3 |
9 |
3 |
20 (13,5%) |
||
|
ЛК 1В |
1 |
1 |
2 (1,3%) |
|||||
|
ЛК 2А |
4 |
1 |
4 |
5 |
14 (9,3%) |
|||
|
ЛК 2Б |
1 |
1 |
1 |
2 |
5 (3,3%) |
|||
|
ЛК 3А |
1 |
2 |
3 (2,1%) |
|||||
|
ЛК 3Б |
1 |
1 |
2 (1,3%) |
|||||
|
Показатель |
Год |
|||||||
|
2021 |
2022 |
2023 |
2024 |
2025 |
Всего |
|||
|
Лечение ЛК |
Ангиография |
Эмб.прав бронх.арт |
2 |
7 |
16 |
30 |
13 |
68 (45,1%) |
|
Эмб.лев бронх.арт |
3 |
3 |
13 |
7 |
6 |
32 (21,1%) |
||
|
Эмб.двух бронх.арт |
4 |
2 |
13 |
9 |
6 |
34 (22%) |
||
|
Cтентирование аорты |
1 |
1 (0,6%) |
||||||
|
Эмболиз щитовидн арт |
1 |
1 (0,6%) |
||||||
|
Эмб. двух и трех сосу-дист. вмешательство |
1 |
2 |
1 |
2 |
1 |
7 (4,6%) |
||
|
Эмбол. не проводилась техн., бол. синдром |
1 |
2 |
1 |
1 |
1 |
6 (4,0%) |
||
|
Эндоскопия |
Бронхоблокация |
1 |
3 |
1 |
5 |
3 |
13 (8,7%) |
|
|
Стентирование бронха |
6 |
3 |
2 |
11 (7,3%) |
||||
|
Эндоскопическое иссечение опухоли |
1 |
3 |
4 (2,7%) |
|||||
При активной форме туберкулёза ЛК обычно происходит вследствие изъязвления прилегающих сосудов вблизи очага [31], а у пациентов с туберкулёзом в анамнезе происходит эрозия сосудов и трахеи кальцинированным лимфатическим узлом. Иногда наблюдается бронхоэктазирование вследствие грибковой или другой перенесённой инфекции – в случаях инфицирования Aspergillus fumigatu (50–90%), который, как известно, вызывает сосудистые и паренхиматозные изменения легочной ткани [32].
ЛК при раке лёгкого наблюдалось в 43 случаях (28,5%), ангиографические изменения при этой патологии зависят от локализации опухоли, её распространённости и возникших осложнений [9]. При центральном раке лёгкого кровоснабжение обеднено, но наблюдается умеренная периферическая гиперваскуляризация, которая может появляться при развитии обструктивного пневмонита. Наиболее достоверным ангиографическим симптомом, независимо от варианта кровоснабжения опухоли, является фрагментация периферических ветвей БА.
Среди заболеваний лёгкого в наших наблюдениях преимущественно наблюдали бронхоэктатическую болезнь – 20 (15,4%) случаев, ХОБЛ – 7 (4,6%), эрозивный бронхит – 2 случая. Интенсивное ЛК происходит вследствие разрыва извитых сосудов в бронхиальной артериальной системе и кровеносных сосудах перибронхиального и подслизистого сплетений.
Заболевания сердца наблюдали в 6 (4,6%) случаях. Это были пациенты с пороками сердца и склерозом коронарных артерий.
К заболеваниям сосудов относили васкулиты: Рандю-Ослера (1) и Виллебранта (1), а также и АV-мальфомацию, наблюдаемую в 3 (5,4%) случаях.
В 22 (14,7%) наблюдениях ЛК носило криптогенный характер, несмотря на проведённое обследование. Возможно, в ряде случаев ЛК было следствием курения [33, 34]. Однако это кровотечение может происходить в результате экстравазации крови в альвеолы и чаще возникает у взрослых обычно в возрасте до 30 лет. Клинический спектр идиопатического ЛГ варьирует от бессимптомных случаев до угрожающей жизни острой дыхательной недостаточности [9], одной из причин могут быть пороки развития сосудов лёгких (патологические соустья между двумя системами кровообращения) (рис. 2).
Точный объём кровопотери при ЛК варьирует и в большинстве случаев составляет 100–200 мл. Выбранная нами классификация тяжести ЛК по Е.Г. Григорьеву (табл 1.) позволила дифференцировать лёгкие и опасные для жизни случаи ЛК, чтобы определить стратегию быстрого и правильного лечения, учитывая такие факторы, как гемодинамическая стабильность и риск летального исхода.
Преимущественно это были пациенты, имевшие ЛК 1А – 103 (69,25%) случая – с разнообразной патологией (табл. 1), ЛК 1Б – 20 (13,6%), ЛК 1В – 2 (1,3%). В этой группе превалировала бронхоэктатическая болезнь, ТБЦ в анамнезе, рак лёгких, саркоидоз, инфекционные поражения лёгких, эхинококк (рис. 3). Причиной ЛК 2А послужили у 14 (9,3%) пациентов рак лёгкого, пневмонии после Сovid-инфекции (рис. 4, а), включая и поражение бронхов, язвенный бронхит, состояние после АКШ, опухоль средостения (рис. 6), ЛК неясной этиологии, ЛК 3А и ЛК 3Б соответственно составляли 3 (2,1%) и 2 (1,3%) случая, причиной были бронхоэктатическая болезнь, в анамнезе перенесённые ТБЦ, аорто-бронхиальное соустье (табл. 1).
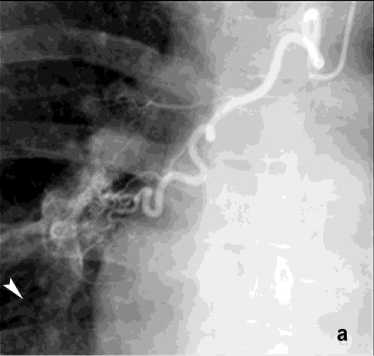
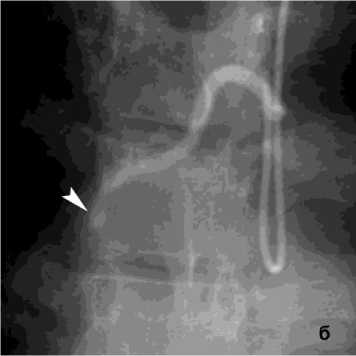
Рисунок 2. Ангиограмма правой БА: а – артерио-венозная мальформация стенки бронха базальных сегментов справа со сбросом в лёгочную артерию, ЛК1Б; б – состояние после эмболизация правой БА цилиндрическими эмболами (800 мкм)
Figure 2. Angiogram of the right bronchial artery (BA): a – arteriovenous malformation of the bronchial wall of the basal segments on the right with shunting into the pulmonary artery, PH grade 1B; б – status post embolization of the right BA with cylindrical embolic particles (800 μm)
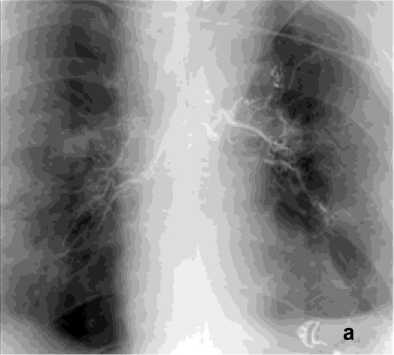
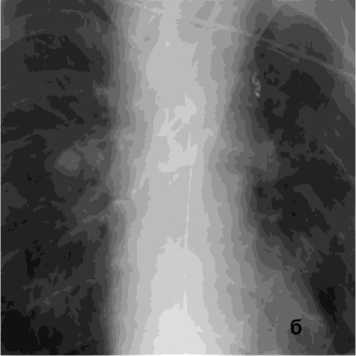
Рисунок 3. Ангиограмма БА у пациента с эхинококком лёгких, ЛК2А: а – выраженная извитость магистрального ствола и периферических отделов БА; б – состояние после эмболизации – окклюзия обеих БА
Figure 3. Angiogram of the BA in a patient with pulmonary echinococcosis, PH grade 2A: a – marked tortuosity of the main trunk and peripheral branches of the BA; б – status post embolization – occlusion of both BAs
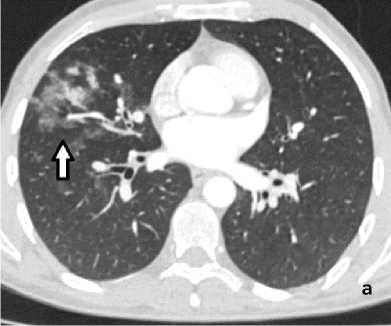
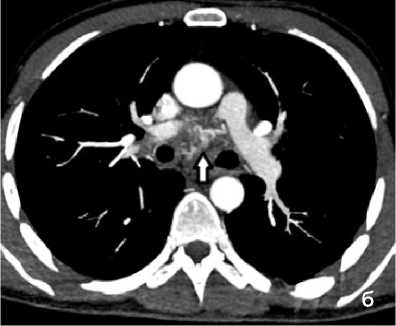
Рисунок 4. КТ грудной клетки с болюсным КУ (артериальная фаза), аксиальные срезы: а (лёгочный режим) – геморрагическое пропитывание в средней доле правого лёгкого (стрелка); б (средостенный режим) – расширение и извитость бронхиальных артерий (сосудистая мальформация – стрелка)
Figure 4. Chest CT with bolus contrast enhancement (arterial phase), axial slices: a (lung window) – hemorrhagic infiltration in the middle lobe of the right lung (arrow); б (mediastinal window) – dilation and tortuosity of bronchial arteries (vascular malformation – arrow)
Основными методами диагностики ЛК являлись рентгенография грудной клетки, фибробронхоско-пия и компьютерная томография (КТ). Заключительным этапом диагностики источника ЛК перед выполнением эмболизации проводили ангиографическое исследование.
При КТ-исследовании косвенным признаком состоявшегося ЛК является геморрагическое пропитывание лёгочной ткани в виде зоны неоднородного повышения плотности от «матового стекла» до мягкотканных значений с визуализаций просвета бронхов (рис. 4, а). Локализация пропитывания в большинстве случаев позволяет установить бассейн повреждённого сосуда. КТ-признаком продолжающего кровотечения является эктравазация контрастного препарата в виде гиперденсивных участков неправильной формы, появляющихся в артериальную фазу (при артериальном кровотечении) и увеличивающихся по размеру в последующие фазы КУ. КТ позволяет выявить не только признаки кровоизлияния, но и в большинстве случаев причину его возникновения (рис. 4, б).
Первым этапом в процессе диагностики бронхоскопии через фибробронхоскоп выполняли промывание трахеи холодным физиологическим раствором, инъекции адреналина (рис. 5). При наличии и доступности определённого источника кровотечения использована электрокоагуляция с ис- сечением опухоли бронха 4 (2,7%), бужирование и стентирование бронха 11 (7,3%). При интенсивном кровотечении в 13 (8,7%) случаях выполняли брон-хоблокацию. Удаление блокатора осуществляли на 5–8 сутки. В одном случае бронхоблокация сочеталась со стентированием аорты. Проведённый анализ ангиограмм позволил выявить косвенные признаки ЛК. В большинстве случаев наблюдалось усиление кровоснабжения зоны поражения независимо от выявленной патологии (рис. 6, а). Локализация сосудистых изменений соответствовала данным, полученным при таких диагностических методах как ФБС и КТ. Эти ангиографические признаки не имеют прямого отношения к ЛК, но достаточно полно характеризуют его причину в силу специфичности семиотики различных лёгочных заболеваний. Прямые признаки экстравазации мы наблюдали в одном случае при наличии аортобронхиального свища (рис. 9, а).
Эмболизация бронхиальных артерий (ЭБА) является радикальным методом лечения ЛК из системы бронхиальных артерий и выполнена в 134 (89,9%) cлучаях. ЭБА часто считается первой линией лечения при массивном ЛК. Эмболизация правой бронхиальной артерии проведена в 68 (45,1%) случаях, левой – в 32 (21,1%), обеих бронхиальных артерий - в 34 (22%) случаях (рис. 6).
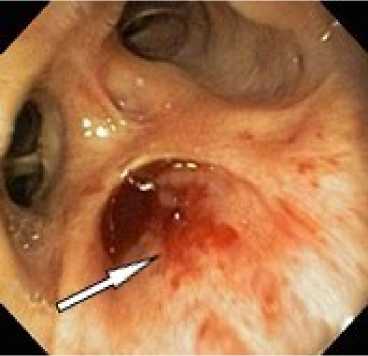
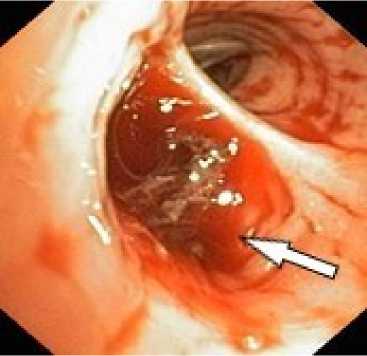
Рисунок 5. Эндоскопическая картина лёгочного кровотечения. Источник кровотечения – бронх В3 справа и средне-долевой бронх правого лёгкого: а – кровь в просвете бронха В3 справа; б – кровь в просвете средне-долевого бронха справа
Figure 5. Endoscopic view of pulmonary hemorrhage. Bleeding source: B3 bronchus on the right and middle lobe bronchus of the right lung: a – blood in the lumen of the right B3 bronchus; б – blood in the lumen of the right middle lobe bronchus
б
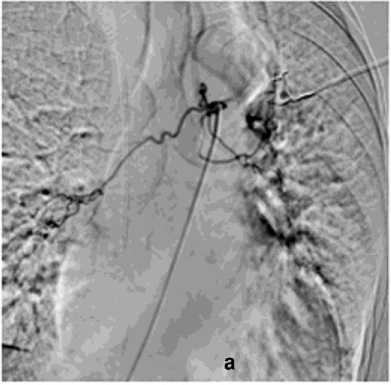
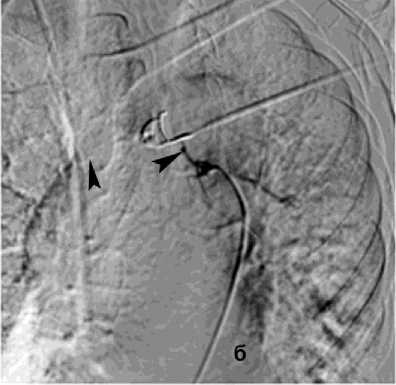
Рисунок 6. Ангиограмма БА у пациента с опухолью заднего средостения и прорастанием лёгкого, ЛК2Б: а – извитость и усиление лёгочного рисунка; б – состояние после эмболизации – окклюзия БА
Figure 6. Angiogram of the BA in a patient with posterior mediastinal tumor and lung invasion, PH grade 2B: a – tortuosity and increased pulmonary vascularity; б – status post embolization – occlusion of the BA
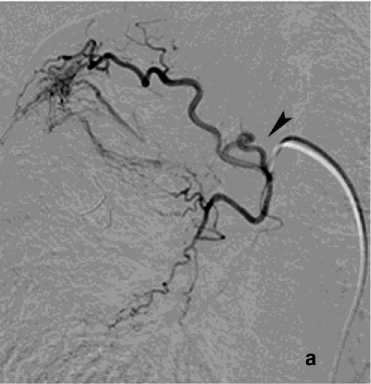
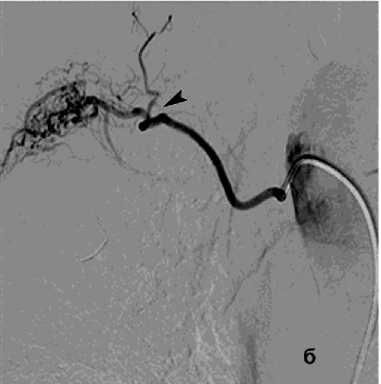
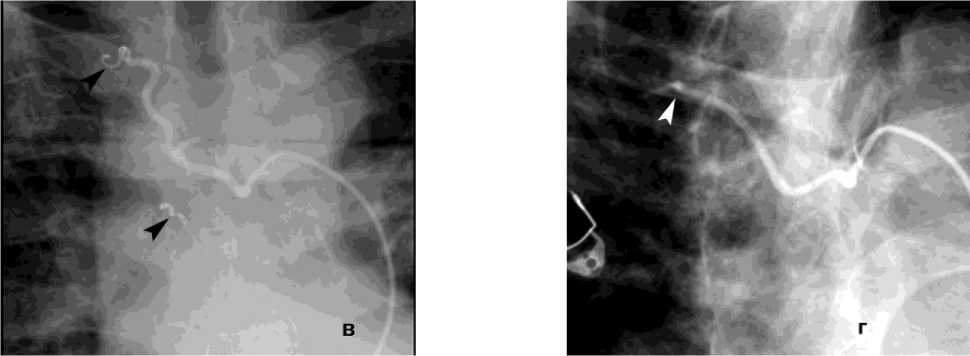
Рисунок 7. Ангиограммы правой бронхиальной артерии (ПБА) и правой межреберной артерии (ПМА) у пациента с кистозным образованием S2 правого лёгкого, ЛК1А: а, б – выраженная гиперваскуляризация дистального русла с ранним венозным сбросом в лёгочные вены; в – состояние после эмболизации ПБА микроспиралями; г – состояние после эмболизации ПМА циллиндрическими микроэмбо- лами (800 мкм)
Figure 7. Angiograms of the right bronchial artery (RBA) and right intercostal artery (RIA) in a patient with a cystic lesion in S2 of the right lung, PH grade 1A: a, б – marked hypervascularization of the distal vascular bed with early venous shunting into the pulmonary veins; в – status post embolization of the RBA with microcoils; г – status post embolization of the RIA with cylindrical microembolic particles (800 μm)
Предполагаемые источники кровотечения эм-болизированы с помощью микросфер, желатиновых губок и спиралей (рис. 8, а, б). Комбинированное применение эндобронхиальной тампонады с эмболизацией бронхиальных артерий выполнено у 13 (8,7%) пациентов и позволило во всех случаях добиться прекращения поступления крови в трахеобронхиальное дерево и избежать асфиксии (рис. 8, в, г).
Рецидив ЛК после эмболизации наблюдался у 15 (10%) пациентов, в 3 случаях из них эмболизация БА была выполнена более года назад. В результате ангиографического поиска выявлены дополнительные источники ЛК: межреберные артерии – 4, внутренняя грудная артерия – 8 (рис. 8), АV – 3 (рис. 7).
Эмболизация бронхиальных артерий не проводилась у 6 (4,02%) пациентов: в 3 случаях из-за выраженного болевого синдрома, а в 3 других – из-за невозможности технического выполнения – вслед- ствие извитости бронхиальной артерии (2) и в одном – после трансплантации лёгких. В этих случаях применяли альтернативные методы, эндобронхиальные силиконовые обтураторы, консервативное ведение, стентирование аорты. Этот комплексный подход способствовал выполнению эффективного гемостаза.
В общей сложности погибло два пациента с аорто-бронхиальными свищами и ЛК3Б. Причиной кровотечения в одном случае у пациентки 86 лет явилось расслоение грудного отдела аорты с прорывом в бронх, в другом – у пациентки 31 года после трансплантации лёгких, стентирования стриктуры левого долевого бронха вызвало в последующим пролежень аорты. После эпизода массивного ЛК пациентам проведён полный комплекс гемостаза, включая стентирование аорты (1), санацию трахеобронхиального дерева (2), бронхоблокацию, на фоне ИВЛ (2) (рис. 9, б).
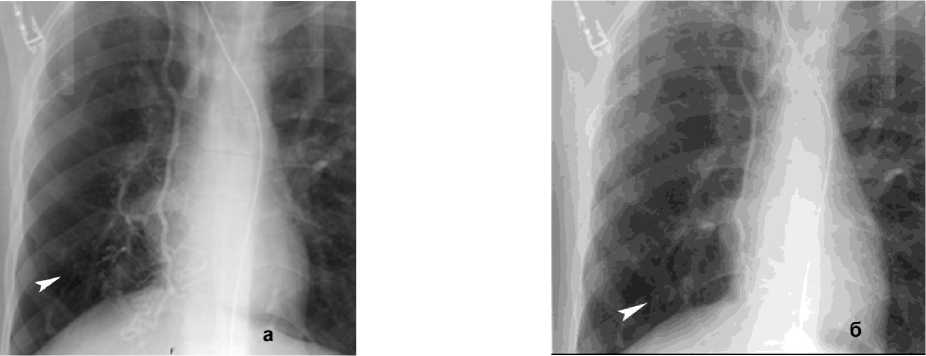
Рисунок 8. Ангиограмма правой внутренней грудной артерии (ПВГА) у пациента с ЛК 2А, клапанная эндоблокация): а – гиперваскуляризация нижней доли правого легкого; б – состояние после эмболизации ПВГА микроэмболами (710–1000 мкм ) – заполнение только ствола ПВГА
Figure 8. Angiogram of the right internal thoracic artery (RITA) in a patient with PH grade 2A (valve endobronchial occlusion): a – hypervascularization of the lower lobe of the right lung; б – status post embolization of the RITA with microembolic particles (710–1000 μm) – filling of the RITA trunk only
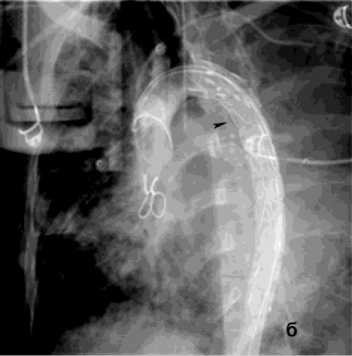
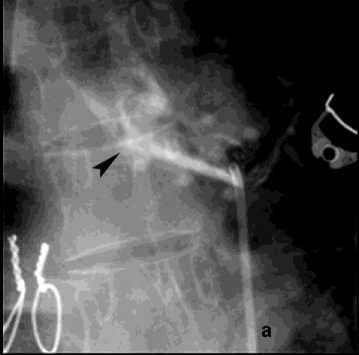
Рисунок 9. Аортография у пациента после трансплантации лёгких, ЛК 3Б: а – аорто-бронхиальный свищ с поступлением контраста в левый главный бронх; б – эндопротезирование нисходящего отдела аорты протезом Ankura TAA2622B160 – без признаков экстравазации
Figure 9. Aortography in a patient after lung transplantation, PH grade 3B: a – aortobronchial fistula with contrast extravasation into the left main bronchus; б – endovascular repair of the descending aorta with Ankura TAA2622B160 stent graft – no signs of extravasation
Таким образом, для пациентов с лёгким или умеренным кровохарканьем при условии эффективного лечения основной причины прогноз благоприятен. Такие заболевания, как бронхоэктатическая болезнь и инфекционные заболевания (туберкулёз, аспергиллома, эхинококкоз) можно контролировать с помощью адекватного медикаментозного или хирургического вмешательства, что приводит к улучшению результатов лечения. Прогноз ЛК зависит от ряда факторов, включая быстроту диагностики и БАЭ, при необходимости проведения бронхоблокации с учётом общего состояния пациента и наличия сопутствующих заболеваний. При неэффективности ЭБА необходим ангиографический поиск с целью выявления дополнительных источников, не бронхиальных артерий, поиск АV сосудистой мальформации и др.
Обсуждение
Этиологические причины ЛК в Европейских странах многообразны и во многом количественно не повторяют друг друга. При анализе 1087 пациентов во Франции причиной ЛК явились: туберкулёз (25%; активная форма -12%, осложнения – 13%), бронхоэктатическая болезнь (20%), мицетомы (6%), криптогенное кровохарканье (18%), бронхогенные карциномы (17%), в то время как при анализе 5 итальянских больниц с участием 606 пациентов: пневмония/абсцесс лёгкого (18,6%), бронхоэктатическая болезнь (14,9%), острый бронхит (13,7%), рак лёгких – (9,1%), туберкулёз (5%; активная форма – 3,3%) и осложнения (1,7%). [7]
По нашим данным, при анализе 149 пациентов воспалительные заболевания лёгких, пневмония, абсцесс лёгкого составили 5,3%, ТБЦ активная фаза – 1,3%, ТБЦ в анамнезе – 4,2%, ХОБЛ – 4,6%, рак лёгкого – 28,5%, бронхоэктатическая болезнь – 28,5%, криптогенный характер – 14,7%.
Комплексная диагностика и раннее выявление источника кровотечения путём ангиографии имеют решающее значение. ЭБА, даже при массивном кровохарканье, имеет эффективность в 90% случаев [3, 27–29]. Согласно нашим данным, ЭБА была радикальным методом лечения в 89,9% случаев, в 10% случаев были небронхиальные артерии, потребовавшие детального ангиографического поиска и дополнительных эмболизаций.
Однако основным недостатком метода ЭБА считают высокую частоту рецидивов лёгочного кровотечения. Так, у 20% пациентов рецидивы кровотечения возникают в течение первых 6 месяцев после вмешательства и у 50% – в более отдалённом периоде [35] .
По нашим данным, рецидив ЛК при поступлении наблюдался в 80 (54%) случаях. Рецидив после эмболизации ЭБА возникал у 15 (10%) пациентов. Это свидетельствует о том, что при первично возникающем ЛК необходимо выполнять эмболизацию и в последующем обязательно проводить лечение по поводу основного заболевания.
Выводы
Комплексная диагностика и раннее выявление источника кровотечения путём ангиографии и ЭБА имеют решающее значение в лечении ЛК.
При ЛК малой и средней интенсивности использование ЭБА, как метода остановки кровотечений, является эффективным в 89,9% случаев. В случаях массивных ЛК целесообразно выполнять брон-хоблокацию в комплексном ведении. При неэффективности ЭБА необходим ангиографический поиск с целью выявления дополнительных источников кровотечения – небронхиальных артерий. Обеспечение временного гемостаза является целесообразным, чтобы избежать экстренной операции.
Высокий рецидив ЛК (50%) и рецидив ЛК (10%) после экстренной эмболизации и в анамнезе диктуют необходимость выполнения ЭБА во всех случаях, дополнительный ангиографический поиск, а в последующем проведение лечения патологического процесса лёгких.


