Диагностика карантинных фитопатогенов методом ПЦР в формате FLASH
Автор: Рязанцев Д.Ю., Абрамов Д.Д., Завриев С.К.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Иммунитет и защита растений
Статья в выпуске: 3 т.44, 2009 года.
Бесплатный доступ
На основе полимеразной цепной реакции (ПЦР) в формате FLASH (fluorescent amplification-based specific hybridization) разработаны специфичные и чувствительные диагностические системы для детекции следующих карантинных фитопатогенов: возбудителей бурой бактериальной гнили картофеля (Ralstonia solanacearum) и кольцевой гнили картофеля (Clavibacter michiganensis subsp. sepedonicus), бледной и золотистой картофельных цистообразующих нематод (Globodera pallida и G. rostochiensis), вируса шарки сливы (Рlum Pox Potyvirus) и возбудителя ожога плодовых (Erwinia amylovora). Тест-системы пригодны для рутинной диагностики и апробированы на широком спектре изолятов и рас фитопатогенов.
Карантинные фитопатогены, молекулярная диагностика, флуоресцентная детекция, пцр
Короткий адрес: https://sciup.org/142133239
IDR: 142133239 | УДК: 633.11:632.488
Текст научной статьи Диагностика карантинных фитопатогенов методом ПЦР в формате FLASH
Импорт растениеводческой продукции сопряжен с угрозой ввоза и распространения карантинных и особо опасных патогенов, вредителей и сорных растений, которые могут нанести огромный экономический вред. Поэтому своевременная диагностика и идентификация карантинных фитопатогенов с целью предотвращения их проникновения на территорию России относится к задачам государственной важности. Изменить опасную тенденцию распространения фитопатогенов, внесенных в список карантинных, в условиях постоянно увеличивающихся объемов анализируемого материала возможно только при наличии быстрых, эффективных и надежных методов диагностики (1-3).
В настоящее время для детекции и идентификации фитопатогенов применяют диагностические системы, основанные на двух методах — им-муноферментном анализе (ИФА) и полимеразной цепной реакции (ПЦР). В Российской Федерации подавляющее большинство лабораторий, рутинно проводящих диагностику фитопатогенов, в качестве основного метода используют ИФА, уступающий методу ПЦР по чувствительности и специфичности. Использованный нами метод ПЦР в формате FLASH (fluorescent amplification-based specific hybridization) (4) позволяет регистрировать результаты амплификации на флуориметре, не открывая пробирок, что исключает риск контаминации рабочей зоны продуктами реакции и снижает время детекции. Для контроля достоверности в систему введен внутренний контроль (ВК). При использовании готовых наборов такой формат анализа позволяет проводить рутинную диагностику, получать стабильные и точные результаты, не требует дорогого оборудования и привлечения высококвалифицированных специалистов (2-4, 6, 7).
Целью наших исследований была разработка эффективных систем для диагностики и идентификации в формате FLASH-ПЦР следующих карантинных объектов: возбудителя бурой бактериальной гнили картофеля (Ralstonia solanacearum), возбудителя кольцевой гнили картофеля (Clavi-bacter michiganensis subsp. sepedonicus), бледной и золотистой картофельной цистообразующей нематоды (Globodera pallida и G. rostochiensis), вируса шарки сливы (Plum Pox Potyvirus) и возбудителя ожога плодовых (Er-winia amylovora). При этом главным условием было максимальное удобство ис- пользования таких систем при сохранении высокого уровня специфичности и чувствительности.
Методика. Образцы патогенов и зараженных растений были предоставлены Всероссийским центром карантина растений (Московская обл., г. Быково), в котором таксономическая принадлежность каждого патогена предварительно определялась и подтверждалась классическими методами.
Все диагностические FLASH-ПЦР-системы были разработаны на основе одного и того же базового состава реакционной смеси и режима амплификации. Выравнивание нуклеотидных последовательностей, подбор праймеров и зондов, выделение РНК и ДНК из растительного материала и культур микроорганизмов, полимеразную цепную реакцию, анализ результатов ПЦР гель-электрофорезом и в формате FLASH, а также клонирование ДНК для положительных контролей выполняли, как описано нами ранее (4-7). Для выделения ДНК из отдельных цист нематод рода Glo-bodera материал помещали в пробирки, добавляли 50 мкл буфера STE (10 мМ Трис-Cl, pH 8,0, 1 мМ EDTA, 0,1 М хлорид натрия), гомогенизировали, инкубировали 5 мин на кипящей водяной бане и центрифугировали 5 мин при 13 000 об/мин. Надосадочную жидкость использовали для амплификации целевого фрагмента ДНК.
Результаты. При выравнивании нуклеотидных последовательностей различных штаммов и изолятов патогенов, имеющихся в GeneBank (8), были подобраны оптимальные высокоспецифичные праймеры и зонды для детекции и идентификации указанных патогенов. В таблице представлены локусы, к которым подбирали олигонуклеотиды, а также условия амплификации и размер амплифицируемого фрагмента.
Олигонуклеотиды, подобранные и оптимизированные для разработанных тест-систем детекции карантинных фитопатогенов методом ПЦР в формате FLASH
|
к о о S е |
S о S о S R О |
Нуклеотидная последовательность |
Локус |
к к К & S 8 § Рч « |
By у 2 В S 1 Н о |
|
А |
Праймер: прямой 5'-TGAGTCAGTGTGGGCAACACCA-3' обратный5'-GACGACAACAGCAATCGTCGAG-3' Зонд 5'-(FAM)GGCCCACAGGGCGCTGTCCATACATTGTTGGGCC(BHQ1)-3' |
ВТС1 |
140 |
67 |
|
|
Б |
Праймер: прямой 5'-AAACTCGGGGACGATTATGCGT-3' обратный5'-CGACAACAGCAATCGTCGGC-3' Зонд 5'-(FAM)GGCCCACAGGGCGCTGTCCATACATTGTTGGGCC(BHQ1)-3' |
ВТС1 |
300 |
67 |
|
|
В |
Праймер: прямой 5'-GACCCTTTCCGTCGTCCAAGC-3' обратный5'-AATTTCGCCTCCCCGAAG-3' Зонд 5'-(FAM)CCGGTGAAAGCCGTTAGGGAGCGTCCACCGG(BHQ2)-3' |
ВТС1 |
140 |
67 |
|
|
Г |
Праймер: прямой 5'-AACGCCAAACGGTGCGAAC-3' обратный5'-CCGAAGGTCGACATGTTGACA-3' Зонд 5'-(FAM)GGCGCGAAAACAACCTGCAGCGTATGCGCC(BHQ2)-3' |
Ген, подобный гену предшественника фла-геллина flicC |
300 |
67 |
|
|
Д |
Праймер: прямой 5'-GAAGAACGACGTATTCACGGCTT-3' обратный5'-AATGCAGCCTGTTTGATAATTCTGT-3' Зонд 5'-(FAM)CGCGGATATCCGTAAAAACCTCAGTGCGACCGCG(BHQ2)-3' |
Плазмида pEA, повторяющиеся элементы |
253 |
64 |
|
|
Е |
Праймер: прямой 5'-GATGAAAAGGAGGACGATGAAGAAG-3' обратный5'-CGACGTCCCTATCCCTTCCTG-3' Зонд 5'-(FAM)GGCCCAGACCAGTTCCTCCAATTTCAGGGGCC(BHQ2)-3' |
Ген БО |
265 |
64 |
|
|
П р и м е ч а н и е. FLASH — fluorescent amplification-based specific hybridization; А, Б, В, Г, Д и Е |
— со- |
||||
|
ответственно |
Globodera pallida , G. rostochiensis , Clavibacter michiganensis subsp. sepedonicus , Ralstonia |
||||
|
solanacearum , Erwinia amylovora и Plum Pox Potyvirus; ВТС — внутренний транскрибируемый спейсер, БО — белок оболочки. |
|||||
На рисунке приведены данные, позволяющие сравнить эффектив-
ность гель-электрофоретического (рис., А) и флуоресцентного (см. рис., Б)
анализа продуктов ПЦР для ДНК из отдельных цист двух видов картофель-
ной нематоды. Как видно, в обоих форматах (ПЦР и FLASH-ПЦР) резуль-
таты полностью совпадали. Аналогичные результаты мы получили и по дру-
гим исследованным в настоящей работе патогенам (данные не представлены).
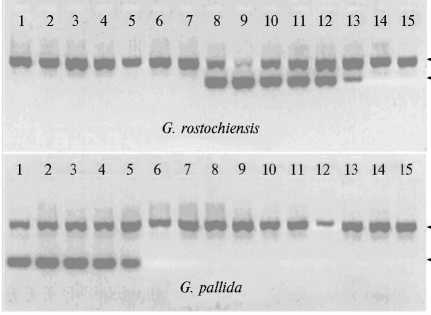
■вк
■СП
■вк
■СП


Интенсивность флуоресценции
Электрофореграммы (А) и интенсивность флуоресценции (Б) продуктов полимеразной цепной реакции (соответственно ПЦР и FLASH-ПЦР форматы) при детекции Globodera rosto-chiensis и G. pallida : 1-6 и 7-13 — соответственно ДНК из цист G. pallida и G. rostochiensis , 14 и 15 — отрицательный контроль; СП — специфическая ДНК (отмечено стрелками), ВК — внутренний контроль (отмечено стрелками). Черный столбик на рис. Б (а) соответствует интенсивности флуоресценции при ПЦР со специфической ДНК (СП), серый столбик (б) — ВК.
Диагностические системы были успешно апробированы на широком спектре изолятов и рас фитопатогенов из России и ряда европейских стран. Так, компанией «HLB» (Нидерланды) апробированы тест-системы для G. pallida и G. rostochiensis — на коллекции базовых патотипов картофельных цистообразующих нематод, распространенных на территории Голландии, для R. solanacearum и C. mi-chiganensis subsp. se-pedonicus — на широком спектре изоля-тов различных видов почвенных бактерий. Все испытания, проведенные Всероссийским центром карантина растений и Всероссийским НИИ фитопатологии (Московская обл., пос. Большие Вяземы), также дали положительные результаты.
Таким образом, для диагностики ряда карантинных фитопатогенов нами
разработаны эффективные, высокоспецифичные,
чувствительные и про-
стые в использовании тест-системы, которые в настоящее время находятся
на стадии внедрения в производство.
Л И Т Е Р А Т У Р А
-
1. Перечень вредителей, возбудителей болезней растений, сорняков, имеющих карантинное значение для Российской Федерации, 2007. Бюл. нормативных актов федеральных органов исполнительной власти, ¹ 6 от 11.02.2008.
-
2. L o p e z M.M., B e r t o l i n i E., O l m o s A. e.a. Innovative tools for detection of plant
-
3. L o p e z M.M., L l o p P., O l m o s A. e.a. Molecular tools solving the challenges posed by detection of plant pathogenic bacteria and viruses? Curr. Issues Mol. Biol., 2009, 11: 13-46.
-
4. Р я з а н ц е в Д.Ю., А б р а м о в а С.Л., Е в с т р а т о в а С.В. и др. Диагностика токсиногенных грибов рода Fusarium методом FLASH-PCR. Биоорганическая химия, 2008, 34: 716-724.
-
5. А б р а м о в а С.Л., Р я з а н ц е в Д.Ю., В о и н о в а Т.М. и др. Диагностика фи-топатогенных грибов Septoria tritici и Stragonaspora nodorum методом FLASH–ПЦР. Био-органическая химия, 2008, 34: 107-113.
-
6. К у л и н и ч О.А., Р ы с с А.Ю., Ч е р н е ц к а я А.Ю. и др. Использование ПЦР-диагностики для идентификации карантинных видов нематод. Защита растений, 2008, 8: 36-39.
-
7. Р я з а н ц е в Д.Ю., З а в р и е в С.К. Эффективный метод диагностики и идентификации вирусных патогенов картофеля. Мол. биол., 2009, 43: 558-567.
-
8. www.ncbi.nlm.nih.gov
pathogenic viruses and bacteria. Int. Microbiol., 2003, 6: 233-243.
1Институт биоорганической химии
Поступила в редакцию 7 апреля 2009 года
им. академиков М.М. Шемякина и
Ю.А. Овчинникова РАН ,
-
2ЗАО «НПФ ДНК-Технология» ,
115446 г. Москва, Каширское ш., 23, корп. 5
DIAGNOSTICS OF QUARANTINE PHYTOPATHOGENS BY THE PCR METHOD IN THE FLASH FORMAT
D.Yu. Ryazantsev1, D.D. Abramov2, S.K. Zavriev1
S u m m a r y
On the basis of PCR in the FLASH format the authors developed the specific and sensitive diagnostic systems for a revealing of following quarantine phytopathogens: Ralstonia solanacearum, Clavibacter michiganensis subsp. Sepedonicus, Globodera pallida and G. rostochiensis, Plum Pox Poty-virus, Erwinia amylovora . The test-systems are suitable for routine diagnostics and were approved on wide range of isolates and race of phytopathogens.
Научные конференции

МЕЖДУНАРОДНАЯ НАУЧНАЯ КОНФЕРЕНЦИЯ
«БИОЛОГИЧЕСКОЕ РАЗНООБРАЗИЕ СЕВЕРНЫХ ЭКОСИСТЕМ В УС
ЛОВИЯХ ИЗМЕНЯЮЩЕГОСЯ КЛИМАТА»
10-12 июня 2009 года, г. Апатиты (Мурманская обл.)
Организаторы: Полярно-альпийский ботанический сад-институт им. Н.А. Ав- рорина Кольского научного центра РАН, Мурманский государственный технический универ- ситет, Мурманский государственный педагогический университет, Кольский филиал Петро- заводского государственного университета, Правительство Мурманской области
Конференция будет проходить вслед за Годичным собранием Общества физиологов растений (ОФР) России и Международной научной конференцией «Физико-химические механизмы адаптации растений к антропогенному загрязнению в условиях Крайнего Севера» (7-11 июня 2009 года).
Основные направления работы конференции:
-
■ Палеоэкология и биоразнообразие на Севере.
-
■ Сравнительная динамика экосистем в различных климатогеографических зонах. Глобальное, региональное и локальное воздействие на биоразнообразие.
-
■ Биоразнообразие в условиях загрязнения окружающей среды.
-
■ Влияние климатогеографических, геофизических и техногенных факторов на генетику популяций и хромосомную изменчивость. Эволюция хромосомных наборов диких и культурных растений.
-
■ Биоразнообразие как источник лекарственных ресурсов. Растительное биоразнообразие и здоровье человека.
-
■ Методологические аспекты создания единой стратегии междисциплинарного изучения биоразнообразия, сравнительной динамики экосистем, интеграции информационных и программных ресурсов.
-
■ Ботанические сады и биоэтика. Проблема сохранения биоразнообразия в образовании. Информация на сайте ПАБСИ КНЦ РАН www.pabgi.ru и ИФР РАН www.ippras.ru .


