Диагностика острых отравлений алимемазином методом ГХ/МС при проведении химико-токсикологических исследований биологических жидкостей лабораторных животных
Автор: Анацкая А.С., Ремезова И.П.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Статья в выпуске: 1 (69), 2021 года.
Бесплатный доступ
В рамках настоящего исследования осуществлена разработка методики обнаружения алимемазина и основных его метаболитов в биологических жидкостях лабораторных животных с помощью метода ГХ/МС. Предположены следующие пути метаболизма алимемазина: деметилирование молекулы алимемазина, в результате которого образуется метаболит М1, далее происходит ряд реакций деметилирования, в ходе которых образуется метаболит М2. Одним из возможных путей метаболизма является окисление атома серы с образованием метаболита М3. Возможно также образование метаболита М4 в результате реакции гидроксилирования с формированием 3-гидроксиалимемазина. Также возможно образование конъюгатов с уксусной кислотой: М5, Ма, М7. В извлечениях из мочи и плазмы с терапевтической концентрацией алимемазина идентифицированы все описанные выше метаболиты, в плазме с токсической концентрацией - метаболиты М2, М5, Ма. Достоверное подтверждение острого отравления алимемазином можно доказать по отсутствию в извлечении из плазмы крови метаболитов М1, Мз, М4, М7. Данная методика может быть включена в схему химико-токсикологического анализа алимемазина.
Алимемазин, гх/мс, химико-токсикологический анализ
Короткий адрес: https://sciup.org/142227858
IDR: 142227858 | УДК: 615.214.21
Текст научной статьи Диагностика острых отравлений алимемазином методом ГХ/МС при проведении химико-токсикологических исследований биологических жидкостей лабораторных животных
Алимемазин (торговое название «Терали-джен», «Терален») – антипсихотическое средство, производное фенотиазина, применяющееся для лечения заболеваний нервной системы. В связи с довольно распространенным назначением данного лекарственного препарата участились случаи передозировок им. При анализе данных литературы установлено большое число отравлений алимемазином, в том числе с летальным исходом [4– 8]. Клиническими проявлениями отравлений являются следующие признаки: экстрапирамидные расстройства (тремор, акатизия), повышение судо- рожной активности (у детей), снижение артериального давления, тахикардия. Симптомы интоксикаций, характерные для алимемазина, имеют довольно схожую клиническую картину отравлений с другими лекарственными препаратами, поэтому для точной постановки диагноза необходимо проведение химико-токсикологического анализа не только по содержанию основного вещества, но и его метаболитам.
В работах зарубежных авторов описаны некоторые основные метаболиты алимемазина: 3-гидрокситримепразин (m/z 314), N – деметил-тримепразин (m/z 284), N-деметил-3-гидрокситри- мепразин (m/z 300) и сульфоксид тримепразина (m/z 314) [9].
В моче после кислотного гидролиза обнаружены шесть метаболитов алимемазина с молекулярными массами 199, 257, 356, 326, 312, 384 а. е. м., большинство из них были ацетилированными продуктами [10].
ЦЕЛЬ РАБОТЫ
Разработать способы обнаружения али-мемазина и его основных метаболитов в биологических жидкостях с помощью метода ГХ/МС для установления факта острого отравления.
МЕТОДИКА ИССЛЕДОВАНИЯ
Для осуществления экспериментального исследования использовали суспензию из таблеток «Тералиджен» с дозировкой действующего вещества – 5 мг (производство: Фармацевтическое Акционерное общество «Хаузянг», Вьетнам), стандартные образцы субстанции алимемазина (Sigma – Aldrich, каталожный номер 32113 – 10 MG) и основных метаболитов: 3-гидрокситри-мепразин (LGC Standards, каталожный номер TLCI-113-10MG) , N-диметилтримепразин (LGC Standards, каталожный номер TLC-E-207-10MG), N-диметил-3-гидрокситримепразин (LGC Standards, каталожный номер TLCT-711-10MG), сульфоксид тримепразина (LGC Standards, каталожный номер TLC-697-10MG) .
Исследование проводили на крысах обоего пола линии Wistar средней массой 200 г. Животным с помощью зонда перорально вводили суспензию алимемазина с терапевтической и токсической концентрацией действующего вещества [2]. Параллельно был проведен контрольный опыт. После чего, через различные промежутки времени (15, 30 минут, 1, 2, 3 часа), животных вводили в наркоз, декапитировали и осуществляли у них забор плазмы крови. Сбор мочи проводили в тех же временных интервалах. Контрольной группе животных али-мемазин не вводили.
Для изолирования алимемазина из мочи и плазмы крови использовали описанные ранее методики [2] с учетом факторов экстрации [3].
Обнаружение алимемазина и его метаболитов проводили методом ТСХ. Растворы извлечений из мочи и плазмы крови, а также раствор стандартного образца алимемазина наносили на хроматографическую пластину «Сорбфил».
Процесс разделения веществ осуществляли с использованием ранее выбранной системы: 25%-й раствор аммиака – этанол (1 : 1) – этилацетат – ацетон (4 : 90 : 45) [1]. Детектирование проводили УФ-светом. Неидентифицированные пятна элюировали с пластины в 96%-м спирте и анализировали методом ГХ/МС.
Анализ полученных извлечений методом ГХ/МС проводили на газовом хроматографе Maestro 7820 с масс-спектрометрическим детектором Agilent 5973 N.
Работа была осуществлена на базе химикотоксикологической лаборатории ГБУЗ «Наркологический диспансер» МЗ Краснодарского края (табл. 1). Ввод пробы проводился автоматически.
Работа масс-селективного детектора проводилась в режиме электронного удара (70 эВ). Сигнал регистрировали по полному ионному току. Диапазон масс-сканируемых ионов 40– 540 а. е. м.
Идентификацию веществ осуществляли по характерным временам удерживания и совпадению масс-спектров веществ с библиотечными и со стандартными образцами.
Таблица 1
Хроматографические условия
|
Показатель |
Условия |
|
Колонка |
Кварцевая капиллярная HP–5–1-MS длиной 30 м, с внутренним диаметром 0,25 мм, толщиной пленки неподвижной фазы 0,25 мкм |
|
Температурная программа колонки |
Начальная температура колонки 90 ° С, далее подъем температуры со скоростью 15 ° С/мин до 280 ° С |
|
Газ-носитель |
Гелий |
|
Скорость потока газа-носителя |
1,10 мл/мин с задержкой на растворитель в 3 мин |
|
Температура инжектора |
260 ° С |
|
Температура детектора |
280 ° С |
|
Скорость потока: воздуха водорода поддувочного газа |
400 мл/мин 40 мл/мин 30 мл/мин |
|
Объем вводимой пробы |
1 мкл |
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
При проведении анализа методом ТСХ на хроматографических пластинах, помимо пятен основного вещества, наблюдались дополнительные пятна, которые были исследованы. Для этого нами была проведено снятие слоя силикагеля с дополнительного пятна. После чего его растворяли в 96%-м спирте, полученный раствор подвергали фильтрованию через бумажный фильтр «синяя лента». Подтверждение присутствия алимемазина в извлечениях из мочи и плазмы проводили методом ГХ/МС.
Полученные хроматограммы представлены на рис. 1–3.
На полученных хроматограммах имеется пик большой интенсивности со временем удерживания 13,52 минуты, который совпадает по времени удерживания с пиком алимемазина в растворе стандартного образца.
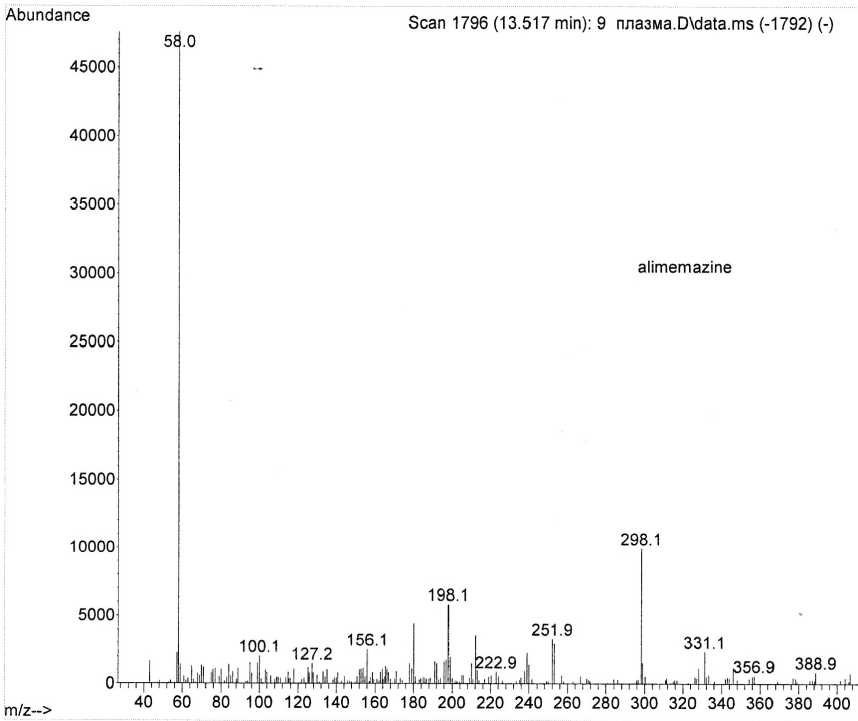
Масс-спектры извлечений из мочи и плазмы представлены на рис. 4–6.
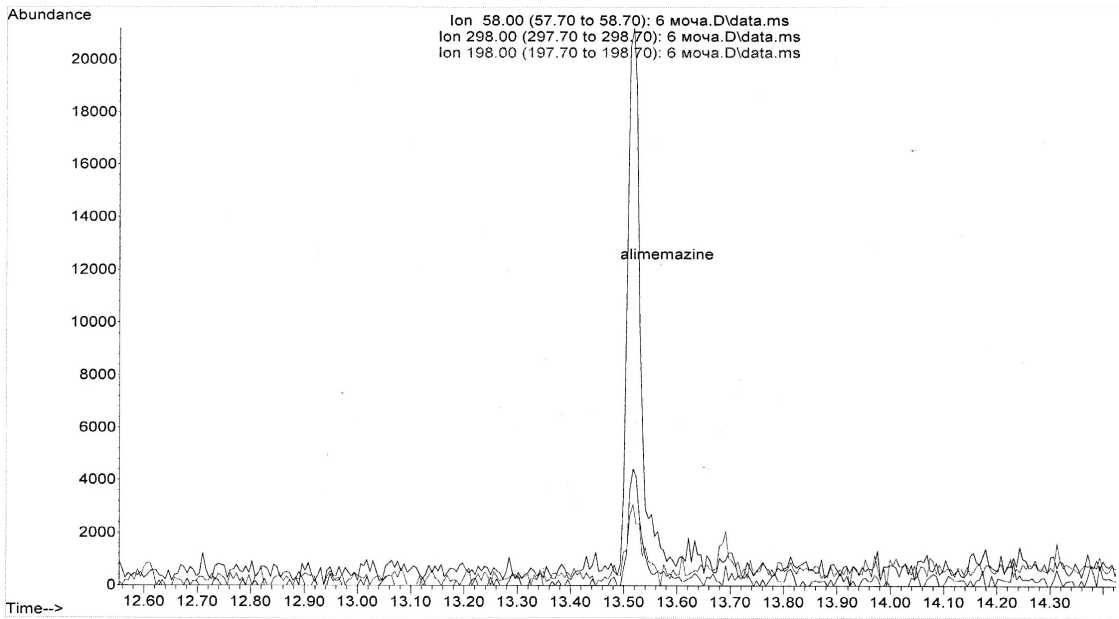
Рис. 1. Хроматограмма извлечения из мочи с терапевтической дозой алимемазина (3 часа)
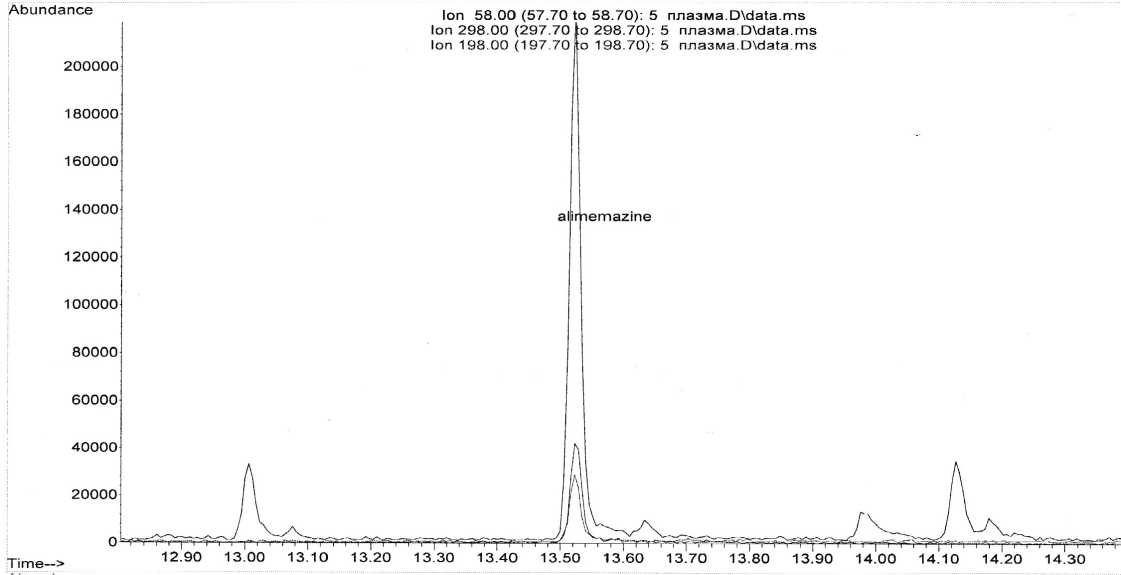
Рис. 2. Хроматограмма извлечения из плазмы с терапевтической дозой алимемазина (2 часа)
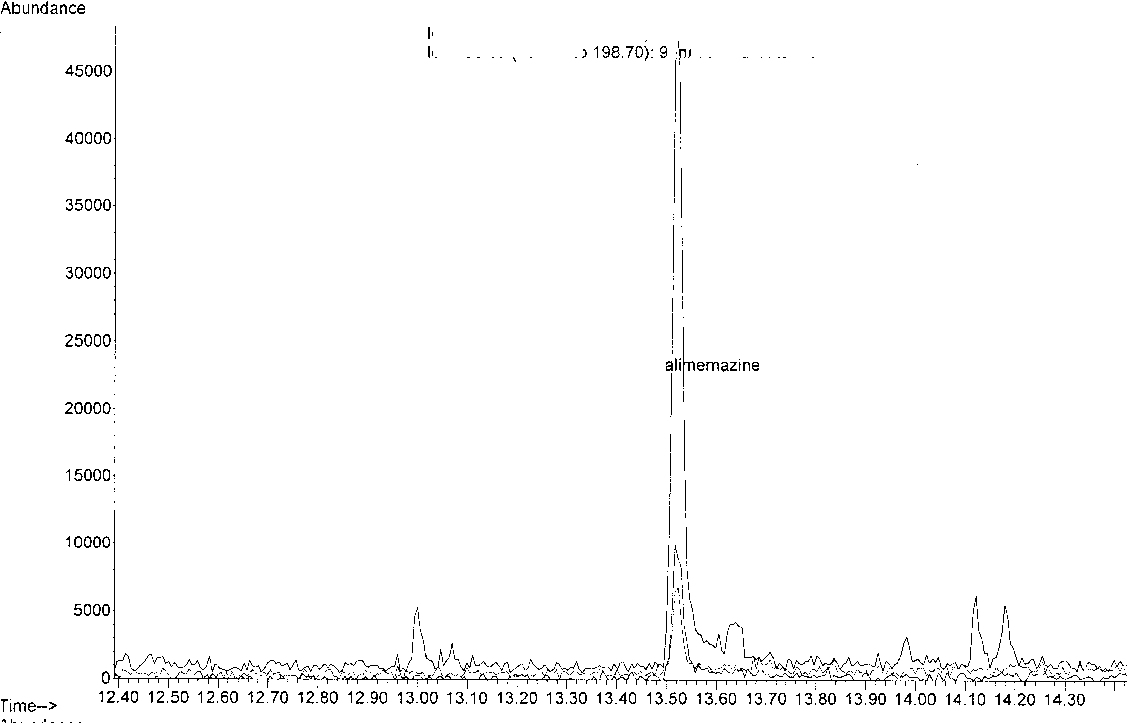
Рис. 3. Хроматограмма извлечения из плазмы с токсической дозой алимемазина (1 час)
Ion 298.00 (297.70 to 298.70): 9
Ion 198.00 (197.70 to
429.8
J| 452.1 479.1 503.1 530.2
i 'і'1] I i111!1 I I I I I 'і I і ‘5'Л i"| I ‘і1 1 I I 'і I I I [■■; ■ I hi f ] I
420 440 460 480 500 520 540
Рис. 4. Масс-спектр извлечения из мочи с терапевтической дозой алимемазина (3 часа)
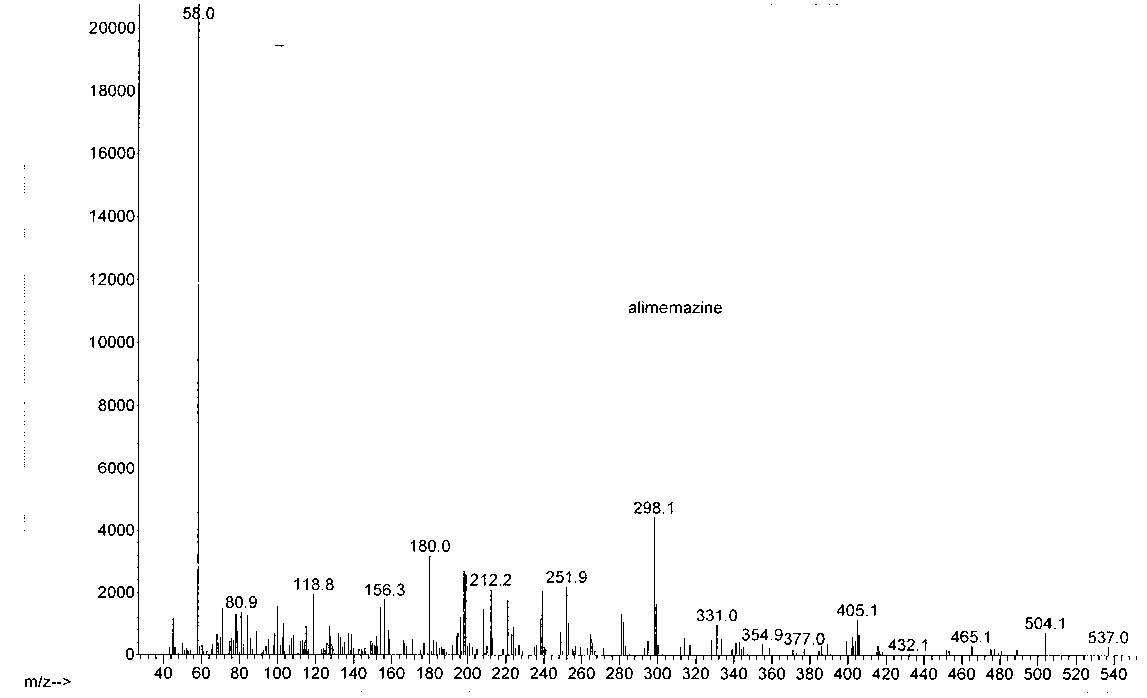
Рис. 5. Масс-спектр извлечения из плазмы с терапевтической дозой алимемазина (2 часа)
220000- 58.о
alimemazine
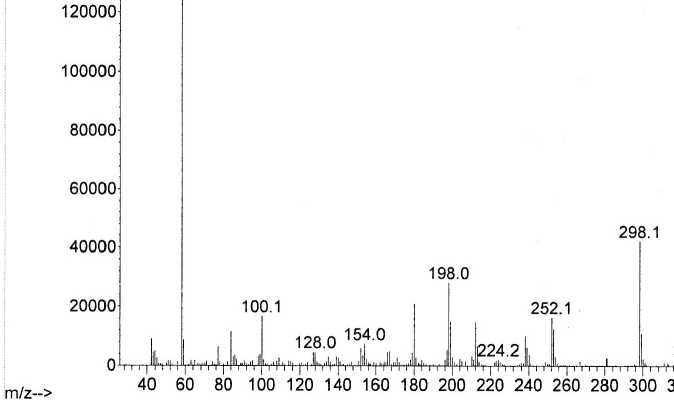
Рис. 6. Масс-спектр извлечения из плазмы с токсической дозой алимемазина (1 час)
326.9349 3 377.1 415.2439.0 467.1489.2 519.0
'I l‘'l"l Г|ТГ I 'I | I T Гі''|'ГГГТ”|"1,"| 'I ’l'] I ГІ I'| I I IT| ГІЧ I"] Г Г I Г | I I I I 'I TT1.....ГТІ I £0 340 360 380 400 420 440 460 480 500 520 540
На масс-спектрах извлечений присутствовал выраженный пик молекулярного иона али-мемазина (m/z 298).
Максимальное количество алимемазина в извлечении из плазмы крови обнаруживалось через 2 часа после введения лабораторным животным суспензии с терапевтической дозой али-мемазина и через 1 час – при введении токсической дозы. В моче лабораторных животных максимальная концентрация алимемазина наблюдалась спустя 3 часа после перорального введения суспензии алимемазина.
Далее в масс-спектрах извлечений из плазмы и мочи были выделены все не идентифицированные молекулярные ионы. На основании возможных реакций метаболизма нами идентифицированы предполагаемые метаболиты по их молекулярным ионам. Идентификация веществ с одинаковыми молекулярными ионами сопоставлена со структурой по дефрагментации молекулярного иона.
В результате анализа нами была установлена структура 7 метаболитов в извлечениях из мочи и плазмы лабораторных животных. Таким образом, можно предположить следующие пути метаболизма алимемазина: деметилирование молекулы алимемазина, в результате которого образуется ион m/z 255 (М1), далее происходит ряд реакций деметилирования, в ходе которых образуется метаболит М2 (m/z 199). Одним из возможных путей метаболизма является окисление атома серы с образованием метаболита М3 (m/z 314).
Возможно также образование метаболита М 4 в результате реакции гидроксилирования с формированием 3-гидроксиалимемазина с Мr 314 г/моль. Также возможно образование конъюгатов с уксусной кислотой: М 5 (m/z 326), М 6 (m/z 357), М 7 (m/z 385).
Обнаруженные метаболиты проявляются в биологических жидкостях в различные промежутки времени (табл. 2).
Таблица 2
Идентификация метаболитов алимемазина в моче и плазме в зависимости от времени
|
Время обнаружения |
Характеристический ион |
Полученные данные |
Данные литературы |
|
1 |
2 |
3 |
4 |
|
Моча с терапевтической дозой алимемазина |
|||
|
30 минут |
m/z 312,8 |
М 3/М4 |
М 3/М4 [6,11] |
|
m/z 252,9 |
М 1 |
М 1[11] |
|
|
1 час |
m/z 327,7 |
М 5 |
М 5 [11] |
|
m/z 357,3 |
М 6 |
М 6 [11] |
|
|
m/z 382,9 |
М 7 |
М 7 [6,11] |
|
|
3 часа |
m/z 313 |
М 3/М4 |
М 3/М4 [6,11] |
|
m/z 384,9 |
М 7 |
М 7 [6,11] |
|
|
m/z 253,9 |
М 1 |
М 1 [11] |
|
|
Плазма с терапевтической дозой алимемазина |
|||
|
15 минут |
m/z 324,9 |
М 5 |
М 5 [11] |
|
30 минут |
m/z 198 |
М 1 |
М 1 [11] |
|
1 час |
m/z 253 |
М 1 |
М 1[11] |
|
2 часа |
m/z 198 |
М 2 |
М 2 [11] |
|
m/z 326,9 |
М 5 |
М 5 [11] |
|
|
Плазма с токсической дозой алимемазина |
|||
|
15 минут |
m/z 198 |
М 2 |
М 2 [11] |
|
30 минут |
m/z 198 |
М 2 |
М 2 [11] |
|
m/z 326,9 |
М 5 |
М 5 [11] |
|
|
m/z 355,8 |
М 6 |
М 6 [11] |
|
|
1 час |
m/z 198,1 |
М 2 |
М 2 [11] |
|
m/z 356,9 |
М 6 |
М 6 [11] |
|
|
2 часа |
m/z 198,1 |
М 2 |
М 2 [11] |
|
3 часа |
m/z 198,1 |
М 2 |
М 2 [11] |
Таким образом, в извлечениях из мочи и плазмы с терапевтической концентрацией али-мемазина идентифицированы все описанные выше метаболиты, в плазме с токсической концентрацией – метаболиты М 2 , М 5 , М 6 . Достоверное подтверждение острого отравления алимемазином можно доказать по отсутствию в извлечении из плазмы крови метаболитов М 1, М 3 , М 4 , М 7 .
ЗАКЛЮЧЕНИЕ
Разработана методика обнаружения али-мемазина и его метаболитов в биологических жидкостях (моча, плазма крови) лабораторных животных, проведен анализ полученных извлечений методом ГХ/МС.
Данная методика анализа рекомендована для экспресс-диагностики отравлений алиме-мазином.
Список литературы Диагностика острых отравлений алимемазином методом ГХ/МС при проведении химико-токсикологических исследований биологических жидкостей лабораторных животных
- Обнаружение алимемазина в вещественных доказательствах небиологического происхождения. - Текст: непосредственный / А. С. Рыбасова, Д. Ю. Санжиева, А. С. Карсаева [и др.] // Разработка, исследование и маркетинг новой фармацевтической продукции: сб. науч. трудов. - 2016. - № 71. - С. 180 - 183.
- Разработка методик изолирования, обнаружения и количественного определения алимемазина в биологических жидкостях лабораторных животных при острых отравлениях. - Текст: непосредственный / А. С. Рыбасова, И. П. Ремезова, Д. А. Любченко [и др.] // Судебно-медицинская экспертиза. - 2019. - № 62 (1). - С. 31 - 35.
- Рыбасова, А. С. Изучение влияния некоторых факторов экстракции на изолирование алимемазина из растворов. - Текст: непосредственный / А. С. Рыбасова // Актуальные направления фундаментальных и прикладных исследований. - 2016. - № 3. - С. 174 - 177.
- A Fatal case of alimemazine poisoning. - Direct text / F. Kintz, F. Berthault, A. Tracqui, P. Mangin // Journal of analytical toxicology. - 1995. - № 7. - P. 591 - 594.
- Alimemazine poisoning as evidence of Munchausen syndrome by proxy: A pediatric case report. - Direct text / I. Gomila, V. Lopez-Corominas, M. Pellegrini [et al.] // Forensic Science International. - 2016. -P. 18 - 22.
- Bonner, L. Newer antihistamines can cause adverse reactions in children - Direct text / L. Bonner // Pharmacy today. - 2016. - № 7. - P. 33.
- Harling, D. W. Trimeprazine tartrate and convulsions. - Direct text / D. W. Harling // Anaesthesia. -1995. - № 50 (1). - P. 97 - 98.
- Kahn, A. Possible role of phenothiazines in sudden infant death. - Direct text / A. Kahn, D. Blum // Lancet. - 1979. - № 2. - P. 364 - 365.
- Kim, T.-J. Identification of new urinary metabolites of trimeprazine in rats by gas chromatography-mass spectrometry. - Direct text / T.-J. Kim // Journal of chromatography B: biomedical sciences and applications. - 1992. - № 2. - P. 295 -300.
- Maurer, H. Identification of phenothiazine antihistamines and their metabolites in urine. - Direct text / H. Maurer, K. Pfleger // Archives of toxicology. - 1988. - P. 185 - 191.


