Диагностика пораженности клематисов мучнистой росой с помощью методов сканирующей электронной и конфокальной лазерной микроскопии
Автор: Рябченко А.С., Дымович А.В., Трубина Н.Н.
Журнал: Лесохозяйственная информация @forestry-information
Рубрика: Охрана и защита лесов
Статья в выпуске: 3, 2017 года.
Бесплатный доступ
Приведены результаты мониторинга распространения и интенсивности развития мучнисто-росяного патогена в коллекции клематисов отдела декоративных растений Главного ботанического сада им. Н. В. Цицина РАН, выполненного методами сканирующей электронной и конфокальной лазерной микроскопии. Установлено поражение 13-ти сортов клематиса 6-ти садовых групп выявленным грибом Erysiphe aquilegiae var. ranunculi (Grev.) R.Y. Zheng& G.Q. Chen.
Конфокальная лазерная сканирующая микроскопия (клсм), мучнисто-росяной патоген, сканирующая электронная микроскопия (сэм)
Короткий адрес: https://sciup.org/14336687
IDR: 14336687 | УДК: 632.4
Текст научной статьи Диагностика пораженности клематисов мучнистой росой с помощью методов сканирующей электронной и конфокальной лазерной микроскопии
А. С. Рябченко, А. В. Дымович, Н. Н. Трубина // Лесохоз. информ. : электрон. сетевой журн. – 2017. – № 3. – С. 67–74. URL:
Clematis L. – род растений семейства Лютиковые (Ranunculaceae) – включает около 300 видов. В основном это многолетние травянистые или деревянистые вьющиеся, реже прямостоячие растения, произрастающие в субтропической, тропической и умеренной климатических зонах. В Западной Европе клематисы начали культивировать в XVI в., а в Японии – ещё раньше. В России они появились в начале XIX в. как оранжерейные растения. К настоящему времени выведено более 3 000 садовых форм и сортов этого растения. Клематисы широко представлены в ботанических садах, в частности, в коллекции Главного ботанического сада им. Н. В. Цицина РАН (ГБС РАН) в Москве. Данная коллекция включает 145 сортов 6-ти садовых групп.
На листьях и побегах видов рода Clematis L. встречается несколько видов мучнисто-росяных грибов. Из них наиболее распространены Erysiphe ranunculi Grev. [1, 2] и Erysiphe aquilegiae DC. [1–3], включающий E. aquilegiae var. ranunculi (Grev.) R. Y. Zheng & G. Q. Chensyn и E. аquile-giae var. clematidis Y.S. Paul & V. K. Thakur [4, 5]. Вид E. аquilegiae отмечен на Cl. terniflora в Японии и Cl. integrifolia в Швейцарии (по данным S. Takamatsu [6]), в Норвегии на разных видах клематиса [7], а также (по данным R. Zhou с соавт. [8]) на клематисе маньчжурском в Китае. Данный вид мучнистой росы также определен и имеет широкое распространение в Англии, Германии, Индии, Польше, Финляндии, где он в основном поражает растения родов: Aquilegia, Aconitum, Anemone, Caltha, Clematis, Coptis, Pulsatilla, Ranuncuilus, Thalictrum и др. [8].
В недавнем прошлом некоторые авторы объединяли виды E. ranunculi и E. aquilegiae, так как они очень близки по морфологии. Так, В. П. Гелюта [3] описывал их как Erysiphe aquilegiae DC. и прикладывал универсальный ключ. Конидии эллипсоидальные, удлиненно-эллипсоидальные, 24-48x14-22 мкм. Клейстотеции полу-шаровидные, 70–135 мкм в диаметре, придатки (5–25 шт.) базальные, по длине равны 1–10 диа- метрам клейстотеция. Сумки (1–8, чаще 2–6) яйцевидные, неравнобокие, 50-80x28-45 мкм, 3–6-споровые, реже 2–7. Споры эллипсоидальные, 18-28x10-16 мкм.
Другие авторы придерживались иного мнения по поводу классификации этих двух видов. Так, М. В. Горленко [1] отмечал схожесть видов по строению сумок, форме и размерам клейстотеци-ев, но указывал на различное количество спор в сумках и разную длину придатков. У E. ranunculi насчитывается 3–6 спор, придатки по длине равны 1–4 диаметрам клейстотеция, у E. аquile-giae – 2–5 спор, придатки по длине равны 4–10 диаметрам клейстотеция.
И. А. Бункина [2], кроме вышеприведенных отличий, также указывала на разные размеры клейстотециев: E. аquilegiae – 90–120 мкм, E. ranunculi – 69–90 мкм.
На данный момент в информационной базе Index Fungorum [9] вышеназванные виды мучнисто-росяных грибов объединены и представлены как синонимы E.aquilegiae DC. В одной из самых новых и полных работ по таксономии порядка Erysiphales [10] E. ranunculi также представлен как синоним E. аquilegiae DC., а тот, в свою очередь, разделен на Erysiphe aquilegiae var. ranunculi (Grev.) R. Y. Zheng & G. Q. Chen и Erysiphe aquilegiae var. aquilegiae (Grev.). Авторы различают грибы по длине придатков клейсто-тециев – у Erysiphe aquilegiae var. ranunculi они превышают диаметр клейстотециев в 0,5–4 раза, у Erysiphe aquilegiae var. aquilegiae – в 3–12 раз, т. е. значительно длиннее. В данной работе мы придерживаемся именно этой системы классификации.
Другой мучнисто-росяной гриб, представитель рода Erysiphe – E. polygoni – был отмечен на Clematis virginiana еще в начале ХХ в. [11] в штате Огайо (США) и в провинции Онтарио (Канада) [12], а также на клематисе сорта Жакмани в Соединенном Королевстве [13]. В Новой Зеландии E. polygoni поражал C. recta и C. stans [14], в Турции гриб обнаружен на разных видах клематиса [15].
Возбудители мучнистой росы – одни из наиболее распространенных облигатных патогенов, выявляемых на растениях клематиса. Наибольшую опасность болезнь представляет в южных районах, где в середине лета при жаркой погоде с достаточной влажностью она развивается наиболее интенсивно. В умеренной зоне болезнь обычно не так активна, но при определенных условиях существует возможность возникновения довольно мощных вспышек заболевания, от которых страдают и могут погибнуть многие растения (данные авторов).
Материалы и методы
Сбор материала осуществляли с растений коллекции клематисов отдела декоративных растений ГБС РАН в сентябре 2016 г. На исследуемом участке клематисы высаживали в открытом грунте с 2002 г. Ботанический состав данного участка коллекции представлен 60 сортами. По происхождению сортовые клематисы относятся к 6-ти садовым группам: Jackmanii (Жакмана), Lanuginosa (Ланугиноза), Patens (Патенс), Florida (Флорида), Integrifolia (Интегрифолия), Viticella (Витицелла). На участке представлены виды и формы: виноградолистный (vitalba), фиолетовый (viticella), прямой (recta), прямой, ф. пурпурнолистный (recta, f. purpurea), пильчатолистный (serratifolia), цельнолистный (integrifolia), сибирский (sibirica), альпийский (alpina), альпийский, ф. розовая (alpina, f. rosea), короткохвостый (brevicaudata).
Визуальный мониторинг поражаемости растений клематиса на исследуемом участке проводили в начале осени, при этом степень инфицирования мучнисто-росяными грибами оценивали по условной шкале: слабая (поражено от 0 до 15 % площади листа); средняя (15–45 %); сильная (более 45 %). Для оценки степени восприимчивости представителей коллекции методом случайной выборки отобрали контрольные листья одного возраста из средней части побега. Во время визуального мониторинга обследовали все растения данной части коллекции. Дальнейшее обследование проводили методами сканирующей электронной (криоСЭМ) и конфокальной лазерной микроскопии (КЛСМ), для чего у инфицированных экземпляров взяли фрагменты 5-ти пораженных листьев из числа контрольных.
Листья клематиса, пораженные мучнисторосяным патогеном, исследовали методом криоСЭМ, позволяющим оперативно работать со свежесобранным материалом при больших увеличениях без длительной подготовки препаратов. При этом качество полученных изображений ультраскульптуры инфекционных структур гриба было стабильно высоким, что позволило объективно провести его таксономическое определение. При использовании данного метода отобранные пораженные фрагменты листовых пластинок растений помещали на столик замораживающей приставки «Deben Cool Stage», предварительно покрытый слоем термопасты [17], охлаждали до -30 °С, а затем просматривали в режиме высокого вакуума с использованием сканирующего электронного микроскопа (LEO-1430 VP, Carl Zeiss, Германия) [18, 19]. Для получения изображения использовали сигналы 4QBSD – 4-квадрантного полупроводникового детектора обратно рассеянных электронов с ускоряющим напряжением 20 кВ и рабочим расстоянием 12–13 мм.
Для уточнения систематического положения выявленного патогена мы использовали метод КЛСМ, позволяющий детально исследовать содержимое плодовых тел мучнисто-росяных грибов – клейстотециев. Нами получены 3-мерные цветные изображения, демонстрирующие количество сумок в плодовых телах и аскоспор в сумках. Препараты просматривали на конфокальном микроскопе Olympus FV1000D при возбуждении фиолетовым лазером 405 нм или с дополнительным освещением 473 и 560 нм. Сигнал регистрировали в синем (425–460 нм), зеленом (485–530 нм) и красном (560–660 нм)
каналах, что соответствовало флуоресценции стандартных красителей: соответственно DAPI (4,6-diamidino-2-phenylindole), Alexafluor и Rhodamine.
Морфометрические параметры патогена оценивали на основе полученных микрографий криоСЭМ и КЛСМ в программе ImageJ.
Таксономическую принадлежность возбудителей мучнисто-росяной инфекции определяли по морфологическим признакам также на основе полученных микрографий c использованием
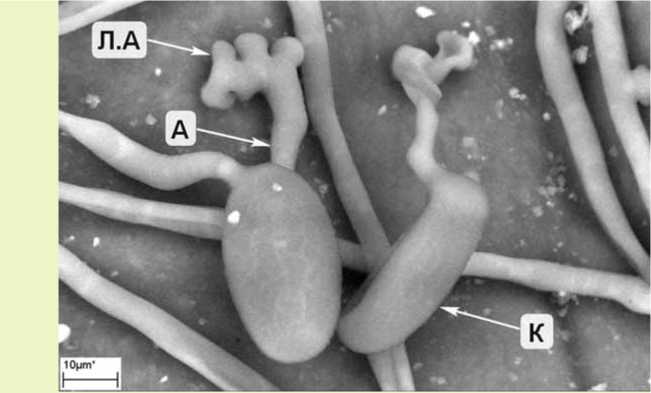
Рис. 1. Конидии с аппрессориями мучнисто-росяного патогена E.aquilegiae var. ranunculi на верхней стороне листа клематиса сорта Маргарет Хант :
К – конидия; А – аппрессорий; Л.А – лопасть аппрессория (криоСЭМ)
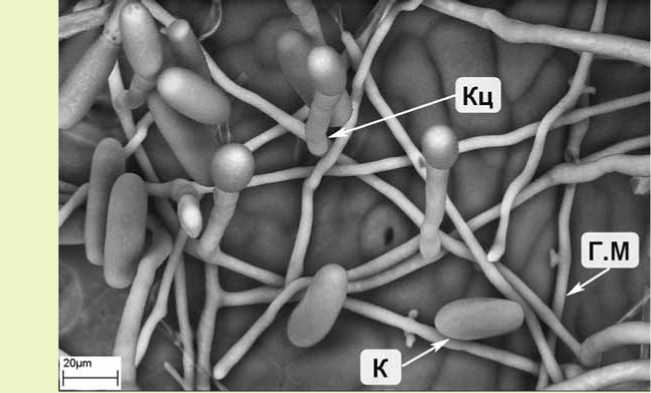
Рис. 2. Развитый мицелий и конидиеносцы с конидиями гриба E.aquilegiae var. ranunculi на верхней стороне листа клематиса сорта Чайка :
Кц – конидиеносец; К – конидия; Г.М – гифа мицелия (криоСЭМ)
определителей и монографий [1–3, 10, 12] и уточняли по информационной базе Index Fungorum [9].
Результаты и обсуждение
При проведении мониторинга растений коллекции рода Clematis L. отдела декоративных растений ГБС РАН из 60-ти сортов клематиса визуально и методом криоСЭМ подтверждено поражение 13-ти из них. На большинстве сортов коллекции поражение мучнисто-росяным патогеном отмечено на верхней стороне листа, но на некоторых сортах мицелий обнаружен также на стеблях. Листья и стебли сортов Виктория и Жакмани (садовая группа Жакма-на) оказались поражены в сильной степени, сортов Маргарет Хант (Патенс) и Чайка (Лану-гиноза) – в средней. Слабо поражены сорта Анастасия Анисимова (Интегрифолия); Бирюзинка, Космическая мелодия, Мефистофель, Пи-илу, Хегли Хайбрид (Жакмана); Виль де Лион, Лесная опера (Витицелла); Миссис Чолмонделли (Флорида).
На пораженных растениях зафиксирован мицелий с конидиальным спороношением (рис. 1, 2) и плодовые тела гриба – клейстотеции (рис. 3, 4). Конидии гриба эллиптической формы, в отдельных случаях переходящей в цилиндр, находились в цепочках из 1–3 шт., отделялись от основания по одной по мере созревания и имели размер 26,4-36,1 x 13,9-16 мкм. Клейстотеции диаметром 43,3–86,3 мкм имели придатки (около 10 шт.) длиной в среднем 92,6 мкм (от 0,5 до 1–2 диаметра клейстотеция) и клетки перидия диаметром 6,5–8,4 мкм. Клейстотеции содержали по 2 сумки размером 54,62 x 33,21 мкм, в каждой из которых находилось 2–4 аскоспоры размером 14,86-17,35 x 9,24-10,84 мкм (рис. 5). Морфометрические данные, полученные нами, соответствовали описанию мучнисто-росяного гриба Erysiphe aquilegiae var. ranunculi (Grev.) R. Y. Zheng & G.Q. Chen в монографии U. Braun [10] и других использованных нами источниках информации.
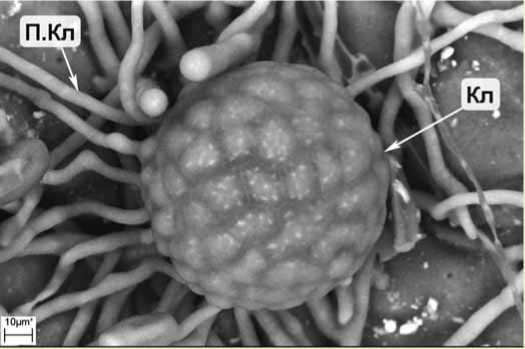
Рис. 3. Клейстотеций с придатками гриба
E. aquilegiae var. ranunculi на верхней стороне листа клематиса сорта Виктория :
Кл – клейстотеций; П.Кл – придаток клейстотеция (криоСЭМ)
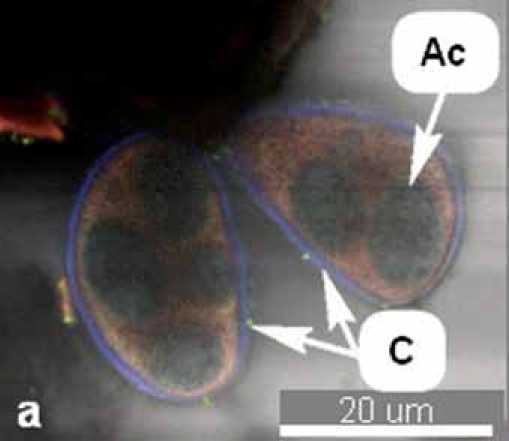
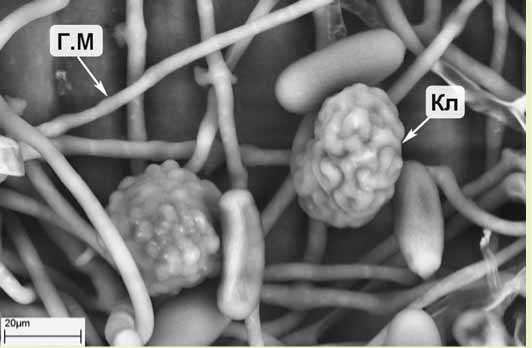
Рис. 4. Развитый мицелий и молодые клейстотеции гриба
E.aquilegiae var. ranunculi на верхней стороне листа клематиса сорта Виль де Лион:
Кл – клейстотеций; Г.М – гифа мицелия (криоСЭМ)
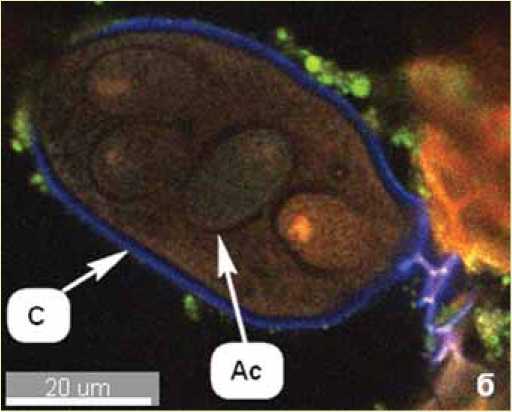
Рис. 5. Две сумки с аскоспорами (а), сумка с 4-мя аскоспорами (б) гриба E. aquilegiae var. ranunculi на представителе рода Clematis L.:
С – сумки, Ас – аскоспоры
(фрагменты 3D-снимков КЛСМ, автофлюоресценция)
Выводы
В результате исследования получены данные о виде мучнисто-росяного патогена, поражающем растения клематисов в коллекции отдела декоративных растений Главного ботанического сада им. Н. В. Цицина РАН – E. aquilegiae var. ranunculi, представителе рода Erysiphe DC. Кроме того, нами выявлены наиболее восприимчивые к патогену сорта коллекции. В целом поражае-мость коллекции невысока, так как визуально и методом криоСЭМ подтверждено инфицирова- ние 13-ти из 60-ти обследованных сортов клематиса. Это – представители садовых групп Вити-целла (сорта Лесная опера, Виль де Лион); Жакма-на (Бирюзинка, Виктория, Жакмани, Космическая мелодия, Мефистофель, Пиилу, Хегли Хайбрид); Интегрифолия (Анастасия Анисимова); Ланугиноза (Чайка); Патенс (Маргарет Хант); Флорида (Миссис Чолмонделли). Сильное и среднее поражение мучнисто-росяным грибом Erysiphe aquilegiae var. ranunculi отмечено у 4-х сортов коллекции, незначительное поражение – у 9-ти.
Список литературы Диагностика пораженности клематисов мучнистой росой с помощью методов сканирующей электронной и конфокальной лазерной микроскопии
- Горленко, М. В. Мучнисторосяные грибы Московской области (Семейство Erysiphaceae)/М. В. Горленко. -М.: Изд-во МГУ, 1983. -77 с.
- Бункина, И. А. Аскомицеты: эризифальные, клавиципитальные, гелоциальные = Ascomycetes: erysiphales, clavicipitales, helociales/И. А. Бункина. -Л: Наука, Ленингр. отд., 1991. -393 с.: ил. -(Низшие растения, грибы и мохообразные советского Дальнего Востока. Грибы/; т. 2.
- Гелюта, В. П. Флора грибов Украины. Мучнисторосяные грибы/В. П. Гелюта. -К.: Наук. думка, 1989. -256 с.
- Paul, Y. S. Indian Erysiphaceae/Y. S. Paul, V. K. Thakur. -Scientific Publishers. Jodhpur. India, 2006. -134 p.
- Braun, U. The Indian Erysiphaceae revisited/U. Braun, Y. S. Paul//Nova Hedwigia. -2009. -V. 89. -P. 371-395.
- Two Erysiphe species associated with recent outbreak of soybean powdery mildew: results of molecular phylogenetic analysis based on nuclear rDNA sequences/S. Takamatsu, H. D. Shin, U. Paksiri, S. Limkaisang //Mycoscience. -2002. -V. 43. -P. 333-341.
- Powdery Mildews on Ornamental Trees and Shrubs in Norway/V. Talgо, L. Sundheim, H. B. Gjаеrum //European Journal of Plant Science and Biotechnology. -2011. -V. 5(1). -P. 86-92.
- Morphological and molecular identification of powdery mildew of Clematis manshurica caused by Erysiphe aquilegiae in China/R. Zhou, H. Xu, Y. Ou //Phytoparasitica. -2015. -V. 43. -№ 1. -P. 15-19.
- www. indexfungorum.org
- Braun, U. Taxonomy Manual of the Erysiphales (Powdery Mildews)/U. Braun, R. T. A. Cook//CBS Biodivers. -2012. -Ser. 11. -703 p.
- O'Kane, W. C. The Ohio Powdery Mildews/W. C. O'Kane//The Ohio Naturalist. -1910. -V. 10 (7). -P. 166-176.
- Parmelee, J. A. The fungi of Ontario. II. Erysiphaceae (mildews)/J. A. Parmelee//Can. J. Bot. -1977. -V. 55. -P. 1940-1983.
- Xu, X. The effects of temperature on the incubation and latent periods of powdery mildew (Erysiphe polygoni) on clematis/X. Xu, J. Robinson//Journal of Phytopathology. -2001. -V. 149. -№. 10. -Р. 565-568.
- Laundon, G. F. New host records of plant disease fungi in New Zealand/G. F. Laundon//New Zealand journal of agricultural research. -1978. -V. 21. -№ 4. -Р. 705-707.
- Severoglu, Z. Powdery mildew disease in some natural and exotic plants of Istanbul, Turkey/Z. Severoglu, I. I. Ozyigit//Pak. J. Bot. -2012. -V. 44. -P. 387-393.
- Liu, T. Golovinomyces clematidis sp. nov. from China/T. Liu, J. Wen//Mycotaxon. -2013. -V. 125. -№ 1. -P. 107-110.
- Патент РФ 2010108947/28, 11.03.2010. Рябченко А. С., Бабоша А. В. Применение термопасты в качестве клеящего и теплопроводящего состава при исследовании биологических образцов на сканирующем электронном микроскопе с использованием замораживающей приставки//Патент на изобр. № 2445660 RU от 2012 г.
- Рябченко, А. С. Исследование мучнисторосяных и ржавчинных грибов древесных и кустарниковых культур методом сканирующей электронной микроскопии/А. С. Рябченко, А. В. Дымович, А. В. Бабоша//Древесные растения: фундаментальные и прикладные исследования. -Вып. 1. -М.: Астра-Полиграфия, 2011. -С. 156-160.
- Мониторинг поражаемости коллекции сирени мучнистой росой в ГБС РАН/О. Б. Ткаченко, А. В. Бабоша, А. С. Рябченко, И. Б. Окунева//Древесные растения: фундаментальные и прикладные исследования. -Вып. 2. -М.: Эквилибрис пресс, 2013. -С. 93-101.


