Диагностика рака щитовидной железы с применением высокопольной магнитно-резонансной томографии
Автор: Фролова Ирина Георгиевна, Чойнзонов Евгений Лхамацыренович, Боберь Е.Е., Быстрова Н.Ю., Мухамедов Марат Рафкатович, Величко Светлана Андреевна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 4 (58), 2013 года.
Бесплатный доступ
Проанализированы данные, полученные при выполнении магнитно-резонансной томографии с использованием динамического контрастирования и построением графиков зависимости «интенсивность сигнала-время», которая выполнялась в предоперационном периоде пациентам со злокачественными новообразованиями щитовидной железы. Проведен анализ диагностической ценности высокопольной МРТ с динамическим контрастированием в диагностике рака щитовидной железы.
Мрт, динамическое контрастирование, рак щитовидной железы
Короткий адрес: https://sciup.org/14056347
IDR: 14056347 | УДК: 616.441-006.6-073.756.8
Текст научной статьи Диагностика рака щитовидной железы с применением высокопольной магнитно-резонансной томографии
Совершенствование методов лучевой диагностики ведет к поиску новых патогномоничных признаков узловых образований различной природы в щитовидной железе (ЩЖ). Ультразвуковое исследование (УЗИ) является ведущим методом визуализации патологии щитовидной железы, метод позволяет на ранних стадиях выявлять различные патологические образования [1, 2]. Сонография, обладая высокой разрешающей способностью, дает возможность оценить размеры, структуру опухолевого узла, исследовать кровоток. Онкологическую настороженность вызывают гипоэхогенные узлы с гетерогенной структурой, неровными и нечеткими контурами [11]. Несмотря на совершенствование ультразвуковой техники, эхография не позволяет с высокой достоверностью исключить или подтвердить злокачественную трансформацию в узлах щитовидной железы [4, 6].
Широкое применение в диагностике опухолевых образований в ЩЖ получила тонкоигольная аспирационная биопсия с цитологическим исследованием пункционного материала [8, 9].
Результативность цитологического заключения при пункции щитовидной железы колеблется в пределах 58,2–82 % [2, 7, 16]. Методика обладает высокой специфичностью в установлении патомор-фологического диагноза.
Трудности диагностики возникают при многоочаговой патологии, при ретротрахеальном и загрудинном расположении зоба, поэтому все чаще у этой категории больных используют рентгеновскую компьютерную томографию и магнитно-резонансную томографию [12, 16, 17]. Магнитно-резонансная томография (МРТ) в отличие от УЗИ и компьютерной томографии обладает наибольшей контрастностью мягких тканей шеи. Метод способен дать информацию об анатомии структур шеи и верхней части грудной клетки, одновременно выявляя объемные образования в щитовидной железе размером до 2–3 мм и увеличенные лимфатические узлы шеи [3, 15]. Однако остается открытым вопрос о способности МРТ определять характер патологического процесса при изучении различных комбинаций интенсивности сигнала от структур узловых образований. Некоторые исследователи считают, что достаточно УЗИ с ЦДК и тонкоигольной аспирационной биопсией. Другие указывают на возможность получения достоверных данных о морфологическом строении узлов щитовидной железы при использовании МРТ, а также на высокую эффективность дифференциальной диагностики доброкачественных очагов и рака ЩЖ [13–17].
Таким образом, вопрос о наличии объективных критериев, определяющих роль МРТ в диагностическом алгоритме при выявлении рака щитовидной железы, продолжает оставаться актуальным.
Материал и методы
Проведено комплексное обследование 22 пациентов с морфологически верифицированным раком щитовидной железы T1–4N0–3M0 стадии, находившихся на лечении в ФГБУ «НИИ онкологии» СО РАМН. Из них 18 женщин и 4 мужчин. Возраст больных колебался в пределах от 27 до 68 лет, средний возраст – 49,3±1,3 года. Комплексная диагностика включала осмотр и пальпацию щитовидной железы и шейных лимфатических узлов, ультразвуковое исследование щитовидной железы с последующей тонкоигольной аспирационной биопсией под ультразвуковым контролем, магнитно-резонансную томографию щитовидной железы. В большинстве случаев (31,8 %) выявлена Т2N0М0 стадия (таблица). При этом в 91 % морфологически был верифицирован папиллярный рак, в 4,5 % – медуллярный вариант карциномы, в 4,5 % – низкодифференцированный рак.
Таблица
распределение больных раком щитовидной железы по стадиям
|
Стадия процесса |
Число больных |
|
Т 1 N 0 М 0 |
3 (13,63 %) |
|
Т2N0М0 |
7 (31,81 %) |
|
Т 2 N 2 М 0 |
1 (4,55 %) |
|
Т2N3М0 |
1 (4,55 %) |
|
Т3N0М0 |
4 (18,18 %) |
|
Т 3 N 1 М 0 |
1 (4,55 %) |
|
Т3N2М0 |
1 (4,55 %) |
|
Т 3 N 3 М 0 |
1 (4,55 %) |
|
Т4N2М0 |
1 (4,55 %) |
|
Т4N3М0 |
2 (9,08 %) |
|
Всего |
22 (100 %) |
Эхография проводилась на ультразвуковом сканере Aloka SSD-5500 ProSound PHD с использованием мультичастотного линейного датчика 7–11 МГц в режиме серошкального сканирования (В-режиме), цветового и энергетического допплеровского картирования (ЦДК и ЭДК) с использованием тканевой гармоники. При выявлении очаговых образований щитовидной железы проводилась тонкоигольная пункционная аспирационная биопсия под контролем ультразвука с последующим цитологическим исследованием.
Магнитно-резонансная томография проводилась на 1,5Т МР-томографе «Magnetom Essenza» (Siеmens, Германия). Исследование начиналось с выполнения локалайзера в 3 плоскостях. По ло-калайзеру выставляли последующие плоскости сканирования с необходимым количеством срезов. Зона исследования начиналась от области околоушных слюнных желез до уровня бифуркации трахеи. Протокол исследования включал получение изображений в стандартных импульсных последовательностях на Т1-взвешанных изображениях (ВИ), Т2-ВИ, методику подавления сигнала от жира, DWI с толщиной срезов 3 мм. Первоначально выполнялась серия изображений в коронарной плоскости с подавлением сигнала от жира. Далее выполнялись сканы в аксиальной и сагиттальной проекциях в Т1, Т2 и DWI изображениях. При необходимости протокол исследования дополнялся серией аксиальных сканов с подавлением сигнала от жира (для оценки состояния лимфатических узлов).
МРТ с динамическим контрастированием выполнялась в аксиальной проекции с получением Т1-ВИ в последовательности VIBE 3D. На первом этапе выполняли одну преконтрастную серию Т1-ВИ в аксиальной проекции. С помощью автоматического инъектора болюсно вводили парамагнетик в стандартной дозе 0,2 мл/кг с последующим введением 30 мл физиологического раствора. Использование инъектора позволяло выполнить введение контрастного препарата непосредственно во время сканирования и избежать смещения тела пациента во время исследования, что важно для дальнейшего постпроцессорного анализа и субтракции с построением динамических кривых. После введения парамагнетика получали серию сканов Т1-ВИ в аксиальной проекции, выполненных с теми же техническими параметрами, кото- рые сравнивали с аналогичными изображениями до введения контрастного вещества.
В завершение исследования осуществляли постпроцессорный анализ в виде математической обработки полученных изображений с методикой цифровой субтракции и построения графиков захвата и выведения контрастного вещества, с помощью которых оценивали степень накопления и динамику прохождения контрастного вещества в узловых образованиях, а также в неизмененной паренхиме щитовидной железы для проведения сравнительного анализа. Данные анализа представляли в виде графической зависимости изменения интенсивности сигнала от времени при прохождении парамагнитного контрастного средства.
Результаты и обсуждение
По данным магнитно-резонансной томографии размеры опухоли колебались от 8 мм до 83 мм, средний размер составил 23 ± 6 мм. Новообразования, как правило, локализовались в одной из долей, в 76,2 % располагались в пределах капсулы железы и не распространялись на окружающие структуры.
В 81,8 % злокачественные опухоли щитовидной железы имели нечеткие и неровные контуры, в 22,7 % отмечалась инвазия в окружающие органы (клетчатка, трахея, сосудистые структуры). При этом в 18,2 % образования имели четкие и ровные контуры (что более характерно для доброкачественных образований), но четкой капсулы не прослеживалось.
Структура опухоли была неоднородной. Злокачественные образования имели преимущественно изо- или слабогиперинтенсивный сигнал на Т1-ВИ и изоинтенсивный сигнал на Т2-ВИ, с наличием различного рода включений. При этом гиперинтенсивные участки на Т2-ВИ были обусловлены накоплением белковых элементов (таких как коллоида, амилоида) и слабой выраженностью фиброза. Линейные гипоинтенсивные участки на Т1-ВИ (72,2 %) и Т2-ВИ соответствовали фиброзным включениям, а мелкие (2–3 мм) участки сниженного МР-сигнала на Т1- и Т2-ВИ соответствовали участкам обызвествления – 22,2 % и 27,8 % соответственно.
МРТ позволила выявить истинные границы опухоли, взаимоотношение с прилежащими анатомическими структурами. В 13,6 % опухолевая инфильтрация распространялась на окружающие
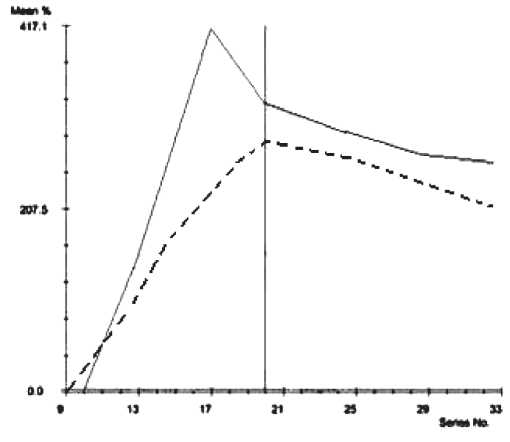
Рис. 1. Динамические кривые зависимости «интенсивность сигнала – время»
Примечание: ------нормальная паренхима щитовидной железы, определяется постепенное увеличение интенсивности сигнала от контрастного вещества, с последующим равномерным снижением интенсивности сигнала во времени; рак щитовидной железы, определяется раннее интенсивное усиление сигнала, с формированием острого пика с последующим быстрым вымыванием сосуды (внутреннюю яремную вену, общую сонную артерию), что характеризовалось нечеткостью контуров между образованием и прилежащей стенкой, а в ряде случаев сужением просвета сосуда. В 4,7 % опухоль инфильтрировала стенки трахеи с образованием экзофитного компонента в ее просвете. В 18,2 % опухоль распространялась загрудинно, и по данным сонографии возникали трудности в оценке истинных границ образования. Максимальный размер загрудинной опухоли достигал 83 мм (рис. 1), при этом она оттесняла и сдавливала окружающие структуры (трахею, пищевод).
В алгоритм обследования была включена оценка лимфатических узлов шеи, начиная от уровня околоушных лимфатических узлов и заканчивая уровнем верхней паратрахеальной группы. Так, в 13,6 % были выявлены увеличенные паратрахеаль-ные лимфатические узлы, не визуализированные по данным УЗИ. В 22,7 % выявлены увеличенные лимфатические узлы размерами более 15 мм, которые при морфологическом исследовании операционного материала определены как метастатические. Как правило, это были узлы на стороне поражения,
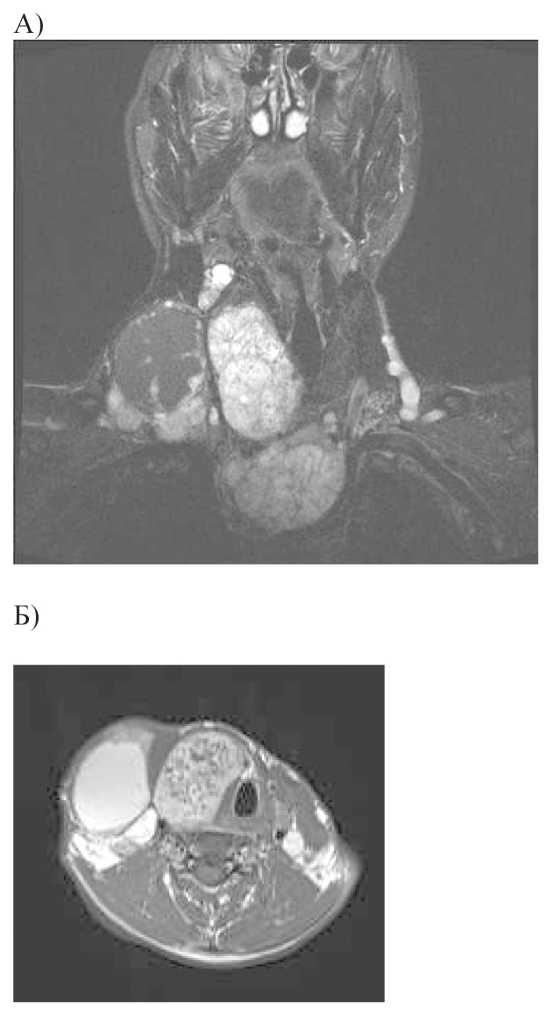
Рис. 2. МР-томограммы: А) Т2 ВИ с подавлением сигнала от жира (фронтальный срез); Б) Т2 ВИ (аксиальный срез). Папиллярный рак щитовидной железы на фоне микро-макрофолликулярного зоба с метастатическим поражением лимфатических узлов шеи, верхнего средостения. Правая доля и перешеек щитовидной железы представлены объемным образованием, с четкими, неровными контурами, неоднородной солидной структуры, с наличием кальцинатов. Справа визуализируется конгломерат метастатически измененных лимфатических узлов в 9,1 % случаев поражение лимфатических узлов носило двусторонний характер.
При выполнении динамической МРТ у всех пациентов очаговые образования злокачественного характера в щитовидной железе усиленно накапливали контрастное вещество по сравнению с паренхимой щитовидной железы. При этом нормальная паренхима щитовидной железы равномерно и однородно накапливала парамагнетик. Как правило, это были очаги, имеющие гипоинтенсивный или слабогиперинтенсивный сигнал с наличием гипоинтенсивных включений на Т2-ВИ.
При анализе параметров динамического МР-сканирования основными критериями оценки явились: тип кривой накопления и выведения контрастного препарата, время достижения пика и степень максимального контрастирования. По данным литературы, выделяют несколько типов кривых интенсивность-время [5, 10]. В неизмененной паренхиме щитовидной железы накопление контрастного вещества выглядело как постепенное увеличение интенсивности сигнала с последующим равномерным снижением во времени (рис. 2). По результатам нашего исследования в 63,6 % случаев характерным был тип кривой, отражающий раннее интенсивное усиление сигнала, с формированием острого пика на 12–17-й сек (быстрое накопление), после достижения – фаза выведения контрастного вещества, называемая в литературе «wash out» и отражающая процесс быстрого его вымывания (рис. 2). В остальных случаях наблюдался тип кривой, который более характерен для доброкачественных образований: раннее и интенсивное усиление сигнала на 14–23 сек, с последующим медленным выведением и/или плато (отсутствием динамики). Таким образом, при оценке параметров динамического контрастирования в 36,4 % случаев однозначно высказаться о наличии злокачественной опухоли было сложно, однако полностью исключить наличие рака в выявленных очагах было нельзя, что было подтверждено результатами морфологического исследования. Также необходимо отметить, что оценку результатов затрудняла высокая степень васкуляризации нормальной паренхимы щитовидной железы, так как в сравнении с другими органами ЩЖ имеет маленький объем и интенсивную васкуляризацию.
Заключение
МРТ следует считать наиболее точным неинвазивным методом диагностики рака щитовидной железы. Преимуществами метода являются получение изображения в любой проекции без потери его качества и отсутствие лучевой нагрузки на пациентов. Использование МРТ при низко расположенной щитовидной железе, анатомических особенностях строения шеи, а также при наличии патологического процесса, распространяющегося загрудинно, имело несомненное преимущество перед УЗИ в выявлении истинных границ опухоли, распространения образования на окружающие структуры и в оценке паратрахеальных лимфатических узлов, не всегда визуализированных при ультразвуковом исследовании. Рак щитовидной железы характеризовался нечеткими, неровными контурами, неоднородностью сигнала, которая была обусловлена преимущественно гипоинтен-сивными включениями как линейного, так и глыб-чатого характера на Т2-ВИ. При распространении за пределы капсулы отмечался инфильтративный характер роста с вовлечением в патологический процесс окружающих структур. При динамическом контрастировании выявлено раннее усиление интенсивности сигнала с формированием острого пика, с последующим преобладанием фазы выведения контрастного вещества.
Таким образом, включение МРТ в алгоритм обследования дополняет данные сонографии о распространенности патологического процесса и состоянии регионарного лимфатического аппарата.


