Диагностика тромбоэмболии легочной артерии у больных хронической сердечной недостаточностью
Автор: Пронин А.Г., Тюрин В.П., Карташева Е.Д.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Оригинальные статьи
Статья в выпуске: 3 т.10, 2015 года.
Бесплатный доступ
Обследовано 102 больных ТЭЛА на фоне ХСН и 58 больных ХСН с повышенным уровнем Д-димера без ТЭЛА по данным КТ-ангиопульмонографии. Уровень мозгового натрийуретического пептида в группах не различался. Наиболее информативными при-знаками ТЭЛА были такие традиционные признаки, как тромбоз глубоких вен нижних конечностей, кровохарканье, парезы, синдром SIQIII, отрицательный зубец Т в отведениях V1-V3 на ЭКГ, повышения ЧСС менее 100 ударов в мин., уровня Д-димера более 1,0 мг/л.
Тромбоэмболия легочной артерии, хроническая сердечная недостаточность, д-димер, мозговой натрийуретический пептид
Короткий адрес: https://sciup.org/140188463
IDR: 140188463 | УДК: 616.24-005.7-07:616-008.46-036.12
Текст научной статьи Диагностика тромбоэмболии легочной артерии у больных хронической сердечной недостаточностью
Тромбоэмболия легочной артерии (ТЭЛА) широко распространена: 23–250 случаев на 100 000 населения в год или до 1% всех госпитализаций [1, 7, 17, 28]. Она является третьей по частоте причиной смерти среди сердечно-сосудистых заболеваний [22]. ТЭЛА выявляется на аутопсии в 12–15% [15].
Летальность зависит от уровня проксимальной окклюзии легочной артерии. При эмболии в крупные легочные артерии она достигает 30–38,6% [15, 19]. При эмболии в долевые или сегментарные ветви летальность значительно меньше [21]. При сегментарном поражении легочного русла ТЭЛА могут вообще не диагностировать в связи с отсутствием патогномоничных признаков или молосимптомностью заболевания [11, 12, 23, 29].
Тромбоэмболия ветвей легочных артерий в 80% от всех случаев является осложнением основных заболеваний различного профиля [8]. У пациентов с терапевтической патологией ТЭЛА диагностируют в 70–83% случаев [9, 21]. В этой кагорте больных наиболее значимой и прогностически неблагоприятной по развитию тромбоэмболических осложнений является хроническая сердечная недостаточность (ХСН). В свою очередь риск возникновения тромбозов и ТЭЛА нарастает с увеличением степени сердечной недостаточности. У больных ХСН II–III функционального класса (ФК) частота возникновения тромбоэмболий в течение года составляла 1,8%, а при ХСН IV ФК – 4,6% [14, 27]. В свою очередь, чем выше ФК ХСН, тем более схожа клиническая картина у пациентов с ТЭЛА и больных с ХСН, а дифференциальная диагностика этих заболеваний еще более затруднена.
ТЭЛА не имеет патогномоничных симптомов, а ее диагностика основывается на совокупности таких клини- ческих данных как: факторы риска наличия тромбоэмболических осложнений, клиническая картина, результаты лабораторных и инструментальных исследований.
Для уточнения возможности наличия ТЭЛА Европейским кардиологическим обществом рекомендованы к использованию шкалы Wells и Geneva, учитывающие вышеперечисленные клинические признаки (табл. 1 и табл. 2) [26].
Обе шкалы ориентированы на прогнозирование ТЭЛА у больных с хирургической патологией. Для терапевтических больных эти шкалы обладают малой чувствительностью [30]. В них большое значение отводится признакам ТГВ и в этих случаях рассматриваемые шкалы наиболее достоверны. Однако у 30–35% больных с достоверно доказанным диагнозом ТЭЛА тромбоза вен нижних конечностей не выявляют [4, 25, 28]. Эта группа пациентов представляет серьезные трудности с точки зрения диагностики ТЭЛА.
Цель исследования
Улучшение диагностики ТЭЛА у больных ХСН путем определения наиболее характерных анамнестических, клинических и лабораторных признаков.
Материалы и методы
С целью решения поставленной задачи нами проведено сравнительное исследование 160 пациентов, находившихся на лечении с 2007 по 2015 г. в НМХЦ им Н.И. Пирогова с подозрением на ТЭЛА на фоне ХСН II–IV ФК по NYHA. Возраст больных колебался от 18 до 96 лет. Мужчин было – 90, женщин – 70. Всем больным выполняли общеклинические и биохимические исследования крови, Д-димер, NT-proBNP, Эхо-КГ,
Табл. 1. Модифицированный индекс Geneva
|
Признак |
Баллы |
|
1. Факторы риска: |
|
|
Возраст > 65 лет |
+1 |
|
ТГБ или ТЭЛА в анамнезе |
+3 |
|
Большая операция или перелом в предшествующий месяц |
+2 |
|
Активный злокачественный процесс |
+2 |
2. Симптомы:
|
Боль в ноге с одной стороны |
+3 |
|
Кровохарканье |
+2 |
|
ЧСС 75-94 ударов в минуту |
+3 |
|
ЧСС ≥ 95 ударов в минуту |
+5 |
|
Признаки тромбоза глубоких вен нижних конечностей |
+4 |
Вероятность ТЭЛА:
|
Низкая (10%) |
0-3 |
|
Средняя (30%) |
4–10 |
|
Высокая (65%) |
≥ 11 |
Табл. 2. Индекс Wells
|
Признак |
Баллы |
|
1. Факторы риска: |
|
|
ТГБ или ТЭЛА в анамнезе |
+1,5 |
|
Недавняя операция или иммобилизация |
+1,5 |
|
Рак |
+1 |
|
2. Симптомы: |
|
|
Кровохарканье |
+1 |
|
ЧСС > 100 ударов в минуту |
+1,5 |
|
Клинические признаки ТГВ |
+3 |
|
3. Клиническое суждение о диагнозе: |
|
|
Другой диагноз менее вероятен, чем ТЭЛА |
+3 |
|
Вероятность ТЭЛА (на основании 1 и 2 групп критериев): |
|
|
Низкая |
0-1 |
|
Средняя |
2–6 |
|
Высокая |
≥ 7 |
Вероятность ТЭЛА (на основании 1, 2 и 3 групп критериев):
|
ТЭЛА менее вероятна |
0–4 |
|
ТЭЛА более вероятна |
> 4 |

УЗДГ вен нижних конечностей. Всем выполняли КТ ангиографию легочных артерий, являющуюся наиболее информативным методом диагностики ТЭЛА: точность, чувствительность и специфичность метода составляет: 96,8%; 96,9%; 100%, соответственно [16]. У 102 пациентов первой группы с достоверно диагности-рованой ТЭЛА. Уровень проксимальной окклюзии был следующим: главная легочная артерия – 41%, долевые – 31%, сегментарные артерии – 28% больных. Возраст больных колебался от 27 до 91 года, 64,6 ± 15,4. Мужчин было 55, женщин – 47. Вторую группу составляли 58 пациентов с ХСН II-IV ФК и имеющих повышенный уровень Д-димера. Мужчин было 35, женщин – 23. Возраст больных колебался от 18 до 96 лет, средний возраст составил 67,3 ± 14,9.
Результаты исследования и обсуждение
При проведении сравнительного анализа предрасполагающих факторов риска ТЭЛА установлена достоверная значимость гиподинамии у больных с парезами и плегией, как последствие перенесенного нарушения мозгового кровообращения (табл. 3).
При сравнении основных клинических проявлений ТЭЛА в группах достоверных различий не установлено, за исключением показателей уровня ЧСС. Тахикардия более 100 в минуту достоверно чаще была в группе больных ХСН (47% и 27%, соответственно, р = 0,01). При ТЭЛА уровень ЧСС был достоверно менее выражен, менее 100 ударов в минуту, чем у больных с ХСН (73% и 53%, соответственно (р = 0,01) (табл. 4).
Типичные ЭКГ признаки ТЭЛА (SIQIII, отрицательные зубцы Т в отведениях V1-V3) достоверно чаще регистрировали в первой группе больных. Различий в диагностике БПНПГ между группами не установлено (табл. 5).
Среди лабораторных показателей самым информативным является определение уровня Д-димера в крови. Принято считать, что он обладает высоким отрицательным и низким положительным (специфичность составляет лишь 53%) прогностическим значением [10, 32].
Табл. 3. Факторы риска тромбоэмболических осложнений в сравниваемых группах пациентов
|
Онкология |
Парез, плегия |
ТЭЛА, ТГВ в анамнезе |
Болезни легких и наличие ХДН |
Пост режим более 5 суток |
Болезни толстой кишки |
Индекс массы тела >29 |
Варикозная болезнь вен н/к |
|
|
ХСН+ ТЭЛА n-102 |
19% |
14% |
20% |
23% |
17% |
7% |
26% |
20% |
|
ХСН с Д-Димером n-58 |
10% |
2% |
9% |
31% |
5% |
2% |
35% |
24% |
|
р |
0,58 |
0,02 |
0,07 |
0,47 |
0,13 |
0,09 |
0,12 |
0,28 |
Табл. 4. Частота встречаемости симптомов у больных с верифицированной ТЭЛА на фоне ХСН и ХСН без ТЭЛА
|
Синкопальные состояния |
Боль в грудной клетке |
Кашель |
Одышка |
Кровохарканье |
Гипоксемия < 90 |
ЧСС < 100 |
Тахикардия > 100 |
|
|
ХСН+ ТЭЛА n-102 |
11% |
29% |
25% |
82% |
6% |
27% |
73 |
27% |
|
ХСН с Д Димером n-58 |
9% |
34% |
21% |
91% |
0% |
36% |
53% |
47% |
|
р |
0,7 |
0,51 |
0,41 |
0,12 |
0,06 |
0,24 |
0,01 |
0,01 |
Табл. 5. ЭКГ признаки ТЭЛА
|
ЭКГ: SIQIII |
ЭКГ: Отриц. зубцы Т V1-V3 |
ЭКГ: БПНПГ |
|
|
ХСН+ ТЭЛА n-102 |
28% |
30% |
26% |
|
ХСН с Д-Димером n-58 |
4% |
9% |
15% |
|
р |
0,001 |
0,003 |
0,11 |

Нами установлен повышенный уровень Д-димера в группе ХСН без ТЭЛА у всех больных. Его уровень у 43% (у 15 из 35 больных) колебался от 0,5 до 1 мг/л; у 31% (11 больных) он был от 1 до 1,5 мг/л, у остальных пациентов значения превышали 1,5 мг/л. Таким образом, почти в 75% случаев уровень Д-димера не превышал значения 1,5 мг/л. А его среднее значение составляло 1,25 ± 0,74 мг/л.
У больных ТЭЛА на фоне ХСН уровень Д-димера был распределялся следующим: в 20% от 0,5 до 1 мг/л, в 44% случаев- от 1 до 2 мг/л, в 26%- от 2 до 4 мг/л, в 10%- более 4 мг/л. В среднем уровень Д-димера в этой группе был больше – 2,1 ± 1,2 мг/л. Сравнение средних показателей Д-димера в группах выявила достоверность различия (р = 0,001). Таким образом, чем выше уровень Д-димера, тем больше вероятность ТЭЛА, а при значениях Д-димера в диапазоне от 0,5 до 1,0 у больного ХСН с повышенным уровнем Д-димера, вероятность ТЭЛА мала.
Проведена оценка диагностической значимости уровня плазменной концентрации мозгового натрийуретического пептида у больных ТЭЛА на фоне ХСН и у больных ХСН с повышенным уровнем Д-димера. Уровень NT-proBNP был повышен у 80,6% больных с доказанной ТЭЛА и у 100% с ХСН без тромбоэмболических осложнений. При этом в первой группе уровень его был достоверно меньше, чем во второй (2707 ± 3986 фмоль/мл и 5273 ± 3286 фмоль/мл, соответственно, р < 0,01). Обращает на себя внимание большой разброс значений мозгового натрийуретического пептида, в обеих группах, находящийся практически в одном диапазоне. В этой связи уровень мозгового натрийуретического пептида невозможно считать специфическим для дифференциальной диагностики ТЭЛА и ХСН.
Корреляционный анализ зависимости уровня NT-proBNP от объема поражения легочного русла у больных с ТЭЛА на фоне ХСН выявил умеренную корреляционную зависимость по таким показателям как поражение главной легочной артерии- r-0,44, долевой артерии- r-0,41. Слабая степень корреляции отмечалась при обтурации сегментарных легочных артерий r-0,22. Исходя из этого, можно сделать вывод, что повышение данного пептида наиболее характерно только для тромбоэмболии крупных легочных артерий.
Из инструментальных методов исследования, позволяющих косвенно, в совокупности с другими симптомами, судить о вероятности наличия ТЭЛА, являются данные Эхо-КГ: признаки перегрузки и дисфункции правых отделов сердца, степень легочной гипертензии и др. [2]. Однако Эхо-КГ критерии были представлены с одинаковой частотой, без достоверности различия, в обеих группах (табл. 6).
При проведении регрессивного анализа нами установлена достоверная разница в пользу ТЭЛА и проведена оценка при помощи метода отношения шансов сравниваемых показателей по следующим позициям (табл. 7).
Наиболее информативными являются показатели инструментальных исследований – признаки тромбоза глубоких вен по данным УЗДГ. Менее специфичными, но так же позволяющими улучшить диагностику ТЭЛА на фоне ХСН являлись: кровохарканье, ЧСС менее 100 ударов в минуту, уровень Д-димера более 1,0 мг/л, признаки ЭКГ (SIQIII и отрицательные Т в V1-V3, БПНПГ). Сочетание 2 и более из этих факторов с большей долей вероятности позволяли судить о наличии у пациента ТЭЛА (рис. 1).
Таким образом, нами были выявлены критерии диагностики ТЭЛА у больных с ХСН (табл. 8).
Данная методика была проверена на контрольной группе больных из 60 пациентов: из которых у 30 больных были ХСН и ТЭЛА с различным уровнем поражения легочного русла и у 30 пациентов была ХСН без ТЭЛА.
Были получены следующие результаты: диагностическая чувствительность – 76,7%, диагностическая специфичность – 86,7%, диагностическая эффективность – 81,7%, отрицательная диагностическая значимость – 78,8%.
Табл. 6. Распространенность Эхо-КГ симптомов в группах сравнения
|
Эхо: дилатация ПЖ более 3 см |
Эхо: дилатация ПП более 65 ми |
Эхо: ЛГ более 30 мм рт. ст. |
Эхо: ТР2-3 |
Эхо: ПЖ/ ЛЖ > 1 |
Эхо: парадоксальное движение МЖП |
Эхо: расширение НПВ более 20 мм |
|
|
ХСН+ ТЭЛА n-102 |
35% |
51% |
87% |
44% |
7% |
5% |
16% |
|
ХСН с Д-Ди-мером n-58 |
25% |
50% |
84% |
38% |
2% |
4% |
17% |
|
р |
0,19 |
0,9 |
0,6 |
0,46 |
0,17 |
0,77 |
0,87 |
Табл. 7. Значимость прогностических параметров для верификации ТЭЛА
|
Признак |
р |
ОШ |
95% ДИ |
|
Признаки наличия ТГВ |
< 0,01 |
26,571 |
11,115–63,522 |
|
Кровохарканье |
0,05 |
6,319 |
0,74–53,483 |
|
Уровень Д-димера более 1,0 мг/л |
< 0,01 |
2,982 |
1,380–6,448 |
|
Уровень Д-димера 0,5–1 мг/л |
< 0,01 |
0,335 |
0,155–0,725 |
|
ЧСС менее 100 ударов в минуту |
0,004 |
2,312 |
1,286–4,156 |
|
Парезы плегии (признаки гиподинамии) |
0,002 |
7,977 |
1,763–36,096 |
|
Наличие одного или нескольких изменений на ЭКГ: SIQIII, Отриц. Т V1-V3, БПНПГ |
0,002 |
4,011 |
2,091–7,693 |
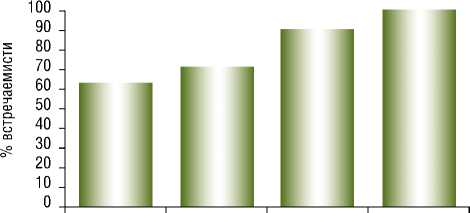
2 фактора 3 фактора 4 фактора 5 и более факторов

сочетание факторов
Рис. 1. Взаимосвязь между совокупностью диагностических признаков и диагностикой ТЭЛА
Табл. 8. Критерии диагностики ТЭЛА у больных с ХСН II-IV функционального
|
класса по NYHA |
|
|
Большой критерий: |
|
|
Признаки тромбоза в системе вен нижних конечностей |
Высокий риск ТЭЛА |
Средние критерии:
|
Кровохарканье |
Сочетание 2 и более критериев – высокий риск наличия ТЭЛА |
|
Парезы, плегии (признаки гиподинамии) |
|
|
Уровень Д-димера более 1,0 мг/л |
|
|
Наличие одного или нескольких изменений на ЭКГ: SIQIII, Отриц. Т V1-V3, БПНПГ |
|
|
ЧСС менее 100 ударов в минуту |
Выводы
При проведении сравнительного анализа клинических признаков, данных лабораторных и инструментальных методов исследования, среди пациентов с диагностированной ТЭЛА на фоне ХСН и ХСН без тромбоэмболических осложнений с повышенным уровнем Д-димера доказано что по большинству оцениваемых позиций достоверных различий нет, кроме таких характерных признаков для ТЭЛА как: наличие признаков тромбоза в системе вен нижних конечностей, кровохарканья, парезов, синдрома SIQIII, отрицательных зубцов Т в отведениях V1–V3 на ЭКГ, повышения ЧСС менее 100 ударов в мин., уровня Д-димера более 1,0 мг/л.
Установлено, что уровень мозгового натрийуретического пептида достоверно выше в группе ХСН без признаков ТЭЛА. Однако специфичность его крайне мала и не позволяет использовать этот маркер для дифференциальной диагностики ТЭЛА и ХСН.
На основе выявленных различий предложена шкала оценки вероятности ТЭЛА у больных ХСН II-IV функционального класса по NYHA. Шкала обладает диагностической чувствительностью – 76,7%, специфичностью – 86,7%, эффективностью – 81,7% и отрицательной диагностической значимостью – 78,8%.
Список литературы Диагностика тромбоэмболии легочной артерии у больных хронической сердечной недостаточностью
- Авдеев С.Н. Тромбоэмболия легочных артерий.//Атмосфера. Пульмонология и аллергология. 2009, № 3, С. 1-8.
- Алехин М.Н. Возможности и ограничения эхокардиографии в оценке давления в легочной артерии и правых камерах сердца Ультразвуковая и функциональная диагностика. 2012, № 6, С. 106.
- Андрюхин А.Н., Фролова Е.В. Клиническое значение определения натрийуретических пептидов при сердечной недостаточности.//Российский семейный врач. 2008, Том 13, №4, С. 24-35.
- Багрова И. В. и др. Современные подходы к диагностике тромбоэмболии легочной артерии//Флебология. 2012, № 4, С. 35-42.
- Баймаканова Г.Е., Авдеев С.Н. Диагностическая и прогностическая значимость концевого N-отрезка мозгового натрийуретического пептида (Nt-proBNP) при обострении хронической обструктивной болезни легких.//Пульмонология. 2011, № 6, С. 80-86.
- Белопольский А.А., Федотова И.Н., Стуров Н.В. Диагностическая значимость NT-proBNP у кардиологических больных.//Трудный пациент. 2013, С. 32-36.
- Бокарев И.Н., Савельев В.С. Венозные тромбозы и тромбоэмболии легочной артерии//Российский кардиологический журнал. 2011, №4, С. 5-12.
- О.В. Булашова, М.И. Малкова. Значение Д-димера в диагностике и прогнозе тромбоэмболических осложнений у кардиологических больных Практическая медицина. 2012, № 60, С. 81-84.
- Вёрткин А.Л., Тополянский А.В., Вовк Е.И., Адонина Е.В., и др. Тромбоэмболия легочной артерии в Терапевтическом стационаре -мифы и реалии//Терапевт. 2010, №3, С. 6-13.
- Воробьева Н.М., Панченко Е.П., Добровольский А.Б., Титаева Е.В. Повышение Д-димера у больных сердечно-сосудистыми заболеваниями без тромбоэмболических осложнений: с чем это связано и что делать?//Ангиология и сосудистая хирургия. 2010, № 4, С. 34-41.
- Глухов А.А. Тромбоэмболия легочной артерии. Воронеж. 2010, С. 79.
- Ермолаев А.А., Плавунов Н.Ф., Спиридонова Е.А., Бараташвили В.Л. Анализ причин гиподиагностики тромбоэмболии легочной артерии на догоспитальном этапе//Кардиология. 2012, № 6, С. 40-47.
- Клименко А.А., Шостак Н.А., Демидова Н.А. и др. Ремоделирование правых камер сердца и уровень мозгового натрийуретического пептида при хронической тромбоэмболической лёгочной гипертензии: сравнительное одномоментное наблюдательное исследование//Рациональная фармакотерапия в кардиологии. 2013, № 3, С. 258-264.
- Кобалава Ж.Д., Аверков О.В., Воробьев А.С., Александрия Л.Г. Сердечная недостаточность и венозные тромбоэмболии: встречаемость, прогноз и профилактика в период госпитализации//«Сердце: журнал для практикующих врачей». 2010, Том 9, № 5, С. 313-318.
- Корнев Б.М., Козловская Л.В., Попова Е.Н., Фомин В.В. Тромбоэмболия легочной артерии: факторы риска, диагностика, лечение.//Consilium medicum. 2003, № 5, С. 289-292.
- Кузнеченко А.А., Китаев В.М., Тюрин В.П, Линчак Р.М. Значение КТАГ в диагностике и оценке эффективности лечения тромбоэмболии легочной артерии//Вестник Национального медико-хирургического центра им Н И Пирогова. 2008, Том З, №1, С. 103-107.
- Куракина Е.А., Дупляков Д.В., Хохлунов С.М., Павлова Т.В. Ценность шкал Geneva и Wells в предсказании клинической вероятности тромбоэмболии легочной артерии//Кардиология и сердечно -сосудистая хирургия. 2011, том 4, №4, С. 85-88
- Мареев В.Ю., Агеев Ф.Т., Арутюнов Г.П., и др. Национальные рекомендации ОССН, РКО и РНМОТ по диагностике и лечению ХСН.//Сердечная Недостаточность. 2013, Том 14, №7, С. 381.
- Медведев А.П., Дерябин Р.А., Немирова С.В. и др. Хирургическое лечение массивной тромбоэмболии легочной артерии у больных пожилого и старческого возраста//Медицинский альманах. 2013, №4, С. 67-71.
- Немирова С.В., Кузнецов А.Н., Медведев А.П. и др. Ошибки в диагностике тромбоэмболии легочных артерий у пациентов терапевтического профиля//Медицинский альманах. 2011, №3, С. 134-138.
- Станиченко Н.С., Загидуллин Б.И., Якубов Р.А. Современные возможности диагностики и лечения тромбоэмболии легочной артерии//Практическая медицина. 2012, С. 128-132
- Терещенко С.Н. Тромбоэмболия легочной артерии ГЭОТАР-Медиа. 2010.
- Тодуров Б.М. Ковтун Г.И. Дружина А.Н. и др. Хирургическое лечение тромбоэмболии легочной артерии. Украина, «Сердечная недостаточность». 2010, №1, С. 62-69.
- Российские клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений//Флебология. 2010, № 4. С. 4-37.
- Casserly B., Klinger J.R. Brain natriuretic peptide in pulmonary arterial hypertension biomarker and potential therapeutic agent. Drug Des Devel Ther 2009, Vol. 3, Р. 269-287.
- Guidelines on the diagnosis and management of acute pulmonary embolism. The Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC)//European Heart Journal 2008, Vol. 29, Р. 2276-2315.
- Peripheral Vascular Disease, and Council on Arteriosclerosis, Thrombosis and Vascular Biology. Management of massive and submassive pulmonary embolism, iliofemoral deep vein thrombosis, and chronic thromboembolic pulmonary hypertension: a scientific statement from the American heart association//Circulation. 2011, Vol. 123, P. 1788-1830.
- Leibovitz A., Blumenfeld O., Baumoehl Y., et al. Postmortem examinations in patients of a geriatric hospital.//AgingClinExpRes. 2001, Vol. 13, P. 406-409.
- Lobo J.L., Zorrilla V., Aizpuru F. et al. Clinical Syndromes and Clinical Outcome in Patients With Pulmonary Embolism. Findings From the RIETE Registry//Chest. 2006, Vol.130, Р. 1817-1822.
- Reesink H.J., Tulevski I.I., Marcus J.T. et al. Brain natriuretic peptide as noninvasive marker of the severity of right ventricular dysfunction in chronic thromboembolic pulmonary hypertension.//Ann Thorac Surg. 2007, Vol. 84, Р. 537-543.
- Righini M., Perrier A., De Moerloose P., Bounameaux H. D-dimer for venous thromboembolism diagnosis: 20 years later.//J Thromb Haemost. 2008, Vol. 6, Р. 1059-1071.
- Suntharalingam J., Goldsmith K., Toshner M. et al. Role of NT-proBNP and 6MWD in chronic thromboembolic pulmonary hypertension.//Respir Med. 2007, Vol. 101, Р.2254-2262.


