Диагностика устойчивости сортов яровой пшеницы и ячменя к обыкновенной корневой гнили кондуктометрическим методом
Автор: Коробова Л.Н., Гурова Т.А., Луговская О.С.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Устойчивость зерновых культур к болезням и вредителям
Статья в выпуске: 5 т.48, 2013 года.
Бесплатный доступ
Известно, что стрессоустойчивость растений — генетически закрепленный признак. У сортов яровых зерновых культур, чувствительных к возбудителю обыкновенной гнили Bipolaris sorokiniana Schoem., модифицируются процессы запасания энергии, интенсивность дыхания, активность ферментов, синтез сахаров и аминокислот, поглощение калия у растений, нарушается целостность мембран, что приводит к частичной потере электролитов из клеток. Степень устойчивости (толерантности) сорта к инфицированию выявляют по потере урожайности (агрономическая устойчивость к болезни) и по изменению физиологических, биохимических и биофизических процессов в ранние фазы вегетации (биологическая устойчивость). Мы апробировали кондуктометрический метод оценки устойчивости растений в лабораторных (искусственное инфицирование в установке искусственного климата; 15 сортов яровой пшеницы и ячменя) и вегетационно-полевых (сосуды без дна; 4 сорта яровой пшеницы, показавших в лабораторных условиях контрастные результаты) экспериментах. Корреляционные связи между разными индикаторами ранней реакции яровой пшеницы и ячменя на биотический стресс оказались достаточно тесными и статистически доказываемыми. Обнаружено, что электрофизические показатели клеточных мембран листовой ткани проростков изменялись пропорционально длине корней и ростков 14-суточных растений, а также интегральному показателю их роста и развития — биомассе, отражая состояние заболевших растений адекватно биометрическим, фитопатологическим и физиологическим показателям, а также потерям урожайности у сорта.
Стрессоустойчивость, обыкновенная корневая гниль, ростовые реакции, проницаемость клеточных мембран, кондуктометрический метод, сорта яровой пшеницы и ярового ячменя
Короткий адрес: https://sciup.org/142133435
IDR: 142133435 | УДК: 633.1:632.4:631.524.86:57.087
Текст научной статьи Диагностика устойчивости сортов яровой пшеницы и ячменя к обыкновенной корневой гнили кондуктометрическим методом
Степень устойчивости (толерантности) сорта к инфицированию выявляют по потере урожайности (агрономическая устойчивость к болезни) и по изменению физиологических, биохимических и биофизических процессов в ранние фазы вегетации растений (биологическая устойчивость). Биологическую устойчивость сорта к инфицированию можно определить инструментальными методами. Они должны быть экспрессными, особенно при постановке экспериментов в камерах искусственного климата, и иметь высокую производительность, что важно на ранних этапах селекции. Перечисленными достоинствами инструментальных методов обладает кондуктометрия. Регистрируемые кондуктометром биофизические характеристики четко проявляются с началом защитно-приспособительных реакций растения к стрессовому воздействию патогена, что позволяет выявить специфику ответа сорта на заражение до появления видимых повреждений корней.
Цель предпринятых исследований — показать, что кондуктометрический метод определяет биологическую устойчивость сортов яровой пшеницы и ячменя к обыкновенной гнили адекватно общепринятым агрономическим, физиологическим и позволяет ранжировать сорта по степени устойчивости к болезни.
Методика . Лабораторные и вегетационно-полевые опыты выполняли в пос. Краснообск Новосибирской области. Объекты исследования в лабораторных опытах — 12 сортов Triticum aestivum L. и три сорта Hordeum vulgare L. Использовали сорта мягкой яровой пшеницы селекции Сибирского НИИ растениеводства (Новосибирская обл., пос. Краснообск) и Сибирского НИИ сельского хозяйства (г. Омск). В первом случае это были ранние сорта Новосибирская 15, Полюшко, среднеранние Обская 14, Новосибирская 29 и среднеспелые — Новосибирская 89, Удача, Александрина, Легенда, Новосибирская 31, во втором — среднеспелый сорт Светланка, среднепоздние Омская 35 и Омская 18. У ярового ячменя изучали среднеспелые сорта Новосибирский 80 и Биом селекции Сибирского НИИ растениеводства и среднеранний сорт Арна селекции Казахского НИИ земледелия (Алматинская обл., пос. Алмалыбак). В вегетационно-полевых экспериментах использовали четыре сорта Triticum aestivum L.: Полюшко, Обская 14, Новосибирская 29, Новосибирская 31.
Лабораторные опыты проводили в 2005-2010 годах по схеме: контроль (семена без инфекции), опыт (семена, искусственно инфицированы B . sorokiniana ). Заражали наклюнувшиеся семена споровой суспензией трех среднепатогенных изолятов с инфекционной нагрузкой 5000 конидий в капле суспензии возбудителя на одно зерно (предварительно споры подсчитывали в камере Тома-Горяева). Использованные изоляты B . sorokiniana выделяли из корней яровой пшеницы (11), их патогенность установили по методике Лачицовой-Лангольф (12). Далее растения выращивали (до учетов) в рулонах в водной культуре (7) в течение 2 нед в установке искусственного климата при температуре 22 °С, освещенности 5000 лк и влажности 60 %. Повторность экспериментов 6-кратная.
Вегетационно-полевые опыты выполняли в 2007-2009 годах. Использовали инфицированные B. sorokiniana семена и почву (в соответствии с двумя существующими в природе способами передачи инфекции). Схема опытов: контроль — семена без инфекции, почва заражена возбудителем ниже порога вредоносности (< 20 спор/г почвы); опыт — семена инфицированы, почва с высокой инфекционной нагрузкой (> 100 спор/г). Как в лабораторных, так и в вегетационно-полевых экспериментах семена предварительно обеззараживали, используя химический протравитель Raxil® Ultra («Bayer CropScience AG», Германия) в дозе 0,25 л/т (контроль осуществлялся методом микоанализа). После этого в опытных вариантах в почву вносили выращенный на кукурузной муке с песком инокулюм возбудителя. Его количество рассчитывали так, чтобы на одну зерновку приходилось 5000 конидий (или более 100 спор/г почвы). Объем нагрузки контро- лировали методом флотации (13). Почвой (чернозем выщелоченный среднегумусный) набивали сосуды без дна объемом 8 кг, которые закапывали на фитоучастке биополигона, размещая рендомизированно (14) с пространственной изоляцией контроля и опыта. Повторность опыта 6-кратная. В каждый сосуд высевали по 20 зерен пшеницы. Опыт продолжался до учета зерновой продуктивности растений.
В лабораторных экспериментах определяли следующие показатели: биофизические (кондуктометрическая оценка) — удельную электропроводность (УЭП) и электрическую емкость водных вытяжек листьев (15), физиологические — биомассу ростков и корней (16), морфометрические — длину ростков и корней (16), а также всхожесть и индекс развития болезни (17). В вегетационно-полевых опытах устанавливали электропроводность и электрическую емкость водных вытяжек листьев, фотосинтетический потенциал (18), индекс развития болезни и урожайность. Показатели регистрировали в течение всей вегетации.
Кондуктометрические характеристики учитывали c помощью лабораторного кондуктометра КЛ-С-1 (ООО «Сибпромприбор», г. Барнаул, Россия) и цифровых измерителей L, C, R, Е 7-8 и Е 7-12.
Статистическую обработку данных выполняли в программах SNE-DECOR (19) и MINITAB.
Результаты . Кондуктометрический метод достаточно чувствительно определял различия в толерантности сортов яровой пшеницы и ячменя к обыкновенной гнили. Используемые нами биофизические диагностические показатели состояния инфицированных растений, а также длина корней и ростков 14-суточных растений, их биомасса (как интегральный показатель роста и развития) изменялись сходным образом (рис. 1, табл.).
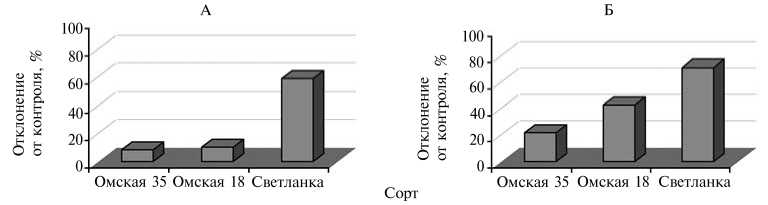
Рис. 1. Удельная электропроводность водных вытяжек листьев (А) и биомасса проростков (Б) при инфицировании Bipolaris sorokiniana Schoem. у яровой пшеницы (сорта селекции Сибирского НИИ сельского хозяйства, г. Омск; камера искусственного климата).
Характеристика реакции на инфицирование возбудителем корневой гнили Bipolaris sorokiniana Schoem. у сортов ярового ячменя (камера искусственного климата)
|
Сорт |
Вариант |
УЭПХ10 "3 , См/м |
Длина проростков, см |
Сухая биомасса 10 проростков, г |
|
Новосибирский 80 Контроль |
3,4 |
16,2 |
3,3 |
|
|
Инфицирование |
4,6 |
12,0 |
1,1 |
|
|
Биом |
Контроль |
4,9 |
22,4 |
1,2 |
|
Инфицирование |
5,0 |
21,3 |
1,1 |
|
|
Арна |
Контроль |
4,8 |
17,3 |
6,0 |
|
Инфицирование |
7,4 |
9,4 |
2,8 |
|
|
НСР 05 по фактору А (сорт) |
0,5 |
3,8 |
1,8 |
|
|
НСР 05 по фактору В (инфицирование) |
0,4 |
3,2 |
1,6 |
|
|
НСР 05 по взаимодействию АВ |
0,7 |
5,5 |
2,1 |
|
Примечание. УЭП — удельная электропроводность. Сорта ячменя Новосибирский 80 и Биом — селекции Сибирского НИИ растениеводства (Новосибирская обл., пос. Краснообск); сорт Арна — селекции Казахского НИИ земледелия (Алматинская обл., пос. Алмалыбак).
Корреляционные связи между разными индикаторами ранней ре- акции яровой пшеницы и ячменя на биотический стресс были достаточно тесными и статистически доказываемыми. Так, для 15 изученных в лабораторных опытах сортов пшеницы и ячменя сила попарной связи между всхожестью, длиной, биомассой, степенью пораженности корневой системы (индекс развития болезни) проростков и УЭП вытяжек листьев составила соответственно -0,68 (10 % уровень достоверности)--0,91 (5 % уровень достоверности), -0,66 (10 % уровень достоверности) — -0,87 (5 % уровень достоверности), -0,66 (10 % уровень достоверности)--0,88 (5 % уровень достоверности) и 0,60 (10 % уровень достоверности) — 0,86 (5 % уровень достоверности).
Тесной оказалась также зависимость между заболеваемостью растений и электрической емкостью вытяжек листьев при поражении обыкновенной гнилью у ряда сортов яровой пшеницы (r = 0,88±0,12), что впо следствии нашло отражение при построении дендрограммы.
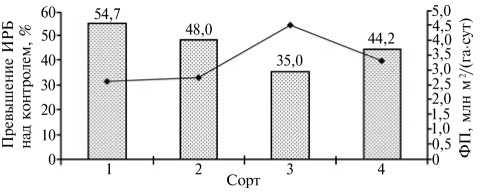
Рис. 2. Характеристка фитопатологического (индекс развития болезни — ИРБ, диаграмма) и физиологического (фотосинтетический потенциал за период всходы—рост стебля — ФП, график) состояния у сортов яровой пшеницы на инфекционном фоне: 1-4 — сорта Новосибирская 29, Новосибирская 31, Обская 14, Полюшко (селекция Сибирского НИИ растениеводства, Новосибирская обл., пос. Краснообск). Возбудитель корневой гнили Bipolaris sorokiniana Schoem. (вегетационно-полевой опыт, Новосибирская обл., 20082009 годы).
Если сравнить устойчивые к обыкновенной корневой гнили и поражаемые сорта по диапазону отклонений приведенных параметров, то у яровой пшеницы определяемые кондуктомет- электрофизические показатели отличались от
рическим методом результирующие различия были больше, чем разница в морфометрических характеристиках растений. Так, у чувствительных к внедрению вирулентных штаммов патогена сортов пшеницы аналогичных у устойчи вых на 30-57 %, а стандартно учитываемые биометрические показатели — не более чем на 20 %. У ячменя морфометрические и электрофизиче ские отклонения у неодинаковых по устойчивости к патогену сортов бы ли сопоставимыми.
В полевых условиях биофизические характеристики клеток заболевших растений яровой пшеницы также изменялись синхронно с физиологическим и фитопатологическим состоянием сортов. У сортов в условиях 2008 года электрофизические процессы в листьях инфицированных растений относительно контроля усилились в ряду: Обская 14 ^ Полюшко ^ Новосибирская 31 ^ Новосибирская 29 (соответственно на 11,1; 17,3; 33,0 и 41,2 %). Аналогичным образом при инфицировании повышалась пораженность корневой системы и уменьшалась площадь листовой поверхности (рис. 2). Расчеты показали, что в паре УЭП—индекс развития болезни (ИРБ) r = 0,85±0,007 и d = 0,72 (d — коэффициент детерминации), в паре УЭП—изменение фотосинтетического потенциала (ФП) r = 0,63±0,060.
Поскольку УЭП как биофизический показатель целостности для клеточных мембран листьев четко отразил реакцию на болезнь у сортов яровой пшеницы, кондуктометрическая оценка их устойчивости к обыкновенной гнили соответствовала потерям урожая зерна. В частности, на силь- ном инфекционном фоне сорт Обская 14 снизил урожайность на 30,5 %, остальные изученные сорта — на 40,8-41,5 %.
5 45,44
ю о
к
| 72,72
£
100,00
1 2 3 4 5 6 8 7
Рис. 3. Кластеризация сортов яровой пшеницы по признаку устойчивости к возбудителю корневой гнили Bipolaris sorokiniana Schoem.: 1 — Полюшко; 2 — Удача; 3 — Новосибирская 29; 4 — Новосибирская 31; 5 — Новосибирская 89; 6 — Новосибирская 15; 7 — Обская 14; 8 — Александрина (по данным кондуктометрических исследований в условиях камеры искусственного климата).
У сортов яровой пшеницы обнаруженная агрономическая устойчивость к обыкновенной гнили оказалась полностью адекватна полученной при лабораторной кондуктометрической оценке биологической устойчивости, поскольку при тестировании в камере искусственного климата сорта Новосибирская 29, Полюшко и Новосибирская 31 тоже были включены в кластер слаботолерантных (малоустойчивых) к болезни (рис. 3). У других сортов селекции Сибирского НИИ растениеводст ва биофизическая реакция на заболевание существенно отличалась от характерной для указанного кластера, особенно у сорта Обская 14. Следовательно, кондуктометрический метод показал себя вполне пригодным для ранней диагностики относительной устойчивости к обыкновенной корне вой гнили у сортов яровой пшеницы и ячменя и использованию в агрономической и селекционной практике.
Таким образом, установлено, что оценка стрессоустойчивости сортов зерновых культур к обыкновенной гнили, проводимая на стадии проростков по биофизическим показателям состояния клеточных мембран, соответствует снижению биометрических показателей, всхожести и биомассы у испытывающих стресс растений. Кондуктометрический метод более чувствительно отражает реакцию сортов яровой пшеницы на стресс, чем биометрические параметры: разница в электрофизических показателях между чувствительными к внедрению возбудителя обыкновенной гнили сортами пшеницы и устойчивыми сортами составляет 30-57 %, в то время как в изменении биометрических параметров — не более 20 %. Следовательно, кондуктометрический метод ранней диагностики стрессоустойчивости сортов может быть рекомендован для экспресс-отбора перспективного селек ционного материала у зерновых культур.


