Диагностика жизнеспособного миокарда до операции и оценка динамики его восстановления после реваскуляризации сердца
Автор: Шевченко Ю.Л., Вахрамеева А.Ю., Вахромеева М.Н., Ульбашев Д.С.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Оригинальные статьи
Статья в выпуске: 1 т.20, 2025 года.
Бесплатный доступ
Сохраняющиеся высокие показатели заболеваемости, госпитализации и смертности населения при ИБС, несмотря на поиск новых методов диагностики и лечения, говорят об актуальности проблемы до настоящего времени. Пациенты с ИБС требуют индивидуального комплексного подхода в силу характера и степени выраженности атеросклеротического поражения, наличия потенциально жизнеспособного миокарда, объема и тяжести его гибернации. Внедрение в клиническую практику метода стимуляции экстракардиального неоангиогенеза позволило значительно расширить возможности лечения больных с диффузным поражением коронарного русла. Представлены данные дооперационной визуализации жизнеспособного миокарда у пациентов с тяжелым атеросклеротическим поражением венечного русла, а также динамика его восстановления в послеоперационном периоде в зависимости от выполненного метода хирургической реваскуляризации.Материалы и методы. В проспективное рандомизированное исследование включены данные 140 пациентов с ИБС и диффузным поражением коронарного русла, которым с 2016 по 2023гг. была выполнена реваскуляризация миокарда в отделении сердечно-сосудистой хирургии Клиники грудной и сердечно-сосудистой хирургии им. Святого Георгия ФГБУ «НМХЦ им. Н.И. Пирогова» Минздрава России. I группа (n = 71) - комплексная реваскуляризации; II группа (n = 69) - изолированное коронарное шунтирование. Результаты синхро-ОФЭКТ миокарда и эхокардиографии оценивались на ранних сроках (10-14 суток) и через 6-12 месяцев после операции. Выполнялся сегментарный анализ изменения перфузии и сократимости миокарда. Оценивались основные варианты перфузионно-функционального соответствия. Первичная конечная точка - изменение объема гибернированного миокарда в течение всего периода наблюдения. Вторичные конечные точки - динамика региональной перфузии и сократимости; изменение фракции выброса левого желудочка.Результаты. Объем гибернированного миокарда левого желудочка в раннем послеоперационном периоде уменьшился с 29 [20; 35]% до 17 [10; 25]% в I группе (р function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Ибс, диффузное поражение коронарного русла, комплексная реваскуляризация, гибернация, миокардиальный резерв
Короткий адрес: https://sciup.org/140309956
IDR: 140309956 | DOI: 10.25881/20728255_2025_20_1_11
Текст научной статьи Диагностика жизнеспособного миокарда до операции и оценка динамики его восстановления после реваскуляризации сердца
ИБС до сих пор остается одной из ведущих причин заболеваемости, инвалидизации, смертности населения в России и во всем мире, при этом в настоящее время растет число пациентов с диффузным поражением коронарного русла [1–3].
У трети пациентов с острым инфарктом миокарда (ИМ) развивается выраженная его дисфункция, сердечная недостаточность (СН), снижается качество жизни и уменьшается ее продолжительность [4]. Ремоделирование левого желудочка (ЛЖ) зависит от объема фиброзных изменений сердца и его резервов. В течение первых часов после тяжелого ишемического повреждения активируются различные механизмы, направленные на ограничение зоны некроза и замещение поврежденной ткани миокарда рубцом, при этом некоторые ассоциации кардиомиоцитов могут оставаться жизнеспособными в течение длительного времени и восстанавливать свою функцию после реваскуляризации миокарда [5].
С морфологической и физиологической точки зрения о жизнеспособности кардиомиоцитов можно говорить при сохраненной клеточной структуре и метаболической активности. В клинических же условиях она определяется наличием дисфункционального миокарда в состоянии покоя с возможностью восстановления сократимости при улучшении его перфузии [6; 7].
Известны два основных механизма обратимости ишемической дисфункции миокарда: оглушение и гибернация. Станнинг или оглушение — это транзиторное нарушение функции миокарда, которое возникает после эпизода ишемии или реперфузионного повреждения. Считается, что основной механизм «оглушения» – избыточное накопление кальция в кардиомиоците, изменения в его энергетическом обмене и регуляции окислительных процессов [8]. Гибернация – хроническое потенциально обратимое снижение функции миокарда, связанное с адаптационными изменениями энергетического метаболизма и возможными структурными перестройками в кардиомиоцитах (редукцией миофибрилл, заполнением свободного пространства гликогеном, уменьшением саркоплазматического ретикулума, исчезновением Т-тубул и поперечных канальцев). Восстановление сократимости таких кардиомиоцитов после реваскуляризации зависит от степени тяжести гибернации и выраженности интерстициальных фиброзных изменений [9]. В настоящее время станнинг и гибернация, несмотря на их патофизиологические особенности, представляются общими звеньями одного процесса адаптации к гипоксии [10; 11].
Определение жизнеспособного миокарда играет важную роль в выборе тактики лечения и прогнозирование исходов реваскуляризации [5]. Кроме того, наличие значимого объема гибернированного миокарда у пациентов, которым не выполнялась реваскуляризация, создает субстрат для желудочковых тахиаритмий, что связано с риском внезапной сердечной смерти [12; 13].
Несмотря на то, что многие исследования подтверждают необходимость дооперационной оценки жизнеспособности миокарда, существуют данные, противоречащие этой концепции [14–16]. До сих пор остается много вопросов относительно влияния степени тяжести гибернации и объема жизнеспособного миокарда на тактику лечения и результаты коронарного шунтирования (КШ), особенно у пациентов с диффузным поражением, у которых полный объем реваскуляризации невыполним, и, соответственно, остается риск прогрессирования ишемического повреждения миокарда.
С целью улучшения результатов лечения таких пациентов уже много лет в Клинике грудной и сердечно-сосудистой хирургии имени Святого Георгия КШ дополняется методом стимуляции экстракардиаль-ного неоангиогенеза (методикой «ЮрЛеон») [17; 18]. Представлены данные дооперационного определения объема жизнеспособного миокарда, степени тяжести гибернации, а также динамики его восстановления в послеоперационном периоде в зависимости от выполненного метода хирургической реваскуляризации у пациентов с ИБС и диффузным поражением коронарного русла.
Материал и методы
В проспективное, рандомизированное исследование включены данные 140 пациентов с ИБС и диффузным поражением коронарного русла, которым с 2016 по 2023 гг. была выполнена реваскуляризация миокарда. Рандомизация проводилась с помощью генератора случайных чисел. Пациенты разделены на две группы: в I группу (n = 71) вошли пациенты, которым выполнялась комплексная реваскуляризация (КШ+ЮрЛеон); во II группу (n = 69) – больные, которым проводилось изолированное КШ.
Критериями включения в исследование являлись наличие перенесенного ИМ, подтвержденного инструментальными методами обследования: ЭКГ, ЭхоКГ; гемодинамически значимое атеросклеротическое поражение коронарных артерий; диффузный коронарный атеросклероз (традиционно определяемый как поражение двух и более сегментов одной магистральной артерии, общей протяженностью поражения более 50% всей длины сосуда при наличии гемодинамически значимого сужения просвета и/или малым диаметром дистального русла (менее 2 мм)); информированное согласие пациента на участие в исследовании.
Критериями невключения являлись нестабильная стенокардия; хроническая сердечная недостаточность (ХСН) в стадии декомпенсации; острый ИМ; наличие гемодинамически значимого поражения клапанного аппарата; острое нарушение мозгового кровообращения, а также отказ пациента от исследования.
Критерием исключения явилось отсутствие контрольного исследования через 6–12 месяцев после операции.

Первичная конечная точка — изменение объема гибернированного миокарда в течение всего периода наблюдения. Вторичные конечные точки — динамика региональной перфузии и сократимости; изменение фракции выброса ЛЖ.
По клинико-анамнестическим данным больные обеих групп статистически значимо не отличались (Табл. 1).
По данным селективной коронарографии (КАГ), до операции у 115 (82,1%) пациентов отмечалось 3-х сосудистое поражение, у 19 (13,6%) и 6 (4,3%) больных – поражение 2-х и 1-го коронарных сосудов, соответственно.
У 95 (67,9%) пациентов – окклюзия хотя бы одного коронарного сосуда. Диффузные изменения коронарных артерий, поражение их дистального русла или мелкие (ги-поплазированные) нешунтабельные артерии выявлены у 140 (100%) пациентов.
ЭхоКГ выполнялось на аппарате «General Electric Vivid 7» (USA) до операции, ежедневно при нахождении больного в ОРИТ, 1 раз в 4 суток в отделении, перед выпиской и в отдаленном послеоперационном периоде (6–12 месяцев) при контрольном обследовании. Глобальную систолическую функцию ЛЖ измеряли по формуле Simpson.
С целью диагностики жизнеспособного миокарда и определения его количества до операции всем пациентам была выполнена однофотонная эмиссионная компьютерная томография миокарда ЛЖ в покое, синхронизированная с ЭКГ (синхро-ОФЭКТ). Радиофармпрепарат (РФП) 99m Tc-технетрил вводили внутривенно в дозе 900 МБк. Регистрацию сцинтиграфических изображений проводили на гибридной установке ОФЭКТ/КТ «Discovery NM CT 670 DR» (GE). Для комплексной оценки перфузии и функции миокарда ЛЖ запись перфузионных изображений синхронизировали с ЭКГ пациента по R-зубцу. Оценку перфузии и функции проводили на унифицированных 20-ти сегментарных полярных диаграммах с использованием программы «QGS/QPS», на которых оценивали сегментарный захват РФП. При этом миокардиальные сегменты, в которых накопление РФП было ниже нормы, составляли общую зону гипоперфузии (Рис. 1 А, Б).
При сопоставлении перфузионных полярных диаграмм с функциональными оценивали зоны снижения регионального систолического утолщения миокарда ЛЖ (Рис. 1 В). Каждому сегменту присваивался балл от 1 до 4 (Рис. 1 Г), где 1 балл соответствовал норме; 4 балла – выраженному снижению регионального систолического утолщения миокарда (СУМ). Для оценки динамики изменений, происходящих в миокарде после операции, все миокардиальные сегменты были распределены на три варианта перфузионно-функционального соответствия (ПФС) в зависимости от уровня снижения перфузионных и функциональных показателей.
Дифференциальную диагностику гибернированного миокарда от рубцовых изменений осуществляли в общей
Табл. 1. Клинико-демографическая характеристика пациентов
|
Показатели |
I группа n = 71 |
II группа n = 69 |
Значения р |
|
|
Пол, n (%) |
Муж. |
53 (74,6) |
57 (82,6) |
0,347 |
|
Жен. |
18 (25,4) |
12 (17,4) |
0,347 |
|
|
Возраст, М±SD |
52,4±11,2 |
51,8±12,3 |
0,879 |
|
|
ИМ в анамнезе, n (%) |
71 (100) |
69 (100) |
– |
|
|
Повторный ИМ в анамнезе, n (%) |
9 (12,7) |
10 (14,5) |
0,754 |
|
|
ХСН по NYHA, n (%) |
I ФК |
2 (2,8) |
1 (1,5) |
0,981 |
|
II ФК |
4 (5,6) |
1 (1,5) |
0,380 |
|
|
III ФК |
56 (78,9) |
60 (86,9) |
0,297 |
|
|
IV ФК |
9 (12,7) |
7 (10,1) |
0,838 |
|
|
Артериальная гипертензия, n (%) |
58 (81,7) |
60 (86,9) |
0,533 |
|
|
Сахарный диабет, n (%) |
17 (23,9) |
12 (17,4) |
0,455 |
|
|
Общая ФВ ЛЖ, Мe [Q1; Q3] (%) |
50[47;53] |
51[46;55] |
0,856 |
|
|
Дефект перфузии до операции, Мe [Q1; Q3] (%) |
35 [28;39] |
37 [31;40] |
0,657 |
|
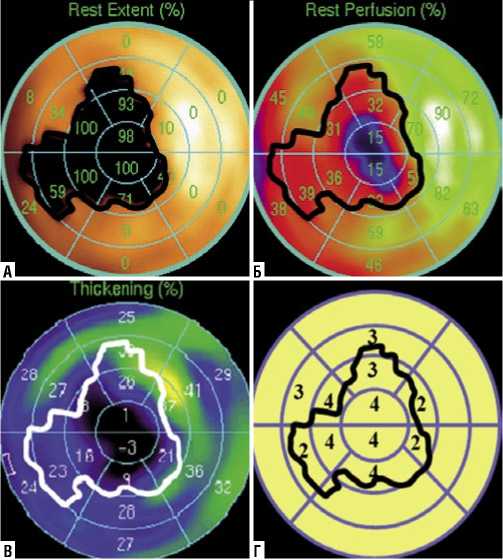
Рис. 1. Оценка перфузионно-функционального соответствия в гипопер-фузируемой зоне миокарда ЛЖ. А – дефект перфузии в покое (гипоперфузируемая зона), Б – сегментарное накопление РФП в гипоперфузируемой зоне, В – региональное СУМ в гипоперфузи-руемой зоне, Г – полуколичественный анализ регионального СУМ в гипоперфузируемой зоне с использованием балльной системы.
зоне гипоперфузии по следующему алгоритму: если в зоне выраженной гипоперфузии отмечалось выраженное снижение регионального СУМ (так называемое «соответствие»), такой миокард расценивался как нежизнеспособный. Если же в зоне выраженной гипоперфузии отмечалось умеренное снижение СУМ (так называемое «несоответствие»), такой миокард расценивался как жизнеспособный (Рис. 2).

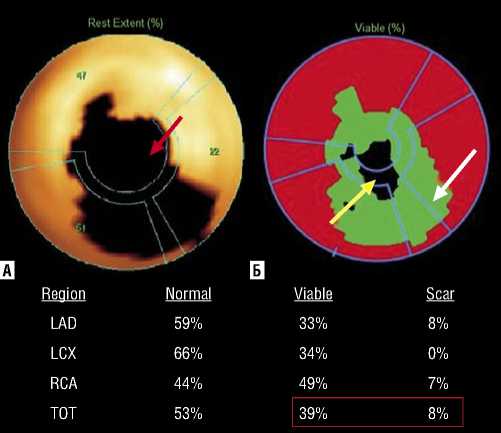
Рис. 2. Оценка объема рубца и жизнеспособного миокарда. На полярной диаграмме (А) визуализируется дефект перфузии (красная стрелка) – 47% от площади миокарда ЛЖ, зона рубца – 8% (задняя стенка с распространением на верхушку ЛЖ – желтая стрелка, Б). Большая часть гипоперфузируемой зоны представлена гиберни-рованным миокардом – 39% (передняя, передне-боковая, задняя, задне-боковая стенки ЛЖ – белая стрелка, Б).
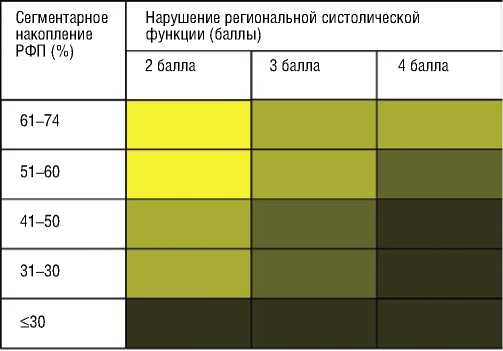
Для более детального анализа все сегменты в зависимости от степени захвата перфузионного индикатора были классифицированы на 5 подгрупп: 1 – 61–74%; 2 – 51–60%; 3 – 41–50%; 4 – 31–40%; 5 – ≤30%
Выделены варианты ПФС в зависимости от исходного уровня перфузии и функциональной активности:
I вариант ПФС – умеренное или выраженное снижение перфузии в сочетании с умеренным снижением функциональной активности – жизнеспособные сегменты миокарда с гибернированными кардиомиоцитами в легкой или средней степени тяжести.
II вариант ПФС – умеренное или выраженное снижение перфузии в сочетании с выраженным снижением функциональной активности – жизнеспособные сегменты миокарда с кардиомиоцитами, находящимися в гибернации средней или тяжелой степени.
III вариант ПФС – выраженное снижение перфузии в сочетании с отсутствием функциональной активности – нежизнеспособные участки миокарда, соответствующие необратимым рубцовым изменениям.
Результаты синхро-ОФЭКТ миокарда ЛЖ оценивались на ранних сроках (10–14 суток) и через 6–12 месяцев после операции. В работе учитывались сцинтиграммы, выполненные в покое.
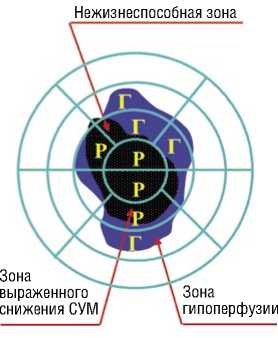
Для определения объемов гибернированного миокарда ЛЖ и необратимых рубцовых изменений в гипопер-фузируемой зоне использовали программу Corridor 4DM (GE) (США) с автоматическим полуколичественным расчетом процента нормально перфузируемой ткани от общего объема миокарда ЛЖ, зоны гибернированного миокарда и рубца (Рис. 3).
СХЕМА СОПОСТАВЛЕНИЯ ПЕРФУЗИИ И ФУНКЦИИ МИОКАРДА ЛЖ
Перфузия миокарда ЛЖ
Функция миокарда ЛЖ
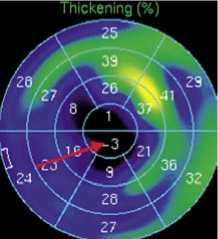
Рис. 3. Алгоритм диагностики жизнеспособного миокарда (Р – рубец, Г – гибернированный миокард, СУМ – систолическое утолщение миокарда).
■ Несоответствие ■ Соответствие
Статистический анализ
Расчет необходимого размера выборки для двусторонней альтернативной гипотезы проводился исходя из мощности 80%, частоты ошибок I рода 5% и допущения о том, что стандартизованный размер эффекта (d Коэна) равен 0.5. Оценка необходимого размера выборки: n = 64 в каждой из групп. Соответствие данных нормальному распределению оценивалось с помощью критерия Колмогорова-Смирнова в программе Statistica 12.
Количественные показатели, имеющие нормальное распределение, описывались с помощью средних арифметических величин (M) и стандартных отклонений (SD). В случае отсутствия нормального распределения количественные данные описывались с помощью медианы (Me) и нижнего и верхнего квартилей [Q1; Q3].
Для суждения о значимости различий количественных переменных в случае распределения, близкого к нормальному, использовали t-критерий Стьюдента. В тех случаях, когда распределение отличалось от нормального, анализ выполнялся с помощью непараметрического критерия Уилкоксона для связанных выборок, для независимых – U-критерия Манна-Уитни. При оценке процентных долей в двух группах проводился анализ четырехпольных таблиц сопряженности с расчетом критерия Хи-квадрат с поправкой Йейтса. Различия считались статистически значимыми при p<0,05.
Результаты
По данным радионуклидной томографии миокарда в покое, у всех 140 пациентов в обеих группах визуали-
зировались зоны гипоперфузии, соответствующие постинфарктным изменениям.
При комплексной оценке перфузионных и функциональных диаграмм было выявлено в двух группах 710 и 690 дисфункциональных сегментов, соответственно. Для более детального анализа все сегменты в зависимости от степени захвата перфузионного индикатора были классифицированы на 5 подгрупп с соответствующей балльной оценкой СУМ (Табл. 2–3).
Варианты ПФС в зависимости от исходного уровня перфузии и функциональной активности:
К I варианту ПФС (умеренное или выраженное снижение перфузии в сочетании с умеренным снижением функциональной активности) относились 427 (60,1%) сегментов (I группа) и 395 (57,2%) сегментов (II группа), т.е. сегменты, в которых уровень накопления РФП колебался от 31 до 74% (подгруппы 1-4), а функциональная активность составляла 2 балла.
Ко II варианту ПФС (умеренное или выраженное снижение перфузии в сочетании с выраженным снижением функциональной активности) включал в себя 229 (32,3%) сегментов в I группе и 240 (34,8%) сегментов во II группе, т.е сегменты 1–5 подгрупп с нарушением СУМ в 3 балла.
III вариант ПФС (выраженное снижение перфузии в сочетании с отсутствием функциональной активности) были отнесены 54 (7,6%) сегмента в I группе пациентов и 55 (8%) сегментов во II группе, т.е. все гипо- и апер-фузируемые сегменты (3-5 подгруппы) с региональным СУМ в 4 балла.
Динамика восстановления гибернированного миокарда
Объем гибернированного миокарда ЛЖ в раннем послеоперационном периоде уменьшился с 29 [20; 35]% до 17 [10; 25]% в I группе (р<0,0001) и с 27 [20; 34]% до 18 [10; 26]% во II группе (р<0,0001) между собой группы статистически значимо не различались (р = 0,25). В отдаленном послеоперационном периоде (6–12 месяцев) в I группе определялось статистически значимо меньший объем гибернированного миокарда: 10 [5; 12]% (I группа), 21 [14; 25]% (II группа) (р = 0,0002).
Сегментный анализ динамики перфузии и функции
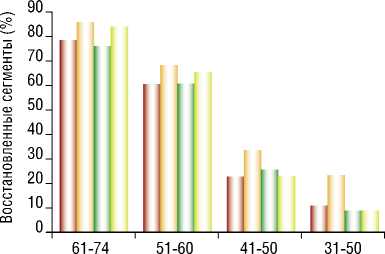
Значимое улучшение сократимости в раннем послеоперационном периоде в I группе отмечалось преимущественно в 1 и 2 подгруппах: 78,8% (n = 160) сегментов (1 подгруппа), 60,3% (n = 132) сегментов (2 подгруппа); через 6–12 месяцев после операции отмечалось восстановление 85,7% (n = 174) сегментов (1 подгруппа) и 68,3% (n = 153) сегментов (2 подгруппа); в 3 подгруппе улучшение функции отмечено в 22,7% (n = 42) сегментов (ранний послеоперационный период) и 33,5% (n = 62) сегментов (отдаленный послеоперационный период); улучшение в 4 подгруппе было в 10,7% (n = 6) сегментов (ранний послеоперационный период) и 23,2% (n = 13) сегментов (отдаленный послеоперационный период); в 5 подгруппе улучшения сократимости выявлено не было (Рис. 4).
Табл. 2. Исходное распределение дисфункциональных сегментов в гипо-перфузируемых зонах в зависимости от уровня накопления РФП в I группе
|
Подгруппы |
Сегментарное накопление РФП, % |
Дисфункциональные сегменты, n |
Всего |
||
|
2 балла |
3 балла |
4 балла |
|||
|
1 |
61–74 |
169 |
34 |
– |
203 |
|
2 |
51–60 |
171 |
53 |
– |
224 |
|
3 |
41–50 |
82 |
99 |
4 |
185 |
|
4 |
31–40 |
5 |
32 |
19 |
56 |
|
5 |
≤ 30 |
– |
11 |
31 |
42 |
|
Всего, n (%) |
427 (60,1) |
229 (32,3) |
54 (7,6) |
710 |
|
Табл. 3. Исходное распределение дисфункциональных сегментов в гипо-перфузируемых зонах в зависимости от уровня накопления РФП во II группе
|
Подгруппы |
Сегментарное накопление РФП,% |
Дисфункциональные сегменты, n |
Всего |
||
|
2 балла |
3 балла |
4 балла |
|||
|
1 |
61–74 |
144 |
36 |
– |
180 |
|
2 |
51–60 |
165 |
70 |
– |
235 |
|
3 |
41–50 |
79 |
94 |
5 |
178 |
|
4 |
31–40 |
7 |
35 |
15 |
57 |
|
5 |
≤ 30 |
- |
5 |
35 |
40 |
|
Всего, n (%) |
395 (57,2) |
240 (34,8) |
55 (8,0) |
690 |
|
Сегментарное накопление РФП (подгруппы)
I I I группа 10-14 сут. п/о I I II группа 10-14 сут. п/о
I группа 6-12 мес. п/о II группа 6-12 мес. п/о
Рис. 4. Динамика изменения сократимости сегментов с различным накоплением РФП в исследуемых группах.
Во II группе в 1 подгруппе отмечалось восстановление 76,1% (n = 137) сегментов (ранний послеоперационный период), 83,9% (n = 151) сегментов (отдаленный послеоперационный период); во 2 подгруппе: 60,9% (n = 143) сегментов (ранний послеоперационный период) и 65,5% (n = 154) сегментов (отдаленный послеоперационный период); в 3 подгруппе улучшение функции составило 25,3% (n= 45) сегментов (ранний послеоперационный период) и 23,0% (n = 41) сегментов (отдаленный послеоперационный период); в 4 подгруп-
пе – 8,7% (n = 5) сегментов (ранний послеоперационный период) и 8,7% (n = 5) сегментов (отдаленный послеоперационный период); в 5 подгруппе улучшения сократимости выявлено не было (Рис. 4). При сравнении между I и II группами отмечена тенденция к улучшению сократимости в отдаленные сроки у пациентов после КШ+ЮрЛеон, в отличие от изолированного проведения КШ, особенно в подгруппах с изначальным накоплением РФП 31–50% и 41–50%.
Степень гибернации клинически определяется скоростью восстановления региональной функции миокарда после полной реваскуляризации. По нашим данным, можно выделить три степени гибернации: легкая (полное восстановление функции «спящего» миокарда в раннем послеоперационном периоде, средняя (полное восстановление в течение 6–12 месяцев), тяжелая (частичное улучшение сократительной способности в течение 12 месяцев) (Рис. 5).
Оценка восстановления функции ассоциаций кардиомиоцитов в зависимости от вариантов ПФС
Сократительная способность миокарда ЛЖ существенно улучшилась при I варианте ПФС: из 427 сегментов в I группе пациентов улучшение сократимости произошло в 72,6% (n = 310) в раннем послеоперационном периоде и в 74,9% (n = 320) в отдаленном послеоперационном периоде. Во II группе пациентов из 395 сегментов улучшение сократимости гибернированного миокарда произошло в 69,4% (n = 274) в раннем послеоперационном периоде и в 64,8% (n = 256) в отдаленном послеоперационном периоде, отмечено ухудшение функции в 18 сегментах. При сравнении групп, отмечены значимые статистические различия в отдаленном послеоперационном периоде (Хи-квадрат с поправкой Йейтса – 9,566, р = 0,002). В сегментах с таким вариантом ПФС кардиомиоциты находились в гибернации легкой или средней степени.
При II варианте ПФС из 229 сегментов в I группе в раннем послеоперационном периоде улучшили сократимость 16,2% (n = 37) сегментов, в течение 6–12 месяцев после операции – 26,6% сегментов (n = 61). Во II группе из 240 сегментов в раннем послеоперационном периоде улучшение сократительной способности отмечено в 18,3% сегментов (n = 44), и в отдаленном – лишь 14,6% сегментов (n = 35). При сравнении групп, отмечены значимые статистические различия в отдаленном послеоперационном периоде (Хи-квадрат с поправкой Йейтса – 9,732, р = 0,002). В сегментах с таким вариантом ПФС кардиомиоциты находились в гибернации средней или тяжелой степени.
Анализ динамики вариантов перфузионно-функционального соотношения показал, что при III варианте ПФС в обеих группах больных ни один сегмент не улучшил сократительную способность после реваскуляризации. Большая часть сегментов была представлена рубцом.
легкая средняя тяжелая нежизне-
□ степень □ степень □ степень ■ способный гибернации гибернации гибернации миокард
Рис. 5. Степени гибернации.
Оценка динамики общей фракции выброса ЛЖ
Общая ФВ в раннем послеоперационном периоде выросла с 50 [47; 53]% до 53 [52; 55]% (I группа) (р<0,0001), с 51 [46; 55]% до 54 [52; 56]% (II группа) (р<0,0001). Группы между собой статистически значимо не различались (р = 0,088). Через 12 месяцев в I группе отмечалось увеличение ФВ ЛЖ до 56 [54; 59] (р<0,0001), во II группе значимых изменений не произошло, ФВ ЛЖ – 53 [51; 57]% (р = 0,46). При сравнении показателей глобальной сократимости миокарда в отдаленные послеоперационные сроки выявлены статистически значимые различия (р<0,0001) (Рис. 6).
В качестве примеров приводим результаты обследования и лечения пациентов с ИБС и диффузным поражением коронарного русла.
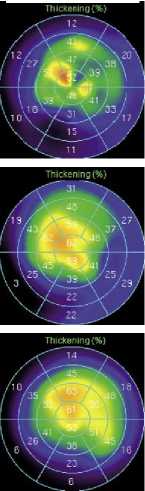
Пациент из I группы. У пациента К., 62 лет до операции, по данным синхро-ОФЭКТ миокарда ЛЖ в покое, визуализировался дефект перфузии в области задней стенки и задней части межжелудочковой перегородки (МЖП) с распространением на задне-боковую стенку ЛЖ. Объем гибернированного миокарда – 24%. На 10 сутки после
% 57^
55_
53 _
51 _
49 _
56%
Рис. 6.
54%
53%
53%
51%
50%
До операции
10-14 сут. 12мес.
после операции после операции
I группа
II группа
Динамика фракции выброса ЛЖ в исследуемых группах.
комплексной реваскуляризации (КШ+ЮрЛеон) при повторном проведении исследования отмечается улучшение перфузии в покое и уменьшение объема гибер-нированного миокарда до 18% (за счет восстановления сегментов, находящихся в легкой степени гибернации). При контрольном обследовании через 12 месяцев после операции отмечена положительная динамика: объем ги-
бернированного миокарда уменьшился до 8% (отмечено восстановление сегментов, находящихся в гибернации средней и тяжелой степени) (Рис. 7).
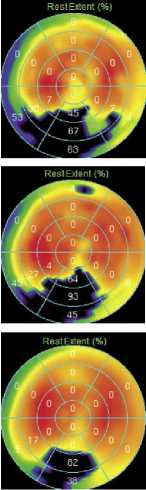
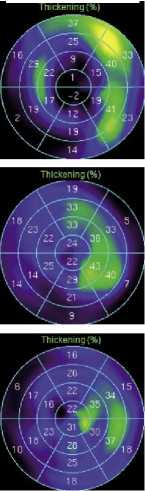
Пациент из II группы. У пациента Т., 65 лет до операции, по данным синхро-ОФЭКТ миокарда ЛЖ в покое, визуализируется дефект перфузии в области верхушки передней стенки и передней части МЖП
До операции
10 сутки после операции
12 месяцев после операции
Перфузия в покое
Региональная функция в покое
Оценка жизнеспособности миокарда ЛЖ в гипоперфузируемой зоне
|
7 |
Region |
Normal |
Viable |
Scar |
|
|
LAD |
99% |
1% |
0% |
||
|
LCX |
76% |
24% |
0% |
||
|
RCA |
21% |
61% |
18% |
||
|
TOT |
73% |
24% |
3% |
|
Region |
Normal |
Viable |
Scar |
|
|
LAD |
99% |
1% |
0% |
|
|
LCX |
91% |
9% |
0% |
|
|
RCA |
46% |
51% |
3% |
|
|
TOT |
82% |
17% |
1% |
|
Region |
Normal |
Viable |
Scar |
||
|
LAD |
100% |
0% |
0% |
||
|
— |
LCX |
100% |
0% |
0% |
|
|
RCA |
60% |
40% |
0% |
||
|
TOT |
92% |
8% |
0% |
Рис. 7. Полярные диаграммы миокарда ЛЖ больного К., 62 л., исходно и в различные сроки после КШ, дополненного методикой ЮрЛеон (пояснение в тексте).
До операции
9 сутки после операции
12 месяцев после операции
Перфузия в покое

Региональная функция в покое
Оценка жизнеспособности миокарда ЛЖ в гипоперфузируемой зоне
|
Region |
Normal |
Viable |
Scar |
||
|
/ A |
LAD |
43% |
54% |
3% |
|
|
r |
LCX |
95% |
5% |
0% |
|
|
RCA |
100% |
0% |
0% |
||
|
\ \ |
|||||
|
TOT |
72% |
27% |
1% |
||
|
Region |
Normal |
Viable |
Scar |
||
|
LAD |
80% |
20% |
0% |
||
|
LCX |
100% |
0% |
0% |
||
|
RCA |
100% |
0% |
0% |
||
|
TOT |
92% |
7% |
1% |
||
|
^7 |
Region |
Normal |
Viable |
Scar |
|
|
Ш |
LAD |
74% |
23% |
3% |
|
|
LCX |
100% |
0% |
0% |
||
|
у |
RCA |
100% |
0% |
0% |
|
|
^7 |
TOT |
89% |
10% |
1% |
|
Рис. 8. Полярные диаграммы миокарда ЛЖ больного Т., 65 л., исходно и в различные сроки после операции КШ (пояснение в тексте).
с распространением на передне-боковую стенку ЛЖ объемом 28% от площади миокарда ЛЖ. Объем гибер-нированного миокарда – 27%. Через 9 дней после КШ отмечается положительная динамика – уменьшение объема гибернированного миокарда до 7% (за счет восстановления сегментов, находящихся в легкой степени гибернации). Через год восстановления сегментов, находящихся в гибернации средней и тяжелой степени не выявлено, отмечена отрицательная динамика (Рис. 8).
Обсуждение
Диагностика гибернированного миокарда до операции и оценка динамики его восстановления после реваскуляризации у пациентов с ИБС на протяжении многих лет остается актуальной проблемой. В отличие от результатов ранних ретроспективных исследований, современные данные не могут строго подтвердить однозначность и необходимость выявления жизнеспособности миокарда у всех пациентов [19–21].
Однако с увеличением количества больных с диффузным поражением коронарного русла, у которых ограничение объема шунтирования является вынужденным решением, появилась особая необходимость индивидуального подхода к визуализации жизнеспособного миокарда ЛЖ и последующему их лечению [22]. Внедрение в клиническую практику метода стимуляции экстракардиального неоангиогенеза «ЮрЛеон» позволило значительно расширить возможности лечения таких больных [23].
Стоит отметить, что не только восстановление функции гибернированного миокарда после операции является основным механизмом, влияющим на прогноз у этой категории пациентов, но и предотвращение дальнейшего его повреждения, а также снижение риска жизнеугрожающих нарушений ритма [16]. Сохраненная общая ФВ ЛЖ при наличии значимой зоны гиберниро-ванного миокарда обеспечивается «мобилизационным режимом» работы оставшихся функционирующих кардиомиоцитов. Переход от «поочередного режима» к «мобилизационному» со временем истощит миокарда, при таких условиях отсутствие своевременной комплексной реваскуляризации приведет в дальнейшем к ухудшению функции сердца, то есть к усугублению тяжести сердечной недостаточности [24–26].
Определение объема жизнеспособного миокарда является недостаточным для формирования оптимального прогноза восстановления функции, необходимо углубленное изучение степени тяжести гибернации, посегментарный анализ перфузии и функции ЛЖ. В нашем исследовании рассмотрены группы пациентов с диффузным поражением венечного русла, у которых шунтирование коронарных артерий в полном объеме ограничено, это увеличивает риск «недостаточности» перфузии для восстановления гибернированного миокарда. Дополнение прямой реваскуляризации миокарда методом «ЮрЛеон» позволило в отдаленные сроки улучшить сократительную способность сердца за счет восстановления зон жизнеспособного миокарда, даже находящегося в более тяжелом состоянии, для восстановление которого необходимо больший временной промежуток. Формирование эктракардиальных коллатералей обеспечило дополнительную перфузию и возможность к улучшению сократимости.
Многолетние и многочисленные наблюдения подтверждают эффективность дополнения КШ методикой экстракардиальной стимуляции неоангиогенеза, в том числе для большего восстановления гибернированного миокарда в отдаленные послеоперационные сроки. Таким образом, прямая хирургическая реваскуляризация, дополненная методом «ЮрЛеон», обеспечивает наиболее оптимальные условия для последующего выхода кардиомиоцитов из состояния гибернации и восстановления нормальной работы сердца.
Современное применение концепции визуализации жизнеспособного миокарда у пациентов с ИБС основано на комплексном подходе к предоперационной диагностике с учетом данных ангиографии для определения анатомического соответствия между жизнеспособными сегментами и сосудами, пригодными для реваскуляризации, то есть для прогнозирования исходов, выбора тактики лечения, и последующей оценки результатов комплексной терапии, особенно это актуально у пациентов с диффузным поражением коронарного русла.
Ограничениями нашего исследования была небольшая выборка пациентов; одноцентровой характер; отсутствие сравнительных данных с результатами позитронно-эмиссионной томографии сердца у пациентов с диффузным поражением коронарного русла при определении объема гибернированного миокарда и динамики его восстановления.
Заключение
Сцинтиграфическая оценка жизнеспособности миокарда является важным критерием выбора тактики лечения больных ИБС, особенно с диффузным поражением коронарного русла. Дополнение коронарного шунтирования методикой стимуляции экстракардиального неоангиогенеза позволяет увеличить восстановление функции большего объема гибернированного миокарда и значительно улучшить отдаленные результаты комплексного лечения пациентов.


