Дифференциальная диагностика холангиокарцином внутрипечёночной локализации
Автор: Ищенко Роман Викторович, Андреева Марина Александровна, Яковлева Евгения Вячеславовна, Ищенко Ксения Борисовна
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Диагностика и лечение опухолей. Оригинальные статьи
Статья в выпуске: 3 (19), 2016 года.
Бесплатный доступ
На биопсийном и хирургическом материале наибольшую трудность в плане дифференциальной морфологической диагностики с метастазами аденокарцином различных локализаций представляют холангиоцеллюлярная карцинома (ХЦК) и гепатохолангиоцеллюлярный рак (ГХЦР). Пациенты в анамнезе не указывали на перенесенный в прошлом вирусный или паразитарный гепатит. Однако следует отметить, что в наших наблюдениях обе формы рака развивались на фоне крупноузлового цирроза печени.
Холлангиокарцинома, метастаз в печень, цирроз печени
Короткий адрес: https://sciup.org/140222656
IDR: 140222656 | DOI: 10.18027/2224-5057-2016-2-34-38
Текст научной статьи Дифференциальная диагностика холангиокарцином внутрипечёночной локализации
Andreeva Marina Aleksandrovna – head of the Pathology
Department, Moscow Regional Oncology Center
Yakovleva Evgeniya Vyacheslavovna – physician pathology department, the Moscow Regional Oncological Center
Ishchenko Kseniya Borisovna – physician pathology department, the Moscow Regional Oncological Center
Всего за 10-летний период подвергнуты анализу 97 случаев холангиоцеллюлярной карциномы внутрипеченочной локализации.
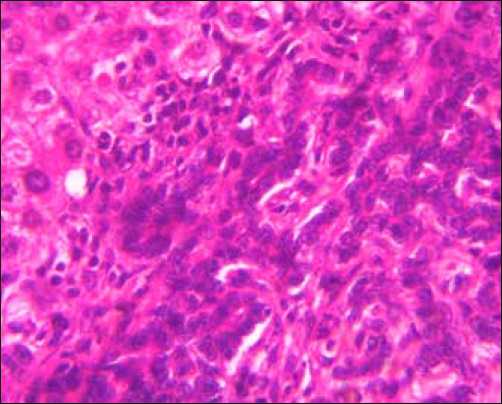
Холангиокарцинома микроскопически напоминает аденокарциному различной степени дифференцировки. Клетки высокодифференцированной ХЦК кубической формы формируют тубулярно-ацинарные структуры, не склонные к продукции слизи (рис. 1а). Холангиобласты по размеру значительно меньше гепатоцитов и тем более гепатобластов ГЦР, напоминают эпителий желчных протоков. Цитоплазма плотная, эозинофильная. Гигантские клетки и опухолевые симпласты отсутствовали. Фигуры атипичных митозов редки. Митотический индекс составляет 7,1±0,9%. Ядра клеток округлой или овальной формы, ядерный хроматин интенсивно окрашивался гематоксилином, располагаются в базальной части клетки. Ядерно-цитоплазматическое соотношение примерно равное. Отмечается формирование протоковых структур. Эпителий протоков не вырабатывает слизь. Стромальный компонент опухоли имел нежную сеть аргирофильных волокон, на большем протяжении строма опухоли представлена нежной волокнистой соединительной тканью. Холестаз отсутствовал. В поляризованном свете коллагеновые волокна sirius red–позитивны, обладают умеренным положительным двойным лучепреломлением и дихроизмом. Шаг двойного лучепреломления составляет 1,42±0,04, фенольный индекс Эбнера равен 1,46±0,01. Удельный объем сосудов МГЦР в низкодифференцированной холан-гиоцеллюлярной карциноме невысокий. В местах инфильтративного роста и в периферических отделах железистых комплексов низкой степени дифференцировки опухолевых клеток Vv составляет 0,126±0,028.
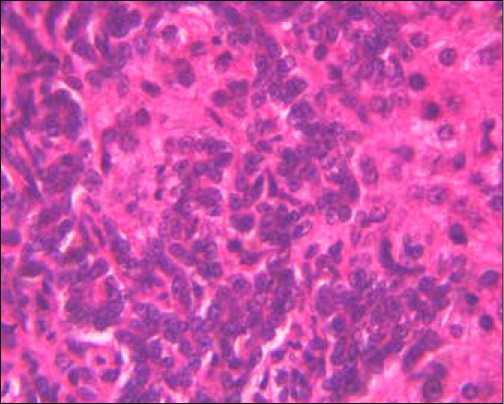
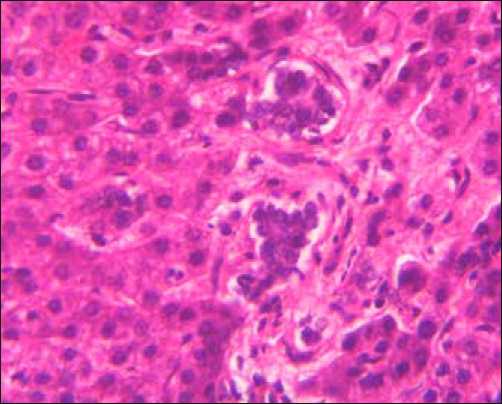
Низкодифференцированная ХЦК представлена уплощенными клетками овоидной или полигональной формы, которые формируют солидные структуры, напоминающие уродливые желчные протоки (рис. 1б). Резко выражен тканевый и клеточный атипизм. Цитоплазма опухолевых клеток скудна, с легким базофильным оттенком, ядра полиморфные, гиперхромные. Ядерно-цитоплазматический индекс явно смещен в сторону ядра. Однако, независимо от степени дифференцировки опухолевых клеток ХЦК, в 74,5%±2,1% в печеночных дольках вне опухоли в просвете лимфатических и кровеносных сосудов выявлялись микрометастазы (рис. 1в). Клетки холангиоцеллюлярной карциномы обладают выраженной положительной иммунореактивностью с антителами к виллину.
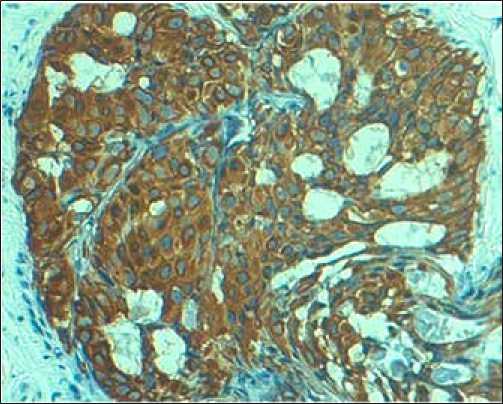
Виллин – это актин-связывающий белок, экспрессирующийся в основном в щеточных каемках эпителия. Положительное окрашивание на виллин характерно для протокового эпителия, что может служить маркером при дифференциальном диагнозе холангиоцеллюлярного рака и метастазов рака толстой кишки. При холангиокар- циноме выявляется положительная реакция с антителами к цитокератинам 7, 8, 19 типов и к эпителиально-мембранному антигену.
Низкодифференцированная ХЦК обладает выраженным инфильтративным ростом, проникая на значительное расстояние вглубь долек, окружая и сдавливая обширные участки гепатоцитов. В гепатоцитах, расположенных внутри таких участков, наблюдаются выраженные атрофические и дистрофические изменения вплоть до некроза. Интерес представляют морфологические изменения в гепатоцитах, расположенных по периферии печеночных долек, на границе с опухолевыми клетками ХЦК. В участках инфильтрации в опухолевых комплексах выявляются множество новообразованных сосудов капиллярного и синусоидного типа (проявления неоангиогенеза), мелкие лимфоидные инфильтраты и тонкие прослойки коллагеновых волоконец. В гепатоцитах в зоне контакта с опухолевыми инфильтратами наблюдаются адаптационные, дисрегене-раторные, диспластические и опухолевые изменения.
Гепатоциты в таких участках увеличены в объеме, некоторые из них содержат два – три крупных ядра. Цитоплазма гепатоцитов имеет своеобразный сетчатый рисунок, который образован эозинофильными нитевидными и светлыми, радиарно расположенными прослойками цитоплазмы. Такие гепатоциты обозначают как «перистые» (рис. 2а). Кроме того, в соседних участках печеночных долек выявляются диспластические изменения: появляются гепатоциты очень больших размеров, ядра гиперхромные, бобовидной формы содержат два и более ядрышка (рис. 2б). Перинуклеарно расположенная цитоплазма эозинофильная, в периферических отделах – «перистая». Скопления таких клеток практически не отличаются от гепатоцеллюлярного рака. Именно такие случаи, по нашему мнению, и можно рассматривать как формирование гепато-холангиоцеллюлярного рака (ГХЦР).
Такие структурные изменения нельзя рассматривать как патогномоничные для первичных раков, поскольку аналогичные изменения мы наблюдали в 78,2%+5,4% метастатического поражения печени.
Оценка степени злокачественности первичных раков печени основана на ядерном полиморфизме, что является субъективной оценкой и зависит от степени подготовленности исследователя. В настоящее время, в связи с широким распространением компьютерных технологий (анализатор изображений) и иммуногистохимического исследования опухолей (в частности применение антител, четко кон-турирующих цитоплазматическую мембрану) появилась возможность свести к минимуму степень субъективизма при оценке площади ядер опухолевых клеток, надежно определять ядерно-цитоплазматическое отношение автоматизированным способом, что позволяет ускорить постановку объективного морфологического диагноза.
а
б
в
г
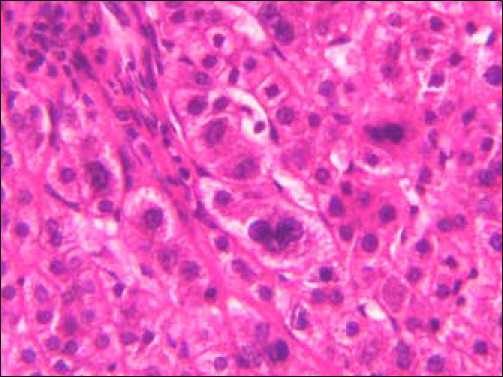
а
Рис. 2. Низкодифференцированная ХЦК, структурные изменения в гепатоцитах на границе с опухолью: а) участок «перистых» многоядерных гепатоцитов, б) участок дисплазии гепатоцитов в зоне неоангиогенеза. Окраска гематоксилином и эозином, Х400
Рис. 1. Холангиокарцинома: а) высокодифференцированный тип, б) низкодифференцированный тип, в) микрометастазы в дольку печени, г) положительное окрашивание на виллин. Окраска: а)-в) – гематоксилином и эозином, иммуногистохимическое типирование с МКАТ анти-villin 1. Х400
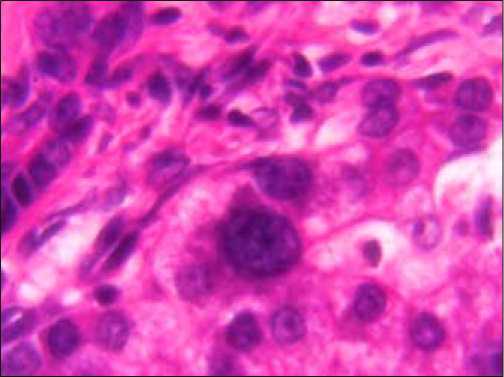
б
При определении степени злокачественности ГЦК общепринятой методикой является градирование по Edmondson. Согласно Edmondson различают 4 степени градации ГЦК. Считается, что более мелкие и мономорфные ядра характерны для высокодифференцированных ГЦК, а крупные или полиморфные ядра характерны для низкодифференцированных ГЦК.
Необходимо отметить, что характеристика опухоли и/или степени анаплазии только по размеру ядра не является достаточной, ведь степень активности клетки определяется не только степенью активности процессов в ядре (деление, транскрипция и т.д.), но и совокупностью биологических процессов, протекающих в цитоплазме клетки.
На наш взгляд, градирование по Edmondson и ее прогностическое значение приемлемо только для опухолей одной гистогенетической группы, например только для гепатоцеллюлярных новообразований. Сравнение аналогичных параметров с ХЦК является не корректным.
Вероятно, с этим положением и связано то обстоятельство, что при анализе выживаемости нами были получены данные, что размеры ядер опухолевых клеток не влияют на показатели выживаемости.
Проводя сравнительный анализ качественных и количественных морфологических и молекулярно-биологических отличий ГЦК и ХЦК, следует отметить, что имеются достоверные отличия в степени развития МГЦР этих типов опухолей печени: в ГЦК удельный объем микрососудов (Vv) колеблется в широких пределах от 0,215±0,039 и до 0,363±0,074. Средний показатель Vv в ГЦК составляет 0,282±0,091. Vv микрососудов в ХЦК низкой степени дифференцировки не превышает 0,126±0,028. Таким образом, Vv ХЦК достоверно (р≤0,005), практически более чем в 2 раза, превышает Vv в ГЦК, что может служить одним из диагностических критериев при дифференциальной диагностике ХЦК, нодулярной гиперплазии, гепатоаденомы, с одной стороны, и ХЦК – с другой.
Дифференциальная гистогенетическая диагностика первичных карцином печени является сложной задачей. Ре- шающее значение в ее разрешении принадлежит иммуногистохимическим исследованиям.
Для ГЦК характерна экспрессия гепатоцитарного антигена (HepParl). Во всех изученных нами биоптатов ГЦК ге-патобласты были позитивны к гепатоцитарному антигену (HepParl). В ХЦК позитивные к HepParl участки гепатобла-стов располагались лишь в очагах атипической гиперплазии и аденоматоидных участках вне предела опухолевых комплексов, что свидетельствует о высокой чувствительности и специфичности этого маркера.
Вторым важным антигеном, выявляемым при ГЦК, является секреция альфа-фетопротеина. Наличие альфа-фе-топротеина в клетках опухолевых комплексов является уникальной характеристикой ГЦК. Другие опухоли, в частности ХЦР, метастазирующие в печень, рак толстой кишки практически не экспрессируют этот маркер. Опухоли печени, позитивные к гепатоцитарному антигену и аль-фа-фетопротеину, следует определять как гепатоцеллюлярную карциному.
ВЫВОДЫ
Для ХЦК патогномоничным является обнаружение выраженной положительной иммунореактивности с антителами к виллину (иммуногистохимическое типиро-вание с МКАТ анти-villin 1). Вторым важным маркером ХЦК является экспрессия клетками СК19. Экспрессия СК 19 характерна для эпителия желчных протоков в норме и сохраняется в опухолях билиарного гистогенеза. СК19 принадлежит к кислому типу цитокератинов и является цитокератином с низкой молекулярной массой. СК19 экспрессируется в простых эпителиях. Мембранное и цитоплазматическое окрашивание СК19 обнаружено в 71,7% ХЦК, в ГЦК – 1,3%. Эти цифры означают, что несмотря на то, что маркер билиарной дифференцировки СК19 может изредка встречаться в ГЦК, его экспрессия характерна для ХЦК. Специфичность и чувствительность СК19 для ХЦК является достаточно высокой.
Список литературы Дифференциальная диагностика холангиокарцином внутрипечёночной локализации
- Welzel T. M., McGlynn K.A., Hsing A. W. et al. Impact of classification of hilar cholangiocarcinomas (Klatskin tumors) on the incidence of intra-and extrahepatic cholangiocarcinoma in the United States. J Natl Cancer Inst. 2006; Vol. 98: p. 873-875.
- B., Komuta M., Roskams T., Gores G. J. Clinical diagnosis and staging of cholangiocarcinoma. Nat Rev Gastroenterol Hepatol. 2011; Vol. 8: p. 512-522.
- Deoliveira M. L., Schulick R. D., Nimura Y. et al. New staging system and a registry for perihilar cholangiocarcinoma. Hepatology. 2011; Vol. 53: p.1363-1371.
- DeOliveira M.L., Cunningham S. C., Cameron J. L. et al. Cholangiocarcinoma: thirty-one-year experience with 564 patients at a single institution. Ann Surg. 2007; Vol. 245: p.755-762
- Blechacz B. G., G. J. Feldman: Sleisenger and Fordtran’s Gastrointestinal and Liver Disease. 9. Vol. 1. Saunders; 2010. Tumors of the Bile Ducts, Gallbladder, and Ampulla; pp. 1171-1176
- Khan S. A., Davidson B. R., Goldin R. D. et al. Guidelines for the diagnosis and treatment of cholanglocarclnoma: an update. Gut. 2012; Vol.61: p.1657-69.
- Everhart J. E., Ruhl C. E. Burden of digestive diseases In the United States Part III: Liver, biliary tract, and pancreas. Gastroenterology. 2009; Vol.136: p.1134-1144.
- Tyson G. L., El-Serag H. B. Risk factors forcholangiocarcinoma. Hepatology. 2011; Vol. 54: p.173-184.
- Shaib Y., El-Serag H. B. The epidemiology of cholangiocarcinoma. Semin Liver Dis. 2004; Vol. 24: p.115-125.
- Sripa B., Pairojkul C. Cholangiocarcinoma: lessons from Thailand. Curr Opin Gastroenterol. 2008; Vol. 24: p.349-356.
- Khan S. A., Taylor-Robinson S.D., Toledano M. B. et al. Changing international trends in mortality rates for liver, biliary and pancreatic tumours. J Hepatol. 2002; Vol. 37: p.806-813.
- Khan S.A., Toledano M.B., Taylor-Robinson S.D. Epidemiology, risk factors, and pathogenesis of cholangiocarcinoma. HPB (Oxford) 2008; Vol. 10: p.77-82.
- McGlynn K.A., Tarone R. E., El-Serag H.B. A comparison of trends in the incidence of hepatocellular carcinoma and intrahepatic cholangiocarcinoma in the United States. Cancer Epidemiol Biomarkers Prev. 2006; Vol. 15: p. 1198-1203.
- Patel T. Increasing incidence and mortality of primary intrahepatic cholangiocarcinoma in the United States. Hepatology. 2001; Vol. 33: p.1353-1357.
- Patel T. Worldwide trends in mortality from biliary tract malignancies. BMC Cancer. 2002; Vol. 2: p.10.
- Khan S.A., Emadossadaty S., Ladep N.G. etal. Rising trends in cholangiocarcinoma: Is the ICD classification system misleading us? Journal of Hepatology. 2012; Vol. 56: p.848-854.
- Razumilava N., Gores G. J. Classification, diagnosis, and management of cholangiocarcinoma. Clin Gastroenterol Hepatol. 2013; Vol. 11: p.13-21.
- Shin H. R., Oh J. K., Lim М. К. et al. Descriptive epidemiology of cholangiocarcinoma and Clonorchiasis in Korea. J Korean Med Sei. 2010; Vol. 25: p. 1011-1016.
- Huang M. H., Chen C. H., Yen C. M. et al. Relation of hepatolithiasis to helminthic infestation. J Gastroenterol Hepatol. 2005; Vol.20: p.141-146.
- Edil B. H., Cameron J. L., Reddy S. et al. Choledochal cyst disease in children and adults: a 30-year singleinstitution experience. J Am Coll Surg. 2008; Vol. 206: p1000-1005. discussion 1005-8.
- Mabrut J.Y., Bozio G., Hubert C., Gigot J. F. Management of congenital bile duct cysts. Dig Surg. 2010; Vol. 27: p 12-18.


