Дифференциальная экспрессия гена NRG1 в церебральных структурах у крыс Wistar при формировании пространственной памяти
Автор: Грудень М.А., Ратмиров А.М., Сторожева З.И.
Журнал: Академический журнал Западной Сибири @ajws
Рубрика: Эксперимент
Статья в выпуске: 1 (72) т.14, 2018 года.
Бесплатный доступ
В релевантных структурах мозга крыс-самцов Wistar, обученных пространственному навыку исследовали экспрессию гена NRG1, белковый продукт которого нейрегулин-1 вовлечен в ряд важных физиологических процессов, в частности в регуляцию процессов нейрогенеза, Показано, что физическая нагрузка и изменение эмоционального состояния в процессе принудительного плавания без обучения в водном лабиринте угнетает на 88 -96% активность гена NRG1 в гиппокампе, префронтальной коре и мозжечке. При этом, формирование пространственной памяти было ассоциировано с восстановлением экспрессии гена NRG1 и образованием специфического межструктурного ансамбля транскрипционной активности гена NRG1. Максимальный уровень экспрессии гена NKG1 обнаружен в коре (на 200%) и мозжечке (460%) у обученных животных с формированной долговременной памяти по сравнению с контролем.
Экспрессии гена nkg1, пространственная память, гиппокамп
Короткий адрес: https://sciup.org/140225987
IDR: 140225987
Текст научной статьи Дифференциальная экспрессия гена NRG1 в церебральных структурах у крыс Wistar при формировании пространственной памяти
Исследование процессов долговременной памяти продолжает быть одной из актуальных проблеем нейробиологии [14]. На современном этапе значительное внимание при изучении данного вопроса уделяется процессам нейрогенеза в обеспечении различных видов поведения и памяти c фокусированием на особенностях их генетической регуляции [1, 2, 9]. К настоящему времени большинство экспериментальных работ указанного аспекта посвящены исследованиям экспрессии ранних генов
-
[5 ] или, как в случае генов – регуляторов нейрогенеза, лишь в одной из релевантных церебральных структур – гиппокампе [4]. При этом, имеются единичные данные о структурно-функциональной сопряженности процессов пролиферации / дифференцировки / гибели нервных клеток и механизмов их генетической регуляции в различных структурах мозга у взрослых крыс при формировании долговременной памяти [3, 4].
Теоретический и практический интерес представляет изучение активности генов, кодирующие белки, которые вовлечены в механизмы дифференциации нервных и глиальных клеток, а также другие процессs нейронального развития и пластичности. Интерес вызывает исследования, направленные на изучение особенностей реактивации экспрессии данных генов при формировании долговременной памяти. Одним из интереснейших семейств генов, вовлеченных в данные процессы, являются гены семейства NRG, продуктами которых являются белки нейрегулины, выполняющие разнообразные функции в процессе развития нервной системы [11]. Нейрегулины связаны с эпидермальным фактором роста (Epidermal Growth Factor, EGF). У млекопитающих обнаружено 4 гена NRG – NRG1, NRG2, NRG3, NRG4, каждый из которых кодирует свою группу белков – нейрегулины-1, нейрегулины-2, нейрегулины-3 и нейрегулины-4. Наиболее изученной и разнообразной является группа нейрегулинов-1 (NКG1) [17]. Белок NRG1 является фактором роста, связанным напрямую с развитием и пластичностью нервной системы, при этом, NКG1/erbB сигнальный путь регулирует не только нейрональное развитие, но и миграцию, миелинизацию, а также функционально поддерживает работу синапсов [7]. Обнаружено, что активность генов данного семейства NКG1также вовлечена в ряд патогенетических процессов при нарушениях регуляции нервной системы. Так, NКG1 ген был идентифицирован как часть генома ассоциированная с таким заболеванием как шизофрения, при которой нарушается процессы памяти [18]. Нейрегулины передают свои сигналы клеткам-мишеням, взаимодействуя с трансмембранными рецепторами тирозинкиназы семейства ErbB. В это семейство входят четыре члена - рецептор эпидермального фактора роста (EGF-R, ErbB1, ErbB2, ErbB3 и ErbB4). Рецепторнолигандное взаимодействие с участием NКG1 индуцирует гетеродимеризацию рецепторных мономеров, что, в свою очередь, приводит к активации внутриклеточных сигнальных каскадов и индукции клеточных ответов, включая пролиферацию, миграцию, дифференцировку, выживание или апоптоз. In vivo, функциональные рецепторы NRG1 представляют собой гетеродимеры, состоящие из ErbB2 с молекулой ErbB3 или ErbB4. Ткане-специфическое распределение различных типов рецепторов дополнительно способствует разнообразию и специфич- ности биологических функций этого сигнального пути. Это типичная особенность прохождения сигнала через NRG1/ErbB для контроля последовательных этапов во время развития конкретной системы органов. Например, данный сигнальный путь функционирует на стадии ранней пролиферации, созревании клеток-предшественников, а также при миелинизации клеток Шванна [6].
Исследования вовлеченности гена NКG1 в процессы обучения и памяти немногочисленны. Имеются данные с использованием в качестве модели генетически модифицированных мышей-самцов Akt1 (+/-), NКG (+/-) которые как и двойные мутантные животные сравнивались с их контролями по типу дикого типа (WT). В условиях Akt1 и NКG1 -белкового дефицита обнаружили нарушение эпизодической памяти и социального поведения [10].
Целью настоящей работы явилось сравнительное изучение особенностей экспрессии NRG1 гена в релевантных структурах мозга: гиппокампе, мозжечке и префронтальной коре мозга у половозрелых крыс *Wistar, обученных пространственному навыку в водном лабиринте, а также у подвергнувшихся принудительному плаванию и интактных животных.
Методы исследования.
Эксперименты были выполнены на крысах-самцах Wistar (n=36, 3-х месячного возраста и массой 250,0±15,0 г.), которые содержались в стандартных условиях при свободном доступе к пище и воде, а также 12-ти часовом световом режиме при соблюдении этических норм работы с экспериментальными животными, сформулированных Советом Европейского сообщества об использовании животных для экспериментальных исследований (Директива 86/609/EEC в пересмотре от 14.11.2005). Поведенческие эксперименты на животных были проведены с использованием пространственного водного лабиринта Морриса (Columbus Instruments, USA) по протоколу, описанному ранее [9]. Крысы были разделены на 3 группы: 1 гр. – интактные животные (n=12), 2 гр. – группа «активного контроля-принудительное плавание без платформы » (n=12), 3 гр. — «обученные в водном лабиринте Морриса» животные (n=12). Экспериментальный протокол составлен таким образом, что время принудительного плавания в группе активного контроля соответствовало времени, проведенному в воде обучавшимся животным, т.е. каждому обучавшемуся животному по времени и паттерну плавания соответствовала одна “контрольная” особь. Через 24 ч по окончании поведенческих экспериментов всех крыс декапитировали, извлекали на холоду (+4ºС) структуры мозга: гиппокамп, префронтальную кору и мозжечок, которые использовали для изучения экспрессии гена NRG1 методом ПЦР в режиме реального времени по описанному ранее протоколу [9], применяя в качестве референсного гена – ген β- актина для последующего расчёта относительно
-ΔΔCt уровня экспрессии изучаемых генов по методу 2
-
[12 ]. Уровень экспрессии гена NRG1 в 2-ой и 3-й группах был подсчитан относительно данных их экспрессии у интактных животных. На Рис. 2 экспрессия изучаемого гена NRG1 у обученных животных представлена в % от таковой у животных из группы «активный контроль».
Статистическую обработку полученных результатов проводили по алгоритмам программы “Statis-tica 7,0”. При сравнении нескольких независимых выборок применяли однофакторный непараметрический дисперсионный анализ по методу Крускал-ла-Уолиса (Н-критерий) с последующим post-hoc анализом по U-критерию Манна-Уитни. Критическое значение уровня статистической значимости при проверке нулевых гипотез принималось равным величине 0,05.
Результаты и обсуждение.
В ходе проведенных поведенческих экспериментов по формированию долговременной пространственной памяти показано, что среднее значение времени достижения платформы у крыс во втором и всех последующих сеансах было достоверно ниже, чем в первом ( р <0,01–0,05), а к концу 4-го сеанса обучения (4 день) значения времени достижения платформы были меньше 10 сек ( р <0,01), что свидетельствует о формировании стабильной долго временной пространственной памяти (рис. 1).
В исследованиях транскрипционной активности изучаемого гена NRG1 были обнаружены значимые различия в уровне его экспрессии в гиппокампе, префронтальной коре и мозжечке животных в группах «активного контроля» и «обучения». Так, анализ межструктурной экспрессии гена NRG1 у животных, подвергнувшихся принудительному плаванию в водном лабиринте без платформы документировал подавление активности гена NRG1при принудительном плавании (физической нагрузке в воде) как в гиппокампе, так и мозжечке до 3% и 5% (p<0,01), соответственно, по сравнению с интактными крысами. Выявлено, что в префронтальной коре у этих животных сохраняется 30% (p<0,05) от контроля активных копий NRG1 гена. В группе крыс с формированной долговременной пространственной памятью структурный паттерн экспрессии изучаемого гена NRG1 отличается от такового у животных, которых принуждали к плаванию в водном лабиринте без платформы. Активность гена NRG1 в гиппокампе обученных животных помнящих расположение платформы составила 75% от нативного контроля, а в других церебральных структурах превысила активность гена NRG1 у интактных животных на 200% и 460% (p<0,001) в префронтальной коре в мозжечке, соответственно (рис. 2).
Таким образом, физическая нагрузка в виде принудительного плавания без обучения в водном лабиринте Морриса и эмоциональное состояние животных индуцируют подавление активности NRG1 гена как в гиппокампе, так и в двух других изучаемых структурах (префронтальной коре и мозжечке) взрослых крыс Wistar. 4-х-дневное обучение животных нахождению платформы в водном лабиринте привело к формированию долговременной пространственной памяти, что было ассоциировано с тенденцией возвращения уровня экспрессии гена NRG1 к таковому у интактных крыс и активацией экспрессии данного гена в других двух структурах.
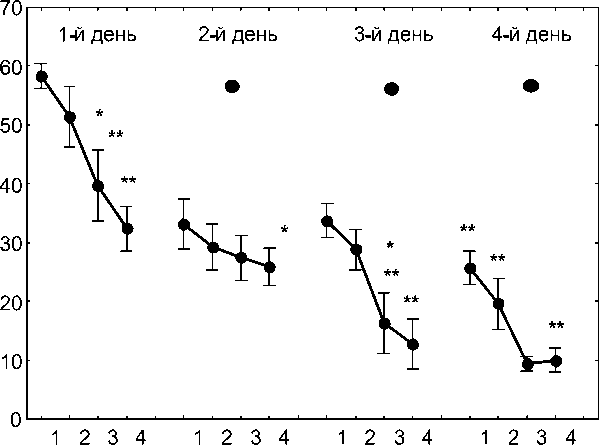
Рис. 1. Формирование долговременной пространственной памяти у половозрелых крыс Wistar в водном лабиринте Морриса (по оси абсцисс – номер пробы, по оси ординат – время достижения платформы (с); * - p <0,05, ** - p <0,01 по сравнению с первой пробой соответствующего дня; • - статистически значимое (p<0,05) снижение среднего значения по всем пробам относительно аналогичного показателя предыдущего дня).
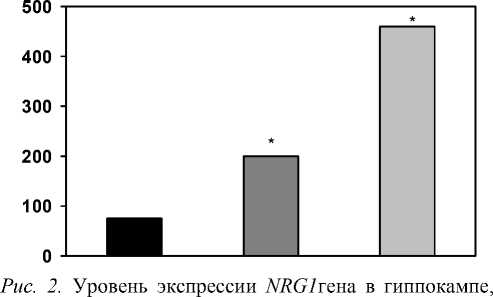
префронтальной коре и мозжечке у обученных пространственному навыку в водном лабиринте
Морриса половозрелых крыс Wistar в % от уровня их экспрессии в соответствующих структурах у животных группы «активного контроля» (по оси абсцисс – структуры мозга, по оси ординат – % от активного контроля. Черный столбик – Гиппокамп, средний – префронтальная кора, светло серый столбик – мозжечок; * p <0,01 по сравнению с гиппокампом).
Можно предположить, что помещение экспериментальных животных в незнакомую ранее им среду (воду) и многодневное нахождение в ней без платформы, олицетворяющую твердую поверхность привело крыс к эмоциональному напряжению и стрессу, вызвало элементы страха и тревожности, а также физическое перенапряжение. Эмоциональная и физическая нагрузка явились негативными сигналами геному, в частности, выразившимися в ингибировании активности гена NRG1 и, вероятно, последующему снижению содержания белка нейре-гулина I. Ранее было показано, что снижение в мозге крыс формы белка нейрегулина I (тип II NRG1) не ведет к нарушению памяти в водном лабиринте Морриса, но имеется дефицит памяти в модели пищевого поведения на визуоскопическую дискриминацию. Крысы со сниженной концентрацией белка NRG1 в данном тесте совершили больше опорных и рабочих ошибок. Эти результаты показывают, что снижение типа II NRG1 в головном мозге может привести к дефициту в визуоскопическом обучении и памяти [15] .
Имеются данные о том, что экспрессия другой изоформы типа I NRG1 в гиппокампе увеличивается при шизофрении [8]. Генная активация влияет на гипокампальные функции и эффекты, вероятно, опосредуются через ингибирующие интернейроны. Тем не менее, данные, полученные с использованием других генетических и фармакологических манипуляций, подчеркивают сложную и плейотроп-ную природу NRG1гена даже в отношении различных изоформ белка. Имеются также данные о том, что NRG1 и его рецепторная тирозинкиназа ErbB4 имеют решающее значение для поддержания ГАМК-ергической активности в другой структуре мозга - амигдале, а ингибирующая нейротрансмис- сия в данной структуре мозга важна для выработки страха и формирования памяти. Нейтрализация эндогенного белка NRG1, ингибирование его синтеза или генетическая изоляция его белкового партнера по сигнальному пути белкаErbB4 в амигдале приводили к уменьшению ГАМК-ергической передачи, влияя на состояние кондиционирования животных, что вероятно, может привести к нарушениям памяти и возникновению тревожности и страза у животных [13]. На основании этих данных, можно предположить участие амигдалы мозга и в наших экспериментах, наряду с другими структурами в формировании эмоционального статуса крыс, подвергавшихся принудительному плаванию и, у которых обнаружено ингибирование экспрессии NRG1 гена во всех исследованных церебральных структурах. Тем не менее, мало известно о вкладе передачи сигналов NRG1/ErbB4 в гиппокампе, ассоциированных с функцией обучения и памяти. Имеются данные по количественному ПЦР в реальном времени оценки уровней мРНК белка NRG1 после фармакологических и генетических манипуляций, где было обнаружено, что пространственное обучение уменьшает экспрессию NRGI гена в гиппокампе. Блокада передачи сигналов NRG1 / ErbB4 в гиппокампе в поле CA1 могла быть связана путем нейтрализации эндогенной активности NRG1, либо ингибирующей / абляционной активности рецептора ErbB4, усиленного Гиппокамп - зависимым пространственным обучением, а также пространственной рабочей памяти и новой памяти распознавания объектов [16]. Таким образом, было подтверждено, что воздействие на сигнальный путь NRG1/ErbB4 выявляет важную роль NRG1/ErbB4 активности в гиппокампе для процессов обучения и памяти. В настоящей работе, было показано, что ингибирование активности NRG1гена происходило в дни адаптации животных к новым условиям выживания, а именно в водной среде, когда происходит модуляция эмоционального их статуса и включаются адаптационные механизмы. Сам процесс формирования долговременной памяти в процессе обучения нахождения скрытой платформы в водном лабиринте в большей степени связан с тенденцией нормализации активности NRG1гена в гиппокампе и резкой активацией экспрессии данного гена в префронтальной коре. Возрастание активности NRG1гена в мозжечке отражает не только увеличение двигательной активности животных на стадии обучения и тестирования, но и вовлеченность данной структуры мозга непосредственно в структурно-функциональные механизмы формирования пространственной памяти. Обнаруженный специфический межструктурный паттерн экспрессии NRG1гена отражает передачу памятного следа первоначально сформированного в гиппокампе другим структурам в процессе его фиксации. Документированные в настоящей работе данные хорошо согла- суются с результатами молекулярно - клеточных исследований, проведенных нами ранее на половозрелых крысах-самцах Wistar в аналогичных экспериментальных условиях. В частности, было показано, что в гиппокампе, префронтальной коре и мозжечке мозга образуются клетки, которые дифференцируются в нейроны и астроциты. При этом, имеются значимые региональные различия выраженности и динамики пролиферации, дифференцировки и апоптотической гибели вновь образованных клеток [3], что тоже может связано с дифференциальной экспрессией NRG1гена, белковый продукт которого является фактором роста.
Таким образом, получены принципиально новые данные о специфической активации NRG1 гена -регулятора нейрогенеза в различных структурах мозга у половозрелых крыс Wistar при формировании и упрочении долговременной пространственной памяти.
Список литературы Дифференциальная экспрессия гена NRG1 в церебральных структурах у крыс Wistar при формировании пространственной памяти
- Грудень М.А., Сторожева З.И., Ратмиров А.М., Шерстнев В.В. Паттерн экспрессии генов Notch2, Numb и Cas8 в релевантных структурах мозга крыс при формировании пространственной памяти//Бюллетень экспериментальной медицины и биологии. -2017. -№ 6. -С. 751-755.
- Грудень М.А, Ратмиров А.М., Соловьева О.А, Шерстнев В.В. Генетическая регуляция активности калиевых каналов типа kir в различных отделах мозга при формировании пространственной памяти у половозрелых крыс//Академический журнал Западной Сибири. -2017. -Т. 13, № 1 (68). -С. 72-73.
- Шерстнёв В.В., Голубева О.Н., Грудень М.А., Сторожева З.И., Гусева Е.В. Нейрогенез и нейроапоптоз в различных отделах зрелого мозга крыс Wistar//Нейрохимия. -2012. -Т. 29, № 3. -С. 206-212.
- Aimone J.B., Li Y., Lee S.W., Clemenson G.D. et al. Regulation and function of adult neurogenesis: from genes to cognition//Physiol. Rev. -2014. -V. 94, № 4. -Р. 991-1026.
- Barry D.N., Commins S. Imaging spatial learning in the brain using immediate early genes: insights, opportunities and limitations//Rev. Neurosci. -2011. -V. 22, № 2. -Р. 131-142.
- Britsch S. The neuregulin-I/ErbB signaling system in development and disease//Adv. Anat. Embryol. Cell. Biol. -2007. -№ 90. -Р. 61-65.
- Chen Y.J., Johnson M.A., Lieberman M.D. et al. Type III neuregulin-1 is required for normal sensorimotor gating,memory-related behaviors, and corticostriatal circuit components//J. Neurosci. -2008. -V. 28, № 27. -Р. 6872-6883.
- Deakin I.H., Nissen W., Law A.J. et al. Transgenic overexpression of the type I isoform of neuregulin 1 affects working memory and hippocampal oscillations but not long-term potentiation//Cereb. Cortex. -2012. -V. 7. -P. 1520-1529.
- Gruden M.A., Storozheva Z.I., Sewell R.D. et al. Distinct functional brain regional integration of Casp3, Ascl1 and S100a6 gene expression in spatial memory.//Behav. Brain Res. -2013. -V.252. -P.230-238.
- Huang C.H., Pei J.C., Luo D.Z. et al. Investigation of gene effects and epistatic interactions between Akt1 and neuregulin 1 in the regulation of behavioral phenotypes and social functions in genetic mouse models of schizophrenia//Front. Behav. Neurosci. -2015. -V. 8. -P. 455-467.
- Krug A., Markov V., Krach S. et al. The effect of Neuregulin 1 on neural correlates of episodicmemory encoding and retrieval//Neuroimage. -2010. -V. 53, № 3. -Р. 985-991.
- Livak K.J., Schmittgen T.D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))//Method. Methods. -2001. -V. 25, № 4. -Р. 402-408.
- Lu Y., Sun X.D., Hou F.Q. et al. Maintenance of GABAergic activity by neuregulin 1-ErbB4 in amygdala for fear memory//Neuron. -2014. -V. 84, № 4. -Р. 835-846.
- Pastotter B., Tempel T., Bauml K.T. Long-Term Memory Updating: The Reset-of-Encoding Hypothesis in List-Method Directed Forgetting//Front. Psychol. -2017. -V. 8. -P. 2076.
- Taylor A.R., Taylor S.B., Koenig J.I.The involvement of Type II Neuregulin-1 in rat visuospatial learning and memory//Neurosci. Lett. -2012. -V. 531, № 2. -Р. 131-135.
- Tian J., Geng F., Gao F. et al. Down-Regulation of Neuregulin1/ErbB4 Signaling in the Hippocampus Is Critical for Learning and Memory//Mol. Neurobiol. -2017. -V. 54, № 6. -Р. 3976-3987.
- Willem M. Proteolytic processing of Neuregulin-1//Brain Res. Bull. -2016. -V. 126 (Pt 2). -P. 178-182.
- Zhang Z., Huang J., Shen Y., Li R. BACE1-Dependent Neuregulin-1 Signaling: An Implication for Schizophrenia//Front. Mol. Neurosci. -2017. -V. 10. -P. 302.


