Дифференцированная оценка антибиотиков на способность ограничивать скольжение Mycobacterium smegmatis
Автор: Цыганов Иван Вадимович, Нестерова Лариса Юрьевна, Ткаченко Александр Георгиевич
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 4, 2018 года.
Бесплатный доступ
Предложен метод дифференцированной оценки веществ, обладающих антибактериальным действием и воздействующих на способность подавлять скольжение Mycobacterium smegmatis за счет влияния на жизнеспособность клеток и/или ограничения подвижности. С помощью данной методики произведена оценка антибиотиков, обладающих антимикобактериальным действием. Показано, что рифампицин в сублетальных концентрациях ограничивает скольжение М. smegmatis, не оказывая действия на жизнеспособность бактерий. В свою очередь, тетрациклин и стрептомицин ингибировали процесс скольжения за счет бактерицидного или бактериостатического действия. Данный подход может быть использован для установления механизма действия новых антибиотиков, а также для изучения их эффекта на свойства клеточной поверхности микобактерий и других микроорганизмов, способных к скольжению.
Микобактерии, скольжение, антибиотики
Короткий адрес: https://sciup.org/147227048
IDR: 147227048 | УДК: 579.22 | DOI: 10.17072/1994-9952-2018-4-402-408
Текст научной статьи Дифференцированная оценка антибиотиков на способность ограничивать скольжение Mycobacterium smegmatis
Изучение механизмов, лежащих в основе координированных действий микробных клеток, направленных на эффективное распространение по поверхности и формирование колониальных и биопленочных сообществ, приобретает все большую актуальность в связи с тем, что такие «поведенческие» реакции сопровождаются образованием толерантных к антибиотикам форм бактерий [Verstraeten et al., 2008; Thayil et al., 2011]. В случае с патогенными микроорганизмами, это сопровождается развитием не поддающихся лечению антибиотиками рецидивирующих хронических инфекций, в особенности вызванных Mycobacterium tuberculosis .
В отличие от жгутиковых микроорганизмов, микобактерии не способны к направленному дви- жению и роению и до недавнего времени считались абсолютно неподвижными. Однако в конце 90-х гг. прошлого века было показано, что микобактерии способны к скольжению (sliding) – особому типу пассивного движения по поверхности [Martinez, Torello, Kolter, 1999], который ранее был описан для других безжгутиковых форм [Henrichsen, 1972]. Распространение скользящей колонии реализуется за счет деления бактерий и возникающей при этом экспансивной силы, которая проталкивает клетки вперед [Daffé, Draper, 1997]. Для облегчения скольжения микроорганизмы могут продуцировать поверхностно активные вещества, уменьшающие трение о поверхность, например рамнолипиды у некоторых грамотрица-
тельных бактерий [Murray, Kazmierczak, 2008]. Хотя скольжение микобактерий не зависит от наличия специфических соединений в матриксе, тем не менее, установлено, что мутанты, у которых в клеточной стенке отсутствовали гликопептидо-липиды, теряли подвижность [Recht et al., 2000; Ghosh, Indi, Nagaraja, 2013]. О регуляции скольжения микобактерий известно немного, однако показано, что переход к скольжению у микобактерий контролируется при участии сигнальных нуклеотидов (p)ppGpp и c-di-GMP, которые не только оказывают влияние на поверхностные свойства клеток, в том числе содержание в их клеточных стенках гликопептидолипидов, но и ответственны за формирование толерантности к антибиотикам [Thayil et al., 2011; Gupta et al., 2016].
Особенности строения многокомпонентной клеточной стенки микобактерий придают им свойства повышенной устойчивости к различным неблагоприятным воздействиям окружающей среды, включая антибиотики и компоненты иммунной системы хозяина. От этого зависит также способность микобактериальных клеток к скольжению и биопленкообразованию, что позволяет им колонизировать субстраты и персистировать в окружающей среде [Etienne et al . , 2005]. В свою очередь, способность к скольжению часто используется для характеристики поверхностных свойств и физиологического состояния микобактерий.
В последнее время активно ведутся поиски эффективных ингибиторов межклеточных взаимодействий, нарушающих функционирование бактериальной системы quorum sensing (QS), агрегацию, адгезию и движение клеток по поверхности субстратов, то есть процессов, играющих основную роль в биопленко-образовании и персистенции. Ранее показано, что некоторые группы соединений могут оказывать значительное влияние на способность микобактерий к скольжению (ПАВ, синтетические гликолипиды, регуляторы метаболизма, биогенные полиамины, антибиотики) [Gopalaswamy et al., 2008; Naresh et al . , 2010; Syal et al . , 2016; Нестерова, Цыганов, Ткаченко, 2017]. Причинами уменьшения диаметра скользящей колонии при их действии может быть не только ингибирование процесса скольжения, но и снижение жизнеспособности бактериальных клеток в результате токсического действия. Это ставит задачу дифференцировать два вида активности при изучении механизма действия исследуемых соединений, что составляет цель данной работы.
Материалы и методы исследования
Объектом исследования служил штамм Mycobacterium smegmatis mc2 155 из коллекции лаборатории адаптации микроорганизмов
Института экологии и генетики микроорганизмов УрО РАН.
Скользящие колонии выращивали в полистироловых чашках Петри (Thermo scientific, 35 мм). В жидкую среду Middlebrook 7H9 (Difco, Франция) добавляли агарозу (Хеликон, Россия) в концентрации 0.3%. Антибиотики вносили в остывшую до температуры 47оС питательную среду, которую разливали по чашкам и подсушивали в течение 40 мин. Культуру M. smegmatis выращивали на питательной среде Middlebrook 7H9 до оптической плотности (ОП) 1.3 (600 нм), разводили до ОП 0.4 (600 нм), наносили на агар в центр чашки Петри каплей (2 мкл) и оставляли в термостате (37оС) на 48 ч.
Подсчет клеток в колонии проводили под микроскопом в камере Горяева. Колонию вырезали вместе с полужидким агаром и помещали в микропробирку, куда вносили физиологический раствор с добавлением tween 80 (0.05%) до конечного объема 1 мл и стеклянные бусы (2 мм, Hofmann Glastechnik, Германия). Микропробирку встряхивали на вортексе (1400 об/мин.; 1ч.). После этого производили подсчет клеток в камере Горяева в 60 малых квадратах по диагонали. Количество клеток на мм2 колонии рассчитывали по формуле
N = (mx4000xs/q)x1000, где N – число клеток в 1 мл раствора; m – сумма посчитанных клеток; s – степень разведения; q – число малых квадратов сетки камеры Горяева, в которых считали клетки.
Измерение площади колонии проводили после фотографирования чашки со скользящей колонией с помощью камеры Olympus C-3040 ZOOM (Япония) с использованием пробной версии программы Adobe Photoshop CC 2015.5, определяя количество пикселей и их площадь.
Минимальную подавляющую концентрацию (МПК) антибиотиков определяли методом двукратных серийных разведений в 96-луночных полистироловых планшетах на среде Middlebrook 7H9 с добавлением tween 80 (0.05%). Приготовление инокулята: культуру M. smegmatis выращивали на среде Middlebrook 7H9 до ОП 1.0 (600нм), затем доводили до ОП 0.1 и разводили ещё в 10 раз. В лунки планшета, содержащие 100 мкл питательной среды с антибиотиком, вносили 100 мкл инокулята. Культивировали 48 ч. в термошейкере Biosan PST-60HL (Латвия) при 37 ° С и 300 об/мин. МПК считали минимальную концентрацию антибиотика, подавляющую видимый рост микроорганизмов.
Для того чтобы определить, сопровождается ли уменьшение размера скользящей колонии уменьшением количества клеток, подсчитали количество бактерий на 1 мм2 скользящей колонии. Эффект ограничения скольжения без бактерицидного действия фиксировали в том случае, если хотя бы при одной из концентраций, достоверно уменьшающих размер скользящей колонии, наблюдалось статистически значимое увеличение количества клеток на мм2 колонии по сравнению с контролем.
Статистическую обработку результатов проводили с использованием пакета стандартных программ Statistica 7.0 (StatSoft, Inc., 2006). На графиках отражены средние значения (4–8 экспериментов), вертикальными отрезками обозначены величины стандартной ошибки среднего. Оценка статистической значимости различий произведена с использованием t-критерия Стьюдента. Различия считали значимыми при р≤0.05.
Результаты
В качестве соединений, способных оказать влияние, как на скольжение, так и на численность клеток в скользящих колониях М. smegmatis , в работе использованы антибиотики, обладающие антимикобактериальной активностью: рифампицин, стрептомицин и тетрациклин.
Действие рифампицина связано с подавлением активности ДНК-зависимой РНК-полимеразы [Се-лизарова, 2003], в то время как стрептомицин и тетрациклин блокируют синтез белка, связываясь с 30S субъединицей рибосомы и нарушая образование комплекса рибосомы с т-РНК соответственно [Epe, Woolley, Hornig, 1987; Егоров, 2004].
Антибиотики добавляли в полужидкую питательную среду, которая использовалась для воспроизведения скольжения микобактерий на чашках Петри (см. раздел «Материалы и методы»). Концентрации антибиотика были подобраны таким образом, чтобы отследить постепенное уменьшение размеров скользящей колонии. Для того, чтобы сравнить между собой эффекты антибиотиков, обладающих разным механизмом действия, их концентрацию выражали в условных единицах, кратных значению минимальной подавляющей концентрации. Для рифампицина она была равна 9.7, стрептомицина – 0.04, а тетрациклина – 0.57.
Результаты исследования показали, что присутствие даже минимальных концентраций рифампицина и тетрациклина в среде (0.06 МПК) приводило к снижению площади колонии по сравнению с контрольным значением приблизительно в 2 и 1.5 раза соответственно (рис. 1, 2). Однако содержание клеток в колонии, выросшей в присутствии этих антибиотиков, существенно различалось. При этом численность клеток на единицу площади колонии в присутствии рифампицина возрастала обратно пропорционально изменению ее площади. В то же время снижение площади колонии в ответ на добавку 0.06 МПК тетрациклина не сопровождалось возрастанием количества клеток на единицу площади, которое оставалось на уровне контрольного. Это свидетельствует о том, что рифампицин в данной концентрации практически не влиял на размножение клеток, но существенно ингибировал их скольжение. В отличие от этого эффект тетрациклина, по-видимому, был вызван ингибировани- ем роста и размножения клеток.
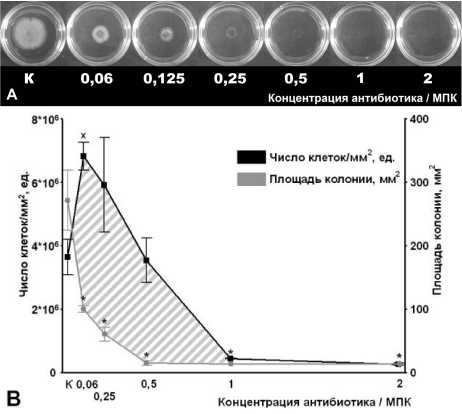
Рис. 1 . Влияние рифампицина на скольжение Mycobacterium smegmatis mc2 155:
МПК – минимальная подавляющая концентрация; К – контроль; А – фото скользящих колоний; В – изменение площади колоний и числа клеток на 1 мм2 колонии; * – статистически значимое отличие площади колонии от контрольной группы (с использованием t-критерия Стьюдента, р≤0.05); х – статистически значимое отличие числа клеток на 1 мм2 от контрольной группы в большую сторону (с использованием t-критерия Стьюдента, р≤0.05)
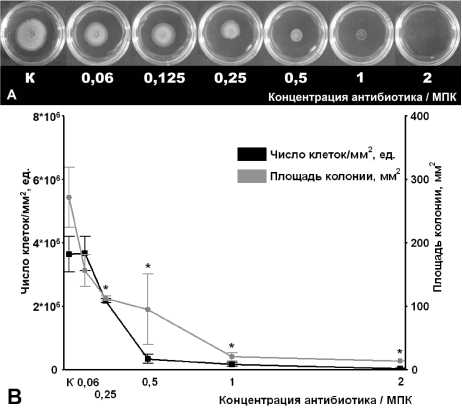
Рис. 2 . Влияние тетрациклина на скольжение Mycobacterium smegmatis mc2 155:
МПК – минимальная подавляющая концентрация; К – контроль; А – фото скользящих колоний; В – изменение площади колоний и числа клеток на 1 мм2 колонии; * -статистически значимое отличие площади колонии от контрольной группы (с использованием t-критерия Стьюдента, р≤0.05
Дальнейшее повышение концентрации рифампицина и тетрациклина подтвердило тенденцию в изменении исследуемых параметров, выявленную при воздействии относительно малых концентраций антибиотиков (рис. 1, 2). При этом повышение концентрации рифампицина вызывало более выраженное ингибирование скольжения по сравнению с изменением количества клеток на единицу площади (рис. 1 – заштрихованная область).
Прямо противоположная тенденция характерна для тетрациклина (рис. 2) и стрептомицина (рис. 3), при действии которых оба параметра менялись сходным образом, что свидетельствует о преобладании бактерицидного или бактериостатического эффекта, вносящего наибольший вклад в снижение диаметра колонии.
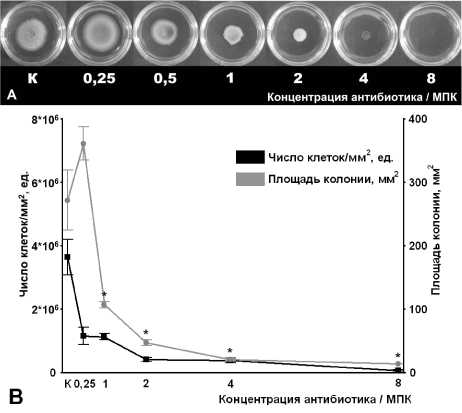
Рис. 3 . Влияние стрептомицина на скольжение Mycobacterium smegmatis mc2 155:
МПК – минимальная подавляющая концентрация; К – контроль; А – фото скользящих колоний; В – изменение площади колоний и числа клеток на 1 мм2 колонии; * – статистически значимое отличие площади от контрольной группы (с использованием t-критерия Стьюдента, р≤0.05)
Обсуждение
Особенности клеток Mycobacterium smegmatis, включая их способность к агрегации во время культивирования, затрудняют определение количества живых организмов в популяции. Использование с этой целью высева образцов культуры на твердую питательную среду для подсчета КОЕ может давать ошибочные результаты. Как показали результаты наших микроскопических исследований, в процессе ресуспендирования скользящей колонии, даже после интенсивного встряхивания с ПАВ, не все клетки микобактерий расходились, частично оставаясь в виде скоплений. Однако используемый нами подсчет в камере Горяева давал возможность точно учитывать не только отдельно расположенные, но и клетки в составе скоплений. Данный метод обеспечивал высокую воспроизводимость результатов. Использование программы Adobe Photoshop, в свою очередь, сделало возможным быстрое и точное определение площади колонии с учетом неровностей её края.
Ранее нами показано, что площадь скользящей колонии может уменьшаться не только в результате торможения деления или бактерицидного действия антибактериальных соединений, но и за счет ингибирующего эффекта не токсичных для бактерий веществ на процесс скольжения [Нестерова, Цыганов, Ткаченко, 2017]. В этом случае действующие вещества могут, проникая в клетку, оказывать регуляторное действие на процессы, контролирующие скольжение, а также взаимодействовать с бактериальной поверхностью, изменяя ее свойства, что сказывается как на характере взаимодействия с субстратом, так и на межклеточных контактах.
Сходное действие могут, по-видимому, оказывать также соединения, обладающие противо-микробной активностью, что может быть выявлено при их использовании в субингибиторных концентрациях. Дифференцировать противомик-робный эффект от влияния на уровне межклеточных коммуникаций или взаимодействия между клетками и средой важно для установления механизма действия вновь открываемых антибактериальных соединений. Это становится особенно актуально в связи с предпринимаемыми в последнее время усилиями по поиску антибиотиков, действие которых направлено на подавление процессов, находящихся под регуляторным контролем QS-системы, включая формирование биопленок, вирулентность, координированное перемещение по твердой поверхности, персистенцию и другие [Garrison et al., 2015; Gutiérrez-Barranquero et al., 2015; Нестерова, Ткаченко, Писцова, 2016].
Таким образом, предложенный нами дифференцированный подход к оценке различных соединений по способности воздействовать на бактериальное скольжение с учетом их возможной антибактериальной активности может быть использован для установления механизма действия новых антибиотиков, а также для изучения их эффекта на свойства клеточной поверхности микобактерий и других микроорганизмов, способных к скольжению.
Работа выполнена в рамках госзадания, номер госрегистрации темы 01201353249 и при финансовой поддержке РФФИ и Администрации Пермского края в рамках научного проекта р_а 16-44590279.
Список литературы Дифференцированная оценка антибиотиков на способность ограничивать скольжение Mycobacterium smegmatis
- Егоров Н.С. Основы учения об антибиотиках. М.: Наука, 2004. 528 с.
- Нестерова Л.Ю., Цыганов И.В., Ткаченко А.Г. Роль биогенных полиаминов в регуляции скольжения у микобактерий // Вестник Пермского университета. Сер. Биология. 2017. Вып. 3. С. 304-311.
- Нестерова Л.Ю., Ткаченко А.Г., Писцова О.Н. Изучение механизмов противомикробного действия соединения ( )-erogorgiane // Вестник Пермского университета. Сер. Биология. 2016. Вып. 4. С. 351-355.
- Селизарова Н.О. Антибиотики, нарушающие синтез макромолекул // Обзоры по клинической фармакологии и лекарственной терапии. 2003. № 1 С. 70-78.
- Epe B., Woolley P., Hornig H. Competition between tetracycline and tRNA at both P and A sites of the ribosome of Escherichia coli // FEBS Letters. 1987. Vol. 213. P. 443-447
- Etienne G. et al. The cell envelope structure and properties of Mycobacterium smegmatis mc2155: is there a clue for the unique transformability of the strain? // Microbiology. 2005. Vol. 151. № 6. Р. 2075-2086.
- Daffé M., Draper P. The envelope layers of mycobacteria with reference to their pathogenicity // Advances in microbial physiology. 1997. Vol. 39. P. 131-203.
- Garrison A.T. et al. Halogenated phenazines that potently eradicate biofilms, MRSA persister cells in non-biofilm cultures, and mycobacterium tuberculosis // Angewandte Chemie. 2015. Т. 127, № 49. Р. 15032-15036.
- Ghosh S., Indi S.S., Nagaraja V. Regulation of lipid biosynthesis, sliding motility, and biofilm formation by a membrane-anchored nucleoid-associated protein of Mycobacterium tuberculosis // Journal of bacteriology. 2013. Vol. 195. № 8. P. 1769- 1778.
- Gopalaswamy R.R. et al. Mycobacterium smegmatis biofilm formation and sliding motility are affected by the serine/threonine protein kinase PknF // FEMS microbiology letters. 2008. Vol. 278, № 1. Р. 121-127.
- Gupta K.R. et al. Regulation of growth, cell shape, cell division and gene expression by second messengers (p) ppGpp and c-di-GMP in Mycobacterium smegmatis // Journal of bacteriology. 2016. Vol. 198, № 9. Р. 1414-1422.
- Gutiérrez-Barranquero J.A.et al. Deciphering the role of coumarin as a novel quorum sensing inhibitor suppressing virulence phenotypes in bacterial pathogens // Applied microbiology and biotechnology. 2015. Т. 99, № 7. Р. 3303-3316.
- Henrichsen J. Bacterial surface translocation: a survey and a classification // Bacteriological reviews. 1972. Vol. 36, № 4. P. 478.
- Martínez A., Torello S., Kolter R. Sliding motility in mycobacteria // Journal of bacteriology. 1999. Vol. 181, № 23. P. 7331-7338.
- Murray T.S., Kazmierczak B.I. Pseudomonas aeruginosa exhibits sliding motility in the absence of type IV pili and flagella // Journal of bacteriology. 2008. Vol. 190, № 8. P. 2700-2708.
- Naresh K. et al. Synthetic arabinomannan glycolipids and their effects on growth and motility of the Mycobacterium smegmatis // Organic & biomolecular chemistry. 2010. Vol. 8, № 3. Р. 592- 599.
- Recht J. et al. Genetic Analysis of Sliding Motility in Mycobacterium smegmatis // Journal of bacteriology. 2000. Vol. 182, № 15. P. 4348-4351.
- Reen F.J. et al. The sound of silence: activating silent biosynthetic gene clusters in marine microorganisms // Marine drugs. 2015. Vol. 13, № 8. Р. 4754-4783.
- Syal K. et al. Synthetic arabinomannan glycolipids impede mycobacterial growth, sliding motility and biofilm structure // Glycoconjugate journal. 2016. Vol. 33, № 5. Р. 763-777.
- Thayil S.M. et al. The role of the novel exopolyphosphatase MT0516 in Mycobacterium tuberculosis drug tolerance and persistence // PloS one. 2011. Vol. 6, № 11. Р. e28076.
- Verstraeten N. et al. Living on a surface: swarming and biofilm formation // Trends in microbiology. 2008. Vol. 16, № 10. P. 496-506.


