Дифференцированная оценка воздействия биогенных полиаминов и алармонсинтетазы RelMsm на характер скольжения Mycobacterium smegmatis
Автор: Цыганов И.В., Нестерова Л.Ю., Ткаченко А.Г.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 4, 2024 года.
Бесплатный доступ
Разработан метод сравнительного анализа скользящих колоний бактерий, включающий оценку плотности расположения бактериальных клеток в монослое. С использованием данного метода исследовано влияние биогенных полиаминов и алармонсинтетазы RelMsm на скольжение Mycobacterium smegmatis. Показан разнонаправленный эффект спермидина и спермина на скольжение, усиление скольжения у штамма с делецией relMsm, а также отсутствие прямой связи между скольжением микобактерий и их гидрофобностью.
Микобактерии, скольжение, полиамины, алармоны, адаптация бактерий
Короткий адрес: https://sciup.org/147247245
IDR: 147247245 | УДК: 579.2 | DOI: 10.17072/1994-9952-2024-4-401-411
Текст научной статьи Дифференцированная оценка воздействия биогенных полиаминов и алармонсинтетазы RelMsm на характер скольжения Mycobacterium smegmatis
letin of Perm University. Biology. Iss. 4 (2024): pp. 401-411. (In Russ.).
Способность к пространственному перемещению дает бактериям множество преимуществ. Оно облегчает колонизацию среды, позволяет избегать влияния неблагоприятных факторов или перемещаться в область оптимального микроокружения, в том числе в условиях макроорганизма (фактор вирулентности). Это способствовало приобретению бактериями в ходе эволюции разнообразных способов транслокации, как с помощью специализированных органелл, так и в их отсутствии [Henrichsen, 1972]. Скольжение – это вид пассивного перемещения по поверхности сред, который возможен за счет действия экспансивной силы, возникающей при делении клеток [Daffé, Draper, 1997; Martínez, Torello, Kolter, 1999]. Скольжение микобактерий не требует специализированных органелл, но становится возможным благодаря наличию в их клеточной оболочке гликопептидолипидов (ГПЛ) [Gupta et al., 2016; Hölscher, Kovács, 2017], образующих липидный слой, окружающий клеточную стенку подобно наружной мембране гра-мотрицательных микроорганизмов [Brennan, Nikaido, 1995; Ghosh, Indi, Nagaraja, 2013]. Согласно актуальной модели скольжения, ГПЛ придают гидрофобность поверхности бактериальной клетки, что снижает ее трение о гидрофильные поверхности сред, благодаря чему микобактерии формируют широкий монослой, а не группируются в трехмерные структуры [Recht et al., 2000]. Патогенные виды микобактерий также способны к скольжению [Schorey, Sweet, 2008]. Более того, способность к скольжению, как и биопленкообразование, прямо коррелирует с вирулентностью бактерий [Lai et al., 2018]. Скольжение по достаточно увлажненным поверхностям внутренних тканей макроорганизма ускоряет распространение патогена и усложняет борьбу с ним [Zegadło et al., 2023]. Таким образом, исследование механизмов скольжения и факторов, модулирующих этот процесс, является актуальной задачей современной микробиологии, которая на сегодняшний день остается одной из наименее изученных проблем в области физиологии микроорганизмов.
Бактерии постоянно находятся под воздействием множества факторов внешней среды, которые индуцируют адаптационные процессы в клетках. При этом изменяется синтез различных соединений, которые могут оказать влияние на свойства внешней оболочки и, следовательно, на скольжение бактерий. У патогенных штаммов микобактерий это отражается на их способности к колонизации. Поэтому исследование влияния адаптационных процессов на скольжение бактерий и различных факторов их модуляции может способствовать совершенствованию современных средств противомикобактериальной терапии. Одним из ключевых элементов адаптации микобактерий к стрессам является алармонсинтетаза Rel Msm [Prossliner et al., 2018]. Данный фермент контролирует уровень алармона – гуанозинтетрафосфата (ppGpp) – благодаря способности как синтезировать, так и гидролизовать это соединение. Кроме того, известно, что ppGpp может модулировать свойства клеточной поверхности микобактерий, оказывая влияние на способность к скольжению [Gupta et al., 2016]. Другим известным фактором, который влияет на адаптацию бактерий к стрессу, являются биогенные полиамины. Данные соединения синтезируются в клетках различных организмов, включая эукариоты, чем объясняется их широкая распространенность в окружающей среде [Igarashi, Kashiwagi, 2010]. Микобактерии в ходе эволюции утратили способность к синтезу полиаминов [Zamakhaev et al., 2020], однако экзогенные молекулы способны модулировать процессы биопленкообразования [Nesterova, Tsyganov, Tkachenko, 2020]. Таким образом, полиамины предположительно могли бы опосредованно участвовать в модуляции скольжения.
Видимое уменьшение площади растущей колонии бактерий может быть вызвано как бактерицидным эффектом изучаемого фактора, так и подавлением скольжения клеток. Поэтому исследование влияния различных факторов на скольжение требует разработки специфических методов, позволяющих дифференцированно оценить скольжение бактериальных клеток в условиях одновременно происходящих процессов их пролиферации или гибели. Подобная дифференцированная оценка затруднена ввиду особенностей, присущих данному объекту исследования. Микобактерии обладают гидрофобной оболочкой, способствующей агрегации клеток, что затрудняет перенос бактерий в жидкую среду и подсчет их количества как при высевах на плотную среду, так и в камере Горяева. В свою очередь, наблюдение за «живым» монослоем и подсчет бактерий в стандартном поле зрения также затруднительны из-за большого количества бактерий и значительной скорости их перемещения.
Вышесказанное требует разработки нового подхода к изучению скользящих колоний, который позволил бы дифференцировать факторы, влияющие непосредственно на подвижность, и исключить при этом изменение ростовых характеристик и выживаемость бактерий.
Материал и методика
Объекты исследования . Объектом исследования служили штаммы Mycobacterium smegmatis mc2 155 (таблица). Штамм без делеций генов использовали в качестве контроля, с которым сравнивали результаты скольжения штамма с делецией гена rel Msm .
Штаммы
[Strains]
|
Штамм |
Источник |
|
Mycobacterium smegmatis mc2 155 |
Штамм дикого типа [Mohan et al., 2015] (Институт биохимии им. А.Н. Баха РАН, АТСС #700084) |
|
Mycobacterium smegmatis mc2 155 Δ rel Msm |
Штамм с одиночной делецией rel Msm . Коллекция Лаборатории адаптации микроорганизмов ИЭГМ УрО РАН (сконструирован сотрудниками лаборатории) |
Условия культивирования . Бактериальную культуру выращивали на среде Middlebrook 7Н9 («Himedia», Индия), в которую предварительно добавляли ампициллин (5 мкг/мл) и твин-80 (0.05%), в термостатируемом шейкере (37оС, 200 об/мин) до оптической плотности 1.0 (600 нм). Затем бактериальные клетки отмывали от питательной среды центрифугированием (5 мин., 13 000 об/мин) в физиологическом растворе до оптической плотности 0.2 (600 нм). Полученную культуру использовали в экспериментах по изучению скользящих колоний M. smegmatis .
Для исследования скольжения готовили специальную среду Middlebrook 7Н9 без глицерина с добавлением агарозы до концентрации 0.3% (полужидкий агар). После автоклавирования среду разливали в пластиковые чашки Петри диаметром 40 мм. При необходимости к среде добавляли полиамины до конечной концен-тации 2 мМ. После этого чашки подсушивали при комнатной температуре в течение 24 часов. Инокулят в виде микрокапли (0.5 мкл) наносили на поверхность среды в центре чашки Петри. После полного впитывания капли чашки помещали в герметичный контейнер, где поддерживали постоянную относительную влажность на уровне 50%. Контейнер выдерживали в термостате (37оС) в течение 16 часов.
Определение гидрофобности бактерий . Культуру в экспоненциальной фазе, выросшую до оптической плотности 1.4 (590 нм), отмывали от питательной среды PUM-буфером [McNeil, Dennison, Parish, 2017] и доводили до плотности 0.8 (590 нм). Подготовленную бактериальную культуру вносили по 5 мл в стеклянные пробирки и добавляли гексадекан до концентрации 0.5% от общего объема, после чего интенсивно встряхивали в течение 15 секунд. После встряхивания пробы оставляли на 30 мин., а затем измеряли оптическую плотность водной фазы. Степенью гидрофобности считали процентное отношение оптической плотности водной фазы после взаимодействия с гексадеканом к изначальной оптической плотности подготовленных проб (0.8, 590 нм).
Определение параметров скользящих колоний . Выросшие скользящие колонии фотографировали при помощи фотоаппарата («Olympus», Япония) для последующего определения их площади, а затем исследовали монослой без применения красителей непосредственно в чашках Петри при 400-кратном увеличении с помощью микроскопа МИКМЕД-6 («ЛОМО», Россия), оборудованного цифровой камерой МС 6.3 («ЛОМО», Россия) и фазово-контрастным устройством. Метод фазового контраста, как известно, основан на принципе интерференции. Световая волна, попавшая на объект исследования (бактериальные клетки), после прохождения через кольцевую диафрагму изменяет фазу колебаний по сравнению с другими волнами. Из-за разности фаз световых волн бактерии выглядят темными образованиями на светлом фоне свободного пространства. Этот результат можно зафиксировать на камеру. Бактериальный монослой фотографировали с помощью цифровой камеры МС 6.3.
Для анализа микрофотографий с целью получения цифровых данных о локальном межклеточном пространстве и площади колоний использовали программу Adobe Photoshop CC 2015.5 («Adobe», США). Площадь колоний определяли путем подсчета количества пикселей, которые занимает колония на фотографии. Зная диаметр чашки, определяли количество пикселей, приходящихся на всю площадь поверх- ности чашки и подсчитывали площадь (мм2), приходящуюся на 1 пиксель (формула 1):
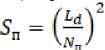
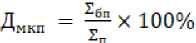
(2) где Д мкп – доля межклеточного пространства, ∑ бп – сумма пикселей, которую занимает межклеточное пространство на микрофотографиях, ∑ п – сумма всех пикселей на микрофотографии.
Важным условием подобного анализа является максимально точное разграничение областей с разными значениями, особенно в случаях, когда бактерии плотно прилегают друг к другу. Этот фактор зависит как от разрешения камеры, так и от программных возможностей анализа. Благодаря описанному ранее методу обработки изображений нам удалось максимально точно сохранить реальное соотношение между межклеточным пространством и областями, занятыми бактериальными клетками.
Статистическую обработку результатов проводили с использованием пакета стандартных программ Statistica 7.0 (StatSoft, Inc., 2006). На рисунках 3, 5 отражены средние значения, а вертикальными отрезками – ошибка среднего. Оценка статистической значимости различий произведена с использованием Т-критерия Стьюдента. Различия считали значимыми при р≤0.05. На рисунке 4 отражены медианные значения, вертикальными отрезками обозначены первые и третьи квартили. Оценка статистической значимости различий произведена с использованием критерия Манна-Уитни. Различия считали значимыми при р≤0.05.
Результаты и обсуждение
Известно, что процесс скольжения осуществляется за счет формирования момента силы, возникающего в точке соприкосновения клеток в процессе их роста и деления. Вектор момента силы ориентирован в направлении наименьшего сопротивления. Это определяется множеством факторов, включая свойства поверхности скольжения, физиологические и метаболические параметры клеток, определяющие строение клеточной поверхности, скорость роста и деления, а также многие другие, природа которых до настоящего времени остается неизвестной. Горизонтальное скольжение клеток вдоль поверхности традиционных плотных питательных сред или в отсутствие факторов скольжения затруднено. Это приводит к тому, что в процессе деления все больше начинает преобладать вектор момента силы, направленный вертикально по отношению к поверхности среды, что сопровождается «наслоением» вновь образованных клеток на своих предшественников и формированием «традиционных» многослойных колоний сравнительно небольшого диаметра.
В отличие от этого, при благоприятных условиях (увлажненная поверхность, продукция факторов скольжения или специфические особенности бактериальной поверхности) перемещение клеточного монослоя в скользящей колонии происходит преимущественно горизонтально, в направлении наименьшей скученности клеток и преобладания свободного межклеточного пространства. Исходя из этого, следует, что воздействие какого-либо фактора, повышающего способность клеток к скольжению, можно оценить по возрастанию свободного пространства между бактериями (межклеточного пространства) и, соответственно, возрастания диаметра скользящей колонии. Наоборот, условия, замедляющие скольжение, вызовут снижение величины межклеточного пространства и диаметра скользящей колонии.
Для определения параметров, характеризующих скольжение клеток M. smegmatis , нами разработан метод, основанный на компьютерном анализе цифровых микрофотографий скользящих колоний, полученных с использованием фазово-контрастной микроскопии (см. раздел «Материалы и методы»). Суть метода заключается в том, чтобы с помощью программной обработки изображений преобразовать данные так, чтобы все области пикселей на фото принимали только одно из этих двух значений, а именно: равное нулю – для области, занимаемой бактериями («черные пиксели»), и значение, равное 255 («белые пиксели») – для области межклеточного пространства (рис. 1).

Рис. 1 . Результат изменения фотографии монослоя M. smegmatis.
Слева – изображение до обработки, справа – изображение после обработки
[Result of modifying M. smegmatis monolayer photo: Left – before modifying, right – after modifying]
Использование данного метода дало возможность оценивать плотность расположения бактерий (формула 2, «Материалы и методы исследований»). Кроме того, при необходимости и при соблюдении определенных условий (небольшие различия в размерах бактерий и отсутствие наслоений бактерий друг на друга), метод может использоваться для вычисления количества бактерий в поле зрения микроскопа посредством деления значения суммы черных пикселей на их число, приходящееся на 1 бактериальную клетку.
С помощью данного метода нами изучено дифференцированное влияние на скольжение микобактерий внутренних и внешних факторов адаптации – гена алармонсинтетазы Rel Msm и экзогенных полиаминов – спермидина и спермина – в концентрации 2 мМ.
Проведенное нами ранее сравнительное исследование показало отсутствие значимых отличий ростовых параметров у родительского и делеционного штамма M. smegmatis , лишенного гена rel Msm , [Tsyganov, Tkachenko, 2022]. В то же время делеция данного гена приводила к почти двукратному увеличению площади скользящей колонии (рис. 2 А, В). Алармонсинтетаза Rel Msm регулирует уровни ppGpp, который, в свою очередь, способствует накоплению полифосфатов и, таким образом, влияет на биоплен-кообразование [Chakraborty, Kumar, 2019], скольжение [Gupta, Kasetty, Chatterji. 2015], вирулентность патогенных штаммов [Petchiappan, Naik, Chatterji. 2020] и процессы адаптации микобактерий к стрессу [Primm et al., 2000]. Следует отметить, что полученные нами данные не согласуются с более ранними исследованиями скольжения штамма с аналогичной делецией [Gupta, Kasetty, Chatterji. 2015]. Это, вероятно, связано с тем, что свойства среды, использованной для изучения скольжения, в нашем эксперименте отличались от таковых для среды, использованной упомянутыми авторами. Мы следовали рекомендациям, данным в описании метода, разработанного для выращивания скользящих колоний микобактерий, согласно которым среда не должна содержать источников углерода [Martínez, Torello, Kolter, 1999]. В отличие от этого, в исследовании, проведенном Gupta с соавторами, в среде присутствовала глюкоза, что могло оказать значительное воздействие на фенотип колонии. Из результатов этих авторов следует, что штамм без делеций обладает способностью к скольжению, но образованная при этом колония по виду не является монослоем и представляет собой трехмерную структуру. Выявленные особенности, с одной стороны, подтверждают важность исследования связи между скольжением и регуляторами бактериального стресса, но с другой – требуют более корректного подхода к его методической части, включая состав питательной среды, что учтено в нашей работе.
Полиамины спермидин и спермин статистически значимо влияли на скольжение микобактерий (рис. 2В). Несмотря на то, что оба из использованных нами полиаминов обладают положительным зарядом, их различия по молекулярной массе и величине заряда, по-видимому, являются причиной разнонаправлен-ности их эффектов на скольжение. Спермидин увеличивал площадь скользящих колоний обоих штаммов, тогда как спермин – уменьшал.
В обоих случаях изменения монослоя колоний на микроуровне прямо коррелировали с изменениями их площадей. Если колония микобактерий в присутствии какого-либо фактора увеличивалась в размерах, это приводило к возрастанию доли межклеточного пространства, и наоборот. Бактерии в скользящей колонии штамма с делецией rel Msm были расположены значительно дальше друг от друга, что прямо коррелировало с увеличением площади всей колонии. Присутствие в среде спермидина также способствовало росту площади и межклеточного пространства. В отличие от этого, внесение в среду спермина приводило к обратному результату (рис. 2А).
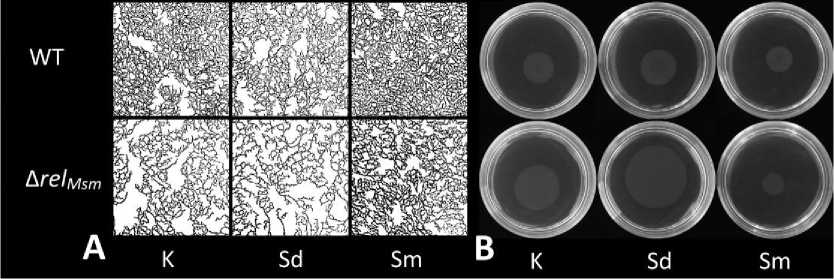
Рис. 2 . Влияние полиаминов и алармонсинтетазы rel Msm на скольжение M. smegmatis :
А – микрофотографии монослоя колоний, В – скользящие колонии M. smegmatis , WT – штамм M. smegmatis mc2 155 без делеций генов, Δ rel Msm – штамм M. smegmatis mc2 155 с делецией гена rel m sm , К –без добавок полиаминов, Sd – спермидин, Sm – спермин
[Effect of polyamines and alarmone synthetase rel Msm on M. smegmatis sliding motility: А – M. smegmatis sliding colony monolayer, В – M. smegmatis sliding colony,
WT – M. smegmatis mc2 155 strain, Δ rel Msm – M. smegmatis mc2 155 with rel Msm deletion, К –without polyamines, Sd – spermidine, Sm – spermine]
Для того, чтобы сделать достоверный вывод о плотности расположения бактериальных клеток в монослое, мы разработали метод преобразования полученных визуальных данных в числовые значения, пригодные для статистической обработки. Учитывая описанные проблемы, связанные с физиологическими особенностями микобактерий (см. «Введение»), в данной работе проведена оценка изменения пространства между клетками. Для этого фотографии монослоя обрабатывали согласно использованному нами методу (см. «Материалы и методы»), позволяющему охарактеризовать величину межклеточного пространства в поле зрения микроскопа. Благодаря этому нам удалось количественно оценить соотношение пространства между бактериями в монослое и пространства, занимаемого клетками. Для того, чтобы исключить разброс значений в разрешении фотографий, межклеточное пространство оценивали как процентную величину от общей площади поля зрения.
В ходе сравнительного исследования межклеточного пространства в скользящих колониях M. smeg-matis было установлено, что как полиамины, так и отсутствие Rel Msm статистически значимо влияли на данный параметр. Спермидин и делеция rel Msm приводили к значительному увеличению количества свободного пространства, в то время как спермин концентрации уменьшал его. При этом эффекты полиаминов и делеции суммировались (рис. 3). Поскольку данные факторы не влияли на скорость роста микобактерий [Tsyganov, Tkachenko, 2022], изменение плотности бактерий в колонии отражалось на ее площади.
演 SRHBdlJodu ӘОНҺО1-①іш关① w
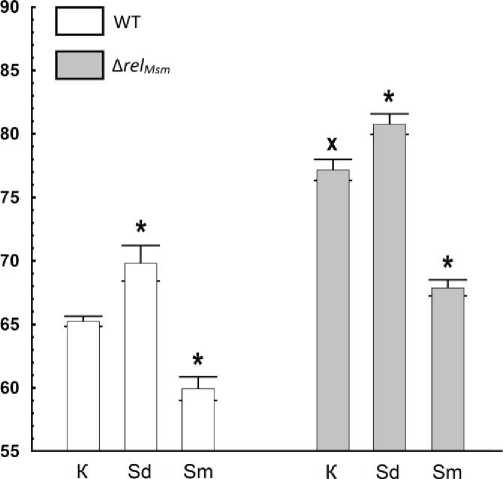
Рис. 3 . Изменение межклеточного пространства колоний штаммов M. smegmatis в присутствии полиаминов:
WT – штамм M. smegmatis mc2 155 без делеций генов, Δ rel Msm – штамм M. smegmatis mc2 155 с делецией гена rel m sm , К –без добавок полиаминов, Sd – спермидин, Sm – спермин.
* – статистически значимые отличия от площади контроля соотвествующего штамма без добавки полиамина, х – статистически значимые отличия от площади колонии родительского штамма WT (с использованием Т критерия Стьюдента, р≤0.05)
[Changes in the intercellular space of colonies of M. smegmatis strains with polyamines:
WT – M. smegmatis mc2 155 strain, Δ rel Msm – M. smegmatis mc2 155 with rel Msm deletion, К – without polyamines, Sd – spermidine, Sm – spermine.
-
* – statistically significant differences from the control area of the corresponding strain without the addition of polyamine, x – statistically significant differences from the colony area of the WT strain (using the Т-test, p≤0.05)]
При сравнительном анализе площадей скользящих колоний M. smegmatis и доли межклеточного пространства на микрофотографиях данных колоний становится заметна положительная корреляция между данными параметрами (рис. 3, 4). Увеличение или уменьшение площади всегда сопровождалось соответствующим возрастанием или снижением межклеточного пространства в скользящих колониях микобактерий.
Таким образом, благодаря применению разработанного нами метода удалось статистически достоверно дифференцировать эффекты ограничения скольжения, вызываемые спермином, и усиление бактериального скольжения в присутствии спермидина. Кроме того, нам удалось показать связь между присутствием алармонсинтетазы Rel Msm и характером скольжения M. smegmatis .
ZWWSBBtnoyLJ
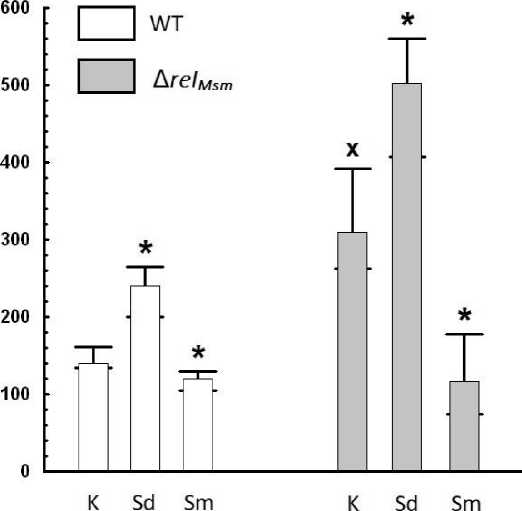
Рис. 4 . Изменение площадей скользящих колоний штаммов M. smegmatis в присутствии полиаминов
WT – штамм M. smegmatis без делеций генов, Δ rel Msm – штамм M. smegmatis mc2 155 с делецией гена rel Msm , К –без добавок полиаминов, Sd – спермидин, Sm – спермин.
* – статистически значимые отличия от площади контроля соответствующего штамма без добавки полиамина, х – статистически значимые отличия от площади колонии родительского штамма WT
(с использованием критерия Мана-Уитни, р≤0.05)
[Changes in the areas of M. smegmatis sliding colony strains in the presence of polyamines:
WT – M. smegmatis mc2 155 strain, Δ rel Msm – M. smegmatis mc2 155 with rel Msm deletion, К – without polyamines, Sd – spermidine, Sm – spermine.
-
* – statistically significant differences from the control area of the corresponding strain without the addition of polyamine, x – statistically significant differences from the colony area of the WT strain (using the Man-Whitney test, p≤0.05)]
Согласно ранее описанной модели [Recht et al., 2000], способность к скольжению связана с изменением структуры поверхности микобактерий. Гидрофобная оболочка, как предполагается в описанной модели, позволяет микобактериям снижать трение о поверхность среды и облегчать скольжение. Таким образом, можно было бы ожидать, что бактерии с более гидрофобной бактериальной оболочкой должны испытывать меньшее сопротивление среды, благодаря чему они должны были бы формировать бóльшие по площади колонии, характеризующиеся более высоким значением межклеточного пространства. И наоборот, чем менее гидрофобна бактериальная поверхность, тем большее сопротивление должны испытывать клетки в процессе скольжения и, соответственно, тем более плотно они должны располагаться относительно друг друга, что уменьшало бы площадь всей колонии.
С целью исследования механизма влияния алармонсинтетазы Rel Msm и полиаминов на скольжение нами изучено изменение гидрофобности поверхности бактериальных клеток M. smegmatis . Несмотря на статистически достоверные отличия в скольжении при добавлении в среду полиаминов, это не отражалось на гидрофобности родительского штамма (рис. 5). В то же время гидрофобность штамма с делецией гена rel Msm , при добавлении в среду полиаминов увеличивалась.
При этом результаты оценки скольжения обоих штаммов микобактерий в присутствии поликатионов не только отличались от контроля, но и демонстрировали разнонаправленный характер: спермидин стимулировал скольжение, тогда как спермин подавлял его.
Аналогичный результат был получен при исследовании влияния делеции rel Msm на гидрофобность микобактерий. Суспензия контрольного родительского штамма в водном буферном растворе демонстрировала снижение оптической плотности после контакта с органической фазой. Это подтверждало высокую гидрофобность клеток M. smegmatis . В свою очередь, оптическая плотность водной фазы штамма с деле-цией гена rel Msm после экспозиции с гексадеканом практически не менялась, что свидетельствует о снижении гидрофобности по сравнению с родительским штаммом (рис. 5). Таким образом, согласно полученным нами данным, штамм, который способен лучше скользить по гидрофильной среде, обладает более гидрофильной оболочкой, что противоречит ранее опубликованной модели скольжения [Recht et al.,
-
2000]. Изменения в скольжении и гидрофобности штаммов микобактерий в присутствии полиаминов также не согласуются с общепринятой моделью. Спермидин и спермин, оказывавшие разнонаправленный эффект на скольжение, статистически значимо повышали гидрофобность у штамма с делецией гена rel Msm , но не оказывали значительного эффекта на гидрофобность родительского штамма.
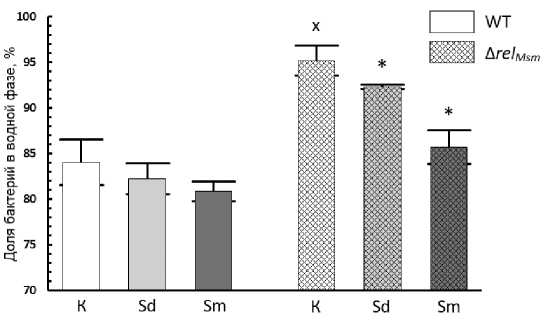
Рис. 5 . Влияние полиаминов на гидрофобность бактериальной поверхности M. smegmatis :
К – без добавок полиаминов, Sd – спермидин 2 мМ, Sm – спермин 2 мМ,
* – статистически значимые отличия от площади контроля соответствующего штамма без добавки полиамина, х – статистически значимые отличия от площади колонии родительского штамма WT (с использованием критерия Т-критерий Стьюдента, р≤0.05
[Changes in the areas of M. smegmatis sliding colony strains in the presence of polyamines:
К – without polyamines, Sd – spermidine, Sm – spermine.
* – statistically significant differences from the control area of the corresponding strain without the addition of polyamine, x – statistically significant differences from the colony area of the WT strain (using the T-test, p≤0.05)]
В то же время полученные нами результаты исследования гидрофобности и скольжения штаммов согласуются с нашими ранними исследованиями биопленкообразования M. smegmatis [Tsyganov, Tkachenko, 2022]. В цитируемой работе нами было показано, что отсутствие алармонсинтетаз у мутантных штаммов приводит к снижению количества ГПЛ в наружной оболочке, что, в свою очередь, вызывало снижение уровня гидрофобности клеточной поверхности и, по-видимому, было одной из причин нарушения процесса образования поверхностных биопленок микобактерий (пелликул). В конечном итоге поверхностные биопленки штаммов с делециями алармонсинтетаз фрагментировались и оседали на дно, в то время как пелликулы родительского штамма оставались целыми и продолжали удерживаться на поверхности [Tsyganov, Tkachenko, 2022]. При этом результаты, представленные нами в настоящей статье (рис. 5), дают возможность ретроспективно подтвердить, что восстановление целостности пелликул, наблюдаемое нами ранее у штаммов с делецией алармонсинтетазы в присутствии полиаминов, сопровождается возрастанием гидрофобности бактериальной оболочки. На этом основании можно прийти к заключению о том, что достаточно высокий уровень гидрофобности микобактерий необходим для био-пленкообразования, однако не является ключевым фактором, регулирующим скольжение микобактерий. Установление полного механизма скольжения микобактерий является перспективой наших дальнейших исследований.
Заключение
Таким образом, с помощью разработанного метода анализа микобактериального монослоя изучена связь между скольжением и гидрофобностью микобактерий, а также оценена специфичность воздействия эндогенных и экзогенных факторов адаптации к стрессу на скольжение, представляющее собой один из признаков вирулентности микобактерий [Lai et al., 2018]. Нам удалось дифференцировать влияние на скольжение микобактерий алармонсинтетазы и биогенных полиаминов от влияния сопутствующих неспецифических изменений ростовых параметров, что ранее было затруднительно. Исследования монослойной структуры скользящей колонии посредством сравнения расположения бактерий относительно друг друга сделали возможным получение прямых доказательств модуляции скольжения за счет воздействия изучаемых факторов на этот процесс. Кроме того, использованный нами метод может быть адаптирован для исследования сопутствующих явлений, таких как агрегация бактерий или иных видов их поверхностного перемещения, например, роения (swarming) и подтягивания (twitching) [Цыганов, Нестерова, Ткаченко, 2021]. С помощью использованного в работе метода можно также значительно ускорить процесс подсчета бактерий, например, в камере Горяева. В наших исследованиях результаты 408
подсчета бактерий традиционным методом, в сравнении с использованным для оценки скольжения, отличались не более, чем на 5%, что соответствует стандартному p-значению р≤0.05.
Полученные данные позволяют сделать вывод об отсутствии прямой зависимости между наличием гидрофобной оболочки микобактерий и их способностью к скольжению по гидрофильным поверхностям. Это указывает на то, что механизм скольжения является более сложным процессом и его регуляция зависит не только от скорости деления бактерий и силы трения о поверхность. Установление реальных факторов регуляции скольжения позволит усовершенствовать методы борьбы с возбудителями микобактериозов.
Список литературы Дифференцированная оценка воздействия биогенных полиаминов и алармонсинтетазы RelMsm на характер скольжения Mycobacterium smegmatis
- Цыганов И.В., Нестерова Л.Ю., Ткаченко А.Г. Скольжение бактерий: способ пассивного распространения без использования жгутиков и пилей (обзор) // Вестник Пермского университета. Сер. Биология. 2021. Вып. 4. С. 263-274. DOI: 10.17072/1994-9952-2021-4-263-274.
- Brennan P.J., Nikaido H. The envelope of mycobacteria // Annual Review of Biochemistry. 1995. Vol. 64. P. 29-63. DOI: 10.1146/annurev.bi.64.070195.000333.
- Chakraborty P., Kumar A. The extracellular matrix of mycobacterial biofilms: could we shorten the treatment of mycobacterial infections? // Microbial Cell. 2019. Vol. 6, № 2. P. 105-122. DOI: 10.15698/mic2019.02.667.
- Daffe M., Draper P. The envelope layers of mycobacteria with reference to their pathogenicity // Advances in microbial physiology. 1997. Vol. 39. P. 131-203. DOI: 10.1016/s0065-2911(08)60016-8.
- Ghosh S., Indi S.S., Nagaraja V. Regulation of lipid biosynthesis, sliding motility, and biofilm formation by a membrane-anchored nucleoid-associated protein of Mycobacterium tuberculosis // Journal of bacteriology. 2013. Vol. 195, № 8. P. 1769-1778. DOI: 10.1128/JB.02081-12.
- Gupta K.R. et al. Regulation of growth, cell shape, cell division and gene expression by second messengers (p) ppGpp and c-di-GMP in Mycobacterium smegmatis // Journal of bacteriology. 2016. Vol. 198, № 9. P. 1414-1422. DOI: 10.1128/JB.00126-16.
- Gupta K.R., Kasetty S., Chatterji D. Novel functions of (p)ppGpp and Cyclic di-GMP in mycobacterial physiology revealed by phenotype microarray analysis of wild-type and isogenic strains of Mycobacterium smegmatis // Applied Environmental Microbiology. 2015. Vol. 81, № 7. P. 2571-2578. DOI: 10.1128/AEM.03999-14.
- Henrichsen J. Bacterial surface translocation: a survey and a classification // Bacteriological reviews. 1972. Vol. 36, № 4. P. 478-503. DOI: 10.1128/br.36.4.478-503.1972.
- Hölscher T., Kovacs Ä.T. Sliding on the surface: bacterial spreading without an active motor // Environ Microbiology. 2017. Vol. 19, № 7. P. 2537-2545. DOI: 10.1111/1462-2920.13741.
- Igarashi K., Kashiwagi K. Modulation of cellular function by polyamines // The International Journal of Biochemistry & Cell Biology. 2010. Vol. 42, № 1. P. 39-51. DOI: 10.1016/j.biocel.2009.07.009.
- Lai L.Y. et al. Role of the Mycobacterium marinum ESX-1 Secretion System in Sliding Motility and Biofilm Formation // Frontiers in Microbiology. 2018. Vol. 9. Art. 1160. DOI: 10.3389/fmicb.2018.01160
- Martinez A., Torello S., Kolter R. Sliding motility in mycobacteria // Journal of bacteriology. 1999. Vol. 181, № 23. P. 7331-7338. DOI: 10.1128/JB.181.23.7331-7338.1999.
- McNeil M.B., Dennison D., Parish T. Mutations in MmpL3 alter membrane potential, hydrophobicity and antibiotic susceptibility in Mycobacterium smegmatis // Microbiology. 2017. Vol. 163, № 7. P. 1065-1070. DOI: 10.1099/mic.0.000498.
- Mohan A. et al. Complete Genome Sequences of a Mycobacterium smegmatis Laboratory Strain (MC2 155) and Isoniazid-Resistant (4XR1/R2) Mutant Strains // Genome Announcements. 2015. Vol. 3, № 1. Art. e01520-14. DOI: 10.1128/genomeA.01520-14.
- Nesterova L.Yu., Tsyganov I.V., Tkachenko A.G. Biogenic Polyamines Influence the Antibiotic Susceptibility and Cell-Surface Properties of Mycobacterium smegmatis // Applied Biochemistry and Microbiology. 2020. Vol. 56, № 4. Р. 387-394. DOI: 10.1134/S0003683820040110.
- Petchiappan A., Naik S.Y., Chatterji D. RelZ-Mediated Stress Response in Mycobacterium smegmatis: ppGpp Synthesis and Its Regulation // Journal of Bacteriology. 2020. Vol. 202, № 2. Art. e00444-19. DOI: 10.1128/JB.00444-19.
- Primm T.P. et al. III. The stringent response of Mycobacterium tuberculosis is required for long-term survival // Journal of Bacteriology. 2000. Vol. 182. P. 4889-4898. DOI: 10.1128/jb.182.17.4889-4898.2000.
- Prossliner T. et al. Ribosome Hibernation // Annual Review of Genetics. 2018. Vol. 23, № 52. Р. 321348. DOI: 10.1146/annurev-genet-120215-035130.
- Recht J. et al. Genetic Analysis of Sliding Motility in Mycobacterium smegmatis // Journal of bacteriology. 2000 Vol. 182, № 15. P. 4348-4351. DOI: 10.1128/JB.182.15.4348-4351.2000.
- Schorey J.S., Sweet L. The mycobacterial glycopeptidolipids: structure, function, and their role in pathogenesis // Glycobiology. 2008. Vol. 18, № 11. P. 832-841. DOI: 10.1093/glycob/cwn076.
- Tsyganov I.V., Tkachenko A.G. Effect of biogenic polyamines on sliding motility of mycobacteria in the presence of antibiotics // Vavilovskii Zhurnal Genetiki i Selektsii. 2022. Vol. 26, № 5. P. 458-466. DOI: 10.18699/VJGB-22-56.
- Zamakhaev M. et al. Mycolicibacterium smegmatis possesses operational agmatinase but contains no detectable polyamines // International Journal of Mycobacteriology. 2020. Vol. 9, № 2. P. 138-143. DOI: 10.4103/ijmy.ijmy_48_20.
- Zegadlo K. et al. Bacterial Motility and Its Role in Skin and Wound Infections // International Journal of Molecular Sciences. 2023. Vol. 24, № 2. Art. 1707. DOI: 10.3390/ijms24021707.


