Дифференцированный подход к оценке почечного повреждения у больных мочекаменной болезнью с помощью неинвазивных маркеров
Автор: Россоловский Антон Николаевич, Глыбочко Петр Витальевич, Попков Владимир Михайлович, Полозов Александр Борисович, Понукалин Андрей Николаевич, Захарова Наталья Борисовна, Березинец Оксана Леонидовна, Блюмберг Борис Исаакович
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Урология
Статья в выпуске: 3 т.6, 2010 года.
Бесплатный доступ
Целью работы стала оценка клинического значения маркеров почечного повреждения при хирургическом лечении мочекаменной болезни. Проанализированы результаты операций у 110 больных мочекаменной болезнью. В исследовании представлены новые кандидаты в качестве биохимических маркеров острого почечного повреждения и интерстициального фиброза, потенциально обладающие высокой чувствительностью и специфичностью. В процессе исследования определяли содержание данных биомаркеров в моче пациентов. Высокие концентрации медиаторов почечного повреждения (Л2, ИЛ-18) и интерстициального фиброза (МСР-1, TGFp, IGF1) у больных на фоне имеющихся выраженных тубулоинтерстициальных изменений, сохраняющиеся в послеоперационном периоде высокие показатели нефрофиброза могут свидетельствовать о необратимости данных изменений, что ведет к прогрессированию хронической болезни почек
Медиаторы острого почечного повреждения и нефрофиброза, мочекаменная болезнь, тубулоинтерстициальный фиброз
Короткий адрес: https://sciup.org/14917163
IDR: 14917163
Текст научной статьи Дифференцированный подход к оценке почечного повреждения у больных мочекаменной болезнью с помощью неинвазивных маркеров
1Введение. В последние десятилетия значительно изменились подходы в диагностике и лечению мочекаменной болезни. Продолжают разрабатываться и совершенствоваться новые малоинвазивные хирургические методы, позволяющие в большинстве случаев избежать открытых операций [1]. При этом послеоперационное течение, как правило, сопровождается ишемией органа с последующими функциональными нарушениями, особенно при наличии исходных признаков почечной недостаточности, что обусловлено повреждением функционально активных паренхиматозных клеток [2].
Вопрос о механизмах прогрессирования хронических заболеваний почек остается одним из центральных в современной уронефрологии. В большинстве развитых стран наблюдается тенденция к неуклонному росту числа лиц со стойким снижением функции почек, требующим крайне дорогостоящих методов лечения [3].
В настоящее время считается, что патоморфо-логической основой прогрессиирования почечной недостаточности является накопление экстрацеллюлярного матрикса и атрофия канальцев с формированием тубулоинтерстициального фиброза [4]. Кроме того, прогрессирующие заболевания почек протекают в тесной связи с нарушением функции сосудистого эндотелия, в том числе и перитубулярных капилляров [5, 6].
Независимо от первичных пусковых механизмов в формировании нефрофиброза основное значение принадлежит повышенной продукции ряда медиаторов клеточного ответа, цитокинов и факторов роста [7]. Одной из моделей развития почечного фиброза [8-10] является мочекаменная болезнь (МКБ), сопровождающаяся полной или частичной обструкцией мочевыводящих путей, ассоциирующаяся со снижением почечного кровотока и ведущая к развитию почечной недостаточности [11]. Согласно исследо ваниям отдельных авторов присутствие конкремен-
та даже в отдельной чашечке способно оказывать влияние на уродинамику в целом. Возникающая при этом дискинезия приводит к изменениям микроциркуляции с последующим воспалением и пролиферативными процессами как в чашечке, так и в мозговом веществе почки с исходом в фиброз, что еще больше ухудшает функциональные возможности почки [12].
W.E. Yarger и J. Buerkert [13] доказали в своей работе, что развитие обстуктивной уропатии связано с ранней дилатацией проксимальных и дистальных канальцев и быстро приводит к истончению кортикального слоя и тубулярной атрофии. Апоптоз клеток почечных канальцев, развивающийся под действием обструктивной уропатии, приводит к уменьшению функционального объема почки [14]. Диапазон функциональных нарушений при нефролитиазе бывает чрезвычайно широким. Степень нарушения почечных функций при МКБ зависит от выраженности обструкции, объема повреждения, наличия инфекционно-воспалительных изменений в паренхиме, а также адекватности проводимой терапии [15].
Для оценки степени выраженности и прогрессирования почечного повреждения в настоящее время предложено большое число прямых и непрямых маркеров. При этом традиционные маркеры почечной недостаточности, такие как, уровень сывороточного креатинина (сКр), скорость клубочковой фильтрации (СКФ), и данные некоторых визуализирующих методов с определением толщины слоя действующей паренхимы позволяют оценивать почечное повреждение на более поздних стадиях, когда большая часть почечной паренхимы необратимо утрачивает свои функции.
Так, измерение концентрации сКр не всегда отражает объем и степень повреждения, так как этот показатель отстает по времени от момента повреждающего воздействия [16], а также не позволяет дифференцировать острое почечное повреждение от хронического почечного заболевания [17].
Одним из ключевых маркеров, использующихся для разграничений стадий хронической болезни почек и прогнозирования темпов ее прогрессирования, является величина СКФ. Однако определение СКФ не всегда отражает степень истинного почечного повреждения. Например, при компенсаторной гипертрофии остаточных нефронов и их сохраненной фильтрационной способности редукции СКФ может не происходить [18]. Эти данные подтверждены и в работе S.S. Waikar и соавт., которые отметили, что снижение СКФ не всегда наблюдается даже в случаях тяжелого паренхиматозного повреждения почек [19].
С внедрением в практику дуплексной допплерографии почечного кровотока с цветным картированием потока крови появилась реальная возможность количественной оценки состояния микроциркулятор-ного русла почки, различные варианты изменений которого могут быть как проявлением адаптации почечной гемодинамики к изменениям внутриполостно-го давления при МКБ, так и следствием изменений структуры почечной паренхимы. Определяемые при стандартном УЗ-сканировании диффузные изменения почечной паренхимы в сочетании с уменьшением ее толщины, наличие участков склероза почечной ткани трактуются как проявления хронического почечного заболевания. Точность и специфичность методов ультразвуковой диагностики весьма субъективна и, по данным различных авторов, колеблется от 45 до 85% [20].
В экспериментальных и клинических исследованиях определен спектр наиболее значимых медиаторов, участвующих в реализации процессов не-фрофиброза: хемокины, факторы роста (monocyte chemoattractant peptide-1, transforming growth factor β), ряд эндотелиальных факторов [21]. Повышение их концентраций в крови и моче пациентов с МКБ ассоциируется с тяжелым течением нефролитиаза на фоне выраженных тубулоинтерстициальных изменений и могет свидетельствовать о прогрессировании хронической болезни почек у этих больных [22].
В последние годы предложен ряд биомаркеров, экскретирующихся с мочой и позволяющих дифференцировать острое и хроническое повреждение почек на самых ранних стадиях. Большинство этих маркеров представляют собой соединения, экспрессирующиеся в канальцевом аппарате почек и в повышенных количествах выделяющиеся в мочу при условии повреждения данного органа. К ним относятся интерлейкин-18 (ИЛ-18), молекула почечного повреждения-1, нейтрофил-гелатиназа-ассоцииро-ванный липокалин (neutrophil gelatinase-associated lipocalin, NGAL или липокалин-2 (Л2)), а также ряд ферментов, в норме обычно локализующихся в щеточной кайме проксимальных канальцев [23].
Липокалин-2, регистрируемый ранее, чем накопление креатинина сыворотки [24-26], является также перспективным маркером хронической болезни почек: он обратно пропорционален СКФ при почечной дисплазии, обструктивной уропатии и гломерулярных заболеваниях почек. Недавно предложена интересная теория «горящего леса», объясняющая связь между Л2 и СКФ [27]. Рост Л2, согласно этой теории, есть не только пассивное следствие снижения почечного клиренса, но результат «горящих» (поврежденных) тубулярных клеток, тогда как рост концентрации креатинина и снижение СКФ есть всего лишь пассивный результат потери функционирующих нефронов. Следовательно, Л2 является индикатором в реальном времени активного повреждения почечной паренхимы при хронической болезни почек.
Не менее интересным маркером при остром почечном повреждении является экскретирующийся с мочой ИЛ-18 – цитокин, структурно подобный ИЛ-1, оказывающий выраженный эффект на активацию T-клеток и являющийся модулятором инфекционных, аутоиммунных и воспалительных процессов. ИЛ-18 очень специфичен для острого почечного повреждения – на его уровень не влияют большинство нефротоксинов, хроническая болезнь почек, инфекция мочевого тракта, нефротический синдром или преренальная азотемия [28]. Определение повышенного уровня ИЛ-18 в моче предсказывала наличие острого почечного повреждения за 24 часа до роста уровня сывороточного креатинина [29].
Клиническое значение этих показателей при различных патологических состояниях только начинает оцениваться.
В связи с этим целью нашего исследования стала оценка клинического значения маркеров почечного повреждения при хирургическом лечении мочекаменной болезни.
Методы. Обследовано 110 пациентов с МКБ, оперированных в клинике уронефрологии клинической больницы им. С.Р. Миротворцева ГОУ ВПО «Саратовский ГМУ им. В.И. Разумовского» Росздрава. Все пациенты были разделены на две группы: первую группу составили 60 больных МКБ с признаками не-фросклероза, которым выполнялось хирургическое лечение; вторую – 50 пациентов с нефролитиазом без признаков нефросклероза; 3-ю группу – сравнения – 30 практически здоровых лиц, сопоставимых по полу и возрасту с больными МКБ.
Критериями исключения из исследования являлись: возраст старше 60 лет, острый пиелонефрит, полная обструкция мочевыводящих путей с нарушением функции, аденома предстательной железы с инфравезикальной обструкцией, почечная недостаточность в острой и терминальной стадиях, больные с конкрементами мочеточников и нижних мочевыводящих путей, а также пациенты с тяжелой сопутствующей патологией, в том числе выраженной артериальной гипертензией и онкологическими заболеваниями.
Всем пациентам проводилось ультразвуковое исследование почек и их сосудов на аппарате SonoAce-9900 Prime (Medison). В В-режиме оценивали размеры почек, толщину почечной паренхимы, состояние кортико-медуллярной дифференцировки и полостной системы, наличие участков склероза паренхимы. В режиме цветокодированных методик получали изображения крупных и мелких сосудов. Параметры импульсноволновой допплерографии регистрировали на уровнях сегментрарных, междолевых и дуговых артериях почек. Оценивали традиционные характеристики почечного кровотока: пиковую систолическую (Vps) и конечную диастолическую (Vpd) скорости кровотока, рассчитывали индекс резистентности (IR) и пульсовой индекс (Pi).
Всем пациентам были исследованы содержания моноцитарного хемоатрактантного протеина (МСР-1) в образцах мочи методом твердофазного иммуно-ферментного анализа с помощью тест-наборов реактивов фирмы «Вектор-Бест» (Россия, Новосибирск) на иммуноферментном анализаторе Stat Fax 2010 (США); ростовые факторы – трансформирующий фактор роста β (ТGF-β), инсулиноподобный фактор роста-1 (IGF-1); маркеры прогрессирования хронического повреждения почек – Л2 и ИЛ-18, показателей состояния канальцевого состояния почек – β2- микроглобулин (β2-МГ).
Концентрация креатинина в сыворотке крови измерялась с использованием стандартных лабораторных методов. Расчет СКФ проводился с использованием пробы Реберга, уравнения Сockroft – Gault и формулы, полученной в исследовании Modification of Diet in Renal Disease Study (MDRD).
Забор мочи для анализа проводился при поступлении, на 7-10-е сутки после операции и через 1-3 месяца. Статистический анализ проводили с использованием пакета программ статистической обработки результатов StatSoft Statistica 7.0.
Результаты. В результате проведенного анализа составлена исходная характеристика больных в группах (табл. 1).
Из табл. 1 видно, что у половины пациентов I группы был выявлен коралловидный нефролитиаз. Кроме того, у 35% этих больных заболевание носило рецидивный характер, что достоверно выше, чем во II группе (p≤0,05). В течение всего периода наблюдения в рамках данного исследования пациенты I группы чаще госпитализировались и подвергались хирургическому лечению. Среднее значение уровня сывороточного креатинина у больных I группы составило 121±24,3, что достоверно выше по сравнению с контролем (p≤0,05). Скорость клубочковой фильтрации оказалась сниженной у больных I группы (p≤0,05), по сравнению с контролем, и несколько ниже, чем у пациентов без нефросклероза (p≥0,05).
В I группе пациентам чаще выполнялись открытые оперативные вмешательства, а во II группе – нефро-литолопаксия. Около половины больных в обеих группах подверглись дистанционной литотрипсии (рис. 1).
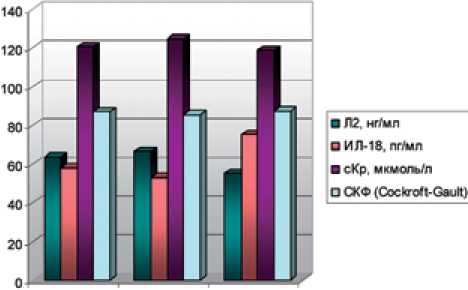
При оценке экскреции с мочой молекулярных биомаркеров их значения в I группе достоверно превосходили контрольные уровни (p≤0,05). Вместе с тем концентрации МСР-1, Л2 и ИЛ-18 были выше контрольных и у пациентов II группы (p≤0,05) (cм. табл. 1).
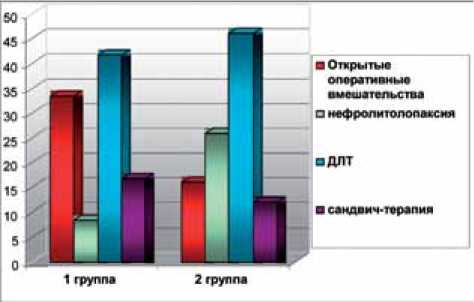
Рис. 1. Хирургическое лечение пациентов с нефролитиазом
При выполнении в предоперационном периоде дуплексной допплерографии почечного кровотока выявлялись достоверные различия между пациентами I группы и контролем по таким параметрам, как Vpd, IR и Pi (p≤0,05). У больных МКБ без признаков нефросклероза подобных изменений не обнаруживалось (табл. 2).
В раннем послеоперационном периоде (7-10-e сутки) у всех обследованных обнаруживается более или менее значимое повышение содержания большинства изучаемых лабораторных показателей, что в значительной степени обусловлено хирургическим воздействием. Однако у пациентов I группы регистрируемые изменения имели более высокие значения (p≤0,05). Так, концентрация маркеров канальциевого повреждения Л2, ИЛ-18 и β2-МГ составила 66,5±16,4 нг/мл, 53±12 пг/мл и 0,55±0,02 мкг/мл соответственно, против 28,8±7,5 нг/мл, 52,4±13,8 пг/мл и 0,36±0,05 мкг/мл во II группе (табл. 3).
Таблица 1
Клинико-лабораторная характеристика пациентов с МКБ (М±m)
|
Показатель |
1 группа (n=60) |
2 группа (n=50) |
Контроль (n=30) |
|
Возраст |
37,1±5.6 |
42,5±6,8 |
27,5±3,7 |
|
Пол, м, % |
63,7 |
57,3 |
55,2 |
|
Анамнез > 5 лет, % |
66%** |
38% |
- |
|
Коралловидный нефролитиаз |
53%** |
30% |
- |
|
Рецидивный нефролитиаз |
35%** |
17% |
- |
|
Артериальная гипертензия II-III ст. |
70% |
58% |
- |
|
Среднее число госпитализаций в течение 1 года |
2,7±1,3 |
1,3±0,7 |
|
|
сКр, мкмоль/л |
121±24,3* |
97±16,3 |
87±14,7 |
|
СКФ (Сockroft-Gault) |
87,2±14,3* |
105±20,1 |
110±18 |
|
СКФ (MDRD) |
73,2±8,8* |
89±10,3 |
103±15 |
|
Проба Реберга |
78,6±10,1 |
93,7±13,4 |
120±11,8 |
|
МСР-1, пг/мл |
1137±187* |
966,2±76* |
303±34 |
|
ТGF-β, пг/мл |
594,3±75** |
405±58,6 |
387,6±45 |
|
IGF-1, нг/мл |
19,3±3,7** |
10,4±3,2 |
18±5,4 |
|
Л2, нг/мл |
63,6±11,3* |
63±13,3* |
1,15±0,7 |
|
ИЛ-18, пг/мл |
58±10,2* |
61±8,6* |
39,7±9 |
|
β2-МГ, мкг/мл |
0,58±0,08* |
0,34±0,07 |
0,2±0,08 |
Примечание : * – р≤0,05 между пациентами с МКБ и группой сравнения; ** – р≤0,05 между группами
Таблица 2
Параметры дуплексной допплерографии почечного кровотока на дооперационном этапе (M±m)
|
Группы больных |
1 группа (n=60) |
2 группа (n=50) |
Контроль (n=30) |
|||
|
Параметр Уровень измерения |
Дуговые артерии |
Сегментарные артерии |
Дуговые артерии |
Сегментарные артерии |
Дуговые артерии |
Сегментарные артерии |
|
Vps |
23,5±3,2 |
46±6,8 |
25,7±4,2 |
50,6±6,9 |
26,7±3,4 |
47±2,1 |
|
Vpd |
11,2±1,4* |
13,7±2,5* |
14,4±2,8 |
20,3±3,7 |
15,5±1,7 |
23,1±3,3 |
|
IR |
0,7±0,02* |
0,74±0,09* |
0,68±0,03* |
0,7±0,02 |
0,63±0,03 |
0,67±0,02 |
|
Pi |
0,98±0,06* |
1,1±0,02 |
0,87±0,01 |
0,97±0,03 |
0,82±0,03 |
0,94±0,02 |
|
Толщина паренхимы |
1,1±0,3** |
1,9±0,2 |
2,0±0,09 |
|||
П р и м еч а н и е :* – р между пациентами с МКБ и группой сравнения; ** – р между группами
Как видно из табл. 3, сКр и СКФ в обеих группах в раннем послеоперационном периоде и через 1-3 месяца после вмешательства практически не менялись (рис. 2,3) (р≥0,05). В то же время у пациентов I группы отмечено более медленное восстановление функции. При этом концентрации молекулярных маркеров канальциевого повреждения в обеих группах существенно отличались через 7-10 дней и 1-3 месяца после операции (рис. 2, 3). Таким образом, в отличие от маркеров острого почечного повреждения ИЛ-18 и Л-2, сКр и СКФ не позволяют достоверно оценивать степень повреждения почечной паренхимы в периоперационном периоде и дифференцированно подходить к назначению нефропротективной терапии.
Через 1-3 месяца у пациентов I группы, на фоне сохраняющихся высоких значений маркеров повреждения тубулоинтерстициального аппарата (Л2, ИЛ-18 и β2-МГ), отмечается нарастание концентрации про-фибротических медиаторов (МСР-1, ТGF- β, IGF-1). Концентрация ТGF-β и IGF-1 через 1-3 месяца после операции составила 598,5±23,8 пг/мл и 27,5±3,2 нг/мл соответственно против 398±26,4 и 13,5±1,8 у пациентов без исходных признаков нефросклероза (рис. 4-6).
Во II группе больных через 1-3 месяца изучаемые показатели значительно снизились, а ряд медиаторов (МСР-1, ТGF-β, IGF-1, ИЛ-18 и β2-МГ) были сопоставимы с контролем (см. табл. 3).
Таким образом, при сформировавшемся исходно нефросклерозе у пациентов с МКБ, несмотря на успешное хирургическое лечение и устранение обструкции мочевыводящих путей, не происходит полного восстановления почечной паренхимы, а у части пациентов на фоне операционной травмы возникает дальнейшая активация процессов нефрофиброза, сохраняющаяся по крайней мере 3 месяца.
Данные дуплексной допплерографии почечного кровотока в раннем послеоперационном периоде свидетельствовали о некоторой нормализации показателей в обеих группах (табл. 4). Тем не менее, у пациентов I группы сохранялось снижение конечной диастолической скорости кровотока и повышение индекса резистентности на уровне дуговых и сегментарных артерий по сравнению с пациентами II группы (p≤0,05).
Через 1-3 месяца после хирургического лечения изучаемые параметры допплерографии не имели статистически значимых различий между группами (р ≥0,05) и являлись малоинформативными (табл. 5).
Обсуждение. Полученные данные свидетельствуют о том, что традиционные методы оценки функционального состояния почечной паренхимы не могут в полной мере отражать стадию почечного повреждения. У больных МКБ необходимость многократного определения значения сКр и СКФ возникает довольно редко, поскольку данные показатели малоизменчивы на этапах хирургического лечения [30].
Таблица 3
Содержание исследуемых маркеров в моче через 7-10 дней и 1-3 месяца после операции (M±m)
|
Показатель |
1 группа (n=60) |
2 группа (n=50) |
||
|
7-10 сутки |
1-3 месяца |
7-10 сутки |
1-3 месяца |
|
|
МСР-1, пг/мл |
684±67,4* |
821±48,2 |
529±52,6 |
302±31,7 |
|
ТGF-β, пг/мл |
469,5±12,6 |
598,5±23,8* |
496,8±25 |
398±26,4 |
|
IGF-1, нг/мл |
23±4,5 |
27,5±3,2* |
18±2,9 |
13,5±1,8 |
|
Л2, нг/мл |
66,5±16,4* |
55,2±11,7* |
28,8±7,5 |
24,9±8,3 |
|
ИЛ-18, пг/мл |
53±12 |
75,2±18* |
52,4±13,8 |
35±11 |
|
β2-МГ, мкг/мл |
0,55±0,02* |
0,31±0,07 |
0,36±0,05 |
0,3±0,01 |
|
сКр, мкмоль/л |
125±13,7* |
119±12,8 |
98±10,7 |
102,4±9 |
|
СКФ (Сockroft-Gault) |
85,7±10,2* |
87,5±10,7 |
108,2±11,3 |
110±8,3 |
|
СКФ (MDRD) |
71,5±12,8* |
75,8±10,5 |
92,7±16,4 |
101,2±12 |
П р и м еч а н и е :* – достоверность различий р ≤0,05 между группами
исходно 7-10сутжн 1-3 месим»
Рис.2. Динамическая оценка функционального состояния почек с применением стандартных методов (сКр, СКФ) и маркеров острого почечного повреждения ИЛ-18 и Л-2 у больных 1 группы
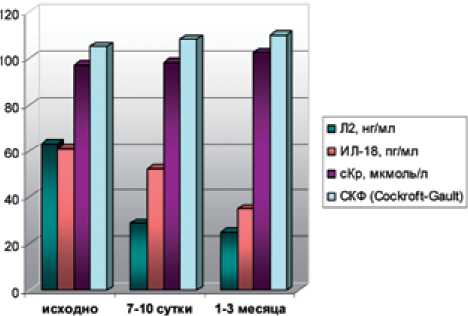
Рис.3. Динамическая оценка функционального состояния почек с применением стандартных методов ( сКр, СКФ) и маркеров острого почечного повреждения ИЛ-18 и Л-2 у больных 2 группы.
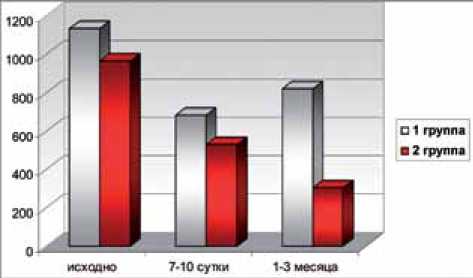
Рис. 4. Активация профибротического маркера МСР-1 в послеоперационном периоде у пациентов с исходным нефросклерозом
Измерением СКФ корректнее пользоваться, когда речь идет уже о хронической болезни почек.
Более значимой представляется оценка стабильности функции почек, а также прогнозирование степени тяжести острого почечного повреждения на фоне существующего хронического с явлениями нефросклероза. В преддверии оперативного вмешательства объективная оценка функционального состояния почечной паренхимы позволяет прогнозировать течение послеоперационного периода и минимизировать воздействие повреждающих факторов
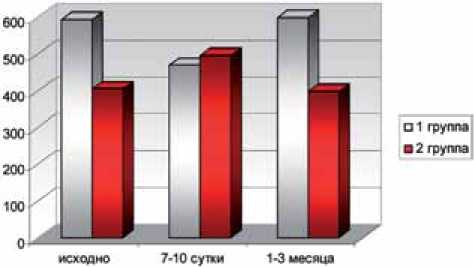
Рис.5. Активация профибротического маркера ТGF-β в послеоперационном периоде у пациентов с исходным нефросклерозом
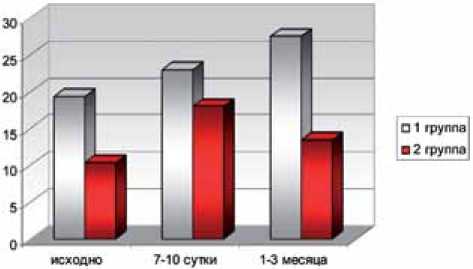
Рис. 6. Сравнительная оценка концентрации мочевого IGF-1 в группах и индукцию клеточного ответа. Предложенные в исследовании подходы позволяют дифференцировать прогрессирование повреждения с активацией клеточных механизмов от функционально менее значимого и потенциально обратимого повышения медиаторов воспаления и фиброза на фоне операционной травмы, что, в свою очередь, диктует необходимость своевременного лечебного воздействия.
Так, при устранении обструкции мочевыводящих путей, сопровождающейся ишемическим воздействием на почечную паренхиму, происходит снижение показателей, характеризующих острое повреждение канальцев (Л2, ИЛ-18). Однако при наличии констатированного нефросклероза на фоне операционной травмы происходит дальнейшее канальци-евое повреждение, о чем свидетельствуют либо сохраняющиеся высокими, либо нарастающие уровни Л2, ИЛ-18, а в итоге – продолжающаяся активация профибротических факторов (ТGF-β, IGF-1). Полученные данные должны учитываться при определении сроков повторных оперативных вмешательств, в том числе при необходимости улучшения качества дренирования полостной системы почки, а также при выполнении этапов «сандвич-терапии».
Повторные эпизоды почечного повреждения у больных с МКБ приводят к снижению репаративных возможностей почки с малой вероятностью полного восстановления почечной функции в отдаленном послеоперационном периоде. У пациентов с длительным анамнезом МКБ на фоне рецидивирующих атак пиелонефрита с явлениями обструкции мочевыводящих путей возникает каскадная активация иммунной системы, приводящая к хроническому почечному повреждению с исходом в нефросклероз.
Перспектива неинвазивной диагностики раннего почечного повреждения, в том числе с помощью
Состояние внутрипочечной гемодинамики через 7-10 дней после операции (M±m)
Таблица 4
|
Группы больных |
1 группа (n=60) |
2 группа (n=50) |
||
|
Параметр Уровень измерения |
Дуговые артерии |
Сегментарные артерии |
Дуговые артерии |
Сегментарные артерии |
|
Vps |
22,5±3,7 |
46±3,8 |
25,7±4,2 |
48±5,6 |
|
Vpd |
12,8±0,4* |
15,7±2,5* |
16,4±2,8 |
19,7±5,7 |
|
IR |
0,7±0,03* |
0,72±0,06* |
0,65±0,04* |
0,68±0,01* |
|
Pi |
0,96±0,04* |
0,98±0,01 |
0,84±0,03 |
0,96±0,01 |
П р и м еч а н и е : * – достоверность различий р ≤0,05 между группами
Таблица 5
Состояние внутрипочечной гемодинамики через 1-3 месяца после операции (M±m)
|
Группы больных |
1 группа (n=60) |
2 группа (n=50) |
|||
|
Параметр |
Уровень измерения |
Дуговые артерии |
Сегментарные артерии |
Дуговые артерии |
Сегментарные артерии |
|
Vps |
25,7±2,3 |
31,4±3,4 |
25,4±1,6 |
36,8±2,1 |
|
|
Vpd |
14,8±2,1 |
18,2±0,06 |
16,2±1,1 |
22,5±3,4 |
|
|
IR |
0,68± 0,01 |
0,65±0.02 |
0,66±0,02 |
0,64±0,01 |
|
|
Pi |
0,9±0,06 |
0,98±0,02 |
0,83±0,01 |
0,94±0,03 |
|
П р и м еч а н и е : измерение IR и Рi производилось в автоматическом режиме с использованием усредненных значений конечных диастолических скоростей.
ультразвуковых технологий, привлекает внимание многих исследователей [20]. Проведенное исследование демонстрирует возможность косвенной оценки структурно-функционального состояния почек по регистрируемым параметрам внутрипочечной гемодинамики. В более отдаленные сроки, когда согласно существующим представлениям воспалительная реакция и ишемическое повреждение нивелируются и состояние внутрипочечной гемодинамики приближается к нормальным значениям, использование предложенных лабораторных маркеров демонстрирует признаки сохраняющегося почечного повреждения и прогрессирующего нефросклероза.
Почечное повреждение у пациентов с МКБ реализуется в основном за счет тубулоинтерстициального компонента [4] и может быть обратимым у больных с непродолжительным анамнезом МКБ, отсутствием признаков нефросклероза и выраженной обструкции мочевыводящих путей.
Выводы.
-
1. Имеющееся при МКБ почечное повреждение, подтвержденное высокими значениями исследуемых биомаркеров у пациентов с нефросклерозом, приводит к увеличению периода восстановления почечных функций после хирургической травмы, что диктует необходимость в нефропротективной терапии.
-
2. Исследование в моче концентрации маркеров канальциевого повреждения позволяет более точно оценить степень повреждения почечной паренхимы по сравнению со стандартными методами (сКр и СКФ). Повышение уровня Л2 более 60 нг/мл и β2 МГ более 0,5 мкг/мл на 7-10-е сутки свидетельствует
-
3. Допплерографические параметры Vpd, IR и Pi являются информативными для скрининговой предоперационной и ранней послеоперационной диагностики внутрипочечной гемодинамики.
-
4. Активация репаративных процессов на фоне операционной травмы приводит к продолжительной экскреции с мочой профибротических медиаторов ТGF-β и IGF-1, что способствует дальнейшему прогрессированию нефросклероза у этих пациентов.
-
5. При наличии у пациентов c МКБ признаков не-фросклероза отмечается повышение экскреции с мочой профибротических факторов МСР-1 более 1000 пг/мл и ТGF-β более 500 пг/мл.
о более выраженном тубулоинтерстициальном повреждении и необходимости назначения этим пациентам нефропротективной терапии.
Список литературы Дифференцированный подход к оценке почечного повреждения у больных мочекаменной болезнью с помощью неинвазивных маркеров
- Саенко В., Руденко В., Сорокин Н. Ведение больных мочекаменной болезнью в послеоперационном периоде//Врач. 2008. №1. С. 76-79.
- Казаченко А.В. Протекторная и регенерационная терапия при остром и хроническом повреждении почки: Дис.... д-ра мед. наук. М., 2009.
- Шилов Е.М., Фомин В.В, Швецов М.Ю. Хроническая болезнь почек//Терапевтический архив. 2007. № 6. С. 75-78.
- Индуцируемые протеинурией механизмы ремодели-рования тубулоинтерстиция и возможности нфропротекции при гломерулонефрите/Н.А. Мухин, Л.В. Козловская, И.Н. Бобкова [и др.]//Вестник Российской АМН. 2005. № 1. С. 3-8.
- Клиническое значение определения в моче маркеров эндотелиальной дисфункции и факторов ангиогенеза в оценке тубулоинтерстициального фиброза при хроническом гломерулонефрите/И.Н. Бобкова, Л.В. Козловская, А.С. Рамее-ва [и др.]//Терапевтический архив. 2007. №. С. 10-15.
- Киричук В.Ф., Глыбочко П.В., Пономарева А.И. Дисфункция эндотелия. Саратов: Изд-во Сарат мед. ун-та, 2008. С. 55.
- Томилина НА, Багдасарян А.Р. Механизмы нефро-склероза и фармакологическая ингибиция внутрипочечной ренин-ангиотензиновой системы как основа нефропротективной стратегии при хронических заболеваниях нативных почек и почечного трансплантата//Нефрология и диализ. 2004. Т. 6, № 3. С. 226-234.
- Klahr S., Morrissey J.J. The role of growth factors, cytokines and vasoactive compounds in obstructive nephropathy//Semin Nephrol. 1998. № 18. 622-632.
- Klahr S. Nephrology Forum: obstructive nephropathy//Kidney Int. 1998. № 54. P. 286-300.
- Morrissey JJ., Klahr S. Transcription factor NF-B regulation of renal fibrosis//Semin Nephrol. 1998. № 18. P. 603-611.
- Vaughan E.D., Sorenson E.J., Gillenwater J.Y Haemodynamic response to chronic unilateral ureteric obstruction//Renal. Invest. Urol. 1970. № 8. P. 78.
- Есилевский Ю.М. Реография органов мочеполовой системы//М: МЕДпресс-информ., 2004. С. 67.
- Yarger W.E., Buerkert J. Effect of urinary tract obstruction on renal tubular function//Semin Nephrol. 1982. № 2. P. 17.
- Truong L.D., Petrusevska G. Cell apoptosis and proliferation in experimental chronic obstructive uropathy//Yang Kidney Int. 1996. № 50. P. 200-207.
- Horgan P.G., Sarazen A.A., Fitzpatric J.M. The effect of stones on renal and ureteric physiology//World J. Urol. 1993. №11. P.7-12.
- Lameire N., Hoste E. Reflections on the definition, classification, and diagnostic evaluation of acute renal failure [Editorial]//Curr. Opin. Crit. Care. 2004. № 10. P. 468-75.
- Bonventre J.V., Weinberg J.M. Recent advances in the pathophysiology of ischemic acute renal failure//J. Am. Soc. Nephrol. 2003. № 14. P. 2199-2210.
- Becker G.J., Hewitson T.D. The role of tubulointerstitial injury in chronic renal failure//Curr. Opin. Nephrol. Hypertens. 2000. №9. P. 133-138.
- Waikar S.S., Liu K.D., G.M. Chertow. Diagnosis, epidemiology and outcomes of acute kidney injury//Clin. J. Am. Soc. Nephrol. 2008. Vol. 3, № 3. P. 844-861.
- Сравнительная оценка результатов допплерографи-ческого исследования сосудов почек и статической ренос-цинтиграфии с Тс-ДМЯК у детей с обструктивными уропати-ями/И.Н. Хворостов, ОН. Зоркин, И.В. Дворяковский [и др.]//Ультразвуковая и функциональная диагностика. 2005. № 6. С. 44-52.
- Wada Т., Okoyama YK Chemokines: new target molecules in renal diseases//Hobayasbi., Clin. Exp. Neph. 2000. № 4. P. 273-280.
- Профибротические медиаторы в оценке тубулоинтер-стициальных изменений при хирургическом лечении больных с мочекаменной болезнью/П.В. Глыбочко, А.Н. Россолов-ский, А.Н. Понукалин [и др.]//Саратовский научно-медицинский журнал. 2009.http://elibrary.ru/issues.asp?id=25814&volu me=5&selid=646307 Т. 5, № 3. С. 428-433.
- Melnikov V.Y Molitoris В.А. Improvements in the diagnosis of acute kidney injury//Saudi J. Kidney Dis.Transpl. 2008. Vol. 4, № 19. P. 537-544.
- Neutrophil gelatinase-associated lipocalin (NGAL) as a biomarker for acute renal injury after cardiac surgery/J. Mishra, О Dent, R. Tarabishi [et al.]//Lancet. 2005. № 365. P. 1231-1238.
- Identification of neutrophil gelatinase-associated lipocalin as a novel early urinary biomarker for ischemic renal injury/J. Mishra, Q. Ma, A. Prada [et al.]//J. Am. Soc. Nephrol. 2003. № 14. P. 2534-2543.
- Association between increases in urinary neutrophil gelatinase-associated lipocalin and acute renal dysfunction after adult cardiac surgery/G Wagener, M. Jan, M. Kim [et al.]//Anesthesiology. 2006. № 105. P. 485-491.
- Mori K, Nakao К Neutrophil gelatinase-associated lipocalin as the real-time indicator of active kidney damage//Kidney Int. 2007, May. Vol. 107. № 1. P. 967-970.
- Lisowska-Myjak, B. Serum and urinary biomarkers of acute kidney injury//Blood Purif. 2010. Vol. 4, № 29. P. 357-365.
- Urinary neutrophil gelatinase-associated lipocalin and urinary interleukin-18 in early diagnosis of acute kidney injury in critically ill patients/Z.D. Zang, YZ. Huang, Y Yang [et al.]//Zhonghua Nei Ke Za Zhi. 2010, May. Vol. 5, № 49. P. 396-399.
- Острое повреждение почек -новое понятие в нефрологии/А.В. Смирнов, И.Г. Каюков, В.А. Добронравов, А.Г. Кучер//Клиническая нефрология. 2009. №1.011-15.


