Дифференцировка мультипотентных мезенхимных стволовых клеток, выделенных из костного мозга и жировой ткани крупного рогатого скота, в клетки мышечной ткани in vitro
Автор: Рогов И.А., Волкова И.М., Кулешов К.В., Савченкова И.П.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Трансгенез. Культура клеток и тканей
Статья в выпуске: 6 т.47, 2012 года.
Бесплатный доступ
Мультипотентные мезенхимные стволовые клетки (ММСК), выделенные из костного мозга (КМ) и жировой ткани (ЖТ) крупного рогатого скота (КРС), представляют собой перспективный материал для создания новых клеточных систем и продуктов для пищевой биотехнологии. Нами показана возможность направленной дифференцировки ММСК, полученных как из КМ, так и из ЖТ КРС, в клетки мышечной ткани при культивировании в средах с индукторами миогенеза (5-азацитидин, 5-аза-2¢-деоксицитидин и ретиноевая кислота). Сравнительный анализ эффективности дифференцировки в направлении миогенеза обнаружил морфологические изменения в ММСК, выделенных из КМ, на 15-21-е сут, в ММСК, выделенных из ЖТ, — на 20-25-е сут культивирования в средах с различными индукторами. Анализ экспрессии генов MYOD 1 и MYOG в реакции ОТ-ПЦР (ПЦР с обратной транскрипцией) выявил различия в потенции этих клеток к дифференцировке в клетки мышечной ткани in vitro, а также показал, что клетки, полученные из КМ, более перспективны как источники для моделирования мышечной ткани in vitro.
Мультипотентные мезенхимные стволовые клетки, костный мозг, жировая ткань, крупный рогатый скот, дифференцировка, миогенез, индукторы, экспрессия генов
Короткий адрес: https://sciup.org/142133363
IDR: 142133363 | УДК: 619+636/639]:576.3/.7.086.83:591.04
Текст научной статьи Дифференцировка мультипотентных мезенхимных стволовых клеток, выделенных из костного мозга и жировой ткани крупного рогатого скота, в клетки мышечной ткани in vitro
В настоящее время во многих странах (Нидерланды, США, Япония, Австралия и др.) ведутся эксперименты по выращиванию культурального мяса in vitro (1-2) как альтернативного источника белоксодержащей ткани животного происхождения. Первые подобные исследования, проведенные в России под руководством И.А. Рогова, позволили предложить оригинальный способ накопления клеток мышечной ткани (3). Современным продолжением этих работ стало изучение возможности использовать мультипотентные мезенхимные стволовые клетки (ММСК), выделенные из костного мозга (КМ) и жировой ткани (ЖТ) крупного рогатого скота (КРС), в качестве источника для наращивания клеточной биомассы.
Получение ММСК сельскохозяйственных животных представляет интерес в связи с их основными свойствами и признаками. Во-первых, достоверно установлено, что ММСК обладают способностью самообновляться in vitro без анеуплоидии, генетической нестабильности и малигни-зации, пролиферируя в культуре длительное время и образуя стабильные диплоидные клеточные линии. Во-вторых, при индукции к дифференцировке они формируют in vitro клетки других тканей, что делает их уникальным материалом для создания новых клеточных систем и продуктов в сельскохозяйственной биотехнологии, в том числе пищевой. Доступностью биологического материала (КМ и ЖТ), из которого выделяют клетки со свойствами и признаками ММСК, обусловлена актуальность этого направления. К достоинствам ММСК относится, в частности, и то, что при культивировании они могут заселять трехмерную матрицу-носитель, формируя пространственные структуры, которые позволяют моделировать разные ткани in vitro (4).
В настоящее время имеется множество сообщений о выделении из КМ и ЖТ человека (5-6), грызунов (7) и сельскохозяйственных животных (8-12) клеток с фенотипом, подобным ММСК, которые при индукции к дифференцировке способны in vitro превращаться в клетки костной, хрящевой и жировой тканей. Также известны работы, свидетельствующие о том, что ММСК человека (6), грызунов (13), кроликов (14), КРС и свиньи (9) могут при определенных условиях in vitro дифференцироваться в клетки мышечной ткани. Это направление представляется новым и перспективным для разных целей — медицинских, ветеринарных, биологических и биотехнологических.
Ранее из КМ и ЖТ КРС нами были выделены и охарактеризованы клеточные популяции, подобные по фенотипу ММСК. Установлено, что ММСК КРС, выделенные как из КМ, так и из ЖТ, способны формировать клетки жировой и костной тканей при культивировании в индукционных средах in vitro (12), однако потенцию к направленной дифференцировке в клетки мышечной ткани in vitro мы не изучали.
В связи с этим цель представляемой работы заключалась в сравнении способности мультипотентных мезенхимных стволовых клеток разного происхождения к направленной дифференцировке (на уровне экспрессии генов — маркеров миогенеза) в клетки мышечной ткани in vitro.
Методика . Индукцию ММСК, выделенных из КМ и ЖТ КРС, в клетки мышечной ткани in vitro осуществляли по методикам, описанным ранее (9, 13, 14). На пятом пассаже клетки (по 5*103-6х103 на лунку) высевали в 6-луночные планшеты с диаметром лунок 35 мм и через 24 ч воздействовали разными индукционными средами. Основной для культивирования была среда DMEM с низким содержанием глюкозы (1 г/л) (DMEM-LG), дополненная 10 % сыворотки плодов коров (СПК) («HyClone», США) и антибиотиками. Конечная концентрация стрептомицина равнялась 100 мкг/мл, пенициллина — 100 ед/мл. Состав индукционных сред: I — DMEM-LG, 10 % СПК, ретиноевая кислота (12 мкМ); II — DMEM-LG, 15 % СПК, 5-азацитидин (10 мкМ), гидрокортизон (50 мкМ); III — DMEM-LG, 15 % СПК, 5-аза-2 ' -деоксицитидин (0,3 мкМ), гидрокортизон (50 мкМ). Культивирование в индукционных средах, дополненных 5-азацитидином и 5-аза-2 ‘ -деоксицитидином («Sigma», США), длилось 24 ч, в среде с ретиноевой кислотой («Sigma», США) — 4 сут (индукционную среду ежедневно обновляли). Далее индукционную среду меняли на основную (без добавления индуктора) и культивировали клетки в СО2-инкубаторе при концентрации СО2 5 % и температуре 37 ° С.
Для оценки потенциала ММСК при формировании in vitro клеток мышечной ткани все образцы разделили на шесть экспериментальных групп. ММСК, выделенными из КМ, были представлены 1-я, 2-я и 3-я группы, ММСК, выделенными из ЖТ, — 4-я, 5-я и 6-я группы. Клетки в 1-й и 4-й группах обрабатывали I индукционной средой, во 2-й и 5-й — II индукционной средой, в 3-й и 6-й — III индукционной средой. Эффект от воздействия индукторов изучали в динамике (на 21-е, 28-е и 33-и сут дифференцировки).
Морфологические изменения ММСК вследствие дифференцировки оценивали визуально как в нативных, так и в окрашенных по Романовскому-Гимзе препаратах с помощью инвертированного фазово-контрастного микроскопа фирмы «Carl Zeiss» (Германия) и программы Ax-ioVision Rel. v. 4.8. При специфическом окрашивании липидных включений применяли краситель Oil Red О («Bio Optica Milano S.P.A.», Италия), который служит индикатором внутриклеточного накопления нейтраль- ных жиров.
Для подтверждения факта дифференцировки проводили оценку экспрессии мРНК генов MYOD1 и MYOG — маркеров миогенеза (с помощью обратной транскрипции с последующей полимеразной цепной реакцией — ОТ-ПЦР) относительно показателя для постоянно экспрессирующегося гена глицеральдегид-3-фосфатдегидрогеназы ( GAPDH). С этой целью на 21-е сут дифференцировки часть клеток использовали для выделения суммарной мРНК. Контролем служили клетки, культивируемые в среде без индукторов. Суммарную РНК из клеток выделяли с помощью набора Mini RNA Isolation II Kit («Zymo Research», США). Элюцию проводили в 30 мкл воды (DNAase RNAase free). Для выполнения обратной транскрипции к 10 мкл подготовленного раствора РНК добавляли 1 мкл смеси гексамерных праймеров (Random Hexamer Primer, UAB «Fermentas», Литва), инкубировали при 70 ° С в течение 5 мин и реакционную смесь помещали на 2 мин в лед. Затем в 11 мкл раствора, содержащего РНК и смесь гексамерных праймеров, вносили 8,5 мкл реакционной смеси для обратной транскрипции, которая содержала 4 мкл 5* реакционного буфера, 1 мМ каждого из дНТФ (№ R0191, UAB «Fermentas», Литва) и 40 ед. M-MuLV обратной транскриптазы (№ EP0351, UAB «Fermentas», Литва). Реакционную смесь инкубировали 10 мин при 25 ° С, затем 60 мин при 42 ° С. Сразу после обратной транскрипции реакционную смесь разводили TE-буфером в 2 раза. При постановке ПЦР для каждой из исследуемых мишеней готовили индивидуальную реакционную смесь объемом 25 мкл, которая включала: 5 мкл матрицы кДНК (5-20 нг), 1* реакционный буфер (ПЦР-смесь-2-FRT, «Ампли-сен», Россия), 1 ед. Taq-F полимеразы («Амплисен», Россия), 200 мкМ каждого из дНТФ (№ R0191, UAB «Fermentas», Литва), прямой и обратный праймеры (по 240 нМ) («Литех», Россия). Реакцию проводили на приборе Терцик (Россия). Температурный профиль амплификации был следующим: 95 ° С, 15 мин (предварительная денатурация и активация Taq-F полимеразы), затем 30 циклов — 95 ° С, 20 с; 60 ° С, 20 с; 72 ° С, 20 с.
Электрофорез фрагментов ДНК выполняли в 2 % агарозном геле в Трис-ацетатном буфере (ТАЕ). Для визуализации ДНК гель прокрашивали в течение 10-20 мин в растворе бромистого этидия в ТАЕ (5 мкг/мл). Гели просматривали в ультрафиолетовом свете при X = 254 нм и документировали. Размер фрагментов определяли с помощью маркера молекулярных масс («Promega», США).
Результаты . Поскольку красители, в том числе моноклональные антитела (МАТ) против антигенов (АГ) КРС, позволяющие подтвердить факт дифференцировки, мы не использовали, наряду с визуальными наблюдениями изменения морфологии клеток под действием индукторов миогенеза оценили уровень экспрессии мРНК генов — маркеров миогенеза методом ОТ-ПЦР. Использованные праймеры, комплементарные транскриптам исследуемых генов, представлены в таблице.
Прямые (F) и обратные (R) праймеры, которые были использованы при амплификации обратных транскриптов, полученных для генов MYOD1 и MYOG (маркеры миогенеза) и постоянно экспрессирующегося гена GAPDH (глицеральдегид-3-фосфатдегидрогеназа)
|
Мишень | |
Название олигонуклеотида |
| Направление 5 ' ^ 3 ' |
|
GAPDH |
Gab F |
TCA-TTG-ACC-TTC-ACT-ACA-TGG-TCT-A |
|
Gab R |
AAG-ATG-GTG-ATG-GCC-TTT-CCA-TTG |
|
|
MYOD1 |
MY F |
GCT-CCA-GAA-CAG-CAG-CAA-GT |
|
MY R |
TCG-AAA-CAC-GGG-TCA-TCA-TA |
|
|
MYOG |
MG F |
CAG-TGA-ATG-CAG-CTC-CCA-TA |
|
MG_R |
CGA-CAT-CCT-CCA-CTG-TGA-TG |
Мы изучили действие трех индукционных сред, которые содержали в качестве дифференцировочных агентов 5-азацитидин, 5-аза-2 ‘ -деоксици-тидин (аналоги цитозина), обладающие деметилирующей активностью, и ретиноевую кислоту. В литературе имеются свидетельства, что обработка этими веществами способствует формированию клеток мышечной ткани in vitro (9, 13, 14).
В 1-й, 2-й и 3-й экспериментальных группах — на 5-е сут, в 4-й, 5-й и 6-й — на 7-е сут культивирования при воздействии I, II и III индукционными средами наблюдали увеличение размера клеток. Клетки вытягивались в одном направлении, сливались и на 15-21-е сут (1-я, 2-я и 3-я группы) или на 20-25-е сут (4-я, 5-я и 6-я группы) формировали плотные миотубоподобные структуры, содержавшие 3-10 ядер на клетку. Окраска по Романовскому-Гимзе показала центральное расположение ядер, что характерно для ранней стадии образования миосимпластов. Визуальные изменения в морфологии имели около 40 % клеток: они округлялись, уплотнялись, удлинялись и становились многоядерными (рис. 1, А). Кроме того, появлялись крупные клетки с видимой исчерченностью цитоплазмы. (см. рис. 1, Б). Интересным оказался тот факт, что наряду с образованием кластеров клеток мышечной ткани происходило формирование липидных везикул, что подтверждалось окраской Oil Red O. Число окрашенных липидных вакуолей в 4-й, 5-й и 6-й экспериментальных группах было значительно больше, чем в 1-й, 2-й и 3-й группах. В контрольных клетках (культивирование без индуктора) морфологических изменений не обнаружили.
А
Б
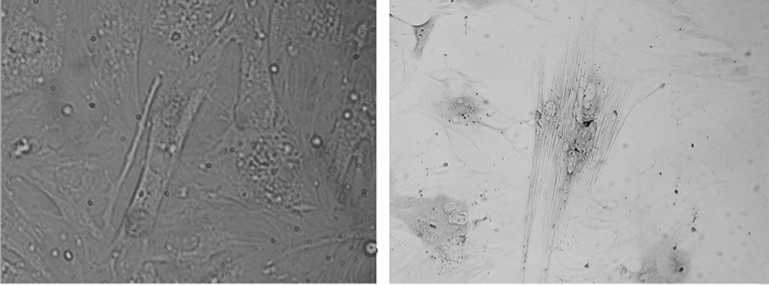
Рис. 1. Направленная дифференцировка мультипотентных мезенхимных стволовых клеток, выделенных из костного мозга (А) и жировой ткани (Б) крупного рогатого скота, в клетки мышечной ткани in vitro при культивировании в миогенной среде: А — 28-е сут (индуктор — 5-азацитидин), нативный препарат; Б — 33-и сут (индуктор — ретиноевая кислота); окрашивание по Романовскому-Гимзе. Увеличение *63 (объектив), *10 (окуляр).
Сравнение действия разных индукторов продемонстрировало, что все они способствуют дифференцировке ММСК in vitro в клетки мышечной ткани, однако при обработке II и III индукционной средой наблюдалась дегенерация и гибель около 5-10 % клеток. Ретиноевая кислота такого токсичного эффекта не оказывала.
Считается, что миогенез регулируется семейством транскрипционных факторов MRF (миогенные регуляторные факторы), включая MYOD1, MYF5, MYF6 и MYOG. В течение эмбрионального развития MYOD1 и MYF5 вовлечены в установление линии скелетной мышцы, тогда как MYOG необходим для терминальной дифференцировки. MYOD1 принадлежит к одному из ранних маркеров, свидетельствующих об инициации дифференцировки ММСК в миогенном направлении. Его экспрессия ха- рактерна для стадии образования миобластов (15).
Выявленные визуально морфологические изменения ММСК in vitro подтвердились на молекулярном уровне (рис. 2).
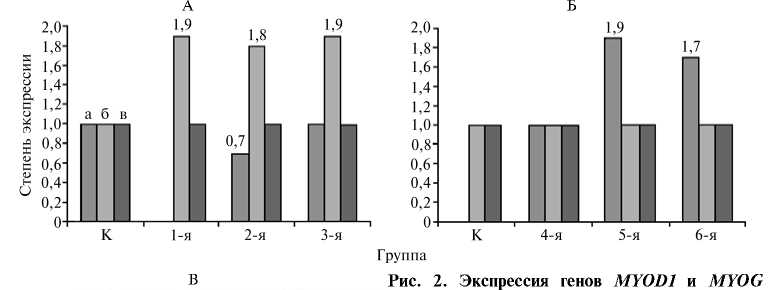
■ (маркеры миогенеза) и GAPDH ( глицераль-
GAPDH дегид-3-фосфатдегидрогеназа) в процессе диф ференцировки мультипотентных мезенхимных стволовых клеток (ММСК), выделенных из
I костного мозга (КМ) и жировой ткани (ЖТ) myodi крупного рогатого скота (КРС), в клетки мы-
■» —- ** ^* ■• ■■ шечной ткани in vitro при культивировании в
■й миогенных средах.
А и Б — гистограммы, отражающие
MYOG влияние разных индукционных сред на экспрес сию генов MYOD1 (а), MYOG (б) и GAPDH (в) в к |-я 2-я 3-я К 4-я 5-я 6-я процессе дифференцировки ММСК, выде-
Груипа ленных соответственно из КМ и ЖТ КРС,
В — электрофореграммы продуктов амплификации участков генов MYOD1, MYOG и GAPDH при ПЦР с обратной транскрипцией (ОТ-ПЦР); К — культивирование без индукторов (контроль). Индукторами служили ретиноевая кислота, 5-азацитидин и 5-аза-2‘-деоксицитидин, с которыми соответственно в 1-й, 2-й и 3-й экспериментальных группах культивировали ММСК КМ, в 4-й, 5-й и 6-й —
ММСК ЖТ.
В процессе дифференцировки клеток всех шести экспериментальных групп в клетки мышечной ткани на 21-е сут обнаружили продукт экспрессии гена MYOD1 в ММСК, выделенных из КМ (в контроле, во 2-й и 3-й экспериментальных группах). В отличие от них в ММСК, выделенных из ЖТ, в среде без индуктора (контроль) продукт экспрессии гена MYOD1 не выявлялся. В ММСК из ЖТ в 4-й, 5-й и 6-й экспериментальных группах была показана экспрессия гена MYOD1 . Как видно из гистограммы (см. рис. 2), в 5-й и 6-й группах количество продукта экспрессии этого гена почти в 2 раза превышало таковое в остальных группах. Во всех шести группах выявляли мРНК гена MYOG , но в 1-й, 2-й и 3-й группах количество продукта экспрессии этого гена оказалось почти в 2 раза выше, чем в контрольных образцах и в 4-й, 5-й и 6-й группах.
В нашем эксперименте продукт экспрессии MYOD1, помимо экспериментальных групп, был обнаружен у ММСК, выделенных из КМ и культивируемых в среде без индуктора, в то время как у ММСК, выделенных из ЖТ, он присутствовал только в клетках, культивируемых в миогенных средах. Присутствие продуктов экспрессии генов MYOD1 и MYOG в контрольных образцах можно объяснить спонтанной миогенной дифференцировкой. Вероятно, отсутствие продуктов экспрессии гена MYOD1 в 1-й экспериментальной группе связано с завершением первичной стадии миогенеза и образованием терминально дифференцированных клеток — миоцитов. Как видно из гистограммы (см. рис. 2), у ММСК, выделенных из КМ, наблюдался высокий уровень экспрессия гена MYOG и отсутствовала экспрессия гена MYOD1. В ММСК из ЖТ, наоборот, отмечалась высокая активность экспрессии гена MYOD1 на уровне транскрипции и проявилась экспрессия гена MYOG. Из полученных данных можно сделать вывод, что у ММСК, выделенных из КМ, процесс миодифференцировки происходит быстрее, чем у ММСК, выделенных из ЖТ КРС.
Полученные нами результаты согласуются с другими опубликованными данными (9, 13), но отличаются от полученных Z. Su с соавт. (14).
Таким образом, мультипотентные мезенхимые стволовые клетки (ММСК), выделенные как из костного мозга (КМ), так и из жировой ткани (ЖТ) крупного рогатого скота (КРС), под действием сред, содержащих в качестве индукторов 5-азацитидин, 5-аза-2 ‘ -деоксицитидин и ретиноевую кислоту, способны дифференцироваться, формируя клетки мышечной ткани in vitro. В наших экспериментах концентрация ретиноевой кислоты 50 мкМ при миодифференцировке губительна, 12 мкМ — оптимальна для культуры. Полученные результаты свидетельствуют о том, что, несмотря на фенотипическое сходство в популяциях ММСК из КМ и ЖТ КРС, эти клетки обладают разными потенциями в отношении миогенеза. Сравнительный анализ уровня экспрессии генов — маркеров миогенеза в ММСК разного происхождения продемонстрировал, что клетки, выделенные из КМ, более перспективны для моделирования мышечной ткани in vitro.


