Диффузия элементов в хромовых рудах массива Рай-Из при окислительном обжиге
Автор: Пашкеев Игорь Юльевич, Гатауллина Ирина Маратовна, Гайнуллина Юлия Равильевна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 36 (253), 2011 года.
Бесплатный доступ
Исследована диффузия оксидов железа, магния, алюминия из хромшпинелида во вмещающую породу магниевого силиката в условиях окислительного обжига при температурах 1000, 1100 и 1200 °С. Экспериментально установлено образование оливина и форстерита в исходном магниевом силикате хромовой руды. Разработан метод расчета коэффициентов диффузии элементов в многокомпонентных оксидных системах.
Хромовые руды, диффузия, окислительный обжиг
Короткий адрес: https://sciup.org/147156676
IDR: 147156676 | УДК: 699.032.4:622.78
Текст научной статьи Диффузия элементов в хромовых рудах массива Рай-Из при окислительном обжиге
Экспериментально установлено, что в результате окислительного обжига в хромовой руде массива Рай-Из Полярного Урала при 1000–1200 °С параллельно протекают различные диффузионные процессы: диффузия катионов железа из зерна хромшпинелида к межфазной границе «хромшпи-нелид – магниевый силикат» и далее в магниевый силикат, диффузия катионов магния и алюминия из хромшпинелида в магниевый силикат вмещающей породы. Эти процессы протекают с различными скоростями и заметно изменяют составы хромшпинелида и вмещающей породы в интервале температур 1000–1200 °С.
В образцах после обжига в окислительной атмосфере наблюдается увеличение концентрации оксида железа (Fe3+) в хромшпинелиде, сопряженным с магниевым силикатом вмещающей породы. Образование фазы α -Fe 2 O 3 при окислительном нагреве хромшпинелида руд Кемпирсайского массива описано по оптическим признакам и результатам рентгенофазового анализа в работе Л.И. Карякина и П.Д. Пятикопа [1]. Авторы впервые наблюдали в оптическом микроскопе с нагревателем выделение фазы α -Fe 2 O 3 при 300 °C и образование магнетита при 1000 °C. Диффузия катионов железа протекает быстро, и по достижении температуры обжига концентрация железа на границе с магниевым силикатом заметно увеличивается. Данный факт для руд массива Рай-Из подтверждает микрорентгеноспектральный анализ (МРСА), выпол-
ненный на электронном микроскопе [2, 3]. Авторами настоящей работы при исследовании руд массива Рай-Из дополнительно установлено, что кроме общих характеристик (структуры, содержания хрома и железа, состава вмещающей породы) руды этого массива значительно отличаются от руд других месторождений содержанием никеля. По внешнему виду руды с повышенным содержанием никеля 0,45–0,55 мас. % имеют серо-голубой цвет вмещающей породы и легко отличимы от руд с обычным содержанием никеля 0,15–0,20 мас. % с характерным белым цветом магниевого силиката. Составы и макроструктуры исследованных типичных представителей этих руд приведены в табл. 1 и на рис. 1.
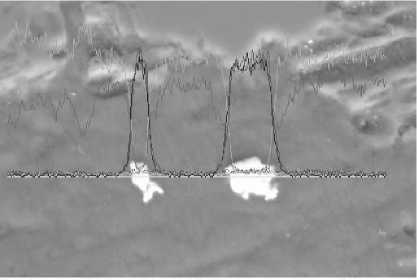
Никель в рудах присутствует в двух формах – оксидной и сульфидной. На рис. 2 показано распределение никеля в магниевом силикате вмещающей породы.
По составу (табл. 2) оксидные включения никеля наиболее соответствуют ревдинскиту (Ni,Mg)6[Si4O10][OH]8. Сульфидные включения никеля показаны на рис. 3, анализ их соответствует хизлевудиту с формулой соединения Ni 3 S 2 (73,3 % Ni, 26,7 % S).
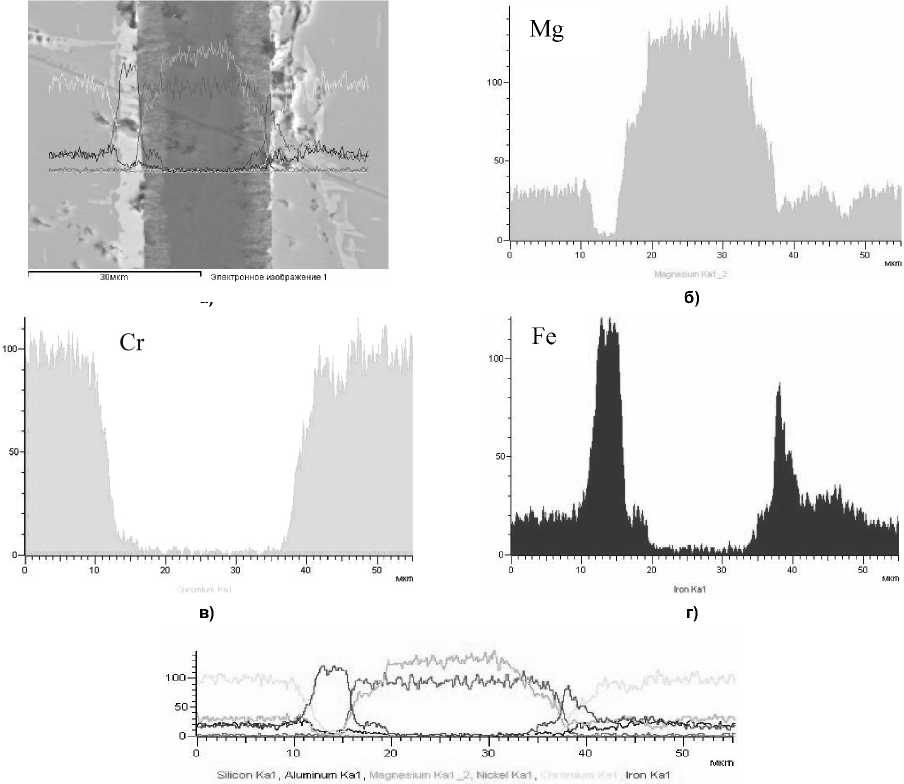
На рис. 4 представлены результаты линейного сканирования образцов исходной руды. Распределение железа по линии сканирования в хромшпи-нелиде равномерное, без участков повышенной концентрации. На рис. 5 представлены результаты
Химический состав исследованных проб хромовой руды массива Рай-Из месторождения «Центральное», мас. %
Таблица 1
|
Проба |
Cr 2 O 3 |
FeO |
Fe 2 O 3 |
Al 2 O 3 |
MgO |
SiO 2 |
NiO |
|
РИ-Ц1 |
36,42 |
8,73 |
2,68 |
6,62 |
26,57 |
12,25 |
но |
|
РИ-Ц2 |
41,94 |
9,55 |
3,30 |
7,58 |
23,55 |
10,26 |
но |
|
РИ-Ц3 |
49,68 |
10,95 |
2,99 |
7,00 |
20,38 |
7,06 |
но |
|
РИ-Ц4 |
40,23 |
12,64 |
но* |
7,69 |
25,00 |
10,77 |
0,18 |
|
РИ-Ц5 |
46,00 |
12,24 |
но |
10,67 |
18,76 |
11,92 |
0,45 |
* но – состав не определялся.

а)

б)
Рис. 1. Макроструктура хромовой руды масива Рай-Из: а – руды с обычным содержанием никеля; б – руды с высоким содержанием никеля

Рис. 2. Распределение никеля в слое (350–400 мкм) магниевого силиката вмещающей породы хромовой руды. Цифры у точек соответствуют номерам спектров табл. 2
Таблица 2
Элементный состав хромовой руды, мас. %
|
Спектр |
O |
Mg |
Al |
Si |
Ti |
Cr |
Fe |
Ni |
|
1 |
23,1 |
10,67 |
7,04 |
46,61 |
12,58 |
|||
|
2 |
22,81 |
9,85 |
6,72 |
47,74 |
12,88 |
|||
|
3 |
22,5 |
10,04 |
6,85 |
47,44 |
13,17 |
|||
|
4 |
40,73 |
51,27 |
0,73 |
6,0 |
1,27 |
|||
|
5 |
39,34 |
50,17 |
0,53 |
0,4 |
7,14 |
2,43 |
||
|
6 |
39,35 |
48,68 |
0,8 |
0,52 |
8,92 |
1,73 |
||
|
7 |
42,88 |
50,2 |
5,27 |
1,66 |
||||
|
8 |
42,85 |
51,76 |
4,5 |
0,89 |
||||
|
9 |
43,73 |
45,41 |
5,41 |
4,09 |
1,35 |
|||
|
10 |
42,4 |
47,54 |
1,24 |
0,4 |
6,91 |
1,51 |
||
|
11 |
42,69 |
30,51 |
25,15 |
0,73 |
0,92 |
|||
|
12 |
17,04 |
8,49 |
5,41 |
54,38 |
14,68 |
|||
|
13 |
22,14 |
10,24 |
6,93 |
47,92 |
12,77 |
|||
|
14 |
22,75 |
10,02 |
6,84 |
47,62 |
12,77 |
|||
|
15 |
23,38 |
10,1 |
6,76 |
47,19 |
12,57 |
1 Электронное изображение 1
ЗОмкт
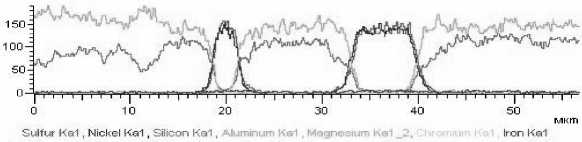
Рис. 3. Включения сульфида никеля в магниевом силикате хромовой руды: Ni – 74,74 %; Fe – 0,72 %; S – 24,54 %

icsliim Ка1,
б)
а)
д)
Рис. 4. Результаты линейного сканирования образцов исходной хромовой руды Рай-Из: а – структура образца по плоскости разреза; б, в, г – распределение Mg, Cr, Fe соответственно; д – суммарное распределение элементов по линии сканирования
д)
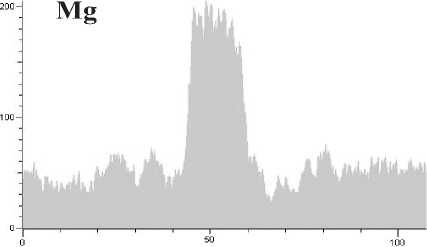
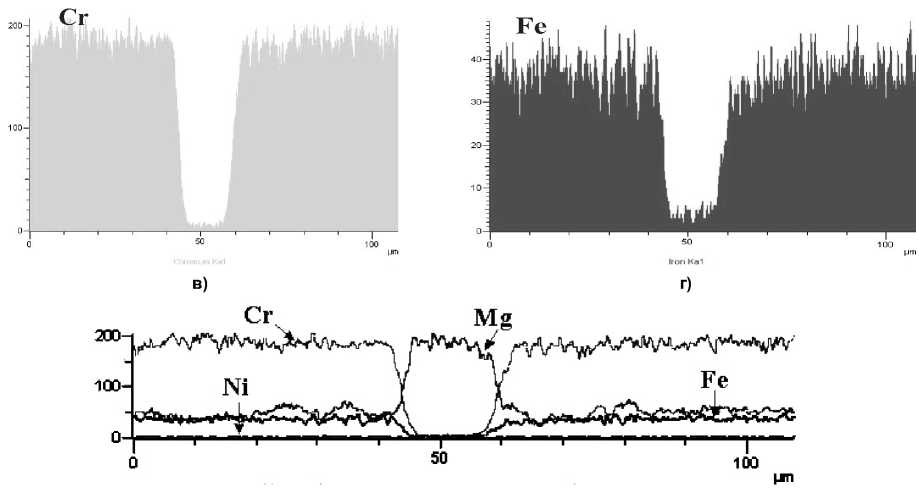
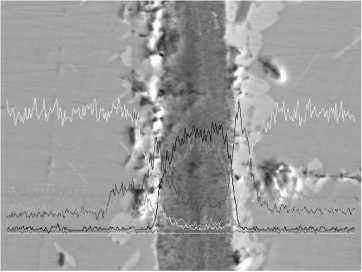
Рис. 5. Результаты линейного сканирования образцов хромовой руды Рай-Из, нагретой до 1100 °C с последующей изотермической выдержкой в течение 4 ч: а – структура образца по плоскости разреза; б, в, г – распределение Mg, Cr, Fe соответственно; д – суммарное распределение элементов по линии сканировании
а)
линейного сканирования образцов этой же хромовой руды после обжига при 1100 °C и изотермической выдержки в течение 4 часов. На линии сканирования появляются концентрационные пики железа, что свидетельствует о диффузии катионов железа из решетки хромшпинелида к межфазной границе. С увеличением времени обжига концентрационные пики увеличиваются, так как увеличивается содержание железа на границе с магниевым силикатом при одновременном понижении его в хромшпинелиде.
В хромшпинелиде, граничащем с магниевым силикатом, протекают последовательно реакции окисления FeO и Fe 3 O 4 :
3FeO + 1/2O 2 → Fe 3 O 4 ,
∆ G º1000 °C = –156,6 кДж; (1) 2Fe 3 O 4 + 1/2O 2 → 3Fe 2 O 3 ,
∆ G º1 000 ° C = –26,15 кДж. (2)
Результаты диффузии катионов железа из хромшпинелида в магниевый силикат вмещающей породы с образованием оливина (Mg,Fe)2[SiО4] приведены на рис. 5. На фотографии структуры хорошо виден слой железистого магниевого силиката толщиной около 3 мкм в структуре первичного магниевого силиката.
Параллельно с диффу з ией катионов железа из х р омшпинелида в магниевый силика т протекает диффузия катионов магния из хромш п инелида в магниевый силикат вмещающей породы с образованием форстерита:
MgO (тв) + MgSiO 3(тв) → Mg 2 SiO 4(тв) ,
∆ G º1 000 ° C = –30,2 кДж. (3)
На рис. 4 в исходной руде по линии сканирования магний распределяе т ся равномерно, никаких «концентрационных» про в алов не наблюдается. Но после 4-часовой выдержки в окислительных условиях при 1100 °С наблюдается понижение концентрации магния в слое хромшпинелида, сопряженном с магниевым с иликатом, практически до нуля. В магниевом сил и кате вмещающей породы содержание оксида магния увеличивается на 5 – 6 % (см. рис. 5).
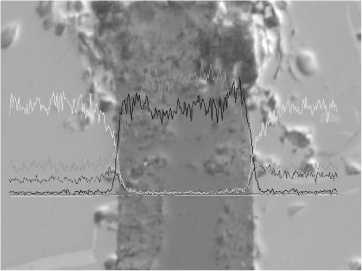
В процессе окислительного обжига хромовой руды массива Рай-Из экспериментально установлена также диффузия катионов алюминия из зерна хромшпинелида. Диффузия алюминия наблюдается при более высоких температурах обжига и времени изотермической выдержки. В процессе окислительного обжига при 1200 °С происходит концентрирование оксида алюминия на границе раздела «хромшпинелид – магниевый силикат». На линии сканирования, на межфазной границе появились пики, что соответствует увеличению концентрации алюминия (рис. 6, б), аналогичный процесс концентрирования железа протекает быстрее при более низких температурах.
Оксид и сульфид никеля также претерпевают изменения: первый теряет кристаллизационную воду, а во втором происходит окисление серы:
Ni 3 S 2 + 7/2O 2 = 3NiO+2SO 2 . (4)
При дальнейшем обжиге никель совместно с железом входит в образовавшуюся структуру оливина в магниевом силикате вмещающей породы.
Экспериментальное исследование диффузии элементов в сложных керамических материалах сопряжены с техническими трудностями в определении концентрации диффундирующих элементов по глубине образцов. Разработанные методики исследования диффузионных процессов в металлах непригодны для решения аналогичных задач в керамических или рудных материалах. Известны немногочисленные данные о диффузии элементов в простые оксиды, собранные в справочнике «Фи- зико-химические свойства окислов». Коэффициент диффузии Fe3+ в Fe2O3 при температуре 900 °C равен 3,5·10–16 м2/с [6].
Разработанная методика определения коэффициента диффузии железа в рудных материалах основана на измерении концентрации железа по глубине слоя в образцах микрорентгеноспектральным методом (МРСА).
Для проведения МРСА исследуемая поверхность шлифа покрывается тонким слоем платины. Эта методика универсальна и пригодна также для исследования диффузии элементов в металлах, при этом не требуется снятие с образцов микрослоев стружки для послойного химического анализа.
Для расчета коэффициента диффузии железа Fe2+, учитывая нестационарность процесса, применяли второй закон диффузии Фика:
d с = _d_ Г D d c ^ d t dx I dx )
В частном случае, для линейной диффузии, при условии, что коэффициент диффузии не зависит от концентрации диффундирующего элемента уравнение (5) принимает вид dC = D d2C dt " dx2 .
Дифференциальное уравнение второго закона диффузии после интегрирования дает зависимость c = f(x, τ),
ЗОмкт 1 Электронное изображение 1
ЗОмкт 1 Электронное изображение 1
а)
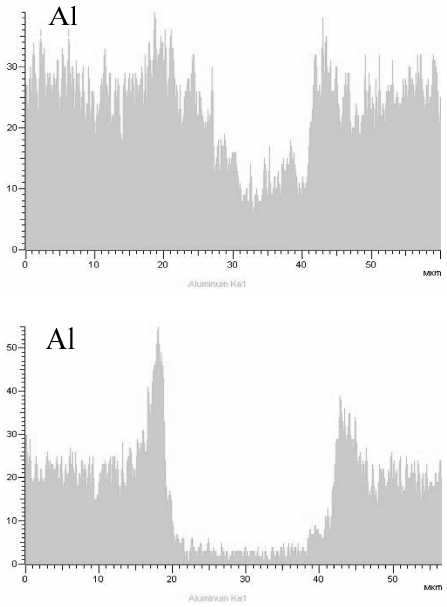
Рис. 6. Концентрирование алюминия в хромовой руде массива Рай-Из при окислительном обжиге: а – при температуре 1100 °С с выдержкой 5 ч; б – при температуре 1200 °С с выдержкой 5 ч
б)
где с – текущая концентрация вещества на расстоянии х от плоскости отсчета; с 0 – предельная концентрация вещества при х = 0.
При условии, что D не зависит от концентрации диффундирующего элемента и его концентрация в растворе ( с ) всегда меньше предельной растворимости ( с 0 ) в веществе-растворителе через т секунд после начала диффузии распределение диффундирующего элемента по глубине х тела-растворителя определяется уравнением
c ( x , т) = c 0 [ 1 -ф (ю) ] , (7)
где Ф (ю) = f | x | - трансцендентная функция ( 2 V D т J
Крампа.
Уравнение (7) может быть преобразовано следующим образом:
— ( Х Л> = 1 -Ф f 1 , (8)
с0 ( 2 V D т J где с – текущая концентрация вещества на расстоянии x от плоскости отсчета; с0 – предельная концентрация вещества при x = 0.
Очевидно, что при заданных условиях опыта (длительность процесса диффузии т и определенное значение коэффициента диффузии) аргумент функции прямо пропорционален расстоянию x от рассматриваемого слоя с концентрацией с0 . Таким образом, зависимость — = f I —x= I для c 0 ( 2V D т J нашей задачи представляет по существу распределение Fe2+ по толщине диффузионного слоя.
Толщину диффузионного слоя x, концентра- ции с и с0 определяли из экспериментальных ре зультатов. Зависимость — = f I —x= I, пред-с 0 ( 2 V D т J ставленная на рис. 7, взята из источника [4]. Подробное решение подобных задач для металлов приведено в работах Я.С. Уманского [4, 5].
Для определения DFe2+ в хромшпинелиде по результатам МРСА в образцах после обжига определяли толщину слоя концентрирования железа (х), содержание железа в пограничном слое ( с0 ), прилегающему к магниевому силикату, и в хромшпи-нелиде (с). Далее по величине отношения c на-с0 ходили графоаналитическим методом [4] численное значение ff| (см. рис. 7) и, подставляя ( 2 V D т J значения х и т, вычисляли DFe +. При этом за величину с0 брали предельное содержание железа на границе с магниевым силикатом, а с – содержание железа в хромшпинелиде. По сути таким образом вычисляли коэффициент диффузии железа от границы хромшпинелида с магниевым силикатом в хромшпинелиде. Однако в действительности за время τ железо диффундирует из хромшпинелида на глубину х, концентрируясь на границе с вмещающей породой. Формальный прием вычисления DFe2+ не противоречит теории вычисления коэффициента диффузии. В данном конкретном случае необходимо учитывать, что диффундирует (Fe2+) и на границе фаз окисляется кислородом воздуха до (Fe3+), т. е. накапливается (Fe3+), а концентрация (Fe2+) на этой границе поддерживается практически равной нулю в соответствии с термодинамическими условиями pO2 =0,21 атм и Т = 1100–1200 °C.
По результатам исследований диффузионных процессов в хромовой руде массива Рай-Из при окислительном обжиге экспериментально установлено:
– уменьшение содержания Fe2+ в хромшпине-лиде и диффундирование его к межфазной границе «хромшпинелид – магниевый силикат» с окислением до Fe3+, D Fe 2 = (0,25÷2,25)·10–9 м2/с. С увеличением температуры и времени обжига – диффундирование Fe2+ в магниевый силикат вмещающей породы с образованием оливина, D Fe 2+ = (7,3÷8,6)·10–10 м2/с;
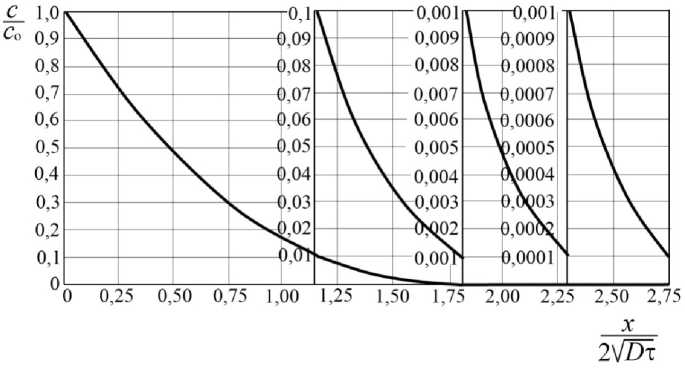
. К расчету коэффициента диффузии [4]
c
Рис. 7. Зависимость с0
– диффундирование оксида магния из хром-шпинелида в магниевый силикат вмещающей породы с образованием форстерита, содержание оксида магния в магниевом силикате при этом увеличивается по сравнению с исходной рудой на 5–6 %;
– концентрирование оксида алюминия на границе раздела «хромшпинелид-магниевый силикат»;
– окисление сульфида никеля и растворение его оксидных форм диффундирующим в магниевый силикат оксидом железа.
Разработана методика расчета коэффициентов диффузии железа в рудных минералах и многокомпонентных оксидных материалах по результатам микрорентгеноспектрального анализа.
Список литературы Диффузия элементов в хромовых рудах массива Рай-Из при окислительном обжиге
- Карякин, Л.И. Изменение хромшпинелидов при нагревании/Л.И. Карякин, П.Д. Пятикоп//Доклады АН СССР. -1955. -Т. 102. -№ 3. -С. 601-603.
- Пашкеев, А.И. Кристаллохимические превращения в хромовых рудах массива Рай-Из при окислительном обжиге/А.И. Пашкеев, И.Ю. Пашкеев, Г.Г. Михайлов//Вестник ЮУрГУ. Серия «Металлургия». -2009. -Вып. 12. -№ 14 (147). -С. 6-16.
- Изменение фазового состава и физических свойств хромовых руд массива Рай-Из при окислительном обжиге/И.Ю. Пашкеев, Г.Г. Михайлов, А.И. Пашкеев, К.И. Невраева//Вестник ЮУрГУ. Серия «Металлургия». -2011. -Вып. 16. -№ 14 (65). -С. 29-35.
- Физические основы металловедения/Я. С. Уманский, Б.Н. Финкельштейн, М.Е. Блантер и др. -М.: Металлургиздат, 1955. -721 с.
- Уманский, Я. С. Физика металлов. Атомное строение металлов и сплавов/Я.С. Уманский, Ю.А. Скаков. -М.: Атомиздат, 1978. -352 с.
- Физико-химические свойства окислов: справ./Т.В. Самсонов, А.П. Борисова, Т.Т. Жидкова и др. -М.: Металлургия, 1978. -472 с.


