Диэлькометрические измерения структурных изменений в разбавленных водных растворах соединений натрия
Автор: Галль Лидия Николаевна, Бердников А.С., Галль И.Р., Максимов С.И., Галль Н.Р.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Приборостроение физико-химической биологии
Статья в выпуске: 2 т.30, 2020 года.
Бесплатный доступ
Методом низкочастотной диэлькометрии высокого разрешения зарегистрированы структурные изменения в водных растворах соединений натрия в диапазоне концентраций 10-2-10-6 М. Все эксперименты проводились при комнатной температуре. Экспериментальные результаты в частотном диапазоне 50-1000 кГц представлены в виде зависимостей tg δ от логарифма частоты ω возбуждения колебательного контура, в катушку индуктивности которого помещена стеклянная пробирка с исследуемым раствором. Наблюдаемые зависимости носят выраженный спектральный характер, положения пиков в спектрах достоверно воспроизводятся и характеризуют катионный и анионный состав раствора. Концентрационные изменения наблюдаемых спектров позволяют отнести водные растворы солей электролитов к классическим растворам.
Вода, структура растворов электролитов, низкочастотная диэлькометрия, реактивные потери, тангенс угла диэлектрических потерь
Короткий адрес: https://sciup.org/142223743
IDR: 142223743 | УДК: 543.31 | DOI: 10.18358/np-30-2-i39
Текст научной статьи Диэлькометрические измерения структурных изменений в разбавленных водных растворах соединений натрия
Методом низкочастотной диэлькометрии высокого разрешения зарегистрированы структурные изменения в водных растворах соединений натрия в диапазоне концентраций 10–2–10–6 М. Все эксперименты проводились при комнатной температуре. Экспериментальные результаты в частотном диапазоне 50–1000 кГц представлены в виде зависимостей tg δ от логарифма частоты ω возбуждения колебательного контура, в катушку индуктивности которого помещена стеклянная пробирка с исследуемым раствором. Наблюдаемые зависимости носят выраженный спектральный характер, положения пиков в спектрах достоверно воспроизводятся и характеризуют катионный и анионный состав раствора. Концентрационные изменения наблюдаемых спектров позволяют отнести водные растворы солей электролитов к классическим растворам.
Кл. сл. : вода, структура растворов электролитов, низкочастотная диэлькометрия, реактивные потери, тангенс угла диэлектрических потерь
ВВЕДЕНИЕ гающую к килогерцовому диапазону частот. Реак тивные потери при этом, как и в диэлькометрии
Важная роль, которую соли натрия играют в живых системах и в технике, уже много десятков лет стимулирует изучение физико-химических свойств их водных растворов. При этом для живых систем, в отличие от технических применений, интерес представляют разбавленные и высокораз-бавленные растворы хлорида натрия, о структуре которых имеется относительно немного информации. Наиболее информативным экспериментальным методом до последнего времени считался метод ИК-спектроскопии высокого разрешения [1], однако область исследований этим методом ограничена ближним окружением раствора вблизи структурирующих центров — ионов диссоциирующей соли. Для получения экспериментальной информации, отражающей структурные изменения раствора в области дальней гидратации, необходимы экспериментальные методы, чувствительные к низкоэнергетическим структурным возмущениям [2]. Как было показано в [3], наиболее чувствительным и информативным методом для этого случая является метод низкочастотной L-диэль-кометрии, в котором исследуемый раствор при измерениях помещается в катушку индуктивности колебательного контура. В этом случае электропроводность раствора влияет на результаты исследований значительно слабее, чем при использовании общепринятой в диэлькометрии емкостной ячейки [4], и это позволяет передвинуть частотную границу измерений водных и водосодержащих растворов в низкочастотную область, приле- вообще, характеризуются изменением параметров резонанса колебательного контура — добротности контура (она уменьшается при увеличении реактивных потерь) и величины настроечной емкости контура, соответствующей резонансу.
ЭКСПЕРИМЕНТАЛЬНАЯ УСТАНОВКА И МАТЕРИАЛЫ
В [5] нами было показано, что наиболее информативной областью частот при измерениях структурных изменений в разбавленных водных растворах электролитов методом L-диэль– кометрии является частотная область 50–800 кГц, где находится наиболее информативная и хорошо воспроизводящаяся часть спектра реактивных потерь для этих растворов. Для повышения надежности измерений были изменены параметры измерительных катушек, перекрывающих указанный диапазон измерений в экспериментальной установке. Эти параметры приведены в таблице.
Внешний вид установки, собранной на базе куметра ВМ-560 фирмы "Тесла" (бывш. Чехословакия) [6] с тремя катушками — "индукционными ячейками", представлен на рис. 1.
Принцип измерений на разработанной установке был подробно описан в [4] и состоит в следующем. В ячейку индуктивности, выполненную в виде соленоида с отверстием по оси, при измерениях вставляется стеклянная пробирка
Параметры ячеек индуктивности установки для исследований растворов
|
№ катушки |
Частотный диапазон, кГц |
Индуктивность L , мГн |
Собств. емкость C 0 , пФ |
Сопротивление R , Ом |
|
3 |
50–140 |
32 |
7 |
28.8 |
|
4 |
90–260 |
9.5 |
6.5 |
15.8 |
|
5 |
240–800 |
1.15 |
17 |
5.6 |

Рис. 1 . Куметр ВМ-560 с ячейкой индуктивности (а) и комплект из трех ячеек (б), используемых для измерений в диапазоне частоты 70–800 кГц

б
с раствором (пробой). Диаметр центральных отверстий в каркасах катушек — 26 мм, длина области однородного магнитного поля — 200 мм. Объем пробы, используемой для измерений и размещаемой в центральной области соленоида, составлял 70 мл.
Процесс измерений состоит в следующем. После установки частоты, на которой производится измерение, контур настроечной емкостью настраивается на резонанс. Параметры контура в резонансе для каждой частоты, т.е. величины Q — добротности контура и С — настроечной емкости контура, последовательно измеряются: без пробы — величины (Q1, С1) и с пробой — величины (Q2, С2), после чего величина tg δ — тангенса диэлектрических потерь, характеризующего реактивные потери в растворе, вызванные его структурированием, определяется по формуле tg δ = (Q1С1 – Q2,С2) / (Q1Q2(С1– С2)).
Как было показано Л.П. Семихиной [3], эта формула представляет величину tg δ при условии, когда в измерениях величина Q ˃ 20 с ошибкой не более 5 %.
Последовательная смена L-ячеек обеспечивает возможность проведения измерений в перекрывающихся частотных окнах в диапазоне частот 50– 800 кГц с высокой точностью и воспроизво- димостью. Для удобства представления экспериментальной информации диапазон частот ω, составляющий в данном случае 1.5 порядка, далее на рисунках дан в логарифмическом масштабе, причем частота ω бралась в кГц.
Для приготовления растворов использовали бидистиллированную воду, физиологический раствор NaCl с концентрацией 0.15 М, а также ХЧ соляную кислоту и едкий натр. Во всех случаях измерения проводились в диапазоне концентраций растворенных веществ 10–2–10–7 М. Концентрации растворов изменялись последовательным разбавлением. Все приводимые далее зависимости воспроизводимо измерялись не менее 10–50 раз. Чистота бидистиллята и отсутствие структурирующих дефектов в пробирках контролировались на той же установке по форме кривой tg δ для бидистиллята в частотном диапазоне проводимых измерений.
На рис. 2 приведена частотная зависимость тангенса диэлектрических потерь (tg δ ) для бидистиллята в стеклянной пробирке в частотном диапазоне 50–160 кГц, полученная на данной установке. Как видно, эта кривая плавно уменьшается с увеличением частоты и не имеет особенностей, что свидетельствует об отсутствии в бидистилляте упорядоченностей, доступных для измерений на данной установке.
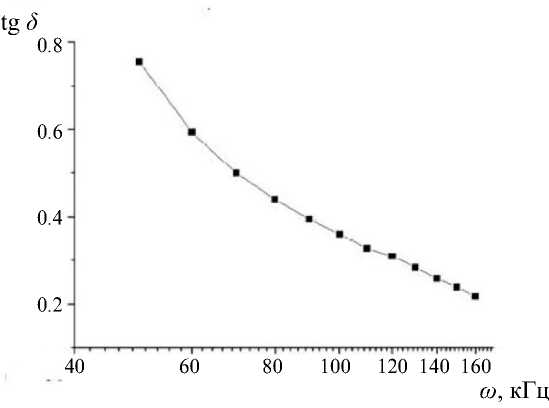
Рис. 2. Зависимость tg δ от частоты для бидистиллированной воды в диапазоне частот 50–160 кГц tg δ 1.0
0.6
0.5
0.4
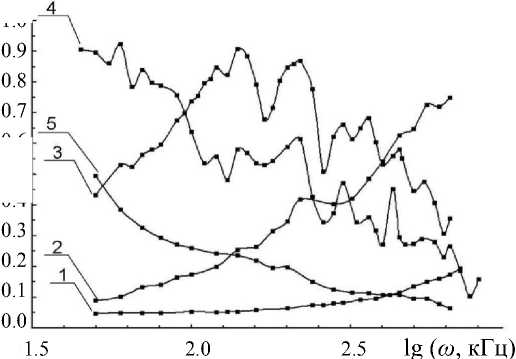
Рис. 3 . Зависимость tg δ от логарифма частоты для водных растворов NaCl разных молярных концентраций.
1 — 10–2, 2 — 10–3, 3 — 10–4, 4 — 10–5, 5 — 10–6 М
РЕЗУЛЬТАТЫ ИЗМЕРЕНИЙ РЕАКТИВНЫХ ПОТЕРЬ РАСТВОРОВ ( tg δ ) ПРИ ИЗМЕНЕНИИ ЧАСТОТЫ ДЛЯ ВОДНЫХ РАСТВОРОВ NaCl, HCl И NaOH
На рис. 3 для водного раствора NaCl в диапазоне концентраций 10–2–10–6 М представлены типичные для проводимых измерений зависимости tg δ (lg ω ), показывающие изменение tg δ от логарифма частоты возбуждения контура ω (в кГц) в диапазоне ω = 50–800 кГц (lg ω = 1.7–2.8). Сходные по характеру концентрационные зависимости наблюдались для всех солей металлов 1 группы.
Как видно из рис. 3, при высоких концентрациях соли NaCl (кривая 1, 10–2 М) измеряемый тангенс диэлектрических потерь очень мал и не информативен, что обусловлено большими активными потерями контура, вызванными высокой проводимостью раствора. При концентрации электро- лита 10–3 М и соответственно существенном уменьшении проводимости раствора на кривых tg δ в конце диапазона измерений отмечаются выходящие за погрешности измерений нарушения плавности кривой tg δ (рис. 3, кривая 2). При концентрациях, близких к 10–4 М, кривые tg δ (lg ω) начинают изменять наклон (линия 3), а при дальнейшем уменьшении концентрации форма зависимости tg δ от частоты приближается к таковой для бидистиллята. Наиболее информативным для интерпретации структурных изменений в растворе является изменение tg δ (lg ω) в диапазоне средних концентраций: 5.10–4–10–5 М, где эти зависимости демонстрируют спектральное поведение с четко выраженными пиками. Качественно зависимости для tg δ (lg ω) по положению пиков достаточно хорошо воспроизводятся при многократных измерениях и от образца к образцу, хотя они могут параллельно сдвигаться на 2–5 %, всегда, однако,
а tg δ
1.5 2.0
1.5
2.5
2.0
2.5
lg ( ω , кГц)
lg ( ω , кГц)
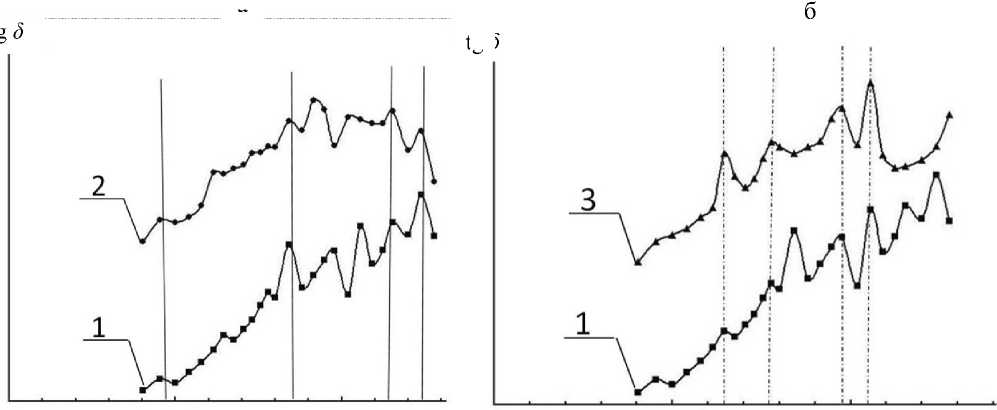
Рис. 4 . Зависимости tg δ от логарифма частоты для водных растворов NaCl (1), HCl (2) и NaOH (3) в концентрациях ~2 · 10–4 М (кривые по оси tg δ условно раздвинуты).
а — сравнение растворов NaCl (1) и HCl (2): вертикальными линиями отмечены совпадающие пики, отнесенные к структурам воды, связанным с ионами Cl ; б — сравнение растворов NaCl (1) и NaOH (3): вертикальными линиями отмечены совпадающие пики, отнесенные к структурам воды, связанным с ионами Na+ оставаясь подобными друг другу по числу и расположению пиков. Амплитуды пиков в разных измерениях также могут отличаться, но не более чем на 20–30 %. При дальнейшем уменьшении концентрации соли в растворе положение пиков на оси частот не изменяется, но они уменьшаются по амплитуде.
Совершенно неожиданным результатом, полученным при этих измерениях, является то, что пики, наблюдаемые в спектрах, создаются как катионами, так и галоген-анионами электролитов. Это продемонстрировано на рис. 4, где представлены результаты измерений частотных зависимостей tg δ (lg ω ) для растворов NaCl, HCl и NaOH с концентрациями, близкими к 2·10–4 М. Если считать, что пики на зависимостях tg δ (lg ω ) связаны со структурированием воды водных растворов катионами и анионами растворенных веществ, то из совпадения пиков для указанных веществ следует, что зависимость для NaCl отражает структурные изменения в растворе, создаваемые как катионом Na+, так и анионом Cl–, в то время как зависимости для NaOH и HCl отражают структурные изменения, относящиеся соответственно только к катиону Na+ или к аниону Cl–. И действительно, такие совпадения на кривых, представленных на рис. 4, наблюдаются достаточно четко.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
При использовании любых интегральных методов, как экспериментальных, включая спектрометрические, так и методов компьютерного моделирования, данные о структуре жидкости, в том числе воды, обычно находят из полученных в этих методах радиальных функций распределения, дающих информацию не о местоположении каждого соседа выбранной молекулы, а только о слое молекул [7]. В рамках этого приближения кластер (домен) водной среды, поляризованной катионом или анионом, представляет собой распределение соседних к центральному иону молекул воды по слоям в соответствии с их расстоянием до этого иона. Для представленных на рис. 2–4 результатов измерений диэлектрических потерь в диапазоне 104–106 Гц соответствующий диапазон энергий таков, что мы можем отнести наблюдаемые реактивные потери к части этого кластера, существенно удаленной от первой координационной сферы иона. Этот результат уже крайне необычный, поскольку свидетельствует о дальнодействии электростатической поляризации водной среды, производимой ионом, а также позволяет интерпретировать ее как информацию об энергетических из- менениях водородных связей в этой части электростатически напряженного кластера.
Не менее новым и неожиданным в полученных результатах является наличие спектральной (немонотонной) зависимости поляризационных эффектов в пределах каждой из сферических структур поляризации вокруг ионов, все более четко проявляющейся в измерениях при понижении концентрации растворенной соли электролита. Представленные на рис. 3 для раствора NaCl зависимости от концентрации соли в растворе являются типовыми для всех проводимых измерений. При этом на изменение величины tg δ и наклона кривых при уменьшении концентрации раствора существенно влияет уменьшение проводимости измеряемых растворов. В данной измерительной установке спектральная природа зависимостей от концентрации наиболее четко проявляется при концентрациях, близких к 10–4 М. При дальнейшем понижении концентрации положения пиков на спектральных кривых во всех случаях сохраняются, но их амплитуды уменьшаются, что связано с уменьшением концентрации ионов в растворе. При концентрации 10–6 М форма зависимости tg δ (lg ω ) приближается к ее форме для бидистиллята, представленной на рис. 2, и при дальнейших разбавлениях становится неотличимой от нее. Спектральные изменения на кривых зависимостей tg δ (lg ω ) в данных измерениях регистрируются уже при концентрациях чуть ниже 10–3 М, однако возможно, что эффект существует и при более высоких концентрациях, но в данных измерениях не фиксируется из-за влияния проводимости, очень высокой для водных растворов электролитов. Но если положения пиков в спектральных зависимостях реактивных потерь трактовать как максимумы энергий поглощения в структурно измененных слоях сферического кластера из молекул воды, образованного ионом, то результаты измерений указывают на существование в нем немонотонной пространственной структуры.
Еще более неожиданным и трудно интерпретируемым является экспериментально обнаруженный эффект специфичности наблюдаемых спектров tg δ (lg ω) для различных соединений натрия. Положения пиков в спектрах на шкале lg ω оказались достаточно хорошо воспроизводимыми для катиона Na+ и для анионов Cl– и ОН–. На рис. 4 приведены спектральные зависимости тангенса реактивных потерь tg δ для растворов NaCl, NaOH и НCl в концентрациях, близких к 10–4 М. На рис. 4, а, при сравнении спектральных зависимо- стей для растворов NaCl и NaOH наблюдаются совпадающие пики, которые, видимо, можно интерпретировать как структуры воды, возмущенные ионом Na+, а пики, совпадающие на рис. 4, б, для NaCl и НCl, видимо, можно отнести к структурам, связанным с ионом Cl–.
При разбавлениях более высоких, чем 10–4 М, регистрируемые пики не изменяют своего положения по частоте, но их амплитуды уменьшаются и частотные зависимости как бы "сглаживаются". При концентрациях, близких к 10–7 М, вклад реактивных потерь от структур, создаваемых ионами, на данной экспериментальной установке практически уже не превышает ошибки измерения, а сами зависимости tg δ (lg ω ) близки к таковой для бидистиллята (рис. 2). Такая концентрационная зависимость для исследованных электролитов позволяет считать относительно них, что мы имеем дело с классическим раствором, причем поляризационное искажение сетки водородных связей воды для электролитов является чисто электростатическим процессом.
ВЫВОДЫ
-
1. Измерение тангенса угла диэлектрических потерь (tg δ ) водного раствора, помещенного в катушку индуктивности колебательного контура, в зависимости от частоты возбуждения в диапазоне частот 104–106 Гц (метод L-диэлькометрии) является эффективным методом, позволяющим наблюдать структурные поляризационные изменения в водном растворе, создаваемые растворенными электролитами в широком диапазоне концентраций.
-
2. Частотные спектры зависимостей tg δ от lg ω для водного раствора NaCl в диапазоне концентраций 10–2–10–7 М демонстрируют немонотонное изменение энергий реактивных потерь поляризованными водными структурами, которое можно интерпретировать как возникновение удаленных пространственных структурных изменений внутри сферического поляризованного кластера.
-
3. Катион Na+ и анионы Cl– и ОН– создают в растворе пространственные электростатически поляризованные кластеры, энергетическая структура внутри которых индивидуальна для вызвавшего ее иона.
-
4. Амплитуды пиков в спектре уменьшаются при уменьшении концентрации растворенных соединений Na, что позволяет отнести водные растворы этих соединений к классическим растворам.
Список литературы Диэлькометрические измерения структурных изменений в разбавленных водных растворах соединений натрия
- Жуковский. А.П., Ровнов Н.В., Петров Л.Н., Сорвин С.В., Вукс Е.М. Исследование структуры водных растворов диметилсульфоксида методом ИК-спектроскопии // ЖСХ. 1992. № 4. С. 100-104.
- Лященко А.К., Новскова Т.А. Структурная динамика и спектры ориентационной поляризации воды и других жидкостей // Структурная самоорганизация в растворах и на границе раздела фаз / Ред. А.Ю. Цивадзе. Серия "Проблемы химии растворов". М.: Изд. ЛКИ, 2008. С. 417-500.
- Семихина Л.П. Диэлектрические и магнитные свойства воды в водных растворах и биообъектах в слабых электромагнитных полях. Тюмень: Изд. ТГУ, 2006. 164 с.
- Бланк Т.А., Экспериандова Л.П., Сидлецкий О.П., Касян Н.А., Острась К.С. Диэлькометрия как один из методов практической акваметрии функциональных материалов // Методы и объекты химического анализа. 2007. Т. 2, № 2. С. 156-161.
- Галль Л.Н., Максимов С.И., Скуридина Т.С., Галль Н.Р. Низкочастотная индуктивная диэлькометрия - эффективный метод для изучения структурирования воды в водных растворах // Научное приборостроение. 2016. Т. 26, № 1. С. 26-33. URL: http://iairas.ru/mag/2016/abst1.php#abst3
- Куметр ВМ-560. Инструкция по эксплуатации. М. 1986. 110 с. URL: http://download.qrz.ru/pub/hamradio/schemes/metering/bm560.pdf
- Лященко А.К., Дуняшев В.С. Комплементарная организация структуры воды // ЖСХ. 2003. T. 44, № 5. C. 909-915. URL: https://jsc.niic.nsc.ru/article/15070


