Динамика ферментативной активности и пигментного состава в тканях водного погруженного растения Ceratophyllum demersum в условиях воздействия ксенобиотиков и последующей реабилитации
Автор: Макурина Ольга Николаевна, Розина Светлана Алексеевна, Розенцвет Ольга Анатольевна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Проблемы прикладной экологии
Статья в выпуске: 4-5 т.17, 2015 года.
Бесплатный доступ
В статье рассматривается влияние стрессовых концентраций ионов свинца, катионных синтетических поверхностно-активных веществ (СПАВ) и их сочетания на ферментативную активность, пигментный состав и содержание водорастворимых белков в тканях водного погруженного растения Ceratophyllum demersum.
Водные растения, тяжелые металлы (тм), поверхностно-активные вещества (пав), каталаза, пероксидаза, водорастворимые белки, хлорофилл а, хлорофилл b, каротиноиды, окислительный стресс, доктор биологических наук, профессор кафедры биохимии
Короткий адрес: https://sciup.org/148203963
IDR: 148203963 | УДК: 582.671:581.5.
Текст научной статьи Динамика ферментативной активности и пигментного состава в тканях водного погруженного растения Ceratophyllum demersum в условиях воздействия ксенобиотиков и последующей реабилитации
В последние два десятилетия значительно возрос интерес к экологическим аспектам загрязнения водных объектов синтетическими поверхностно-активными веществами (СПАВ), получаемыми из углеводородов нефти. Это обусловлено, с одной стороны, возрастающими масштабами производства и объемами использования этих соединений в различных отраслях промышленности и сельского хозяйства, в том числе в производстве синтетических моющих средств (СМС), а с другой – чрезвычайной широким диапазоном отрицательного влияния СПАВ как на водные экосистемы, так и на организм человека, а также их устойчивостью к биодеградации [31]. Катионные СПАВ наиболее устойчивы к биодеградации и представляют большую опасность для живых организмов по сравнению с анионными и амфотерными СПАВ [19,35].
Активные формы кислорода (АФК), образующиеся при поступлении поллютантов в организм, способны повреждать нативную структуру клеточных мембран и инициировать процессы перекисного окисления липидов (ПОЛ), что может привести к развитию окислительного стресса. Вместе с тем, в клетках существуют антиоксидантные системы, включающие ферменты (каталазу, пероксидазу, супероксиддисмутазу и др.) и низкомолекулярные соединения, которые обеспечивают защиту живых организмов от АФК [20, 27, 30].
Фотосинтетические пигменты (хлорофиллы и каротиноиды) являются основными компонентами фотосинтетического аппарата зеленых растений, и изменение их содержания служит чувствительным маркером нарушений метаболизма растительной клетки в целом [5]. ТМ нарушают водный статус и газообмен, снижают содержание пигментов и инактивируют ключевые ферменты метаболических путей. СПАВ вызывают солюбилизацию мембран, нарушая работу пигментного аппарата. Количественное содержание пигментов и их соотношение в тканях растений являются фактором, определяющим физиологическое состояние растения, отражают изменения роста и развития при различных стрессах [5, 22].
Содержание водорастворимых белков в растительных тканях изменяется под действием огромного количества стрессоров (в том числе поллютантов) и служит чувствительным маркером изменений клеточного метаболизма [33].
В отечественных работах изучены биологические эффекты различных видов СПАВ на ряд высших наземных и водных растений [12, 13], приведены механизмы действия и выдвинута идея самоочистки сточных вод с помощью водных макрофитов [9]. В работах Мурзина и соавт. [11] изучено действие катионных и анионных СПАВ по отдельности и в сочетании с ионами меди и кадмия на биохимические показатели высшего водного растения Egeria densa . Согласно исследованиям наших соотечественников [11, 13], наиболее эффективная концентрация ионов свинца – 100 мкМоль/л, катионных СПАВ – 1%. Период воздействия токсиканта составил 12 и 72 часа. Реабилитация проводилась в течение пяти суток. Объектом исследования был выбран пресноводный макрофит с широким ареалом обитания Ceratophyllum demersum, фактор воздействия –ионы свинца (100 мкМоль/л ионов свинца в растворе ацетата свинца), катионные СПАВ (1% раствор широкодоступного катионного СПАВ – ополаскиватель для белья «Дося» и их сочетание в указанных концентрациях.
Целью нашей работы явилось исследование динамики каталазной, пероксидазной активности, пигментного состава и содержания водорастворимых белков в тканях водного погруженного растения C. demersum при воздействии ионов ТМ (на примере свинца), катионных СПАВ (на примере ополаскивателя для белья «Dosia») и их сочетания, а также в период реабилитации, после удаления поллютантов из воды.
МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследования был выбран пресноводный макрофит роголистник погружённый ( Ceratophyllum demersum L.) [7].
Эксперимент проводился в лабораторных условиях при одинаковой интенсивности и регулярности светового потока, а также при постоянной температуре (20°С). Для этого в опыте была использована комбинация люминесцентных ламп и установлен постоянный период освещения, равный 18 ч.
В ходе эксперимента растения были разделены на 4 группы, различающиеся средой выращивания. Контрольная группа растений находилась в среде отфильтрованной водопроводной воды, первая опытная группа инкубировалась в присутствии 100 мкМоль/л ионов свинца в растворе ацетата свинца, вторая – в присутствии 1% катионного СПАВ, третья – в присутствии обоих поллютантов в указанных концентрациях. Непосредственно перед началом исследований фрагменты растений длиной до 50 мм, считая от точки роста, помещали в стеклянные емкости объемом 1 дм3.
Продолжительность воздействия поллютанта составила 12 и 72 часа. По истечении указанного периода экспозиции часть растений из каждой группы отбирали на исследования, а часть переносили в чистую отфильтрованную воду для реабилитации. Длительность реабилитации составила 5 суток: для 12 часов инкубации – это 132 час, для 72 часов инкубации – 192 час эксперимента. После реабилитации также проводили измерения биохимических показателей.
Методы исследования . Исследование уровня каталазной активности проводили по методу по Королюк М.А. и Ивановой Л.И. [8]. Определение пероксидазной активности осуществляли общепринятым методом по Бояркину А.М. (метод основан на определении скорости реакции окисления бензидина до образования синего продукта окисления определенной концентрации) [2]. Определяли содержание водорастворимых белков по методу М. Брэдфорд [21] и выражали ферментативную активность в удельных единицах на г белка. В растительных тканях исследовали содержание фотосинтетических пигментов по методу Брагинского Л.П. (количественное определение пигментов основано на определении оптической плотности пигментов на длинах волн, являющихся максимумами их поглощения) [1]. Статистическую обработку данных (среднее значение, стандартное отклонение) проводили с использованием стандартных статистических методов и компьютерных программ.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Инкубация в среде ионов свинца приводила к развитию хлороза листьев C. demersum , эффект усиливался по мере увеличения срока инкубации. Токсическое действие 1% раствора катионных СПАВ вызвало опад листьев после 12 часов воздействия и фрагментацию растения после 72 часов. Эффекты сочетания ксенобиотиков стали причиной хлороза и частичного опада листьев. Реабилитация от воздействия ионов свинца и сочетания поллютантов прошла более менее успешно, после инкубации в среде катионных СПАВ растение не восстановилось.
Динамика каталазной активности представлена на рис. 1а. Токсическое действие 100 мкМоль/л ионов свинца вызвало снижение уровня каталазной активности в два раза на 12 и 72 часы инкубации, влияние 1% раствора катионных СПАВ привело к повышению ферментной актив-
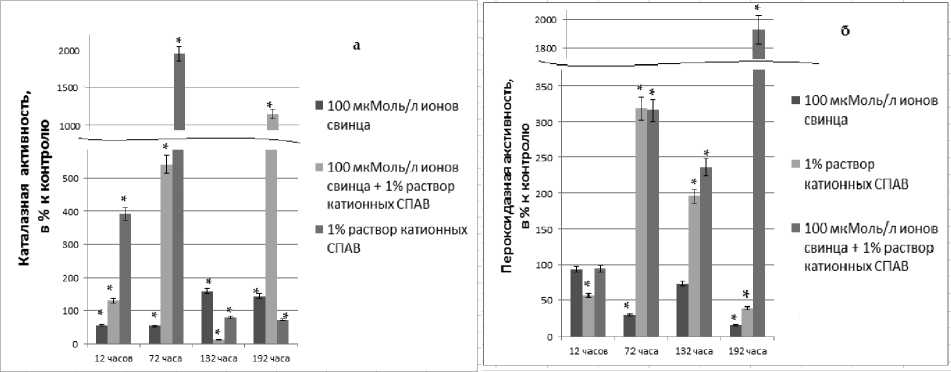
Рис. 1. Динамика каталазной (а) и пероксидазной (б) активности в тканях С. demersum ;
контроль принят за 100%; * - степень достоверности р< 0,01
ности в 4 раза к 12 часу инкубации и в 19 раз к 72 часу инкубации, а сочетание ксенобиотиков повысило каталазную активность в 1,3 и 5,4 раза соответственно.
Для СПАВ характерно образование плёнки на границе раздела сред: воздух-вода, вода-ткани растения. В эксперименте с катионными СПАВ и их сочетанием с ионами свинца наблюдалось образование плёнки на поверхности сосуда и на организме растения, из-за чего оно погрузилось на дно сосуда. Вероятно, плёнка катионных СПАВ препятствовала нормальному дыханию тканей С. demersum, поэтому индуктивно повышалось содержание молекул каталазы в клетках и, соответственно, ферментативная активность повышалась в разы.
Реабилитация от токсических эффектов ионов свинца показала, что каталазная активность превысила контрольные значения в 1,4 - 1,5 раза, что может быть связано процессами ликвидации последствий окислительного стресса, вызванного ионами тяжёлого металла. Реабилитация от действия катионных СПАВ привела к снижению ферментативной активности на 21 - 27%, что является следствием истощения пула фермента и ресурсов клетки после усиленного синтеза каталазы в период инкубации. Интересно отметить, что реабилитация от 12 часов сочетанного воздействия ксенобиотиков привела к снижению каталазной активности в семь раз, а реабилитация от 72 часов инкубации вызвала повышение ферментативной активности в 11,5 раз. Возможно, поллютанты взаимодействуют между собой, характеристика взаимодействия меняется с течением времени, усиливается окислительный стресс и образование активных форм кислорода (АФК), поэтому реабилитация от 72 часов инкубации в среде сочетания поллютантов является результатом дальнейшей борьбы организмы С. demersum с токсическими эффектами.
Динамика пероксидазной активности представлена на рис. 1б.
Через 12 часов инкубации 100 мкМоль/л ионов свинца и сочетание ксенобиотиков не вызвало достоверного изменения пероксидазной активности. Токсическое действие 1% раствора катионных СПАВ после 12 часов воздействия привело к снижению пероксидазной активности в 2 раза. К 72 часу инкубации ферментативная активность резко изменилась: в среде с добавлением ионов свинца она снизилась в 3 раза, а в средах с добавлением катионных СПАВ и сочетанием ксенобиотиков - повысилась в 3,2 раза.
Из литературных данных известно, что двухвалентные ионы ТМ в высоких концентрациях способны частично или полностью вытеснять металлы из активного центра ферментов, в результате чего теряется их активность [14, 32]. На наш взгляд, по-видимому происходило вытеснение кальция из молекул фермента ионами свинца, что и приводило к значительному ингибированию пероксидазной активности в тканях С. demersum в условиях инкубации в среде с добавлением 100 мкМоль/л ионов свинца. Токсический эффект СПАВ на пероксидазную активность может проявляться по-разному. В исследованиях Давлетшина А.И. с сотр. [3,4] показано, что СПАВ способны как вызывать активацию фермента пероксидазы, так и приводить к ингибированию его активности, воздействуя как на молекулы фермента непосредственно, так и на его мембранное окружение, либо на состояние субстрата, что и наблюдалось в условиях инкубации: после 12 часов пероксидазная активность понизилась в два раза, а к 72 часу - повысилась в 3,2 раз. Эффекты сочетания ксенобиотиков повторяют эффекты катионных СПАВ.
Снижение пероксидазной активности в период реабилитации от действия ионов свинца (на 27% от 12 часов инкубации и 85% от 72 часов инкубации) соотносится с повышением каталазной активности. Ионы свинца привели к повреждениям в клетке и развитию окислительного стресса, активно ликвидируемым ферментом каталазой, в результате чего развивается субстратное ингибирование пероксидазы. Реабилитация от 12 часов воздействия 1% раствора катионных СПАВ привела к повышению пероксидазной активности в 2 раза, реабилитация от 72 часов – к снижению ферментативной активности в 2,5 раз. Столь значительное снижение пероксидазной активности может быть следствием истощения пула фермента после инкубации. Реабилитация от сочетанного воздействия ксенобиотиков привела к повышению пероксидазной активности в 2,4 раза (от 12 часов) и 19 раз (от 72 часов), что, как и в случае с каталазой, свидетельствует о дальнейшем влиянии токсикантов на организм C. demersum.
Изменение содержания водорастворимых белков на протяжении всего эксперимента представлено на рис. 2. После 12 часов инкубации в среде поллютантов только действие ионов свинца привело к достоверному снижению в 1,7 раза содержания водорастворимых белков. Инкубация в течение 72 часов в среде 100 мкМоль/л ионов свинца вызвала снижение содержания водорастворимых белков в 1,4 раза, в среде с добавлением 1% раствора катионных СПАВ – в 6,7 раз, в среде с сочетанием ксенобиотиков – в 4,3 раза. Подобная тенденция могла быть обусловлена инактивацией или даже денатурацией белков этими ксенобиотиками [34]. Известно, что СПАВ способны также повреждать молекулы нуклеиновых кислот [6], и мы предполагаем, что поступление катионных СПАВ в организм индуцировало структурные изменения в молекулах ДНК, которые влекли за собой нарушение процессов белкового синтеза.
Из литературных данных известно, что в присутствии СПАВ возможно увеличение поступления ТМ в ткани растений [25]. По-видимому, подобный механизм имел место в проведенной нами работе. В этих условиях предположительно более интенсивно протекали процессы повреждения белковых молекул и ингибирования их биосинтеза. В условиях повышенного поступления ТМ в клетку, и такой эффект известен из литературы [28], могли также усиливаться процессы протеолиза, приводящие к деградации белков.
Реабилитация от 12 часового воздействия ксенобиотиков показала снижение содержания водорастворимых белков на 21 – 40 %, тогда как в результате реабилитации от 72 часов инкубации от эффектов ионов свинца и катионных СПАВ содержание водорастворимых белков достоверно не отличалось от контрольных величин. Реабилитация от сочетания ксенобиотиков показала снижение содержания водорастворимых белков в 2,6 раза, что свидетельствовало о сложной и длительной адаптации растений к токсическому действию смеси поллютантов.
Динамика содержания хлорофилла а представлена на рис. 3а. Наибольшие отклонения в содержании данного пигмента вызвало воздействие 1% раствора катионных СПАВ. К 12 часам содержание хлорофилла а превысило контрольные значения в 2,2 раза и стало снижаться в последующие часы инкубации. Через 72 часа воздействия катионных СПАВ содержание хлорофилла а превышало контрольные значения всего на 16%, а в период реабилитации снизилось и составило 34% от контроля. Ионы свин-
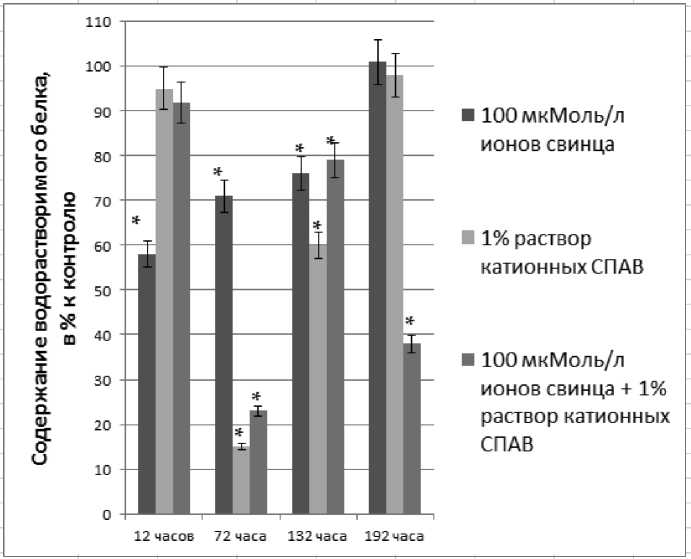
Рис. 2. Динамика содержания водорастворимых белков в тканях C. demersum; контроль принят за 100%; * - степень достоверности р< 0,01
ца и сочетание ксенобиотиков через 12 часов воздействия привели к снижению содержания хлорофилла а в 1,7 и 2 раза соответственно. Однако на 72 часу инкубации в присутствии 100 мкМоль/л ионов свинца содержание хлорофилла а возросло и превысило контрольные показатели в 1,7 раз. В период реабилитации содержание хлорофилла а сначала сравнялось со контрольными значениями, а потом, к 192 часу эксперимента, понизилось в 3 раза. Реабилитация от сочетанного действия поллютантов показала, что содержание хлорофилла а превысило контрольные значения на 15 – 19%.
Содержание хлорофилла b на протяжении всего эксперимента представлено на рис. 3б. Токсическое действие поллютантов привело к снижению содержания хлорофилла b в 1,5 – 3 раза на 12 час инкубации, однако на 72 час содержание пигмента повысилось в 2,4 раз (100 мкМоль/л ионов свинца) и в 1,6 раза (1% катионных СПАВ). Эффект сочетанного действия ксенобиотиков снизил содержание хлорофилла b в 2 раза на 72 час инкубации. Реабилитация показала резкое изменение содержание пигмента в тканях C. demersum . Хотя на 132 час эксперимента содержание хлорофилла b после воздействия ионов свинца и сочетания поллютантов достоверно не отличалось от контрольных величин, на 192 час эксперимента содержание хлорофилла b после воздействия ионов свинца составило всего 2,5 % от контроля, а после сочетанного воздействия – превысило контроль в 20 раз. В период реабилитации от токсических эффектов катионных СПАВ содержание хлорофилла b снизилось в 3,3 раза на 132 час эксперимента и в 7,7 раз на 192 час.
Токсическое действие поллютантов привело к снижению содержания хлорофилла b в 1,5 – 3 раза на 12 час инкубации, однако на 72 час содержание пигмента повысилось в 2,4 раз (100 мкМоль/л ионов свинца) и в 1,6 раза (1% катионных СПАВ).
Эффект сочетанного действия ксенобиотиков снизил содержание хлорофилла b в 2 раза на 72 час инкубации. Реабилитация показала резкое изменение содержание пигмента в тканях C. demersum . Хотя на 132 час эксперимента содержание хлорофилла b после воздействия ионов свинца и сочетания поллютантов достоверно не отличалось от контрольных величин, на 192 час эксперимента содержание хлорофилла b после воздействия ионов свинца составило всего 2,5 % от контроля, а после сочетанного воздействия – превысило контроль в 20 раз. В период реабилитации от токсических эффектов катионных СПАВ содержание хлорофилла b снизилось в 3,3 раза на 132 час эксперимента и в 7,7 раз на 192 час.
Динамика содержания каротиноидов представлена на рис. 4. Токсические эффекты ионов свинца привели к повышению содержания каротиноидов в 3,8 раз на 12 час инкубации и к снижению на 40% на 72 час эксперимента. Реабилитация показала увеличение содержания пигментов на 132 час в 2,2 раза и на 192 час – в 1,3 раза.
Раствор катионных СПАВ на двенадцатый час инкубации также вызвали повышение содержания каротионидов в 2,4 раз, а в последующие часы реабилитации их содержание превышало контроль на 11 – 24%. Хотя сочетанное действие ксенобиотиков и вызвало снижение содержания каротиноидов на 40% на 12 час и увеличение в 4,7 раза на 72 инкубации, после периода реабилитации опытные показатели достоверно не отличались от контрольных.
Исходя из анализа содержания хлорофиллов a и b в растении в период воздействия катионных СПАВ, можно предположить, что многократное увеличение содержания хлорофиллов служило ответом клетки на возросшие потребности в дыхании (т.к. катионные СПАВ образовывали пленку на поверхности стеблей и листьев, препятствуя проникновению кислорода внутрь), однако
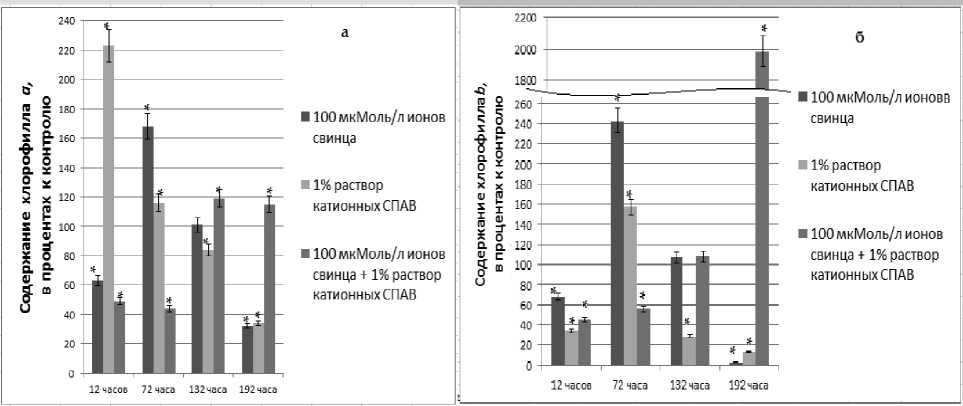
Рис. 3. Динамика содержания хлорофилла а (а) и хлорофилла b (б) в тканях C. demersum в процентах к контролю, контроль принят за 100%; * – степень достоверности р< 0,01
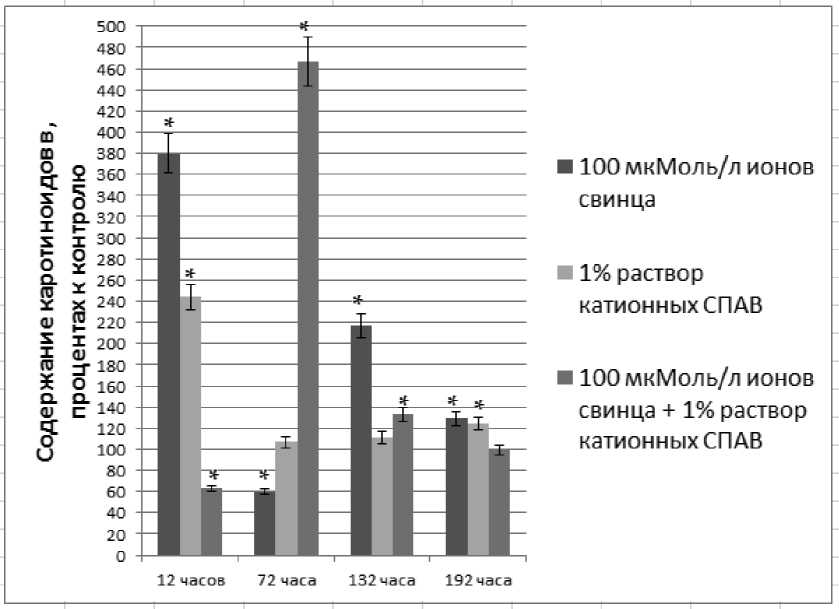
Рис. 4. Динамика содержания каротиноидов в тканях C. demersum в процентах к контролю, контроль принят за 100%; * - степень достоверности р< 0,01
в метаболизме уже возникали необратимые нарушения, приводящие к последующей деградации пигментов в период последействия. Снижение содержания хлорофиллов a и b при воздействии ионов свинца, вероятно, связано, с повреждением ионами ТМ тиллакоидных мембран и нарушением работы пигментного аппарата.
Из литературных данных известно, что в фотосинтетическом аппарате каротиноиды выполняют функцию антиоксидантов, обладающих способностью замедлять фотохимические реакции, приводящие к образованию свободных радикалов, повреждению мембран хлоропластов и деградации хлорофиллов [23]. По-видимому, увеличение их содержания в растении при воздействии поллютанта и в период реабилитации было вызвано необходимостью защиты хлорофиллов в условиях стресса.
Во время реабилитации фитотоксическое действие поллютантов сохранялось и предположительно приводило к истощению энергетических ресурсов клетки, что затрудняло поддержание нормальной жизнедеятельности растения. На наш взгляд, и это также подтверждается данными литературных источников [24, 26, 29, 36], повреждение пигментного комплекса в растительных тканях было обусловлено солюбилизацией тил-лакоидных мембран, изменением их жирно-кислотного состава, нарушением ультраструктуры хлоропластов, а также солюбилизацией хлоро-филл-белковых комплексов под действием СПАВ. После процессов реабилитации от токсических эффектов ионов свинца и катионных СПАВ в тканях C. demersum сохранялось низкое содержание хлорофиллов a и b, а содержание каротиноидов лишь на 11 – 24% превысило нормальные значения, что свидетельствует о процессах ликвидации окислительного стресса.
Реабилитация от сочетанного действие ксенобиотиков показала, что все показатели, кроме содержания хлорофилла b , вернулись к контрольным значениям. Вероятно, этот пигмент взял на себя основную работу по выполнению защитных и дыхательных функций.
Токсические эффекты ионов свинца и катионных СПАВ оказывают разнонаправленное действие на ферментативную активность и содержание пигментов и водорастворимых белков в тканях C. demersum. Ионы ТМ замещают ионы металлов в активных центрах ферментов, нарушают работу пигментного аппарата, вызывая хлороз. Основной токсический эффект катионных СПАВ – солюбилизация мембран, выход ферментов в клетку, нарушение внутриклеточных взаимосвязей, реабилитация от 1% катионных СПАВ крайне затруднительна для тканей C. demersum.
Эффекты сочетанного воздействия ксенобиотиков развивают и в реабилитационных период. Преобладают токсические эффекты катионных СПАВ, однако поллютанты взаимодействуют между собой, смягчая повреждения мембранных структур. Для более полной реабилитации от сочетанного воздействия требуется, вероятно, более 5 суток.
Список литературы Динамика ферментативной активности и пигментного состава в тканях водного погруженного растения Ceratophyllum demersum в условиях воздействия ксенобиотиков и последующей реабилитации
- Бриттон Г. Биохимия природных пигментов. Пер. с англ. М.: Мир, 1986. 422 с.
- Бояркин А.Н. Быстрый метод определения активности пероксидазы//Биохимия. 1951. Т. 16. Вып. 4. С. 352-355.
- Давлетшин А.И., Калабина Н.А., Зайцев С.Ю., Егоров В.В. Влияние поверхностно-активных веществ на активность пероксидазы. Влияние катионных ПАВ//Биоорган. химия. 1998. Т. 24. № 6. С. 430 -432.
- Давлетшин А.И., Сильвестрова И.Г., Зубов В.П, Егоров В.В. Влияние ПАВ различной природы на активность пероксидазы и трипсина//Вестн. Моск. ун-та. Сер. 2. Химия. 1998. Т. 39. № 4. С. 272 -275.
- Головко Т.К., Далькэ, И.В., Бачаров, Д.С. Мезоструктура и активность фотосинтетического аппарата трех видов растений сем. Crassulaceae в холодном климате//Физиология растений. 2008. Т. 55, № 5. С. 671-680.
- Гостюхина О.Л., Солдатов А.А. и др. Влияние тетрадецилтриметиламмоний бромида на состояние ферментной системы антиоксидантной защиты тканей черноморского моллюска Mytilus galloprovincialis Lam.//Доп. НАН України. 2007. № 11. С. 147-151.
- Жизнь растений. В 6-ти т. Т. 5. Ч. 1. Цветковые растения . М.: Просвещение, 1980. С. 188-190.
- Королюк М.А., Иванова Л.И., Майорова И.Г., Токарев В.Е. Метод определения активности каталазы//Лаб. дело. 1988. № 1. С. 16-19.
- Лазарева Е.В., Остроумов С.А. Ускорение снижения концентрации поверхностно-активного вещества в воде микросома в присутствии растений: инновации для фитотехнологии. ДАН, 2009. Т. 425. №6. С. 843 -845.
- Маслова Т.Г., Мамушина, Н.С., Шерстнева О.А., Буболо Л.С., Зубкова Е.К. Структурно-функциональные изменения фотосинтетического аппарата у зимневегетирующих хвойных растений в различные сезоны года//Физиология растений. 2009. Т. 56, № 5. C. 672-681.
- Мурзин И.Р., Макурина О.Н., Косицына А.А., Розенцвет О.А. Особенности действия загрязнителей различной химической природы на содержание водорастворимых белков в тканях водного погруженного растения Egeria Densa//Вестник СамГУ Естественнонаучная серия, 2010. Т. №4 (78). С. 191-199.
- Остроумов С.А. Биологические эффекты при воздействии поверхностно-активных веществ на организмы. М.: МАКС-пресс, 2001. 334 с.
- Остроумов С.А. О биотическом самоочищении водных экосистем. Элементы теории//ДАН, 2004. Т. 396. №1. С. 136 -141.
- Прохорова Н.В., Матвеев Н.М., Павловский В.А. Аккумуляция тяжелых металлов дикорастущими и культурными растениями в лесостепном и степном Поволжье. Самара: Изд-во Самар. ун-та, 1998. 131 с.
- Стайлс В. Микроэлементы в жизни растений и животных. М.: Наука, 1949. 290 с.
- Титов А.Ф., Таланова В.В., Казнина Н.М., Лайдинен Г.Ф. Устойчивость растений к тяжёлым металлам. Петрозаводск: Карельский научный центр РАН, 2007. 172 с.
- Трахтенберг И.М. Тяжелые металлы во внешней среде: Современные гигиенические и токсикологические аспекты. Минск: Наука и техника, 1994. 286 с.
- Филенко О.Ф., Михеева И.В. Основы водной токсикологии. М.: Колос, 2007. 140 с.
- Холмберг К., Йенссон Б., Кронберг Б., Линдман Б. Поверхностно-активные вещества и полимеры в водных растворах. М.: БИНОМ. Лаборатория знаний, 2007. 528 с.
- Bhattacharjee S. Reactive oxygen species and oxidative burst: Roles in stress, senescence and signal transduction in plants//Curr. Sci. 2005. Vol. 89. No. 7. P. 1113 -1121.
- Bradford M.M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding//Anal. Biochem. 1976. Vol. 72. P. 248-254.
- Dubey R.S. Metal toxicity, oxidative stress and antioxidative defense system in plants/Ed. by S. Dutta Gupta. Reactive oxygen species and antioxidants in higher plants. Enfield: Science Publishers, 2010. P. 177 -203.
- Knox J.P., Dodge, A.D. Singlet oxygen and plants//Phytochemistry. 1985. Vol. 24. P. 889-896.
- Kobayashi I., Kunoh H. et al. Effects of several nonionic and anionic surfactants on cucumber protoplasts//J. Pesticide Sci. 1990. Vol. 15. P. 71-80.
- Maresova J., Hornik M. et al. Influence of anionic surfactants on Zn2+ and Sr2+ uptake by ivy (Hedera helix L.) leaves//Nova Biotechnol. 2009. Vol. 9. No. 3. P. 333-339.
- Markwell J.P., Thornber J.P. Treatment of the thylakoid membrane with surfactants//Plant Physiol. 1982. Vol. 70. P. 633-636.
- Mohd M., Taqi A.K., Firo M. Role of nitric oxide in regulation of H2O2 mediating tolerance of plants to abiotic stress: A synergistic signaling approach//J. Stress Physiol. Biochem. 2011. Vol. 7. No. 2. P. 34 -74.
- Palma J.M., Sandalio L.M. et al. Plant proteases, protein degradation and oxidative stress: Role of peroxisomes//Plant Physiol. Biochem. 2002. Vol. 40. P. 521-530.
- Rinallo C., Bennici A., Cenni E. Effects of two surfactants on Triticum durum Desf. plantlets//Env. Exp. Bot. 1988. Vol. 28. No. 4. P. 367-374.
- Rio L.A., Puppo A. Reactive oxygen species in plant signaling/Berlin: Springer, 2009. 245 p.
- Rosen M.J., Li F., Morall S.W., Versteeg D.J. The relationship between the interfacial properties of surfactants and their toxicity to aquatic organisms//Environ. Sci. Technol. 2001. Vol. 35. No. 5. P. 954-959.
- Schützendübel A., Polle A. Plant responses to abiotic stresses: Heavy metal-induced oxidative stress and protection by mycorrhization//J. Exp. Bot. 2002. Vol. 53. No. 372. P. 1351 -1365.
- Singh P.K., Tewari R.K. Cadmium toxicity induced changes in plant water relations and oxidative metabolism of Brassica juncea L. plants//J. Environ. Biol. Vol. 24. No. 1. 2003. P. 107-112.
- Vincenzini M., Favilli F. et al. Detergents as selective inhibitors and inactivators of enzymes//Physiol. Chem. Phys. Med. 1985. Vol. 17. No. 3. P. 279-295.
- Ying G.G. Fate, behavior and effects of surfactants and their degradation products in the environment//Environ. Int. 2006. Vol. 32. No. 3. P. 417-431.
- Yang C. M., Hsu J.-C. et al. Pigment solubilization of the chloroplast thylakoid membranes by a surfactant//Bot. Bull. Acad. Sci. 1996. Vol. 37. P. 121-126.


