Динамика формирования поглощённых доз в органах и тканях лабораторных животных от альфа-излучающих радионуклидов с последовательными распадами
Бесплатный доступ
Основная сложность в оценке поглощённых доз внутреннего облучения от меченных альфа-излучающими радионуклидами препаратов заключается в учёте лучевых нагрузок от всех дочерних радионуклидов последовательного распада с альфа- и бета-превращениями. Цель работы - разработка методики расчёта накопленных к определённому моменту времени и полных поглощённых доз в органах и тканях лабораторных животных от альфа-излучающих радионуклидов с последовательными распадами в рамках метода фармакокинетического моделирования. Для апробации разработанной методики и расчёта дозиметрических характеристик был выбран меченный 225Ac препарат 225Ac-ПСМА (простатспецифический мембранный антиген), предназначенный для таргетной пептид-рецепторной радионуклидной терапии рака предстательной железы. Для идентификации необходимых параметров были использованы количественные данные о биораспределении 225Ac-ПСМА в организме мышей линии BALB/c nu/nu (nude) с имплантированной подкожно злокачественной опухолью предстательной железы 22Rv1. Расчёты показали, что значения накопленных поглощённых доз в органах и тканях монотонно возрастают от момента введения препарата в кровь, достигая своих предельных значений за промежуток времени, равный пяти эффективным периодам полувыведения препарата из соответствующего органа или ткани. Основной вклад в значения суммарных поглощённых доз дают альфа-излучающие материнский и дочерние радионуклиды. Вклад дочерних бета-излучающих радионуклидов существенно меньше, поэтому при предварительных оценках значений поглощённых доз их можно не учитывать. Выявлено, что 225Ас-ПСМА, обладая высоким клиренсом, быстро выводится из крови преимущественно почками. При этом, суммарная поглощённая доза в опухолевой ткани предстательной железы превышает в несколько раз суммарные поглощённые дозы в других органах и тканях, кроме печени и почек. Полученные результаты свидетельствуют о перспективности дальнейших исследований 225Ac-ПСМА и возможности его клинического применения для радионуклидной терапии рака предстательной железы.
Дозиметрия, актиний-225, радиофармпрепарат, радионуклид, камерное моделирование, ядерная медицина, поглощённая доза, радиоактивность, радиобиология
Короткий адрес: https://sciup.org/170209567
IDR: 170209567 | УДК: 539.164:546.797.02.225]-092.9 | DOI: 10.21870/0131-3878-2025-34-2-81-93
Текст научной статьи Динамика формирования поглощённых доз в органах и тканях лабораторных животных от альфа-излучающих радионуклидов с последовательными распадами
Разработка и доклиническое исследование перспективных терапевтических радиофармацевтических лекарственных препаратов (РФЛП), меченных альфа-излучающими радионуклидами, в настоящее время является весьма актуальным направлением в отечественной ядерной медицине [1, 2]. Такие РФЛП находят широкое применение для лечения злокачественных опухолей и их метастазов [3, 4]. Испускаемые альфа-частицы имеют высокую линейную передачу энергии и короткий пробег в мягких тканях (до 100 мкм), что способствует эффективности лечения небольших поражений и метастазов, а также обеспечивает низкую лучевую нагрузку на здоровые органы и ткани [5]. Это их несомненное преимущество перед бета-излучающими РФЛП.
В настоящее время альфа-излучающий радионуклид 223Ra в составе препарата 223RaCl 3 уже используется в клинике для лечения пациентов с кастрационно-резистентным раком пред-
стательной железы со множественными метастазами в кости без висцеральных метастазов [5]. Другие перспективные альфа-излучающие радионуклиды, такие как 224Ra, 225Ac, 213Bi, 227Th, изучаются в доклинических и клинических исследованиях в составе разных РФЛП [6]. Именно они являются наиболее подходящими для радионуклидной терапии опухолей и метастазов по ядерно-физическим характеристикам [7]. Эти радионуклиды порождают несколько последовательных распадов (альфа- и бета-распады) до образования стабильного изотопа. Внутри организма передача энергии биологическим тканям обеспечивается взаимодействием с ними не только альфа-частиц, но и ядер отдачи, электронов и гамма-квантов. При этом доза облучения за счёт альфа-частиц существенно превышает дозу за счёт всех остальных. Заметный вклад во внутреннее облучение также могут давать электроны и ядра отдачи [8]. Наряду с альфа-частицами их пробеги в биологической ткани не превышают нескольких мм, т.е. выделение энергии происходит лишь в ближайшей окрестности меченной радионуклидом молекулы.
В нашей стране второе место по количеству исследований после 223Ra в последние годы занимает 225Ac. Ядерно-физические характеристики 225Ac и всех его дочерних радионуклидов приведены в работе [8]. Меченные им РФЛП (225Аc-атезолизумаб, 225Аc-ПСMA) показали свою эффективность при лечении онкологических заболеваний и в настоящее время изучаются в доклинических и клинических исследованиях [9, 10]. Кроме того, использование 225Ac, конъюгированного с антителами или носителем, является многообещающим методом лечения многих видов рака (предстательной железы, молочной железы, яичников, мочевого пузыря, поджелудочной железы, лёгких и др.) [11].
В единичных работах представлены экспериментальные данные о биораспределении меченных 225Аc РФЛП у лабораторных животных и человека, полученные в рамках доклинических и клинических исследований [12]. Например, целью проведённых экспериментов в работе [13] было создание моделей рака предстательной железы для изучения эффективности лечения 225Аc-ПСМА-617 метастазов при разных стадиях заболевания. В работе [14] представлены результаты оценки биораспределения 225Ac-DOTA-anti-PD-L1-BC у мышей с введёнными подкожно клетками рака молочной железы.
Ещё меньше работ посвящено расчёту поглощённых доз от меченных 225Аc РФЛП и его дочерних радионуклидов в организмах животных и человека. Например, в работе [15] были рассчитаны поглощённые дозы от 225Ac-ПСМА-617 в органах и тканях пациентов на основании кривых изменения активности от времени, которые были получены в серии сканирований пациентов с введённым 177Lu-ПСМА-617 c экстраполяцией на физический период полураспада 225Ac, предполагая при этом мгновенный распад дочерних радионуклидов. В работе [8] на основе экспериментальных данных о биораспределении 225Ac-КОЭДФ (монокалиевая соль гидроксиэтилидендифосфоновой кислоты) получены оценки полных доз внутреннего облучения некоторых органов и тканей лабораторных мышей методом Монте-Карло с помощью программы MCNP-4C [16], рассчитаны вклады в полные дозы облучения всех дочерних радионуклидов 225Ac и сделаны выводы относительно вкладов альфа- и бета-частиц, гамма-квантов и ядер отдачи в полные поглощённые дозы. Однако оценки накопленных к определённому моменту времени поглощённых доз от альфа-излучающих радионуклидов с последовательными распадами и их динамика в органах и тканях в этих работах отсутствуют.
Немаловажную роль в расчёте фармакокинетических и дозиметрических характеристик РФЛП имеет метод фармакокинетического моделирования [17]. Камерное моделирование кине- тики РФЛП в организме экспериментальных животных позволяет количественно описать течение процесса in vivo, математически рассчитать скорости перехода РФЛП между органами и тканями (камерами модели), а также зависимые от них фармакокинетические и дозиметрические характеристики [17]. Кроме того, метод камерных моделей и построения экспоненциальных функций камерного накопления-выведения даёт естественную возможность строить индивидуальные модели кинетики РФЛП в критических органах и патологических очагах и, тем самым, обеспечить более адекватную оценку уровней их внутреннего радиационного облучения, чем применение стандартных методик из рекомендаций Международной комиссии по радиологической защите (см. [12] и ссылки в ней).
В предыдущей нашей работе [18] в рамках метода фармакокинетического моделирования была предложена методика расчёта накопленных к определённому моменту времени и полных поглощённых доз в крови лабораторных животных от альфа-излучающих радионуклидов на примере 225Ac. Данная методика была апробирована на двух препаратах, 225Ac-хлорид и 225Ac-КОЭДФ, вводимых внутривенно в хвостовую вену мышей. Были рассчитаны дозиметрические характеристики и проанализирована динамика формирования поглощённых доз в крови животных от альфа-излучающих радионуклидов. Однако расчёты аналогичных поглощённых доз в органах и тканях мышей не проводились, а в дальнейшем планировалось обобщение данной методики и её применение для расчёта дозиметрических характеристик во всех органах и тканях лабораторных животных. Таким образом, цель данной работы заключалась в разработке методики расчёта накопленных к определённому моменту времени и полных поглощённых доз в органах и тканях лабораторных животных от альфа-излучающих радионуклидов с последовательными распадами в рамках метода фармакокинетического моделирования.
Материалы и методы
Объектом исследования являлся препарат 225Ac-ДОТА-ПСМА, предназначенный для тар-гетной пептид-рецепторной радионуклидной терапии рака предстательной железы. Раствор данного соединения получали непосредственно перед проведением биологических испытаний. Эксперименты по исследованию фармакокинетических характеристик проводились на мышах линии BALB/c nu/nu (nude) с имплантированной подкожно злокачественной опухолью предстательной железы 22Rv1. Масса тела лабораторных мышей составляла 27±2 г. Введение РФЛП осуществлялось внутривенно (в хвостовую вену) по 185 кБк (5 мкКи) каждой мыши. Через определённые интервалы времени (5 мин, 1, 3 ч, 1, 2, 7, 10 сут) по четыре животных в каждый срок забивали под наркозом декапитацией, выделяли пробы органов и тканей, помещали в пластиковые пробирки, взвешивали на электронных весах «Sartorius» (Германия) и проводили радиометрию с помощью автоматического гамма-счётчика «Wizard» версии 2480 фирмы «PerkinElmer/Wallac» (Финляндия).
Регистрацию активности в выделенных органах и тканях животного проводили по линии гамма-излучения 218 кэВ, соответствующей излучению дочернего изотопа 221Fr, считая, что его концентрация равна концентрации 225Ac. При этом предполагали, что за время распада 221Fr (4,8 мин) этот изотоп не выходит за пределы органа. По данным радиометрии на каждый срок наблюдения рассчитывали удельную активность на 1 г органа (ткани) в процентах от введённого количества. Затем определяли среднее значение удельной активности в органе или ткани и среднеквадратичное отклонение от среднего.
Методика расчёта поглощённых доз в органах и тканях. Альфа-излучающий материнский нуклид, используемый в составе терапевтических РФЛП, в результате последовательных распадов может порождать до десяти дочерних радионуклидов. Радионуклид 225Ac образует следующую цепочку последовательных распадов:
-
225Ac → 221Fr + α → 217At + α → 213Bi + α → 213Po + β- → 209Pb + α → 209Bi + β-. (1)
При этом, в формуле (1) показаны только преобладающие типы распадов (с вероятностью близкой к 100%). Характеристики всех радионуклидов приведены в работе [8].
Накопленные и полные поглощённые дозы в органах и тканях организма в рамках камерного моделирования можно рассчитать с использованием полученных на основе экспериментальных данных фармакокинетических кривых «Активность-время» [18]. Для радионуклида с последовательным распадом доза внутреннего облучения к моменту времени t от начала введения РФЛП будет определяться как сумма доз от каждого радионуклида (материнского и всех дочерних):
D(t) = E "= 1Di(t) , (2)
где n – количество последовательных распадов материнского радионуклида до стабильного изотопа.
В свою очередь, накопленная к моменту времени t поглощённая доза от i -го радионуклида определяется через площадь AUC i под кривой «Активность-время»:
-
0 , (1-) = XA0^AUCi(f) , AUCt(t) = ^(fidr , (3)
где A o - вводимая в кровь начальная активность РФЛП; E i /m - энергии, выделяемые всеми излучениями, испускаемыми при распаде i -го радионуклида, на единицу массы крови; χ – коэффициент пропорциональности; F i – кривая «Активность-время» для i -го радионуклида.
В рамках камерного моделирования фармакокинетическая кривая «Активность-время» в органе или ткани (камере) может быть представлена в виде:
F(t)=f(t)^ , A0
где A ( t ) – временная зависимость активности радионуклида (материнского или дочернего); f( t ) - временная зависимость концентрации радионуклида, или фармакокинетическая кривая.
При доклинических исследованиях, когда не требуется достижения повышенной точности расчётов фармакокинетических и дозиметрических характеристик РФЛП, фармакокинетические кривые достаточно выразить через одну экспоненту для камеры крови (учитывает процесс выведения РФЛП) и через комбинацию двух экспонент для остальных камер (учитывают процессы накопления и выведения РФЛП) [19]:
-
f o (t) = C o exp(-K o t) , f j (t) = Cj-^0^ (exp( - K jo t) — exp( - K ofi) , (5)
где С о - начальная концентрация и K о - константа скорости выведения радионуклида из камеры крови; C j - максимальная концентрация и K о j , K j о - константы скорости накопления, выведения радионуклида для j -й камеры (органа), идентифицируемые на основе экспериментальных данных фармакокинетики конкретного РФЛП.
Методики расчёта активностей материнского и всех дочерних радионуклидов последовательного распада, а также основных фармакокинетических параметров РФЛП, необходимых для расчёта поглощённых доз, приведены в наших работах [18, 19].
Полные поглощённые дозы для всех радионуклидов последовательного распада получаются из формул (2) и (3) при t → ∞.
Результаты и обсуждение
Экспериментальные значения концентрации 225Ас-ДОТА-ПСМА в органах и тканях мышей линии BALB/c nu/nu (nude) с раком предстательной железы 22Rv1 в различные сроки после внутривенного введения РФЛП представлены в табл. 1. В каждой ячейке приведены средние значе- ния концентрации и среднеквадратичное отклонение от среднего.
Таблица 1
Концентрация 225Ас-ДОТА-ПСМА в организме мышей (в % на 1 г органа или ткани)
|
№ |
Наименование органа, ткани |
Время после введения препарата |
||||||
|
5 мин |
1 ч |
3 ч |
24 ч |
48 ч |
7 сут |
10 сут |
||
|
1 |
Кровь |
3,943±0,355 |
0,325±0,034 |
0,172±0,042 |
0,075±0,009 |
0,047±0,009 |
0,015±0,015 |
0,003±0,001 |
|
2 |
Головной мозг |
0,104±0,015 |
0,066±0,011 |
0,042±0,002 |
0,039±0,01 |
0,033±0,004 |
0,017±0,010 |
0,002±0,001 |
|
3 |
Лёгкие |
2,111±0,396 |
0,231±0,023 |
0,347±0,038 |
0,189±0,072 |
0,110±0,016 |
0,093±0,018 |
0,066±0,012 |
|
4 |
Печень |
1,373±0,066 |
3,422±0,493 |
5,896±0,814 |
3,477±0,359 |
3,339±0,189 |
2,859±0,026 |
1,298±0,068 |
|
5 |
Почки |
9,885±0,363 |
5,598±0,727 |
4,684±1,526 |
1,545±0,275 |
1,178±0,207 |
0,409±0,109 |
0,193±0,040 |
|
6 |
Сердце |
1,699±0,113 |
1,157±0,099 |
1,313±0,075 |
0,523±0,07 |
0,278±0,035 |
0,099±0,019 |
0,005±0,001 |
|
7 |
Селезёнка |
0,717±0,081 |
0,275±0,044 |
0,219±0,031 |
0,197±0,049 |
0,182±0,053 |
0,142±0,025 |
0,090±0,025 |
|
8 |
Желудок б/сод |
1,219±0,036 |
0,205±0,022 |
0,704±0,017 |
0,327±0,044 |
0,18±0,052 |
0,126±0,021 |
0,056±0,008 |
|
9 |
Кишечник б/сод |
0,927±0,017 |
0,360±0,048 |
0,299±0,031 |
0,19±0,015 |
0,14±0,023 |
0,098±0,015 |
0,034±0,034 |
|
10 |
Мышца бедра |
0,453±0,165 |
0,225±0,025 |
0,131±0,018 |
0,126±0,019 |
0,100±0,012 |
0,070±0,006 |
0,028±0,008 |
|
11 |
Опухоль |
4,450±0,894 |
2,225±0,109 |
1,294±0,108 |
1,040±0,065 |
0,802±0,094 |
0,616±0,021 |
0,387±0,074 |
|
12 |
Кость бедра |
1,821±0,112 |
1,189±0,183 |
1,222±0,066 |
0,711±0,137 |
0,670±0,122 |
0,388±0,048 |
0,248±0,056 |
|
13 |
Кожа |
2,833±0,137 |
1,323±0,148 |
0,643±0,109 |
0,172±0,049 |
0,164±0,022 |
0,084±0,016 |
0,080±0,012 |
|
14 |
Щитовидная железа |
4,436±0,710 |
1,597±0,288 |
1,930±0,127 |
0,628±0,098 |
0,305±0,066 |
0,259±0,022 |
0,091±0,046 |
|
15 |
Предстательная железа |
1,104±0,302 |
0,723±0,076 |
0,436±0,023 |
0,175±0,027 |
0,158±0,033 |
0,117±0,028 |
0,062±0,003 |
Для осуществления расчётов фармакокинетических параметров и поглощённых доз по формулам (2-5) нами была разработана и написана авторская программа на языке программирования С++. Идентификация параметров C 0 , C j , K 0 , K 0 j и K j 0 в формуле (5) проводилась с использованием метода наименьших квадратов [19].
В табл. 2 представлены рассчитанные во всех камерах (органах и тканях, см. табл. 1) транспортные константы накопления и выведения и основные фармакокинетические параметры исследуемого РФЛП (идентифицированные максимальные концентрации C 0 , C j и времена их достижения t max , биологические и эффективные периоды полувыведения [19]). Данные величины использовались далее для расчёта накопленных и полных поглощённых доз в органах и тканях лабораторных животных.
Анализ результатов расчёта характеристик, представленных в табл. 1, показал, что после внутривенного введения происходит максимально быстрая миграция исследуемого РФЛП из крови в периферические камеры (органы и ткани). В то время, как биологическое выведение РФЛП из всех камер происходит значительно медленнее, рассчитанные константы выведения в 200-10000 (!) раз меньше констант накопления. При этом, константы накопления оценивались по одному-двум экспериментальным значениям концентрации активности РФЛП в соответствующих камерах, тогда как константы выведения – по шести-семи значениям. Поэтому точность, с которой были рассчитаны транспортные константы, тоже существенно отличается. В табл. 1 для транспортных констант накопления указаны приближённые значения. Они одинаковы для всех органов, кроме печени.
Таблица 2
Фармакокинетические характеристики 225Ас-ДОТА-ПСМА в организме мышей BALB/c nu/nu (nude) с перевитой подкожно карциномой предстательной железы 22Rv1
|
Ткань, орган |
t max |
C j , %/г |
Биологические константы скорости, ч-1 |
Периоды полувыведения, ч |
||
|
накопления |
выведения |
биологические |
эффективные |
|||
|
Кровь |
- |
0,39 |
- |
0,021 |
33,0 |
29,0 |
|
Головной мозг |
5 мин |
0,067 |
55,5 |
0,013 |
53,4 |
43,7 |
|
Лёгкие |
5 мин |
0,39 |
55,5 |
0,009 |
77,1 |
58,4 |
|
Печень |
3 ч |
4,76 |
1,54 |
0,005 |
141,6 |
89,1 |
|
Почки |
5 мин |
4,40 |
55,5 |
0,014 |
49,6 |
41,1 |
|
Сердце |
5 мин |
1,23 |
55,5 |
0,021 |
33,1 |
29,1 |
|
Селезёнка |
5 мин |
0,31 |
55,5 |
0,005 |
138,7 |
87,9 |
|
Желудок |
5 мин |
0,48 |
55,5 |
0,009 |
77,1 |
58,4 |
|
Кишечник |
5 мин |
0,37 |
55,5 |
0,010 |
69,4 |
53,8 |
|
Мышца бедра |
5 мин |
0,21 |
55,5 |
0,008 |
86,7 |
63,7 |
|
Опухоль |
5 мин |
1,85 |
55,5 |
0,007 |
99,1 |
70,1 |
|
Кость бедра |
5 мин |
1,19 |
55,5 |
0,007 |
99,1 |
70,1 |
|
Кожа |
5 мин |
0,80 |
55,5 |
0,012 |
57,8 |
46,6 |
|
Щитовидная железа |
5 мин |
1,60 |
55,5 |
0,013 |
53,4 |
43,7 |
|
Предстательная железа |
5 мин |
0,50 |
55,5 |
0,009 |
77,1 |
58,4 |
С использованием значений начальной концентрации и константы выведения РФЛП для камеры крови (табл. 1) можно рассчитать эффективные значения клиренса крови Cl и кажущегося объёма распределения V d по формулам, приведённым в нашей работе [19]. Для 225Ас-ДОТА-ПСМА Cl =6,15 мл/ч и V d =256 мл. Большие значения кажущегося объёма распределения по сравнению с общим объёмом крови мышей (примерно 3 мл) указывают на депонирование РФЛП в органах и тканях. В работе [18] также приведены значения клиренса и объёма для свободного 225Ac, вводимого в организм мышей в форме хлорида 225АсCl 3 : Cl =1,22 мл/ч и V d =102 мл. Сопоставление этих значений со значениями клиренса крови и объёма распределения для 225Ас-ДОТА-ПСМА позволяет сделать следующий вывод. 225Ас-ДОТА-ПСМА быстрее выводится из крови (клиренс крови примерно в 5 раз больше) и лучше депонируется в органах и тканях (кажущийся объём распределения в 2,5 раза больше) по сравнению со свободным 225Ac. При этом более высокое значение клиренса крови для 225Ас-ДОТА-ПСМА обусловливает меньшие лучевые нагрузки на кровеносную систему в связи с уменьшением активности РФЛП, что также является преимуществом 225Ас-ДОТА-ПСМА in vivo . А сопоставление рассчитанных значений констант выведения для почек и печени (табл. 1) позволяет сделать вывод о том, что 225Ас-ДОТА-ПСМА выводится из организма преимущественно почками (скорость выведения примерно в 3 раза больше).
Относительно периодов полувыведения (биологических и эффективных) наблюдается обратная закономерность. Чем больше значение периода полувыведения, тем меньше значение константы выведения РФЛП из камеры. Рассчитанные значения биологических периодов полувыведения для 225Ас-ДОТА-ПСМА лежат в пределах 33,0-141,6 ч, что указывает на разные скорости выведения данного РФЛП из органов и тканей. Медленнее всего этот препарат выводится из печени, селезёнки, кости бедра и опухоли. Значения эффективных периодов полувыведения отражают элиминацию РФЛП с учётом радиоактивного распада 225Ас (период полураспада 240 ч). При этом, как было показано ранее в нашей работе [19], рассчитанные значения эффективных периодов полувыведения РФЛП совпадают со значениями времён (периодов) половинного накопления полной поглощённой дозы для всех органов и тканей (время, за которое достигается ½ от значения полной поглощённой дозы).
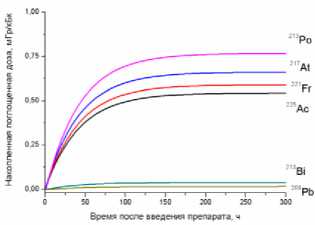
1) кровь
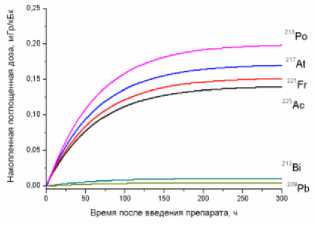
2) головной мозг
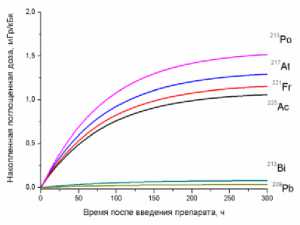
3) лёгкие
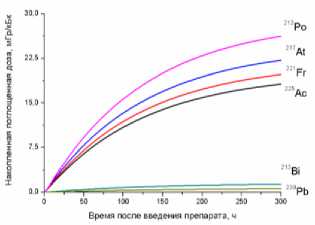
4) печень
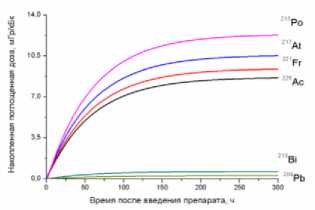
5) почки
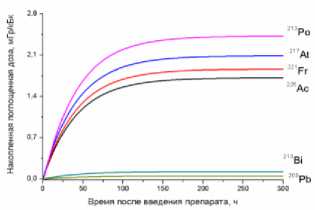
6) сердце
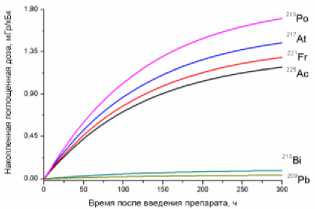
7) селезёнка
8) желудок
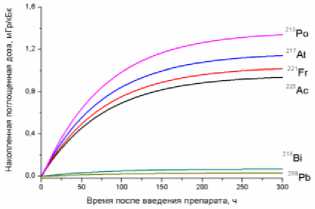
9) кишечник
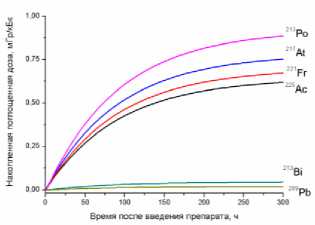
10) мышца бедра
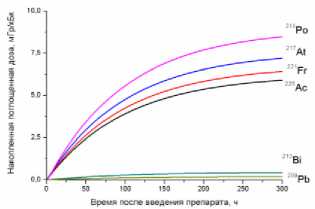
11) опухоль
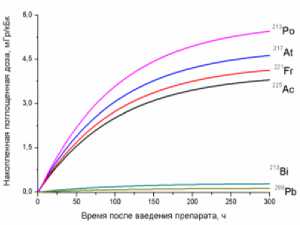
12) кость бедра
13) кожа
"я ' 1WOI ' 1150I ' 200 ' 25o"
Время после введения препарата ч
15) предстательная железа
-
14) щитовидная железа
Рис. 1. Накопленные поглощённые дозы в органах и тканях от 225Ас-ДОТА-ПСМА, рассчитанные для всех радионуклидов последовательного распада 225Ac.
На рис. 1 приведена динамика формирования поглощённых доз в органах и тканях мышей для 225Ас-ДОТА-ПСМА. Нумерация графиков соответствует порядку перечисления органов и тканей в табл. 1 и 2. Значения накопленных поглощённых доз рассчитывались для всех радионук- лидов последовательного распада 225Ac (1) с использованием формул (2-5). При этом, было сделано предположение о схожей фармакокинетике всех радионуклидов цепи распада 225Ac в организме лабораторных животных.
Как видно из рис. 1, рассчитанные значения накопленных поглощённых доз монотонно возрастают от момента введения РФЛП в кровь, достигая своих предельных значений, равных полным поглощённым дозам за определённый промежуток времени t D . Причём величина t D для конкретного органа или ткани зависит от значения эффективного периода полувыведения T eff 225Ас-ДОТА-ПСМА из этого органа (табл. 1). Как показали наши расчёты, предельное значение поглощённой дозы в органе достигается примерно за промежуток времени, равный пяти эффективным периодам полувыведения, т.е. t D ≈5 T eff . Например, для крови нами получено самое маленькое значение T eff =29,0 ч и предельное значение поглощённой дозы в крови достигается за меньший промежуток времени t D ≈145 ч, чем в других органах. Напротив, для печени получено самое большое значение T eff =89,1 ч и t D ≈445,5 ч.
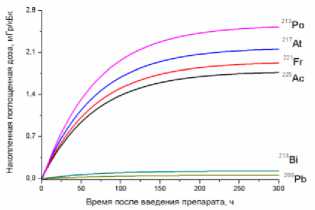
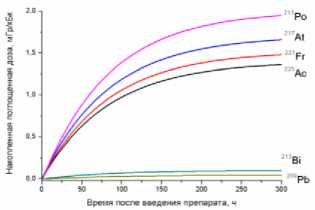
Наибольший вклад в значения суммарных поглощённых доз (от всех радионуклидов последовательного распада 225Ac) дают альфа-излучающие радионуклиды: 213Po, 217At, 221Fr, 225Ac (перечислены в порядке убывания). Вклад бета-излучающих радионуклидов (213Bi, 209Pb) существенно меньше, поэтому при предварительных оценках значений суммарных поглощённых доз от альфа-излучающего РФЛП их можно не учитывать.
Таблица 3 Значения полных поглощённых доз (мГр/кБк) от всех радионуклидов последовательного распада 225Ас-ДОТА-ПСМА в организме мышей BALB/c nu/nu (nude) с перевитой подкожно карциномой предстательной железы 22Rv1
|
Ткань, орган |
225Ac |
221Fr |
217 At |
213 Bi |
213 Po |
209 Pb |
Суммарная доза |
|
Кровь |
0,544 |
0,590 |
0,661 |
0,039 |
0,767 |
0,017 |
2,618 |
|
Головной мозг |
0,141 |
0,153 |
0,171 |
0,010 |
0,200 |
0,004 |
0,679 |
|
Лёгкие |
1,093 |
1,188 |
1,332 |
0,080 |
1,565 |
0,035 |
5,293 |
|
Печень |
20,057 |
21,828 |
24,461 |
1,489 |
28,955 |
0,669 |
97,459 |
|
Почки |
8,682 |
9,434 |
10,573 |
0,636 |
12,360 |
0,274 |
41,959 |
|
Сердце |
1,716 |
1,864 |
2,088 |
0,125 |
2,423 |
0,052 |
8,268 |
|
Селезёнка |
1,309 |
1,423 |
1,595 |
0,097 |
1,883 |
0,043 |
6,350 |
|
Желудок |
1,345 |
1,462 |
1,639 |
0,099 |
1,926 |
0,044 |
6,515 |
|
Кишечник |
0,957 |
1,040 |
1,165 |
0,070 |
1,368 |
0,031 |
4,631 |
|
Мышца бедра |
0,642 |
0,699 |
0,783 |
0,047 |
0,921 |
0,021 |
3,113 |
|
Опухоль |
6,232 |
6,776 |
7,594 |
0,460 |
8,945 |
0,205 |
30,212 |
|
Кость бедра |
4,009 |
4,359 |
4,885 |
0,296 |
5,754 |
0,132 |
19,435 |
|
Кожа |
1,791 |
1,946 |
2,181 |
0,131 |
2,555 |
0,057 |
8,661 |
|
Щитовидная железа |
3,356 |
3,647 |
4,087 |
0,246 |
4,783 |
0,107 |
16,226 |
|
Предстательная железа |
1,401 |
1,523 |
1,707 |
0,103 |
2,006 |
0,045 |
6,785 |
В табл. 3 приведены рассчитанные значения полных поглощённых доз (при t →∞ от момента введения препарата) в органах и тканях мышей для 225Ас-ДОТА-ПСМА. Суммарная поглощённая доза в опухолевой ткани предстательной железы (30,212 мГр/кБк) превышает в несколько раз суммарные поглощённые дозы в других органах и тканях, кроме печени и почек. И, следовательно, препарат 225Ас-ДОТА-ПСМА может быть перспективным для радионуклидной терапии рака предстательной железы. Критическими органами являются почки (41,959 мГр/кБк), через которые преимущественно элиминируется данный РФЛП из организма, и печень (97,459 мГр/кБк). Наименьшие значения суммарных поглощённых доз были получены для крови (2,618 мГр/кБк) и головного мозга (0,679 мГр/кБк). Наибольший вклад в суммарную поглощённую дозу даёт 213Po (средняя энергия альфа-частиц составляет 8,38 Мэв [8]), наименьший – 209Pb (средняя энергия бета-частиц составляет 0,198 Мэв [8]).
Заключение
В рамках метода камерного моделирования разработана методика расчёта накопленных к определённому моменту времени и полных поглощённых доз в органах и тканях лабораторных животных от альфа-излучающих радионуклидов с последовательными распадами. Расчёты данных поглощённых доз в органах и тканях мышей линии BALB/c nu/nu (nude) с раком предстательной железы 22Rv1 для 225Ас-ДОТА-ПСМА показали следующее:
-
1. Значения накопленных поглощённых доз в органах и тканях монотонно возрастают от момента введения РФЛП в кровь, достигая своих предельных значений (полных поглощённых доз) за промежуток времени, равный примерно пяти эффективным периодам полувыведения РФЛП из соответствующего органа или ткани.
-
2. Введённый в кровь препарат 225Ас-ДОТА-ПСМА быстро депонируется в органах и тканях, т.к. имеет большое значение кажущегося объёма распределения в организме. При этом, обладая высоким клиренсом (примерно в пять раз больше, чем у свободного 225Ас3+), 225Ас-ДОТА-ПСМА быстро выводится из крови (преимущественно почками), что обуславливает низкие лучевые нагрузки на кровь при использовании этого препарата. Медленнее всего 225Ас-ДОТА-ПСМА выводится из печени, селезёнки, кости бедра и опухолевой ткани.
-
3. Основной вклад в значения суммарных поглощённых доз (от всех радионуклидов последовательного распада 225Ac) дают альфа-излучающие радионуклиды: 213Po, 217At, 221Fr, 225Ac (перечислены в порядке убывания вклада в поглощённую дозу). Вклад дочерних бета-излучающих радионуклидов (213Bi, 209Pb) существенно меньше, поэтому при предварительных оценках значений суммарных поглощённых доз от альфа-излучающего РФЛП их можно не учитывать.
-
4. Суммарная поглощённая доза в опухолевой ткани предстательной железы превышает в несколько раз суммарные поглощённые дозы в других органах и тканях, кроме печени и почек. Следовательно, препарат 225Ас-ДОТА-ПСМА может быть перспективным для радионуклидной терапии рака предстательной железы. Критическими органами при этом являются почки и печень, в которых суммарная поглощённая доза в 2-3 раза превышает значение в опухолевой ткани.


