Динамика изменений тумор-ассоциированных макрофагов у пациентов с первичной меланомой кожи в зависимости от способа хирургического лечения
Автор: Яргунин С. А., Решетов И. В., Шойхет Я. Н., Пятаков С. Н.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования
Статья в выпуске: 2 т.13, 2023 года.
Бесплатный доступ
Актуальность: Несмотря на кажущийся радикальный характер оперативных вмешательств у пациентов с первичной меланомой кожи, частота локорегионарного рецидивирования и метастазирования остается высокой. Малоизученным является вопрос о влиянии хирургического лечения на эволюцию микроокружения меланомы.Цель: оценить влияние динамики поляризации в тумор-ассоциированных макрофагах у пациентов в первичных меланомах кожи 0-IIa стадий и в последующих метастатических поражениях при использовании различных способов устранения операционного дефекта на выживаемость больных с меланомой кожи.Материалы и методы: проводилось исследование Post-Hoc, в котором использованы данные о 128 пациентах с меланомой кожи 0-IIa стадий, которые не были подвергнуты адъювантной терапии после оперативного вмешательства, рандомизированных на 2 группы: основную (с применением пластического закрытия послеоперационного дефекта тканей) и группу сравнения (с линейным ушиванием дефекта тканей). Разделение на группы производилось на основании добровольного информированного согласия пациента на выполнение того или иного типа оперативного вмешательства. Исследована динамика рецепторов макрофагов с коллагеновой структурой CD68 и CD163 в образцах тканей у пациентов с первичной МК и в метастазах у прогрессирующей категории пациентов. Изучена 5-летняя выживаемость без прогрессирования и общая выживаемость пациентов.Результаты: выявлено, что у пациентов с первичной меланомой кожи 0-IIa стадий пластическое замещение дефекта тканей, по сравнению с обычным ушиванием может приводить к уменьшению плотности в интрастромальном распространении провоспалительных макрофагов CD68 операционного очага, а также менее частой поляризации ТАМ-клеток в М2 сторону и миграции в интрастромальный компонент опухоли, более частому смешанному их содержанию, что в итоге улучшает выживаемость у данной категории пациентов.Выводы: пластический способ закрытия операционного дефекта у пациентов с первичной меланомой кожи 0-IIa стадий может влиять на поляризацию ТАМ-клеток. Пластическое замещение дефекта тканей после удаления опухоли позволяет улучшить пятилетние результаты выживаемости (выживаемости без прогрессирования на 22,6% (р = 0,003) и общей выживаемости на 13,1% (р = 0,029).
Меланома кожи, хирургическое лечение, пластическое замещение дефекта тканей, микроокружение опухоли, выживаемость без прогрессирования, общая выживаемость
Короткий адрес: https://sciup.org/140300124
IDR: 140300124 | DOI: 10.18027/2224-5057-2023-13-2-2
Текст научной статьи Динамика изменений тумор-ассоциированных макрофагов у пациентов с первичной меланомой кожи в зависимости от способа хирургического лечения
Хирургическое вмешательство неизбежно является по своей сути повреждением тканей, естественной реакцией организма на которое будет воспаление, сопровожда- ющееся лимфангиогенезом и являющееся необходимым этапом заживления [1]. В последнее время большой интерес уделяется микроокружению первичной меланомы кожи [2], представляющему собой многокомпонентную и сложную сеть взаимодействий [3]. Множество клеток, окружающих новообразование (например, иммунные клетки, связанные с опухолью фибробласты (CAFs), жировая ткань и керати-ноциты), а также внеклеточный матрикс, могут взаимодействовать друг с другом напрямую или через секретируемые молекулы, способны усиливать или ослаблять иммуносупрессивные условия опухолевого окружения меланомы и, таким образом, влиять на эффективность лечения [3].
Тумор-ассоциированные макрофаги (ТАМ) являются частью микроокружения при многих видах опухолей [4]. Повышенное количество ТАМ в микроокружении опухоли часто коррелирует с плохим прогнозом при меланоме кожи (МК) [5]. Кроме того, увеличение количества ТАМ при воспалительной инфильтрации может быть надежным прогностическим маркером [6]. ТАМ включают иммуногенные и иммуносупрессивные подтипы и обладают различными функциями в зависимости от их микроанатомической локализации [2]. ТАМ присутствуют внутри опухоли или в перитуморальной области [7]. Инфильтрация ТАМ напрямую коррелирует с повышенным ангиогенезом, плотностью микрососудов посредством модуляции опухолевых провоспалительных факторов [8]. TAM снижают восприимчивость клеток меланомы к апоптозу, индуцированному ингибиторами МЕК, α- и MITF-зависимым способом [9]. ТАМ часто делят на два основных типа [4]. Провоспалительные макрофаги М1 участвуют в стадиях инициации опухоли, создавая мутагенную микросреду, например, производя свободные радикалы [10]. На более поздних стадиях рака ТАМ часто дифференцируются в противовоспалительные макрофаги М2, которые усиливают рост опухоли, создавая иммуносупрессивную среду [4]. Макрофаги M2 играют центральную роль в распространении опухоли, стимулируя развитие опухоли как в первичных, так и в метастатических участках благодаря их вкладу в разрушение и отложение базальной мембраны, ангиогенез, рекрутирование лейкоцитов и общее подавление иммунитета [11]. В зависимости от сигналов микроокружения, макрофаг, независимо от состояния поляризации, сохраняет способность к пластичности, включая способность переключаться между фенотипами [12].
Фибробласты, ассоциированные с меланомой, подавляют активность цитотоксических Т-лимфоцитов и влияют на передачу сигналов T-клеток через истощение L-аргинина [13]. Кроме того, они снижают восприимчивость опухолевых клеток к NK-опосредованному лизису путем секреции активных MMPs, которые уменьшают количество лигандов NKG2D на поверхности опухолевых клеток и, таким образом, снижают NKG2D-зависимую цитотоксическую активность NK-клеток [14].
Одним из внеклеточных факторов, влияющих на иммунный ответ на раковые клетки, является подкисление [15]. Более низкий рН (6,0–7,0) характерен для меланомы, которая проявляет повышенную гликолитическую активность и высокую воспалительную сигнатуру [15]. Большинство опубликованных данных указывают на иммуносупрессивную роль ацидоза, который также способствует более «мигрирующему» фенотипу клеток меланомы [16].
На первых стадиях развития опухоли иммунные клетки выполняют свою надлежащую функцию в виде противо- опухолевого действия путем индукции апоптоза трансформированных клеток, выработки противоопухолевых цитокинов или цитотоксических реакций [17]. Рост опухоли и метастазов меланомы определяется сложным перекрестным взаимодействием между опухолевыми клетками и окружающей микросредой посредством секреции онкогенных медиаторов [8].
Наличие в лимфоидном инфильтрате большого количества воспалительных клеток, стимулирующих неоангиогенез, является неблагоприятным прогностическим фактором, может вызвать рост опухоли и способствовать увеличению инвазивности и агрессивности в ходе опухолевого процесса [18]. При длительном воспалении возникает недостаточность как острого, так и хронического иммунного ответа [19]. К этому могут приводить такие процессы, как рубцевание [20] и лимфатическая недостаточность, как результат рубцевания лимфатических сосудов после операции [21]. При усилении жесткости кожа создает напряжение для дермальных фибробластов, способствует их чрезмерной активации и приводит к усилению генерации коллагена и фибронектина [22], что снова приводит к усилению жесткости кожи [23], появляется устойчивая петля положительной обратной связи, а окружающая среда гипоксии в жесткой коже может индуцировать дальнейший ангиогенез, который способствует пролиферации клеток, тем самым создавая большую потребность в кислороде [24]. Воспалительные состояния могут индуцировать пластичность меланомы в сторону более «мигрирующего» фенотипа и способствовать миграции клеток меланомы вдоль внешней поверхности кровеносных сосудов и их периваскулярной инвазии [25]. Макрофаги переносят цитоплазматические молекулы в клетки меланомы или сливаются с ними, что приводит к усилению диссеминации клеток меланомы in vivo [26]. Дифференцировка ТАМ-клеток в сторону М2 опосредуется гипоксией и различными сигнальными молекулами, продуцируемыми опухолевыми и стромальными клетками [8]. Продолжительное воспаление ведет к повышенной плотности лимфатических сосудов, расширению и гиперплазии лимфатической сосудистой сети [27], увеличению лимфоотока [28] и метастазированию в регионарные лимфатические узлы [29], что коррелируют с худшей выживаемостью [30].
Таким образом, можно предположить, что в процессе первичного оперативного вмешательства при создании благоприятных условий заживления операционной раны (со снижением длительного подкисления и грубого рубцевания) возможно улучшить результаты выживаемости пациентов с МК.
МАТЕРИАЛЫ И МЕТОДЫ
Исследована динамика изменений в ТАМ (рецепторы макрофагов с коллагеновой структурой CD68 и CD163, которые участвуют в регуляции опухолевого иммунитета и экспрессируются на макрофагах) у пациентов с первич-
ДИНАМИКА ИЗМЕНЕНИЙ ТУМОР-АССОЦИИРОВАННЫХ МАКРОФАГОВ У ПАЦИЕНТОВ С ПЕРВИЧНОЙ МЕЛАНОМОЙ КОЖИ В ЗАВИСИМОСТИ ОТ СПОСОБА ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ
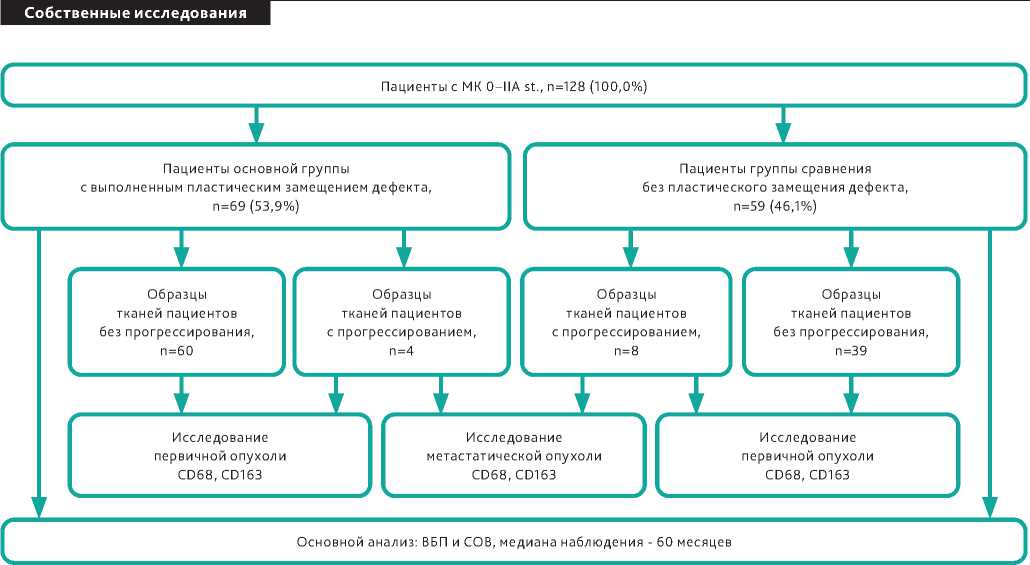
Рисунок 1. Динамика изменений в тумор-ассоциированных макрофагах у пациентов с первичной и метастатической МК в зависимости от способа хирургического лечения (дизайн исследования).
ными МК 0–IIa стадий и при последующих метастатических поражениях для определения влияния послеоперационной ишемии (регулируемой способом устранения операционного дефекта) на поляризацию ТАМ, выживаемость без прогрессирования (ВБП, от момента первичного хирургического вмешательства до момента признаков прогрессирования заболевания) и скорректированная общая выживаемость (ОВ, от момента первичного хирургического вмешательства до момента смерти только от меланомы) пациентов с МК.
В основу исследования положены данные о 128 пациентах с МК 0–IIa стадий, которые не были подвергнуты адъювантной терапии после оперативного вмешательства. У всех пациентов выполнено иссечение первичной МК с последующим закрытием дефекта тканей. Все пациенты были разделены на 2 группы по признаку закрытия послеоперационного дефекта тканей. В основную группу (n = 69, 53,9%) вошли пациенты с пластическим замещением дефекта тканей, выполненным для исключения натяжения в зоне послеоперационных швов, а в группу сравнения (n = 59, 46,1%) — пациенты с обычным линейным ушиванием послеоперационного рубца. С аркальной МК оперировано 4 пациента (3 пациента из основной группы и 1 пациент из группы сравнения), 39 больных с локализацией первичной МК на конечностях (27 пациентов из основной группы и 12 пациентов из группы сравнения), 10 пациентов с локализацией МК на лице, голове и шее (5 – из основной группы и 5 – из группы сравнения), 75 пациентов с локализацией первичной МК на туловище (34 из основной группы и 41 из группы сравнения). Исследованы образцы тканей у прогрессирующих больных с первичной МК и в метастазах на содержание и динамику изменений в ТАМ (рецепторы макрофагов с коллагеновой структурой CD68 и CD163). Всего на содержание макрофагов было проанализировано 128 первичных образцов тканей меланомы с 0–IIa стадий (глубина Бреслоу < 2 мм) и 29 образцов с метастазами в послеоперационном рубце или лимфатических узлах и мягких тканях. Оценивалась плотность и распределение ТАМ в горячих точках относительно опухоли. Изучаемые группы были статистически сравнимы по плотности в горячих точках и расположению макрофагов CD68 и CD163 относительно опухолевых очагов (р > 0,05). Все пациенты были прослежены в течение 5 лет, оценена выживаемость без прогрессирования и общая выживаемость (рис. 1).
Иммуногистохимия (выбрана доступная в учреждении методика определения макрофагов CD68 и CD163 на двух разных срезах одного препарата): сначала все образцы первичных меланом и опухолей были окрашены гемато-ксилин-эозином (рис. 2 и 3). Образцы окрашивали иммуногистохимически на CD68 и CD163, представляющие провоспалительные и М2-макрофаги соответственно. Макрофаги подсчитывали с помощью анализа горячих точек полуколичественно по гнездам опухолевых клеток и стромальному компоненту. Окрашивание и его оценка с помощью анализа горячих точек проводились по методике Tiainen S. с соавторами [32].
Макрофаги вблизи некротических участков исключались из подсчета. Содержание макрофагов в меланомах и метастазах оценивалось полуколичественно с использованием пятиуровневой системы баллов от 0 до 4. Иммуноокрашенные слайды CD68 оцифровывались с помощью цифрового сканера всего предметного стекла
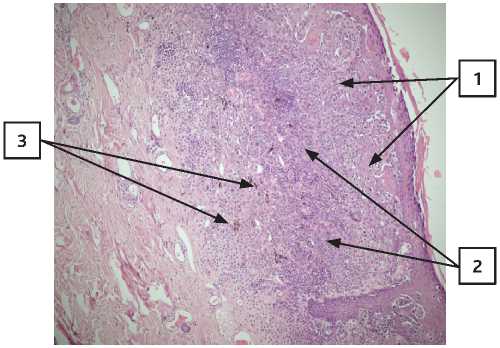
Рисунок 2. Первичная меланома кожи, окраска гематоксилин-эозином сувеличением×100 (1 –опухолевая ткань; 2 – лимфоидная инфильтрация; 3 – меланофаги).
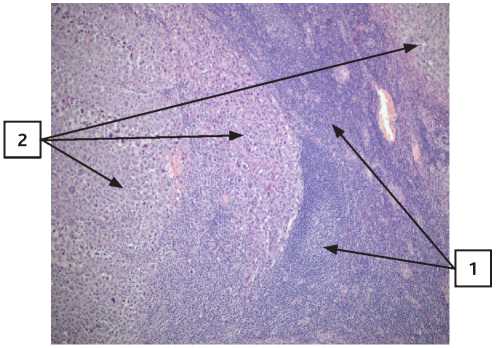
Рисунок 3. Метастаз меланомы в лимфоузел, окраска гематоксилин-эозином сувеличением×100 (1 – ткань лимфоузла; 2 – опухолевая ткань меланомы).
(NanoZoomer-XR; Hamamatsu Photonics, Hamamatsu, Япония). Оценка 0 присваивалась, если содержание макрофагов составляло 0–5% всех клеток, а баллы 1, 2, 3 и 4 присваивались, если макрофаги составляли 6–25%, 26–50%, 51–75% и 76–100% клеток соответственно. Пропорции макрофагов оценивались отдельно от гнезд опухолевых клеток и стромы. Стромальный отдел включал стромальную область ниже инвазивного фронта и толстые стромальные тяжи, разделяющие опухолевые гнезда. Оценивался весь очаг поражения. Как и в случае анализа горячих точек, макрофаги CD163 не могли быть оценены в образцах, содержащих меланин.
Статистический анализ проводили с использованием IBM SPSS Statistics 24 (IBM Corporation, Армонк, Нью-Йорк, США). Применялся метод Каплана–Мейера и критерий логарифмического ранга использовались для одномерного анализа и регрессии Кокса для многомерного анализа выживаемости. Для χ 2 -теста и оценки выживаемости количество макрофагов, полученное с помощью анализа горячих точек, было разделено на две группы (низкое или высокое) на основе медианы. Низкое или высокое число макрофагов соответствовало количеству макрофагов меньше медианы или количеству, равному или больше медианы
(медиана = 92,78 для CD68 и 76,86 для CD163 макрофагов) соответственно. При полуколичественной оценке категории 0–1 и 2–4 объединялись. Слитные категории 0–25% и 26–100% соответствовали низкой и высокой доле макрофагов соответственно. Значения P менее 0,050 считались статистически значимыми.
РЕЗУЛЬТАТЫ
Группы сравнивались по распределению пациентов по стадиям: пациентов с 0 стадией было 22 (17,2%), 9,4% в основной группе и 7,8% больных — в группе сравнения; с I стадией по всей когорте было 67 больных (52,3%), 28,1 % — в основной и 24,2 % в группе сравнения (с Ia стадией — 15,6% в основной группе и 13,3 % — в группе сравнения, с Ib стадией 12,5% в основной и 10,9% — в группе сравнения; со IIа стадией — 39 (30,4%) по всей когорте (16,4% больных в основной и 14,0% — в группе сравнения). Между сравниваемыми группами статистических различий не выявлено, р > 0,050 (табл. 1).
Из 128 пациентов с 0–IIa стадиями 29 пациентов в последующем прогрессировали в течение 5 лет. Исследованы
Таблица 1. Распределение больных с МК основной и группы сравнения по стадиям.
|
Стадия |
Все больные |
Группа больных |
р |
||||||||||
|
Основная |
Контроль |
||||||||||||
|
абс. число |
% |
абс. число |
% |
абс. число |
% |
||||||||
|
0 |
22 |
17,2 |
12 |
9,4 |
10 |
7,8 |
0,971 |
||||||
|
IA |
37 |
67 |
28,9 |
52,3 |
20 |
36 |
15,6 |
28,1 |
17 |
31 |
13,3 |
24,2 |
1,0 |
|
IB |
30 |
23,4 |
16 |
12,5 |
14 |
10,9 |
0,949 |
||||||
|
IIA |
39 |
30,4 |
21 |
16,4 |
18 |
14,0 |
0,977 |
||||||
|
Всего |
128 |
100,0 |
69 |
100,0 |
59 |
100,0 |
1,0 |
||||||
128 образцов первичных МК и 29 образцов метастатических тканей, из которых было приготовлено 256 и 58 стекол для окрашивания CD68 и CD163 соответственно. Пригодными для интерпретации оказались 111 (86,7%) образцов первичных образцов и 23 (79,3%) образца метастатических тканей.
Из доступных интерпретации 111 образцов первичных МК 0–IIa стадий были отобраны 12 образцов прогрессирующих в последующем пациентов и 99 образцов пациентов без признаков прогрессирования.
Содержание макрофагов CD68 в первичных опухолях и метастатических очагах
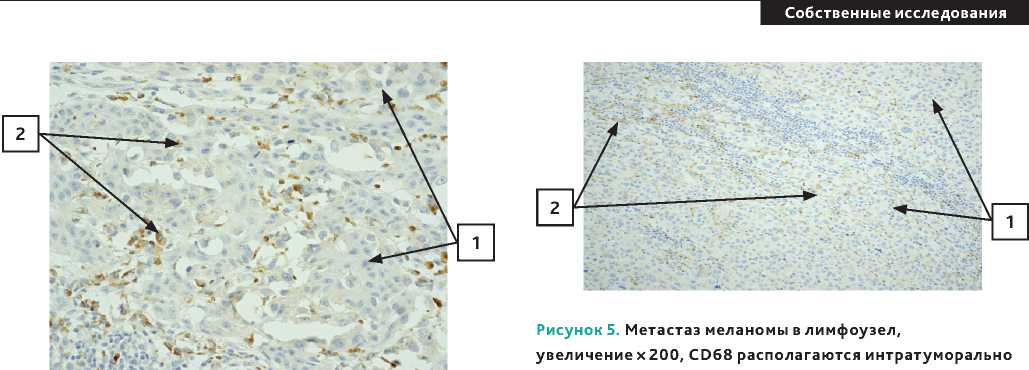
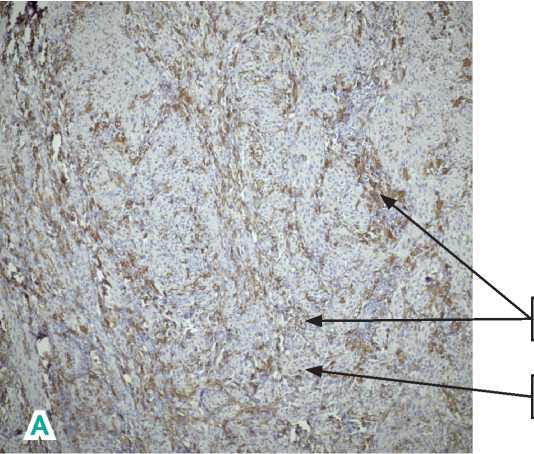
При окраске первичных опухолей и метастазов МК CD68 ТАМ могли не определяться, располагаться интра-туморально (рис. 4, 5), перитуморально, или расположение могло носить смешанный характер (рис. 6).
Из 111 первичных пациентов с МК интерпретированных образцов тканей плотность макрофагов CD68 в гнездах опухолевых клеток у пациентов с первичной тонкой меланомой кожи была низкой у всех пациентов в 100% случаев с преимущественным перитуморальным расположением (63,1 % случаев), в 35,1% случаев макрофаги отсутствовали, а в 0,9% случаев находились интратумо-рально и смешанном варианте (интра- и перитуморально) в горячих точках (табл. 2).
Плотность макрофагов CD68 в гнездах опухолевых клеток у пациентов с первичной тонкой МК как с прогрессированием, так и без прогрессирования была низкой в 100% случаев (не превышала 1 балла) с преимущественным перитуморальным расположением (в 75% случаев образцов у пациентов с последующем прогрессированием и 61,6% образцов пациентов без прогрессирования), причем у пациентов без прогрессирования в 38,4% случаев во-
Таблица 2. Плотность и расположение макрофагов CD68 в горячих очагах первичных и метастатических МК в группах сравнения.
|
Группы пациентов по признаку пластического замещения дефекта тканей |
Плотность (баллы) |
Расположение относительно опухоли |
|||||
|
Низкая (0–1) |
Высокая (2–4) |
Отсутствуют |
Интра-туморальное |
Пери-туморальное |
Смешанное |
||
|
Первичная опухоль CD68 (1) |
|||||||
|
Основная (n = 64) |
Прогрессирующие (n = 4) |
4 100,0% |
0 |
0 |
1 25,0% |
3 75,0% |
0 |
|
Не прогрессирующие (n = 60) |
60 100,0% |
0 |
24 40,0% |
0 |
36 60,0% |
0 |
|
|
Итого (n = 64) |
64 100,0% |
0 |
24 37,5% |
1 1,6% |
39 60,9% |
0 |
|
|
Сравнения (n = 47) |
Прогрессирующие (n = 8) |
8 100,0% |
0 |
1 12,5% |
0 |
6 75,0% |
1 12,5% |
|
Не прогрессирующие (n = 39) |
39 100,0% |
0 |
14 35,9% |
0 |
25 64,1% |
0 |
|
|
Итого (n = 47) |
47 100,0% |
0 |
15 31,9% |
0 |
31 66,0% |
1 2,1% |
|
|
Всего (n = 111) |
111 (100%) |
0 |
39 35,1% |
1 0,9% |
70 63,1% |
1 0,9% |
|
|
Vs (основная/сравнения) |
- |
- |
0,543 |
0,386 |
0,584 |
0,246 |
|
|
Vs (основная с прогрессированием/ сравнения с прогрессированием |
- |
- |
0,480 |
0,157 |
1,0 |
0,480 |
|
|
Vs (основная без прогрессирования/ сравнения без прогрессирования) |
- |
- |
0,683 |
- |
0,683 |
- |
|
|
Метастаз CD68 (2) |
|||||||
|
Основная (n = 9) |
9 100,0% |
0 |
1 11,1% |
0 |
9 100,0% |
0 |
|
|
Сравнения (n = 14) |
12 85,7% |
2 14,3% |
1 7,1 % |
7 50,0% |
5 35,7% |
1 7,1% |
|
|
Итого (n = 23) |
21 91,3% |
2 8,7% |
2 8,7% |
7 30,4% |
14 60,9% |
1 4,3% |
|
|
Vs (основная/сравнения) |
0,246 |
0,246 |
0,745 |
0,013 |
0,003 |
0,424 |
|
|
Vs (основная- первичная опухоль/ основная -метастаз) |
1,0 |
- |
0,021 |
0,704 |
0,022 |
- |
|
|
Vs (сравнения первичная опухоль/ сравнения -метастаз) |
0,009 |
0,009 |
0,067 |
< 0,001 |
0,045 |
0,359 |
|
|
Vs (всего по первичным опухолям/ итого –метастаз) |
0,002 |
0,002 |
0,013 |
< 0,001 |
0,843 |
0,221 |
|
(1 – клетки меланомы с крупными ядрами; 2 – макрофаги
Рисунок 4. Первичная меланома кожи, CD68 располагаются интратуморально, увеличение × 400 (1 – клетки меланомы с крупными ядрами; 2 – макрофаги CD68).
CD68).
обще не наблюдалось CD68, тогда каку прогрессирующих CD68 отсутствовали только в 8,3% случаев, максимальное частое их расположение было перитуморальным (75%), тогда как интратуморальное и смешанное присутствие отмечалось одинаково — 8,3% случаев (табл. 2).
При исследовании метастатических образцов местных рецидивов и лимфоузлов (n = 23) высокое количество макрофагов CD68 в гнездах опухолевых клеток было выявлено в 91,3% случаев с преимущественным перитумораль-ным расположением (60,9%), тогда как стали выявляться интратуморальные очаги в 30,4% случаев, смешанный вариант расположения гнезд был выявлен в 4,3% случаев, отсутствие макрофагов выявлялось в 8,7% (табл. 2).
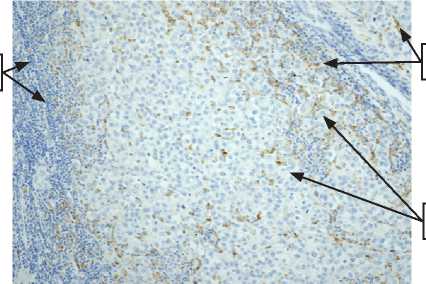
Рисунок 6. Метастаз меланомы в лимфоузел, увеличение × 200, CD68 располагаются интра-и перитуморально (1 – клетки меланомы с крупными ядрами; 2 – макрофаги CD68; 3 – лимфоциты).
Содержание макрофагов CD163 в первичных опухолях и метастатических очагах
При окраске первичных опухолей и метастазов МК CD163 ТАМ также могли не определяться, располагаться пе-ритуморально (рис. 7), интратуморально (рис. 8), или расположение могло носить смешанный характер (рис. 9, 10).
В основной группе пациентов, как и в группе сравнения, плотность CD163 была в большинстве случаев низкой (67,2% в основной группе и 66,7% в группе сравнения), в 32,8% случаев в основной группе была высокая плотность CD163, как и в группе сравнения (34,0%). Преимущественным распределением CD163 в опухолях основной и группы сравнения было перитуморальное (62,5% и 63,8% соответственно), смешанное присутствие в основной группе зафиксировано в 10,9% случаев, тогда как в группе сравнения — в 14,9% случаев. CD163 в основной группе отсутствовали в 23,4% случаев, а в группе сравнения в 19,1 % случае. Интратуморальное расположение CD163 в основной группе было в 3,1 % случаев, а в группе сравнения — в 3,0% случаев. Смешанное расположение (пери- и интратуморально) в основной группе было в 10,9% случаев, а в группе сравнения — в 14,9% случаев (табл. 3).
Макрофаги М2 (CD163) в горячих точках в рецидивных опухолях выявлялись с преимущественно высоким содержанием (78,3% случаев), низкое их содержание выявлено в 21,7% случаев, причем преимущественным было интра-туморальное (65,2%) и смешанный вариант расположения (30,4%), перитуморальное выявлено только 4,3% случая, случаев же отсутствия макрофагов CD163 выявлено не было (табл. 3).
Сравнение результатов плотности макрофагов CD68 и CD163 в первичных и метастатических опухолях у пациентов основной и группы сравнения
При анализе данных выявлено, что плотность макрофагов CD68 в горячихточках у пациентов основной группы (с пластикой) в первичных и метастатических очагах не менялась и оставалась низкой на фоне увеличения перитуморальной их локализации с 75% до 100% (увеличение на 25%, р = 0,022), в группе сравнения (без пластики) в метастатических очагах увеличилось количество случаев высокой плотности макрофагов в горячих точках с 0 до 14,3% (р = 0,009), а количество случаев низкой плот-
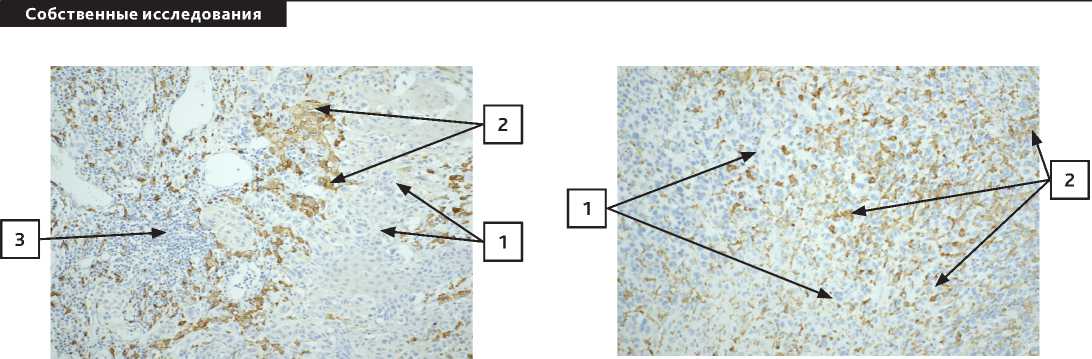
Рисунок 8. Метастаз меланомы в лимфоузел,
Рисунок 7. Первичная меланома кожи, увеличение × 200, CD163 располагаются перитуморально (1 – клетки меланомы с крупными ядрами; 2 – макрофаги CD68; 3 – лимфоциты).
увеличение×200, CD163 располагаются интратуморально (1 – клетки меланомы с крупными ядрами; 2 – макрофаги CD68).
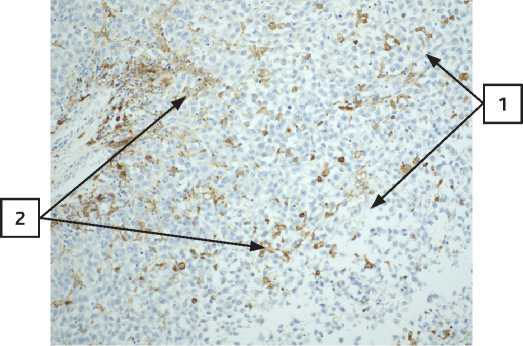
Рисунок 10. Метастаз меланомы в лимфоузел, увеличение×200, CD163 располагаются интра-и перитуморально (1 – клетки меланомы с крупными ядрами; 2 – макрофаги CD163).
Рисунок 9. Первичная меланома кожи, увеличение × 400, CD163 располагаются пери- и интратуморально (1 – клетки меланомы с крупными ядрами; 2 – макрофаги CD68; 3 – лимфоциты).
ности снизилось с 100% до 85,7% (р = 0,009). Преимущественным оказалось интрастромальное расположение макрофагов в метастатических очагах до 50% случаев, перитуморально макрофаги располагались в 35,7% случаев и в 7,1% случаев наблюдалось смешанное расположение (интра- и перитуморально), также в 7,1 % случаев макрофаги CD68 отсутствовали в горячих очагах. Очевидно, что произошла миграция макрофагов CD68 в перитумо-ральную зону в основной группе с75% до 100% (р = 0,022, табл. 2).
У пациентов в основной группе (с пластикой) в метастатических очагах увеличилась плотность макрофагов М2 (CD163) (количество случаев в горячих точках низкой плотности снизилось относительно первичной меланомы с 67,2% до 22,2% случаев (на 45,0%, р = 0,010), а количество высокой плотности увеличилось с 32,8% до 77,8% случаев (на 45,0 %, р = 0,010). Наблюдалась миграция макрофагов М2 из перитуморальной зоны первичной опухоли в интрастромальную зону метастатического очага. Так, преимущественным в метастатических опу- холях основной группы пациентов оказалось смешанное (интра- и экстрастромальное) расположение макрофагов CD163 с 10,9% до 55,6% случаев (на 44,7%, р = 0,001) и интрастромальное расположение — с 3,1 % до 44,4% случаев (на 41,3%, р < 0,001), тогда как перитумораль-ного расположения CD163 не было выявлено (с 62,5% до 0%, р < 0,001). В группе сравнения также наблюдалось увеличение плотности макрофагов CD163 в горячих точках прогрессирующих пациентов (количество случаев низкой плотности снизилось с 66,0% в первичных МК до 21,4% в метастатических очагах (на 44,6%, р = 0,003), а количество случаев высокой плотности увеличилось с 34,0% до 78,6% (на 44,6%, р = 0,003). В горячих очагах метастатических опухолей группы сравнения также преимущественным было интрастромальное расположение макрофагов CD1633,0% до 78,6% (на 75,6%, р < 0,001), смешанное присутствие практически не изменилось (с 14,9% до 14,3 %, р = 0,956), а перитуморальное расположение макрофагов CD163 снизилось с 63,8% до 7,1 % (на 56,7%, р < 0,001, табл. 3).
Собственные исследования
Таблица 3. Плотность и расположение макрофагов CD163 в горячих очагах первичных и метастатических МК в основной группе и группе сравнения
|
Группы пациентов по признаку пластического замещения дефекта тканей |
Первичная опухоль CD163 (1) |
||||||
|
Плотность (баллы) |
Расположение относительно опухоли |
||||||
|
Низкая (0–1) |
Высокая (2–4) |
Отсутствуют (нет) |
Интра-туморально |
Пери-туморально |
Смешанное |
||
|
Первичная опухоль CD163 (1) |
|||||||
|
Основная (n = 64) |
Прогрессирующие (n = 4) |
3 75,0% |
1 25,0% |
1 25,0% |
0 |
2 50,0% |
1 25,0% |
|
Не прогрессирующие (n = 60) |
40 66,7% |
20 33,3% |
14 23,3% |
2 3,3% |
38 63,3% |
6 10,0% |
|
|
Итого (n = 64) |
43 67,2% |
21 32,8% |
15 23,4% |
2 3,1 % |
40 62,5% |
7 10,9% |
|
|
Сравнения (n = 47) |
Прогрессирующие (n = 8) |
7 87,5% |
1 12,5% |
2 25,0% |
0 |
5 62,5% |
1 12,5% |
|
Не прогрессирующие (n = 39) |
24 61,5% |
15 38,5% |
7 17,9 % |
1 3,6% |
25 64,1% |
6 15,3% |
|
|
Итого (n = 47) |
31 66,0% |
16 34,0% |
9 19,1% |
1 3,0% |
30 63,8% |
7 14,9% |
|
|
Всего (n = 111) |
74 66,6% |
37 33,4% |
24 21,6% |
3 2,7% |
70 63,1% |
14 12,6% |
|
|
Vs (основная/сравнения |
0,895 |
0,895 |
0,587 |
0,976 |
0,889 |
0,530 |
|
|
Vs (основная — прогрессирующие/ сравнения — прогрессирующие) |
0,584 |
0,584 |
1,0 |
— |
0,679 |
0,584 |
|
|
Vs (основная — не прогрессирующие/ сравнения — не прогрессирующие) |
0,599 |
0,599 |
0,523 |
0,936 |
0,936 |
0,432 |
|
|
Метастаз CD163 (2) |
|||||||
|
Основная (n = 9) |
2 22,2% |
7 77,8% |
0 |
4 44,4% |
0 |
5 55,6% |
|
|
Сравнения (n = 14) |
3 21,4% |
11 78,6% |
0 |
11 78,6% |
1 7,1% |
2 14,3% |
|
|
Итого (n = 23) |
5 21,7% |
18 78,3% |
0 |
15 65,2% |
1 4,3% |
7 30,4% |
|
|
Vs (основная/сравнения) |
0,965 |
0,965 |
— |
0,100 |
0,424 |
0,040 |
|
|
Vs (основная первичная опухоль/ основная — метастаз) |
0,010 |
0,010 |
0,106 |
< 0,001 |
< 0,001 |
0,001 |
|
|
Vs (сравнения первичная опухоль/ сравнения — метастаз) |
0,003 |
0,003 |
0,079 |
< 0,001 |
< 0,001 |
0,956 |
|
|
Vs (всего — первичная опухоль/ итого — метастаз) |
< 0,001 |
< 0,001 |
0,014 |
< 0,001 |
< 0,001 |
0,031 |
|
Выживаемость без прогрессирования пациентов с МК со стадиями 0–IIa
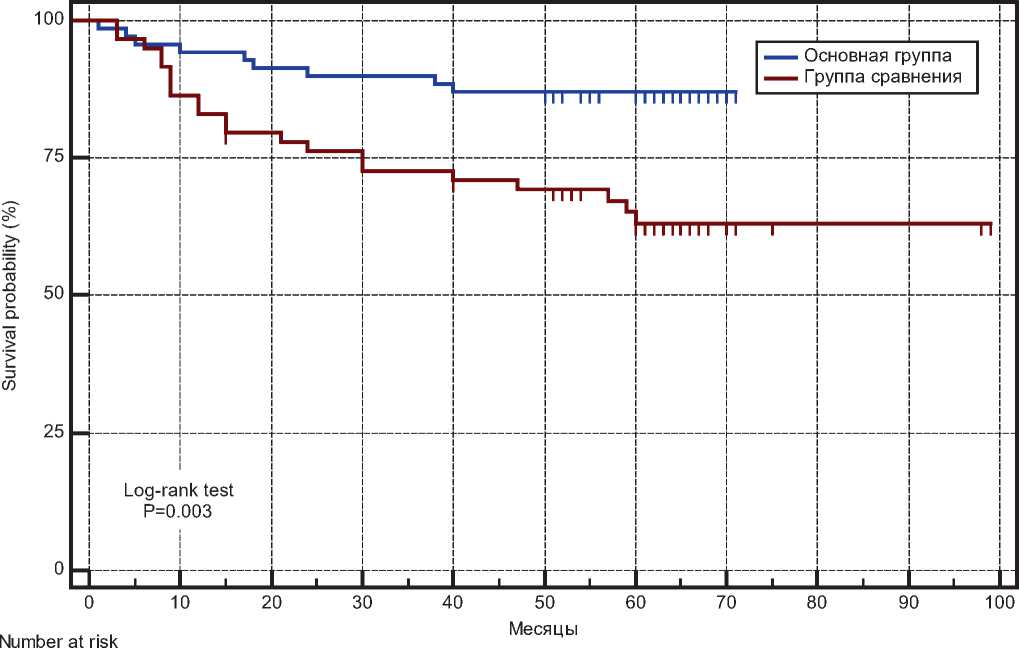
ВБП у пациентов со стадиями 0–IIa в основной группе в период наблюдения после операции до 12, 36 и 60 месяцев ВБП была выше, чем у пациентов в группе сравнения на 11,1% (94,2% и 83,1%, соответственно, р = 0,045), на 17,0% (89,9% и 72,9%, соответственно, р = 0,013) и на 22,6% (87,0% и 64,4%, соответственно, р = 0,003) (табл. 4, рис. 11).
Общая выживаемость
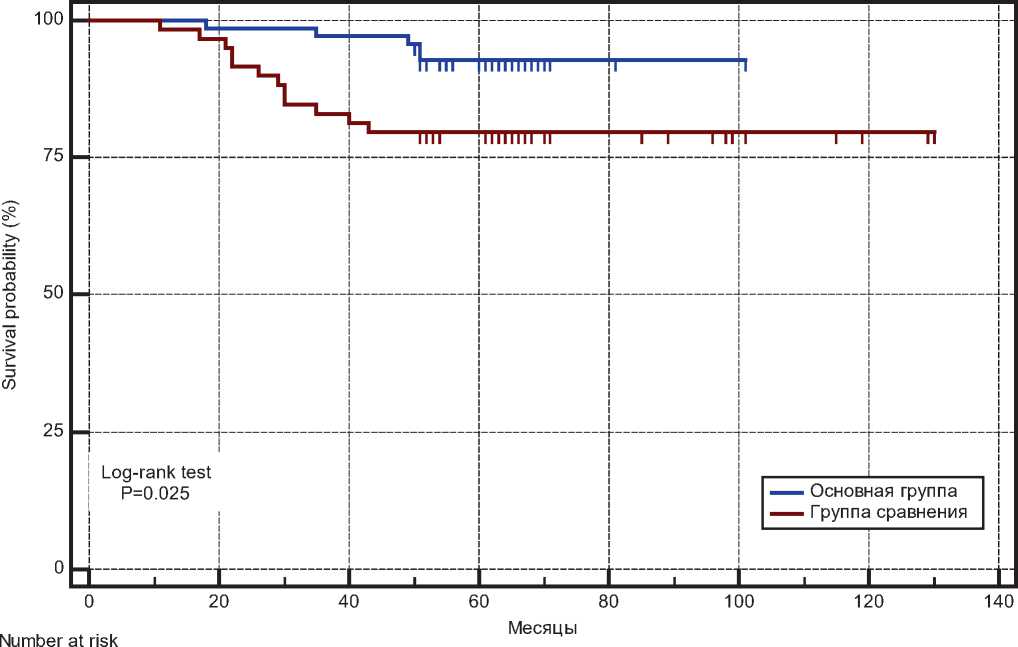
У пациентов с МК со стадиями 0–IIa в основной группе с пластикой по сравнению с пациентами без пластического замещения дефекта показатели ОВ в период наблюдения после операции до 12, 36 и 60 месяцев были выше на 1,7%
(100,0 % и 98,3 %, соответственно, р > 0,050), на 14,0 % (97,1% и 83,1%, соответственно, р = 0,007) и на 13,1% (92,8% и 79,7%, соответственно, р = 0,029). Медиана выживаемости в группах не достигнута (табл. 5, рис. 12).
Для иллюстрации приводим клиническое наблюдение.
Пациентка Х., 60 лет. Диагноз: меланома кожи спины TхNоMо, II клиническая группа. Прооперирована 05.03.2013 – выполнено иссечение опухоли с закрытием дефекта с помощью реконструктивно-пластического компонента. По ПГИ — поверхностно-распростра-няющаяся пигментная меланома из эпителиоидных, веретенообразных клеток без изъязвления. Высота опухоли 2,2 мм, уровень инвазии по Кларку 3. Митотическая активность 0–1 на мм 2 . Лимфоидная инфильтрация слабо выражена. Послеоперационный диагноз: меланома кожи спины рT3аNоMо, IIа стадия, II клиническая группа.
Собственные исследования
Group: Основная группа
|
69 |
65 |
63 |
62 |
60 |
59 |
49 |
3 |
0 |
0 |
0 |
|
Group: Группа сравнения |
||||||||||
|
59 |
51 |
46 |
42 |
40 |
39 |
30 |
4 |
2 |
2 |
0 |
Рисунок 11. Выживаемость без прогрессирования у пациентов с 0–IIA стадиями МК в группах сравнения. ДИ 95%.
Медиана выживаемости не достигнута в обеих группах сравнения.
На рисунке 12 показана первичная опухоль, окрашенная гематоксилин-эозином с увеличением × 200 и × 400. При ИГХ маркером CD68 ТАМ находятся перитумо-рально менее 2 % (рис. 13), ТАМ CD163 окрашивались как единичные клетки, располагавшиеся перитумо-рально (рис. 14).
Несмотря на пластическое замещение дефекта тканей, через 36 месяцев у пациентки выявлена рецидивная опухоль в зоне послеоперационного рубца, причем в области наибольшего натяжения швов (зона наибольшей ишемии и рубцевания — рис. 15).
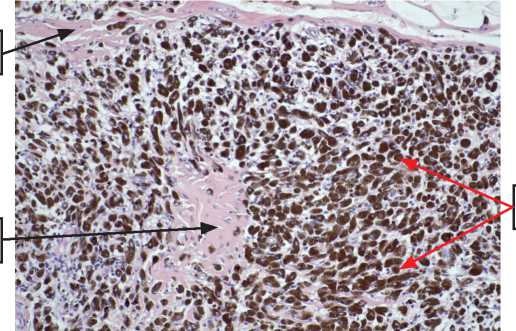
Образец метастатической опухоли сначала был окрашен гематоксилин-эозином, на котором видны рубцовая ткань (1) и опухолевая ткань (2) метастаза меланомы (рис. 16). При увеличении × 400 на рисунке 17 видны крупные скопления меланофагов (1) вокруг опухоли (2) на фоне рубца (3).
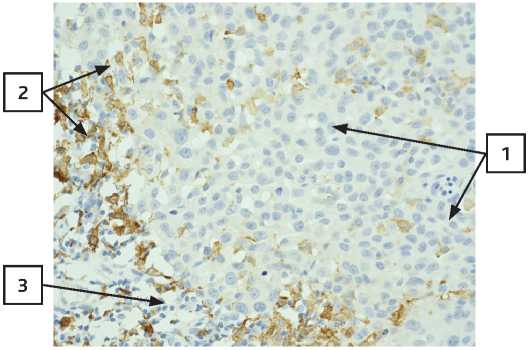
При ИГХ исследовании маркером CD68 (рис. 18) видно, что гистиоциты отсутствуют в горячих точках, окрашены только меланофаги × 200. По количеству окрашенных гистиоцитов CD68 картина не отличается от количества пигментированных клеток, окрашенных гематоксилин-эозином (рис. 16), поэтому расценена как отсутствие макрофагов CD68 в горячих точках.
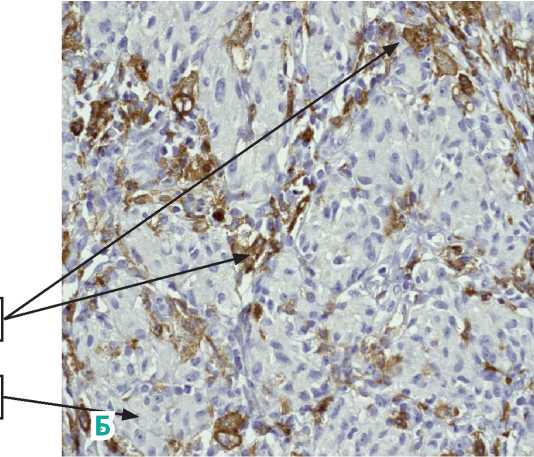
При ИГХ маркером CD163 ТАМ расположены пери-туморально, до 30 %, окружают группы опухолевых клеток (1), опухоль минимально пигментирована, скопления меланофагов по периферии опухоли (2), без некроза с увеличением × 100 и × 400 (рис. 19).
ОБСУЖДЕНИЕ
Если в целом рассматривать всю когорту пациентов с 0–IIa стадиями МК, то можно проследить тенденцию к увеличению плотности провоспалительных макрофагов CD68 от первичного очага МК к метастатическому (от 0% до 8,7%, р = 0,002) и миграцией в строму опухоли от 0,9% до 30,4%, р < 0,001 (табл. 2). Наблюдалось увеличение плотности макрофагов CD163 (М2) в горячих очагах опухолевой ниши от первичной опухоли к метастатической более чем в 2 раза с 33,4% до 78,3% (на 44,9%, р < 0,001), а также смещение миграции из перитуморальной зоны опухолевой ниши с 63,1 % до 4,3% (на 58,8%, р < 0,001) в интратуморальную с 2,7% до 65,2% (на 62,5%, р < 0,001) и смешанную с 12,6% до 30,4% (на 17,8%, р = 0,031) зоны метастатических очагов (табл. 3).
В образцах основной группы пациентов, которым была произведена пластика при закрытии операционного дефекта, от первичной к метастатической опухоли плотность провоспалительных макрофагов CD68 не менялась и находилась во всех образцах на низком уровне, тогда как распределение сместилось в перитуморальную зону с 60,9 % до 100,0 % (на 39,1 %, р = 0,022). В группе сравнения (у пациентов без пластического замещения
Таблица 4. Выживаемость без прогрессирования пациентов с меланомой кожи сравниваемых групп за период 60 месяцев (абс., % от n по группам)
|
Группа больных |
Период наблюдения (месяцев) |
||||||||
|
12 |
36 |
60 |
|||||||
|
абс. число |
%* |
абс. число |
%* |
р |
абс. число |
%* |
р |
р 1 |
|
|
Основная, n = 69 |
65 |
94,2 |
62 |
89,9 |
0,250 |
60 |
87,0 |
0,063 |
0,500 |
|
Сравнения, n = 59 |
49 |
83,1 |
43 |
72,9 |
0,031 |
38 |
64,4 |
0,001 |
0,063 |
|
Все больные, n = 128 |
114 |
89,1 |
105 |
82,0 |
0,004 |
98 |
76,6 |
< 0,001 |
0,016 |
|
Vs (между пациентами основной и группы сравнения в стадии 0–IIa, %), р |
∆11,1 (0,045) |
∆17,0 (0,013) |
∆22,6 (0,003) |
||||||
Group: Основная группа
69 68 67 53 2 1 0 0
Group: Группа сравнения
59 57 48 42 10 5 2 0
Рисунок 11. Общая выживаемость пациентов с МК в группах сравнения с 0-IIa стадиями. ДИ 95%. Медиана выживаемости в группах не достигнута.
Таблица 5. Общая выживаемость у больных МК в группах сравнения за период 60 месяцев (абс., % от n по группам)
|
Группа больных |
Период наблюдения (мес.) |
||||||||
|
12 |
36 |
60 |
|||||||
|
абс. число |
% от n |
абс. число |
% |
р |
абс. число |
% |
р |
р 1 |
|
|
Основная, n = 69 |
69 |
100,0 |
67 |
97,1 |
0,500 |
64 |
92,8 |
0,063 |
0,250 |
|
Сравнения, n = 59 |
58 |
98,3 |
49 |
83,1 |
0,004 |
47 |
79,7 |
0,001 |
0,5 |
|
Все больные, n = 128 |
127 |
99,2 |
116 |
90,6 |
0,001 |
111 |
86,7 |
< 0,001 |
0,063 |
|
Vs (между пациентами основной группой и группой сравнения в стадии 0–IIа, %), р |
∆ 1,7 (0,277) |
∆ 14,0 (0,007) |
∆ 13,1 (0,029) |
||||||
Примечание: р — показатель статистической значимости различий с периодом 12 месяцев; р 1 – между периодами 36 и 60 месяцев
Примечание: р — показатель статистической значимости различий с периодом 12 месяцев; р 1 – между периодами 36 и 60 месяцев.
дефекта тканей), плотность CD68 возросла с 0% до 14,3%, р = 0,009 высокой плотности, и распределение макрофагов сместилось из перитуморальной зоны (снижение в 2 раза — с 66,0% до 35,7%, р = 0,045) в интрастромальную (от 0% до 50,0%, р < 0,001) и смешанную (от 2,1 % до 7,1 %, но разница статистически была не достоверна, р = 0,359), что может косвенно указывать на длительные воспалительные состояния, обусловленные натяжением краев раны и более длительным заживлением у пациентов группы сравнения по отношению к основной группе (табл. 2).
Плотность макрофагов М2 (CD163), провоцирующих прогрессирование, в образцах пациентов основной группы при сравнении первичных и метастатических опухолей увеличивалась в горячих очагах (количество случаев низкой плотности уменьшилось с 67,2% до 22,2% случаев (на 45,0 %, р = 0,010), а высокой плотности увеличилось с 32,8% до 77,8 % случаев (на 45,0 %, р = 0,010), причем распределение CD163 из перитуморальной зоны первичной опухоли к метастатической (62,5% до 0,0%, р < 0,001) первичной опухоли сместилось в интрастромальную зону с 3,1% до 44,4% (увеличение на 41,3%, р < 0,001) и смешанную зону с 10,9% до 55,6% (увеличение на 44,7%, р = 0,001) в метастазе (табл. 3).
В образцах пациентов группы сравнения плотность макрофагов CD163 в динамике от первичной до метастатической опухоли также увеличилась в горячих очагах (количество случаев низкой плотности уменьшилось с 66,0% до 21,4% (уменьшение на 44,6%, р = 0,003) случаев, а высокой плотности увеличилось с 34,0% до 78,6% случаев (увеличение на 44,6 %, р = 0,003). Причем распределение CD163 из перитуморальной зоны (63,8% в первичных опухолях до 7,1 % в метастазе с уменьшением на 56,7%, р < 0,001) сместилось в интрастромальную зону с 3,0% в первичной опухоли до 78,6% (увеличениена 75,8%, р < 0,001), при стабильной картине в смешанной зоне с 14,9% до 14,3% (р = 0,956) в метастазе. Отмечается различие в распределении макрофагов CD163 в метастазах основной группы, в которой превалирует смешанное распределение ТАМ клеток, на 41,3% (55,6% в основной и 14,3% в группе сравнения, р = 0,040), тогда как в группе
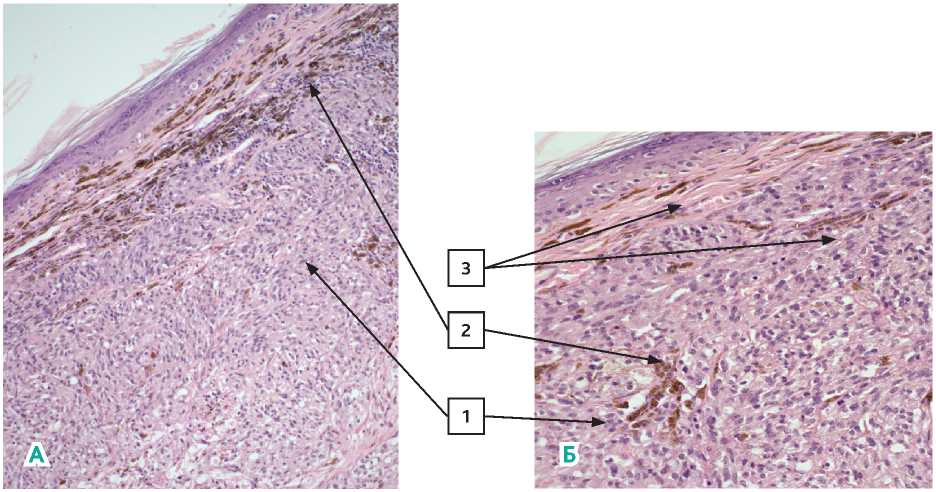
Рисунок 12. Пациентка Х. Первичная меланома кожи, окраска гематоксилин-эозином (1 – опухолевая ткань меланомы; 2 – меланофаги; 3 – меланин в клетках меланомы). А — увеличение × 200, Б — увеличение × 400.
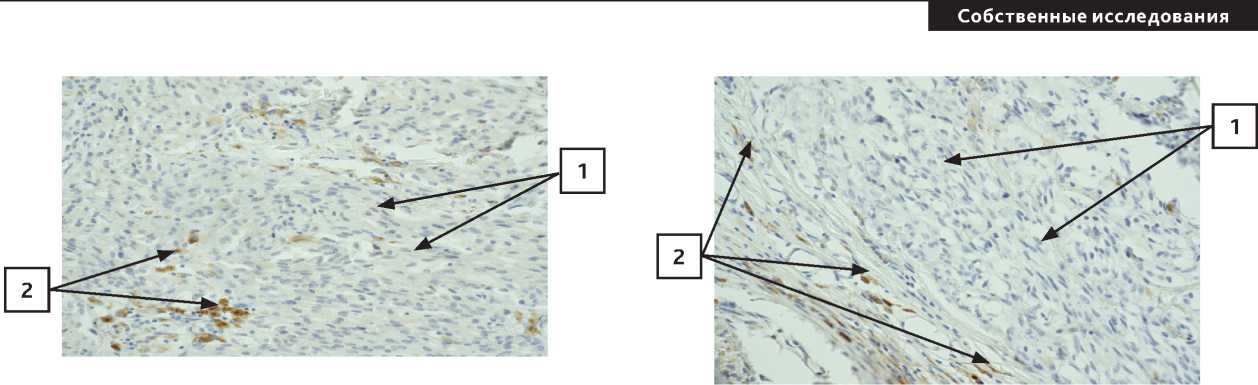
Рисунок 13. Пациентка Х. Первичная меланома кожи,
увеличение × 400, CD68 находятся перитуморально менее 2% (1 – клетки меланомы с крупными ядрами; 2 – макрофаги CD68).
Рисунок 14. Пациентка Х. Первичная меланома кожи, увеличение × 400, единичные клетки CD163 расположены перитуморально (1 – опухолевые клетки; 2 – группы макрофагов CD163 вокруг скоплений опухолевых клеток).
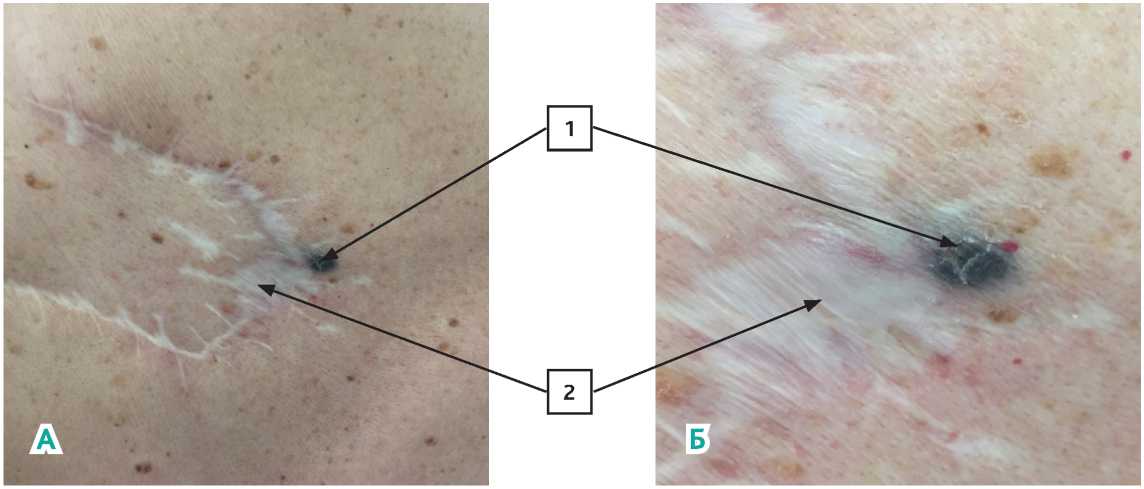
Рисунок 15 (А, Б). Пациентка Х. Местный рецидив меланомы кожи (1) в зоне наибольшего натяжения и рубцевания (2).
А. Общий вид послеоперационного рубца с метастазом меланомы. Б. Участок послеоперационного рубца с наибольшим натяжением и метастазом меланомы.
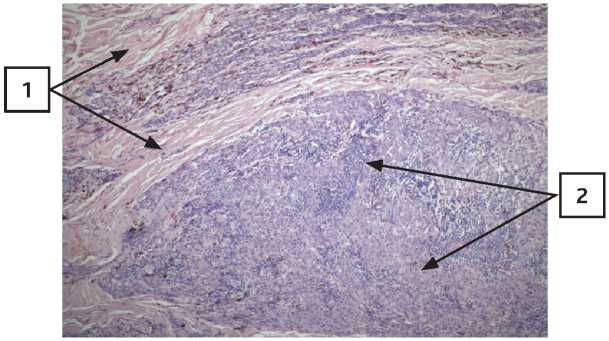
Рисунок 16. Метастаз меланомы в послеоперационный рубец. Окраска гематоксилин-эозином, увеличение × 100 (1 – рубцовая ткань; 2 – опухолевая ткань меланомы).
№
Рисунок 17. Метастаз в послеоперационный рубец. Окраска гематоксилин-эозином, увеличение × 400 (1 – скопления меланофагов; 2 – опуолевая ткань; 3 – рубцовая ткань).
сравнения отмечено преимущественно интрастромаль-ное — больше на 34,2% (78,6% и 44,4%), но статистически это не подтверждено, р = 0,106 (табл. 3).
ВБП за 5 лет оказалась на 22,6 % (р = 0,003), а ОВ на 13,1% (р = 0,029) выше в основной группе (с пластическим замещением дефекта) по отношению к группе сравнения (без пластического замещения дефекта тканей).
Известно, что продолжительное воспаление ведет к повышенной плотности лимфатических сосудов, расширению и гиперплазии лимфатической сосудистой сети [27], увеличению лимфоотока [28] и учащению регионарного метастазирования в лимфатические узлы [29], что коррелируют с худшей статистикой выживаемости [30]. Также известно, что выбор метода пластического закрытия послеоперационного дефекта позволяет избежать осложнений, связанных с натяжением краев раны и формированием порочных рубцов [31]. Гипотетически, при устранении факторов,
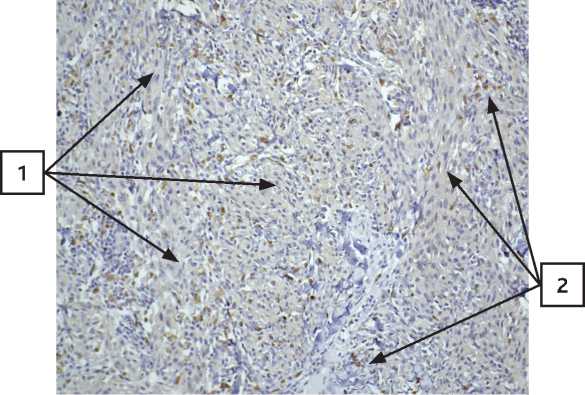
Рисунок 18. Метастаз меланомы в послеоперационный рубец, увеличение × 200. (1 – скопления клеток меланомы; 2 – пигментированные клетки). Окраска маркером CD68.
способствующих увеличению распространения опухоли, возможно влиять на выживаемость пациентов уже на первичном этапе лечения — хирургическом. При исследовании ВБП и ОВ у пациентов с первичной меланомой кожи 0–IIa стадий и выполненной пластикой дефекта тканей эти показатели оказались лучше, чем у пациентов после обычного ушивания. Группы сравнения были статистически сопоставимы по полу, возрасту, наличию сопутствующих заболеваний, индексу массы тела (р > 0,05), а различия были только в способе закрытия операционного дефекта. У пациентов, дефект тканей которых закрывался обычным линейным ушиванием, практически во всех случаях наблюдалось натяжение краев раны с последующим развитием более грубых рубцов, нежели у пациентов, которым была произведена пластика дефекта тканей с полным исключением натяжения краев раны. Из литературных данных известно, что фибробласты, ассоциированные с меланомой, подавляют активность цитотоксических Т-лимфоцитов, влияют на передачу сигналов T-клеток [13] и снижают цитотоксическую активность NK-клеток [14]. Большинство опубликованных данных указывают на иммуносупрессивную роль ацидоза, который также способствует более «мигрирующему» фенотипу клеток меланомы [16]. Также известно, что натяжение краев раны создает напряжение для дермальных фибробластов, способствует их чрезмерной активации и приводит к усилению генерации коллагена и фибронектина [22], а рубцевание [20] и лимфатическая недостаточность, как результат рубцевания лимфатических сосудов после операции [21] при длительном воспалении, приводят к недостаточности как острого, так и хронического иммунного ответа [19]. Воспалительные состояния могут индуцировать пластичность меланомы в сторону более «мигрирующего» фенотипа и способствовать миграции клеток меланомы вдоль внешней поверхности кровеносных сосудов и их периваскулярной инвазии [25]. В свою очередь, макрофаги переносят
^ У* .
* • Л -7< "v
Рисунок 19. Метастаз меланомы в послеоперационный рубец. Окрашены группы макрофагов CD163 (1) вокруг скоплений опухолевых клеток (2). А. Увеличение × 100; Б. Увеличение × 400.
цитоплазматические молекулы в клетки меланомы или сливаются с ними, что приводит к усилению диссеминации клеток меланомы in vivo [26]. Дифференцировка ТАМ клеток в сторону М2 опосредуется гипоксией и различными сигнальными молекулами, продуцируемыми опухолевыми и стромальными клетками [8], что доказывается снижением поляризации макрофагов в М2-сторону у пациентов с выполненной пластикой по сравнению с пациентами с обычным ушиванием раны. Рост опухоли и метастазирование меланомы определяются сложным перекрестным взаимодействием между опухолевыми клетками и окружающей микросредой посредством секреции онкогенных медиаторов [8], что теоретически может влиять и на отдаленное метастазирование. В результате исследования выяснено, чтоу пациентов с первичной меланомой кожи 0–IIa стадий пластическое замещение дефекта тканей по сравнению с обычным ушиванием привело к уменьшению плотности провоспалительных макрофагов CD68 в интрастро-мальном компоненте опухоли в метастатических очагах, а также выявлено, что ТАМ клетки реже поляризовались в М2 сторону и мигрировали в интрастромальный компонент опухоли, что проявлялось более частым смешанным их содержанием. В итоге выживаемость у данной категории пациентов была лучше. Эти данные подтверждаются результатами исследований других авторов, которые показали, что повышенное содержание макрофагов М2, создающих иммуносупрессивную среду, усиливает рост опухоли как в первичных, так и метастических очагах [4,11]. Соответственно, снижение поляризации макрофагов М1 в М2 и концентрации М2-клеток в интрастро-мальном компоненте опухоли сочетается с улучшением прогноза выживаемости, что и подтверждается в данном исследовании.
Таким образом, воздействуя на начальный этап лечения — оперативный — и учитывая главную задачу (закрытие послеоперационного дефекта без натяжения), сократив время послеоперационного воспаления, предотвратив ишемию сшиваемых тканей и образование грубых рубцов, возможно улучшить показатели выживаемости паци- ентов с первичной меланомой кожи 0–IIa стадий. Это возможно только при пластическом замещении дефекта тканей. Данные мероприятия могут вести к уменьшению плотности в интрастромальном распространении провоспалительных макрофагов CD68 в операционном очаге, а также менее частую поляризацию ТАМ клеток в М2 сторону и миграцию в интрастромальный компонент опухоли, более частому смешанному содержанию по сравнению с пациентами без пластического замещения, что в итоге улучшает ВБП и ОВ у данной категории пациентов. Пластическое замещение дефекта тканей после удаления первичной меланомы кожи позволяет получить максимально быстрое заживление с наименьшими воспалительными явлениями и исключить грубое рубцевание тканей. Таким образом, хирургический этап лечения пациентов с первичной меланомой кожи в виде пластического замещения дефекта тканей после удаления опухоли позволяет улучшить пятилетние результаты выживаемости (ВБП на 22,6 % (р = 0,003) и ОВ на 13,1 % (р = 0,029) у пациентов с первичной меланомой кожи 0– IIa стадий.
ВЫВОДЫ
Информация о спонсорстве. За счет личных средств.
Список литературы Динамика изменений тумор-ассоциированных макрофагов у пациентов с первичной меланомой кожи в зависимости от способа хирургического лечения
- Bakker A., Maertens K.J., Van Son M.J., Van Loey N. E. Psychological consequences of pediatric burns from a child and family perspective: a review of the empirical literature. Clin Psychol Rev. 2013 Apr; 33 (3): 361-71. https:// doi.org/10.1016/j.cpr. 2012.12.006.
- Salmi S., Siiskonen H., Sironen, R., Tyynelä-Korhonen K., Hirschovits - Gerz B., Valkonen M. et al. The number and localization of CD68 + and CD163 + macrophages in different stages of cutaneous melanoma. Melanoma Research: June 2019 - Volume 29 - Issue 3-p 237-247. https://doi.org/10.1097/CMR. 0000000000000522.
- Simiczyjew A., Dratkiewicz E., Mazurkiewicz J., Zi^tek M., Matkowski R., Nowak D. The Influence of Tumor Microenvironment on Immune Escape of Melanoma. Int J Mol Sci. 2020 Nov 7; 21 (21): 8359. PMID: 33171792. https:// doi.org/10.3390/ijms21218359.
- Chanmee T., Ontong P., Konno K., Itano N. Tumor-associated macrophages as major players in the tumor microenvironment. Cancers (Basel). 2014 Aug 13; 6 (3): 1670-90. https://doi.org/10.3390/cancers6031670.
- Piaggio F., Kondylis V., Pastorino F., Di Paolo D., Perri P., Cossu I. et al. A novel liposomal clodronate depletes tumor-associated macrophages in primary and metastatic melanoma: anti-angiogenic and anti-tumor effects. J. Control Release. 2016 Feb 10; 223: 165-177. https://doi.org/10.1016/j.jconrel. 2015.12.037.
- Falleni M.; Savi, F., Tosi D., Agape E., Cerri, A., Moneghini L., Bulfamante G. P. M1 and M2 macrophages' clinico-pathological significance in cutaneous melanoma. Melanoma Res. 2017 Jun; 27 (3): 200-210. https://doi.org/10.1097/ CMR. 0000000000000352.
- Georgescu S. R., Tampa M., Mitran C. I., Mitran M. I., Caruntu C., Caruntu A. et al. Tumor Microenvironments in Organs, Tumour Microenvironment in Skin Carcinogenesis. In Tumor Microenvironments in Organs; Springer: Cham, Switzerland, 2020; pp. 123-142. ISBN 9783030362133. https://doi.org/10.1007/978-3-030-36214-0_10.
- Pieniazek M., Matkowski R., Donizy P. Macrophages in skin melanoma-the key element in melanomagenesis. Oncol Lett. 2018 Apr; 15 (4): 5399-5404. https://doi.org/10.3892/ol.2018.8021.
- Smith M. P., Sanchez-laorden B., Brien K. O., Brunton H., Young H., Dhomen N., et al. The immune-microenvironment confers resistance to MAP kinase pathway inhibitors through macrophage-derived TNFa. Cancer Discov. 2014 Oct; 4 (10): 1214-1229. https://doi.org/10.1158/2159-8290.CD-13-1007.
- Noy R., Pollard J. W. Tumor-associated macrophages: from mechanisms to therapy. Immunity 2014; 41: 49-61. PMID: 25035953. PMCID: PMC4137410. https://doi.org/10.1016/j.immuni.2014.06.010.
- Caux C., Ramos R. N., Prendergast G. C., Bendriss-Vermare N., Menetrier-Caux C. A Milestone Review on How Macrophages Affect Tumor Growth. Cancer Res. 2016 Nov 15; 76 (22): 6439-6442. https://doi.org/10.1158/0008-5472. CAN-16-2631.
- Quail D. F., Joyce J. A. Microenvironmental regulation of tumor progression and metastasis. Nat Med. 2013 Nov; 19 (11): 1423-37. https://doi.org/10.1038/nm. 3394.
- Ersek B., Sillo P., Cakir U., Molnar V., Bencsik A., Mayer B. et al. Melanoma-associated fibroblasts impair CD8 + T cell function and modify expression of immune checkpoint regulators via increased arginase activity. Cell Mol Life Sci. 2021 Jan; 78 (2): 661-673. https://doi.org/10.1007/s00018-020-03517-8.
- Ziani L., Safta- Saadoun T. B., Gourbeix J., Cavalcanti A., Robert C., Favre G. et al. Melanoma-associated fibroblasts decrease tumor cell susceptibility to NK cell-mediated killing through matrix-metalloproteinases secretion. Onco-target. 2017 Mar 21; 8 (12): 19780-19794. https://doi.org/10.18632/oncotarget. 15540.
- Diaz F. E., Dantas E., Geffner J. Unravelling the Interplay between Extracellular Acidosis and Immune Cells. Mediators Inflamm. 2018 Dec 30; 2018: 1218297. https://doi.org/10.1155/2018/1218297.
- Böhme I., Bosserhoff A. Extracellular acidosis triggers a senescence-like phenotype in human melanoma cells. Pigment Cell Melanoma Res. 2020 Jan; 33 (1): 41-51. https://doi.org/10.1111/pcmr. 12811.
- Marzagalli M., Ebelt N. D., Manuel E. R. Unraveling the crosstalk between melanoma and immune cells in the tumor microenvironment. Semin Cancer Biol. 2019 Dec; 59: 236-250. https://doi.org/10.1016/j.semcancer. 2019.08.002.
- Tan S., Khumalo N., Bayat A. Understanding Keloid Pathobiology From a Quasi-Neoplastic Perspective: Less of a Scar and More of a Chronic Inflammatory Disease With Cancer-Like Tendencies. Front Immunol. 2019 Aug 7; 10: 1810. https://doi.org/10.3389/fimmu. 2019.01810.
- Das S., Skobe M. Lymphatic vessel activation in cancer. Ann N Y Acad Sci. 2008; 1131: 235-41. https://doi.org/10.1196/ annals. 1413.021.
- Rutkowski J. M., Moya M., Johannes J., Goldman J., Swartz M. A. Secondary lymphedema in the mouse tail: lymphatic hyperplasia, VEGF-C upregulation, and the protective role of MMP-9. Microvasc Res. 2006 Nov; 72 (3): 161-71. https:// doi.org/10.1016/j.mvr. 2006.05.009.
- Zampell J. C., Yan A., Elhadad S., Avraham T., Weitman E., Mehrara B. J. CD4 (+) cells regulate fibrosis and lymphan-giogenesis in response to lymphatic fluid stasis. PLoS One. 2012; 7 (11): e49940. https://doi.org/10.1371/journal.pone. 0049940.
- Backs J., Song K., Bezprozvannaya S., Chang S., Olson E. N. CaM kinase II selectively signals to histone deacetylase 4 during cardiomyocyte hypertrophy. J Clin Invest. 2006 Jul; 116 (7): 1853-64. https://doi.org/10.1172/JCI27438.
- Humphrey J. D., Dufresne E. R., Schwartz M. A. Mechanotransduction and extracellular matrix homeostasis. Nat Rev Mol Cell Biol. 2014 Dec; 15 (12): 802-12. https://doi.org/10.1038/nrm3896.
- Salica J. P., Guerrieri D., Maffia P., Croxatto J., Chuluyan H. E., Gallo J. E. Transglutaminase binding fusion protein linked to SLPI reduced corneal inflammation and neovascularization. BMC Ophthalmol. 2015 Feb 4; 15: 12. https:// doi.org/10.1186/1471-2415-15-12.
- Bald T., Quast T., Landsberg J., Rogava M., Glodde N., Lopez-Ramos D. et al. Ultraviolet-radiation-induced inflammation promotes angiotropism and metastasis in melanoma. Nature. 2014 Mar 6; 507 (7490): 109-13. https://doi.org/10.1038/ nature13111.
- Roh-Johnson M., Shah A. N., Stonick J. A. et al. Macrophage-Dependent Cytoplasmic Transfer during Melanoma Invasion In Vivo. Dev Cell. 2017 Dec 4; 43 (5): 549-562. e6. https://doi.org/10.1016/j.devcel.2017.11.003.
- Harrell M. I., Iritani B. M., Ruddell A. Tumor-induced sentinel lymph node lymphangiogenesis and increased lymph flow precede melanoma metastasis. Am J Pathol. 2007 Feb; 170 (2): 774-86. https://doi.org/10.2353/ajpath. 2007.060761.
- Abouelkheir G. R., Upchurch B. D., Rutkowski J. M. Lymphangiogenesis: fuel, smoke, or extinguisher of inflammation's fire? Exp Biol Med (Maywood). 2017 Apr; 242 (8): 884-895. https://doi.org/10.1177/1535370217697385.
- Sund B. New developments in wound care. vol. 86. PJB. PJB Publications: Lon-don 1: 255 (Clinical Report CBS 836), 2000. https://doi.org/10.1136/bmj. 326.7380.88.
- Van der Auwera I., Cao Y., Tille J. C., Pepper M. S., Jackson D. G., Fox S. B. et al. First international consensus on the methodology of lymphangiogenesis quantification in solid human tumours. Br J Cancer. 2006 Dec 18; 95 (12): 1611-25. https://doi.org/10.1038/sj.bjc.6603445.
- Behan F. C., Lo C. H., Sizeland A., Pham T., Findlay M. Keystone island flap reconstruction of parotid defects. Plast Reconstr Surg. 2012 Jul; 130 (1): 36e-41e. https://doi.org/10.1097/PRS. 0b013e3182547f55.
- Tiainen S., Tumelius R., Rilla K., Hamalainen K., Tammi M., Tammi R., Kosma V.- M., Oikari S., Auvinen P. High numbers of macrophages, especially M2-like (CD163-positive), correlate with hyaluronan accumulation and poor outcome in breast cancer. Histopathology. 2015 May; 66 (6): 873-83. doi:10.1111/his.12607. Epub 2015 Jan 15.


