Динамика изменения жирно-кислотного состава церамидов седалищного нерва крысы при повреждении
Автор: Деринская Е.В., Ревин В.В.
Журнал: Инженерные технологии и системы @vestnik-mrsu
Рубрика: Биохимия и физиология человека и животных
Статья в выпуске: 4, 2007 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/14718923
IDR: 14718923
Текст статьи Динамика изменения жирно-кислотного состава церамидов седалищного нерва крысы при повреждении
Изучение восстановления функций поврежденных нервных проводников является актуальной проблемой, так как целый ряд патологических состояний возникают за счет атрофии и дегенерации аксонов при травмах и ишемии нервных стволов [7]. При повреждении нерва происходят глубокие изменения в составе липидных компонентов мембран [2]
Отдельные липидные компоненты мембран принимают непосредственное участие в развитии ряда патологических процессов на уровне мембранных образований клеток. К этой группе липидов относятся церамиды, которые являются вторичными посредниками в передаче различных внешних сигналов в клетку и участвуют в процессах регуляции пролиферации, дифференцировки и апоптоза клеток [3; 4; 5]. Было установлено, что биологические функции церамидов зависят от их химической структуры. Прежде всего биологическая активность зависит от структуры сфингоидного основания [1]. Однако церамид является N-ацилпроизводным сфингоида, т. е. в молекуле церамида имеются две углеводородные цепи — сфингоидного основания и жирной кислоты, каждая из которых вносит определенный вклад в биологический эффект.
Целью данной работы было исследование изменений количества церамидов и их жирнокислотного состава в седалищных нервах крысы при травмировании.
Методика исследования. Эксперименты выполнены на беспородных крысах-самцах массой 200 — 250 г, содержащихся на стандартном рационе. Повреждения вызывали передавливанием седалищного нерва. Животных выводили из эксперимента на 5-е, 10-е, 15-е и 30-е сутки после повреждения. После препаровки седалищные нервы выдерживали в растворе, содержащем 0,1 мМ NaCl, 4 мМ KCI, 1 мМ СаС12, 1мМ MgSO4, 25 мМ NaH2CO3, 3 мМ NaH2PO4,
30 мМ. С6Н]2О6. О функциональной активности нерва судили по его способности проводить ритмическое возбуждение. Потенциал действия отводили в термостатируемой камере, раздражение осуществляли лабораторным стимулятором ЭСЛ-1 (Россия), сигнал наблюдали на экране осциллографа С1-68 (Россия).
Липиды выделяли из ткани многократной экстракцией смесью хлороформ : метанол (2 : 1, а затем 1 : 2, по объему) до их полного извлечения. Экстракты упаривали в роторном испарителе и промывали по методу Фолча [6] для удаления полярных гликосфинголипидов (в том числе ганглиозидов). Для освобождения липидного экстракта от глицеролипидов проводили метанолиз 0,2 М раствором NaOH в метаноле в течение 18 ч при температуре 20 °C, после чего реакционную смесь нейтрализовали 0,2 М НС1 в метаноле и упаривали. Разделение липидных фракций осуществляли методом микротонкослойной хроматографии на силикагеле сначала в диэтиловом эфире, затем в системе хлороформ : метанол (9:1, по объему). Идентификацию липидов проводили с помощью свидетелей и известных из литературы величин Rr Концентрацию церамидов оценивали по количеству жирных кислот, входящих в состав Метилирование жирных кислот проводили с помощью раствора трехфтористого бора в метаноле.
Жирно-кислотный состав церамидов анализировали на газовом хроматографе Кристалл 5000.1 (Россия) с капиллярной колонкой
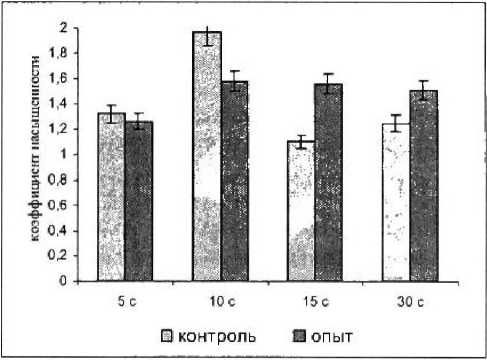
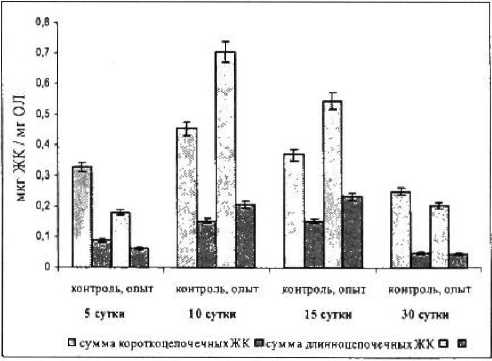
Рисунок 2
Изменения содержания длинноцепочечных и короткоцепочечных жирных кислот седалищного нерва крысы при повреждении
ВЕСТНИК Мордовского университета | 2007 | № 4
Рисунок /
Изменение коэффициента насыщеннос-; ти жирных кислот седалищного нерва крысы на различные сутки после повреждения
Таблица /
Жирнокислотный состав церамидов, выделенных из контрольного и поврежденного нерва ( % от суммы кислот)
|
Кислоты |
5-е сутки |
10-е сутки |
15-е сутки |
30-е сутки |
||||
|
Контроль |
Опыт |
Контроль |
Опыт |
Контроль |
Опыт |
Контроль |
Опыт |
|
|
8:0 |
1,41 ±0,07 |
3,08 ±0,15 |
4,62 ±0,23 |
1,32 ±0,07 |
0,74 * 0,04 |
2,14*0,11 |
2,60 + 0.13 |
1.69 * 0,08 |
|
10:0 |
0,28*0,01 |
1,37 ±0,07 |
0,19 ±0,01 |
0,07*0,01 |
1,1 6 ±0,06 |
1,67 ±0,08 |
2,90 ±0,15 |
1,96*0,10 |
|
И :0 |
0,64 ± 0,03 |
0,82 * 0,04 |
0 |
0,15*0,01 |
0,20 ±0,01 |
0,74 ±0,04 |
0,33 ±0,02 |
0,20*0,01 |
|
12:0 |
0.52 * 0,03 |
0,41 ±0,02 |
0,25 ±0,01 |
0,33 ± 0,02 |
0,22*0,01 |
0,34 ±0,02 |
0,56*0,03 |
0,34*0,02 |
|
14:0 |
4,67 ± 0,23 |
4,72 ±0,24 |
4,34 ±0,22 |
2,18*0,11 |
2,86*0,14 |
3,85 ±0,19 |
3,23*0,16 |
4,79 * 0,24 |
|
14:1 |
2,86 ±0,14 |
3,49 ±0,17 |
1,92 ±0,10 |
0 |
0,87*0,04 |
0,27*0,01 |
0,67*0,03 |
0,74 * 0,04 |
|
15:0 |
3,14* 0,16 |
4,65 ±0,23 |
3,57 ±0,18 |
1,27* 0,06 |
2,18*0,11 |
1,80*0,09 |
1,45*0,07 |
2,63*0,13 |
|
16:0 |
26,88* ±1,34 |
25,77 ± ± 1,29 |
18,52* ±0,93 |
28,76 ± ± 1,44 |
26,65 ± * 1,33 |
27,58 * * 1,38 |
26,98 * * 1,35 |
30,21 * ±1,51 |
|
16 : 1 |
1,85 ± 0,09 |
0 |
0 |
0,84 ±0,04 |
1,35 ±0,07 |
1,17 ±0,06 |
0,67*0,03 |
4,72 * 0,24 |
|
17:1 |
3,54 ±0,18 |
3,62 ±0,18 |
1.13 ±0,06 |
0.64 ±0,03 |
0 |
0 |
0 |
0 |
|
18:0 |
16,90 * ±0,85 |
8,95 ±0,45 |
29,95 * ± 1.50 |
22,45 ± ± 1,12 |
16,86* ±0,84 |
20,09± ± 1,01 |
15,61 ± ±0,78 |
15,44* ±0,77 |
|
18 : 1 |
9,34 * 0,47 |
9,09 ± 0,46 |
8,87 ±0,44 |
17,15* ±0,86 |
9,57 ±0,48 |
5,53 ±0,28 |
22,74 ± ± 1,14 |
10,92* ±0,55 |
|
18:2 |
4,31 ±0,22 |
2.73 ±0,14 |
0 |
1,80 ±0,09 |
4,14 ±0,21 |
2,17 ±0,11 |
4,24*0,21 |
4,38*0,22 |
|
18:3 |
2,33 ±0,12 |
5,61 ±0,28 |
1,48 ±0,07 |
0,37 ± 0,02 |
2,89*0,14 |
1,44*0,07 |
1,56*0,08 |
2,90*0,15 |
|
20:0 |
1,05 ±0,05 |
0,96*0.05 |
2,52 ±0,13 |
1,34 ±0,07 |
0,96 * 0,05 |
0,78 * 0,04 |
0,89*0,05 |
1,15*0,06 |
|
20 : 1 |
1,29 ±0.06 |
1,16 ±0,06 |
4,15*0,21 |
5,43 * 0,27 |
0,90 ±0,05 |
0,56 ±0,03 |
0,94*0,05 |
0,88*0,04 |
|
20 :4 |
0,81 ± 0,04 |
0 |
0 |
0,84 ±0,04 |
0,51 ±0,03 |
1,13*0,06 |
2,90*0,15 |
4,05 ± 0,20 |
|
22 :0 |
0,64 ± 0,03 |
1.03 ±0,05 |
1.59 ±0,08 |
1,72 ± 0,09 |
0,06 ±0,0! |
0,81 ±0.04 |
О,67±О,03 |
0.67*0.03 |
|
22 :2 |
16,74* ±0,84 |
18,52* ±0,93 |
16,15* ±0,81 |
11,66* * 0,58 |
12,08 ±0,60 |
6,99 ± 0,35 |
10,70* *0,54 |
П,13± ±0,56 |
|
24 :0 |
0,81 ±0,04 |
4,03 ±0,20 |
0,77 ±0,04 |
1,69 ±0,08 |
0 |
0,49 * 0,03 |
0,33*0,02 |
0,27*0,01 |
HP-FFAP 50 m 0,32 mm 0,5 pm (США). Полученные экспериментальные данные статис- электронных таблиц Microsoft Excel 2000 и пакета программ STAT 2.
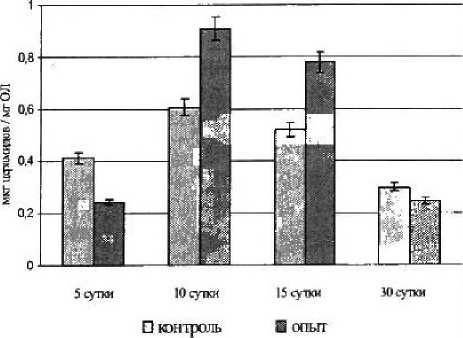
Рисунок 3
Содержание церамидов в седалисцном нерве крысы на различные сутки
I после повреждения
Результаты исследования. Повреждение нерва приводит к потере" способности нерва прово- рации седалищного нерва выявлены изменения в жирнокислотном составе церамидов, зависящие от длительности посттравматического периода.
Анализ жирнокислотного состава церамидов показал, что в контрольном образце определяется набор из 20 кислот (табл. 1).
Жирнокислотный состав церамидов нерва после травмы изменялся. Восстановлению способности проводить ритмическое возбуждение предшествует нормализация состава церамидов нерва. Происходит уменьшение коэффициента насыщенности (рис. 1} и увеличение доли длинноцепочечных жирных кислот с максимумом их накопления на 5-е сутки (рис. 2).
С увеличением длительности послеоперационной выдержки запускаются репарационные процессы. К 15-м суткам после повреждения происходит восстановление жирнокислотного состава, соотношения насыщенных и ненасыщенных жирных кислот (рис. 1).
Серия «Биологические науки*
В процессе послеоперационной выдержки увеличивается уровень церамидов на 10-е и 15-е сутки почти на треть по сравнению с контролем, а к 30-м суткам содержание церамида уменьшается до контрольного значения (рис. 3).
Таким образом, можно заключить, что повреждение периферических нервов вызывает увеличение количества церамидов, накопление которых стимулирует внутриклеточные процессы, приводящие к дегенерации соматических нервов.
Список литературы Динамика изменения жирно-кислотного состава церамидов седалищного нерва крысы при повреждении
- Дятловицкая Э. В. Зависимость биоэффекторных свойств сфинголипидов от строения их гидрофобного фрагмента/Э. В. Дятловицкая//Биохимия. 1998. Т. 63, вып. 1. С. 67 -74.
- Ревин В. В. Состав липидов соматических нервов крысы при действии повреждающих факторов/В. В. Ревин, М. А. Юданов, Г. В. Максимов//Бюллетень экспериментальной биологии и медицины. 2006. Т. 142, No 8. С. 155 -157.
- Buccoliero R. The roles of ceramide and complex sphingolipids in neuronal cell function/R. Buccoliero, A. H. Futerman//Pharmacological Research. 2003. Vol. 47. P. 409 -419.
- Ceramide in Apoptosis: A Revisited Role/T. Levade, S. Malagarie-Cazenave, V. Gouazo //Neurochemical Research. 2002. Vol. 27. P. 601 -607.
- Colombaioni L. Sphingolipid metabolites in neural signalling and function/L. Colombaioni, M. Garcia-Gil//Brain Research Reviews. 2004. Vol. 46. P. 328 -355.
- Folch J. A simple method for the isolation and purification of total lipids from animal tissues/J. Folch, M. Lees, J. H. Sloane-Stanley//J. Biol. Chem. 1957. Vol. 226. P. 497 -509.
- Vance J. E. The synthesis and transport of lipids for axonal growth and nerve regeneration/J. E. Vance, R. B. Campenot, D. E. Vance//Biochim. Biophys. Acta. 2000. Vol. 1486. P, 84 -96.


